2013高一化学人教版必修一课件第一章 第二节 第二课时 气体摩尔体积
文档属性
| 名称 | 2013高一化学人教版必修一课件第一章 第二节 第二课时 气体摩尔体积 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-24 12:27:30 | ||
图片预览









文档简介
课件36张PPT。第一章
第二节
第二课时课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 化学计量在实验中的应用第二课时 气体摩尔体积 (1)物质的三种聚集状态是 、 和 。在测量其量时,固体易测其质量, 和 易测其体积。
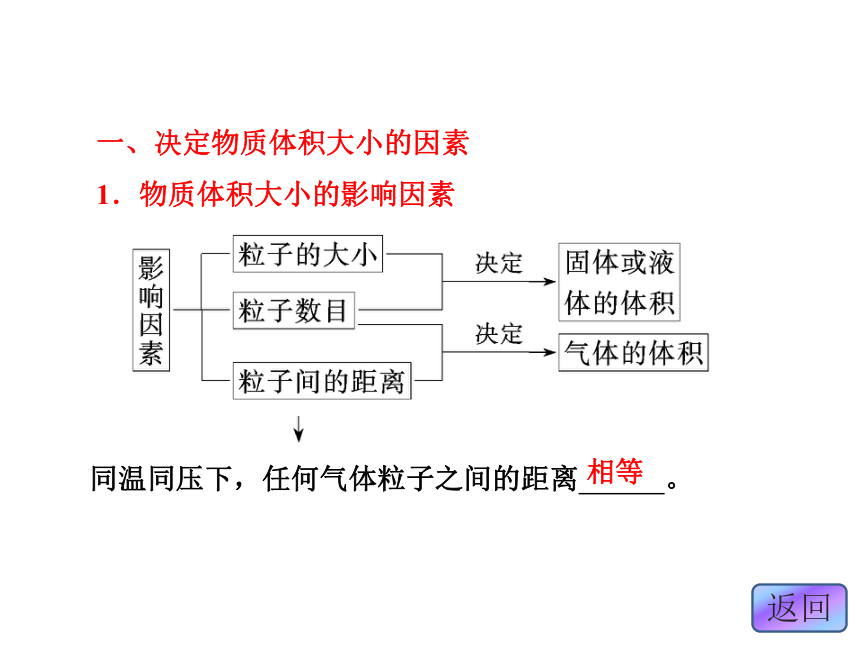
(2)气体物质体积的大小主要与 、 等因素有关。
(3)1 mol H2、O2、H2SO4、Fe的质量分别为 、
、 、 ,0℃,101 kPa下其密度分别为0.089 g/L、1.429 g/L、1.831 g/cm3、7.86 g/cm3,则1 mol四种物质的体积分别为 、 、 、 。气态液态固态液体 气体温度压强2 g32 g98 g56 g22.4 L22.4 L53.5 cm37.12 cm3一、决定物质体积大小的因素
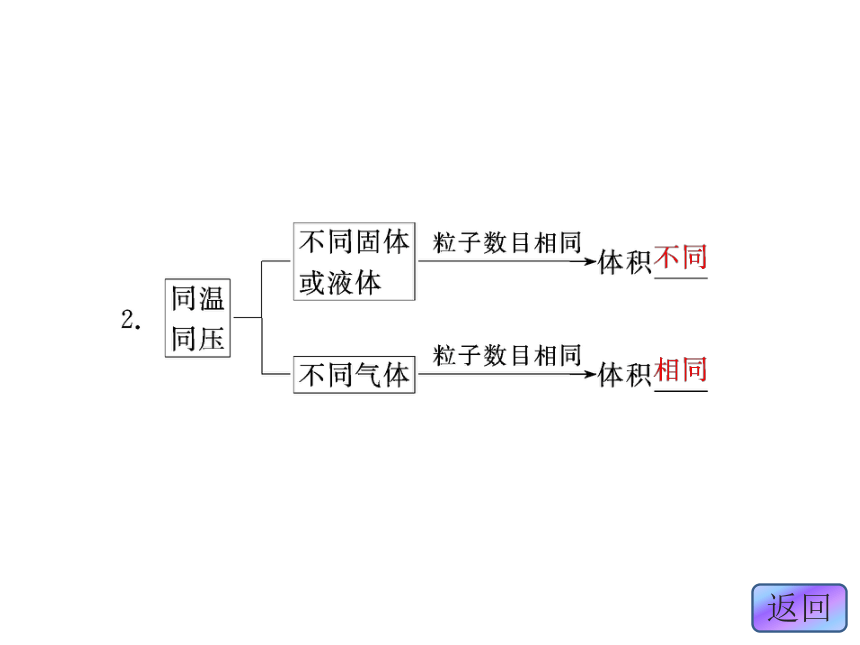
1.物质体积大小的影响因素同温同压下,任何气体粒子之间的距离 。相等 3.阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有 的粒子。相同数目 二、气体摩尔体积
1.概念
单位 的气体所占有的 ,符号: ,单位: 和m3/mol(或m3·mol-1)。物质的量体积VmL/mol(或L·mol-1) 3.影响气体摩尔体积的因素
(1)气体摩尔体积的数值取决于气体所处的 ,温度越高,体积越 ,压强越 ,体积越 。
(2)标准状况下(即0℃和101 kPa),气体摩尔体积为
。温度和压强大大小22.4 L/mol1.同温同压下,两种气体的体积不同,其主要原因是
( )
A.气体的分子大小不同
B.气体分子间的平均距离不同
C.气体的物质的量不同
D.气体的性质不同
分析:同温同压下,气体分子间的平均距离相同,两种气体的体积不同,其主要原因只能是气体的物质的量不同。
答案:C2.判断正误(正确的打“√”,错误的打“×”号)。
(1)标准状况下,气体摩尔体积为22.4 L ( )
(2)在标准状况下,1 mol任何物质的体积都是22.4 L
( )
(3)在标准状况下,22.4 L H2和N2的混合气体的物质的量约为1 mol ( )
(4)在相同的温度和压强下,任何气体粒子之间的距离相等 ( )
答案:(1)× (2)× (3)√ (4)√3.将下列物理量与相应的单位连线。
物理量 单位
(1)物质的量 A.L/mol
(2)摩尔质量 B.g/mol
(3)气体摩尔体积 C.mol
(4)阿伏加德罗常数 D.mol-1
答案:(1)—C,(2)—B,(3)—A,(4)—D4.在同温同压下,A容器中盛有H2,B容器中盛有NH3,
若使它们所含的原子总数相等,则两个容器的体积之比是 ( )
A.2∶1 B.1∶2
C.2∶3 D.1∶3
解析:同温同压下,两种气体的体积之比等于物质的量之比。根据题意:n(H2)×2=n(NH3)×4,则V(H2)×2=V(NH3)×4,故V(H2)∶V(NH3)=2∶1。
答案:A气体摩尔体积的使用及相关计算 1.使用22.4 L/mol时的注意事项
(1)条件:必须为标准状况,因此使用时,一定要看清气体所处的状况。
(2)物质状态:必须为气体。如水、酒精、四氯化碳等物质在标准状况下不是气体。
(3)数值:22.4 L/mol是近似值。 2.适用范围
气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状况下0.2 mol H2与0.8 mol O2的混合气体的体积约为22.4 L。3.计算 [例1] 下列说法正确的是 ( )
A.在标准状况下,1 mol水的体积是22.4 L
B.1 mol氢气所占的体积一定是22.4 L
C.标准状况下,6.02×1023个Cu原子所占有的体积约是22.4 L
D.标准状况下,28 g N2与CO的混合气体,体积为22.4 L[答案] D 进行有关计算或判断时常出现的错误
(1)忽视物质在标准状况下的状态是否是气态,如水在标准状况下不是气态,计算该条件下的体积时就不能应用22.4 L/mol。
(2)忽视气体所处的状态是否是标准状况,如计算25℃,101 kPa下氢气的体积时不能应用22.4 L/mol。阿伏加德罗定律及其推论 1.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的分子。2.阿伏加德罗定律的推论 [例2] 在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法正确的是 ( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等[答案] D点击下图进入 (1)物质的体积大小主要取决于构成物质的粒子数目、粒子的大小和粒子之间的距离。
(2)在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
(3)气体摩尔体积是指单位物质的量的气体所占的体积,符号为Vm。气体摩尔体积的数值随温度和压强的改变而改变,在标准状况(0℃,101kPa)下,气体的摩尔体积为22.4 L/mol。
(4)同温、同压下,气体的体积V=Vm×n。点击下图进入
第二节
第二课时课前预习
·巧设计名师课堂
·一点通考点一创新演练
·大冲关设计1设计2考点二设计3课下30分钟演练课堂10分钟练习课堂5分钟归纳第二节 化学计量在实验中的应用第二课时 气体摩尔体积 (1)物质的三种聚集状态是 、 和 。在测量其量时,固体易测其质量, 和 易测其体积。
(2)气体物质体积的大小主要与 、 等因素有关。
(3)1 mol H2、O2、H2SO4、Fe的质量分别为 、
、 、 ,0℃,101 kPa下其密度分别为0.089 g/L、1.429 g/L、1.831 g/cm3、7.86 g/cm3,则1 mol四种物质的体积分别为 、 、 、 。气态液态固态液体 气体温度压强2 g32 g98 g56 g22.4 L22.4 L53.5 cm37.12 cm3一、决定物质体积大小的因素
1.物质体积大小的影响因素同温同压下,任何气体粒子之间的距离 。相等 3.阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气体都含有 的粒子。相同数目 二、气体摩尔体积
1.概念
单位 的气体所占有的 ,符号: ,单位: 和m3/mol(或m3·mol-1)。物质的量体积VmL/mol(或L·mol-1) 3.影响气体摩尔体积的因素
(1)气体摩尔体积的数值取决于气体所处的 ,温度越高,体积越 ,压强越 ,体积越 。
(2)标准状况下(即0℃和101 kPa),气体摩尔体积为
。温度和压强大大小22.4 L/mol1.同温同压下,两种气体的体积不同,其主要原因是
( )
A.气体的分子大小不同
B.气体分子间的平均距离不同
C.气体的物质的量不同
D.气体的性质不同
分析:同温同压下,气体分子间的平均距离相同,两种气体的体积不同,其主要原因只能是气体的物质的量不同。
答案:C2.判断正误(正确的打“√”,错误的打“×”号)。
(1)标准状况下,气体摩尔体积为22.4 L ( )
(2)在标准状况下,1 mol任何物质的体积都是22.4 L
( )
(3)在标准状况下,22.4 L H2和N2的混合气体的物质的量约为1 mol ( )
(4)在相同的温度和压强下,任何气体粒子之间的距离相等 ( )
答案:(1)× (2)× (3)√ (4)√3.将下列物理量与相应的单位连线。
物理量 单位
(1)物质的量 A.L/mol
(2)摩尔质量 B.g/mol
(3)气体摩尔体积 C.mol
(4)阿伏加德罗常数 D.mol-1
答案:(1)—C,(2)—B,(3)—A,(4)—D4.在同温同压下,A容器中盛有H2,B容器中盛有NH3,
若使它们所含的原子总数相等,则两个容器的体积之比是 ( )
A.2∶1 B.1∶2
C.2∶3 D.1∶3
解析:同温同压下,两种气体的体积之比等于物质的量之比。根据题意:n(H2)×2=n(NH3)×4,则V(H2)×2=V(NH3)×4,故V(H2)∶V(NH3)=2∶1。
答案:A气体摩尔体积的使用及相关计算 1.使用22.4 L/mol时的注意事项
(1)条件:必须为标准状况,因此使用时,一定要看清气体所处的状况。
(2)物质状态:必须为气体。如水、酒精、四氯化碳等物质在标准状况下不是气体。
(3)数值:22.4 L/mol是近似值。 2.适用范围
气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状况下0.2 mol H2与0.8 mol O2的混合气体的体积约为22.4 L。3.计算 [例1] 下列说法正确的是 ( )
A.在标准状况下,1 mol水的体积是22.4 L
B.1 mol氢气所占的体积一定是22.4 L
C.标准状况下,6.02×1023个Cu原子所占有的体积约是22.4 L
D.标准状况下,28 g N2与CO的混合气体,体积为22.4 L[答案] D 进行有关计算或判断时常出现的错误
(1)忽视物质在标准状况下的状态是否是气态,如水在标准状况下不是气态,计算该条件下的体积时就不能应用22.4 L/mol。
(2)忽视气体所处的状态是否是标准状况,如计算25℃,101 kPa下氢气的体积时不能应用22.4 L/mol。阿伏加德罗定律及其推论 1.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的分子。2.阿伏加德罗定律的推论 [例2] 在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法正确的是 ( )
A.两种气体的压强相等
B.O2比O3质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等[答案] D点击下图进入 (1)物质的体积大小主要取决于构成物质的粒子数目、粒子的大小和粒子之间的距离。
(2)在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子。
(3)气体摩尔体积是指单位物质的量的气体所占的体积,符号为Vm。气体摩尔体积的数值随温度和压强的改变而改变,在标准状况(0℃,101kPa)下,气体的摩尔体积为22.4 L/mol。
(4)同温、同压下,气体的体积V=Vm×n。点击下图进入
