第九单元溶液测试题-2021-2022学年九年级化学人教版上册(无答案)
文档属性
| 名称 | 第九单元溶液测试题-2021-2022学年九年级化学人教版上册(无答案) |  | |
| 格式 | doc | ||
| 文件大小 | 304.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-18 23:33:33 | ||
图片预览


文档简介
第九单元 溶液 单元测试题
一、选择题
1.下列物质中属于溶液的是( )
A.石灰水 B.液氧 C.牛奶 D.冰水
2.市场上有一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前
摇动饮料罐使它们混合,罐内饮料温度就会降低,这种固体物质可能是( )
A.硝酸铵 B.烧碱 C.食盐 D.熟石灰
3.有一瓶密封保存长期放置的氯化钠溶液,下列说法正确的是( )
A.瓶口附近的溶液较稀 B.瓶底附近的溶液较浓
C.瓶底会有固体析出 D.瓶内各部分溶液的浓度都相同
4.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则( )
A.晶体质量不变 B. 晶体质量减少
C.氯化钠溶解度增大 D. 溶质质量分数增大
5.打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随( )
A.压强增大而减小 B.压强减小而减小
C.温度升高而升高 D.温度降低而减小
6.生活中的洗涤问题大都与化学知识有关.下列说法中不正确的是( )
A.洗涤剂能够除去油污的原因是因为洗涤剂具有乳化作用
B.汽油能够除去油污的原因是汽油能够溶解油污从而挥发除去
C.食醋能够除去热水瓶中水垢的原因是二者发生了化学反应
D.盐酸能够除去铁制品表面上的铁锈的原因是二者发生了物理变化
7.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 ( )
8.实验室要配制50g 10%的氯化钠溶液,其中操作方法不正确的是( )
A.计算所需氯化钠的质量为5g,水的体积为45mL
B.在托盘天平左盘加5g砝码,然后在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.用50mL量筒量取45mL水,倒入上述烧杯中
D.用玻璃棒搅拌,使氯化钠完全溶解
9.右图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和
D.乙物质的溶解度随温度的升高而增大
10、某温度下,向一定量饱和石灰水中加入适量生石灰,充分反应后,恢复到原来温度,则溶液的质量( )
A.增大 B.减小 C.不变 D.无法判断
11.将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.80g B. 100g C.200g D.280g
12.如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体B倒入液体A中,观察到装置中的小气球鼓起来,则使用的固体和液体可以是( )
①石灰石和稀盐酸 ②镁和稀硫酸 ③氯化钠固体和水 ④生石灰和水.
A.①②③ B.①③④ C.①②④ D.②③④
13.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10% 的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B. 加入少量硝酸钾晶体
C. 略降低温度 D. 室温时,蒸发少量水
14.如图是 A、B、C三种固体物质(均不含结晶水)的溶解度曲线,下列说法不正确的是( )
A.t1℃时,取50gA的饱和溶液,将温度升高到t2℃,此时溶
液中A的质量分数变大(假设升温时溶剂没有损失)
B.t1℃,将A、B、C各a g放入100g水中,充分搅拌,
所得溶液溶质质量分数均相等
C.t3℃时,取相同质量的A、B、C三种饱和溶液降温到t1℃,
析出晶体最多的是A,没有晶体析出并变成不饱和溶液的是C
D.从A与少量C的混合物中提纯A,可用降温结晶的方法
二、填空题
15.现有20℃时10%的碳酸钠溶液150g,则:
(1)从该溶液中取出50g,其中含溶质 g
(2)将剩余溶液蒸发20g水后,其溶液的溶质质量分数是 。(蒸发过程中无晶体析出)
16.有A、B、C、D四个烧杯中分别盛有质量相等的同种溶剂,在相同的温度下,向四个小烧杯中分别加入200 g、150 g、100 g、50 g某溶质,充分溶解后,如图所示。请回答:
(1) (填序号,下同)中盛的可能是饱和溶液; 中盛的一定是不饱和溶液。
(2)四个烧杯中溶液的溶质质量分数由小到大的顺序是: 。
(3)若固体溶质是硝酸钾,对A、B两个烧杯同时升高温度(均匀进行),固体物质先消失的是 。
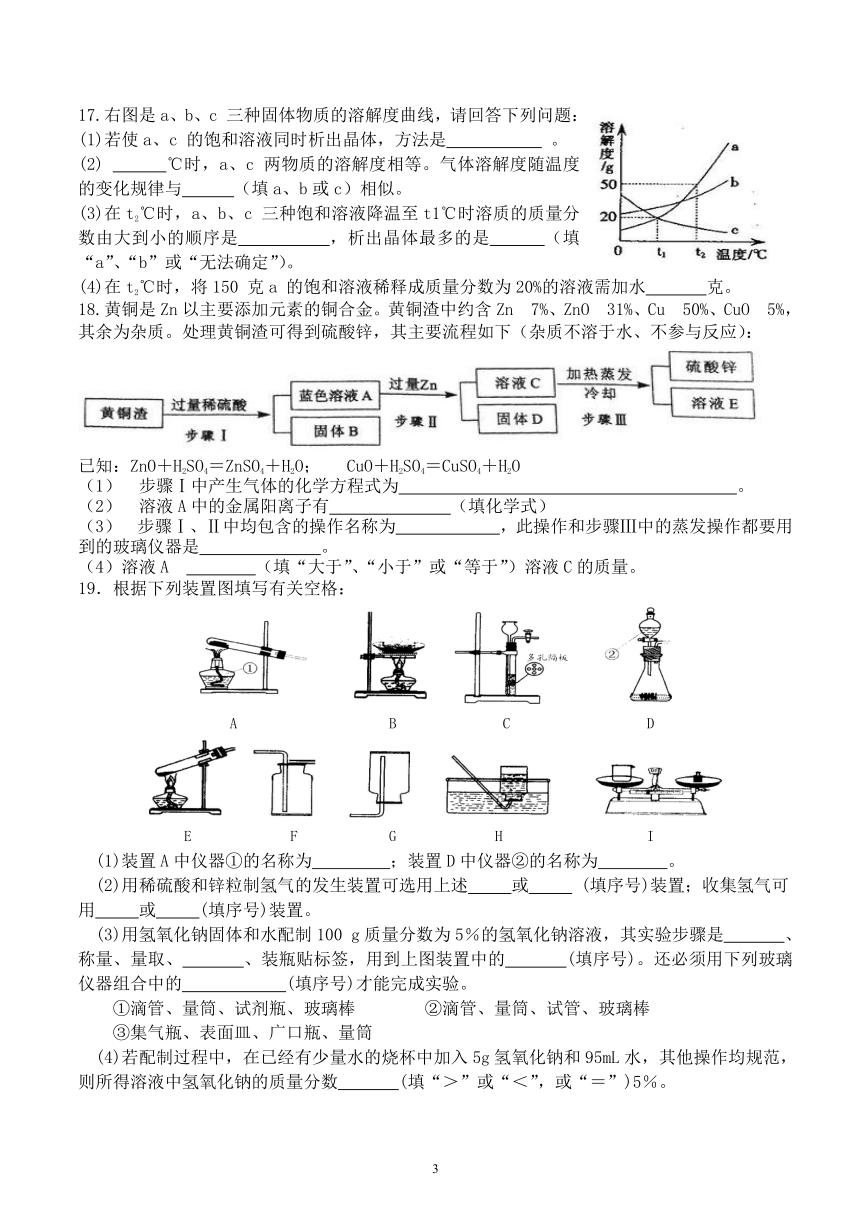
17.右图是a、b、c 三种固体物质的溶解度曲线,请回答下列问题:
(1)若使a、c 的饱和溶液同时析出晶体,方法是 。
(2) ℃时,a、c 两物质的溶解度相等。气体溶解度随温度的变化规律与 (填a、b或c)相似。
(3)在t2℃时,a、b、c 三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是 ,析出晶体最多的是 (填“a”、“b”或“无法确定”)。
(4)在t2℃时,将150 克a 的饱和溶液稀释成质量分数为20%的溶液需加水 克。
18.黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
步骤Ⅰ中产生气体的化学方程式为 。
(2) 溶液A中的金属阳离子有 (填化学式)
(3) 步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
19.根据下列装置图填写有关空格:
A B C D
E F G H I
(1)装置A中仪器①的名称为 ;装置D中仪器②的名称为 。
(2)用稀硫酸和锌粒制氢气的发生装置可选用上述 或 (填序号)装置;收集氢气可用 或 (填序号)装置。
(3)用氢氧化钠固体和水配制100 g质量分数为5%的氢氧化钠溶液,其实验步骤是 、称量、量取、 、装瓶贴标签,用到上图装置中的 (填序号)。还必须用下列玻璃仪器组合中的 (填序号)才能完成实验。
①滴管、量筒、试剂瓶、玻璃棒 ②滴管、量筒、试管、玻璃棒
③集气瓶、表面皿、广口瓶、量筒
(4)若配制过程中,在已经有少量水的烧杯中加入5g氢氧化钠和95mL水,其他操作均规范,则所得溶液中氢氧化钠的质量分数 (填“>”或“<”,或“=”)5%。
三、实验探究题
20. Mg与NH4Cl溶液反应,除生成MgCl2外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是HCl,NH3,H2中的一种或几种。猜想的依据是________________。
【查阅资料】
NH3+HCl=NH4Cl ② NH3+H2SO4=(NH4)2SO4
④NH3溶于水呈碱性,酚酞遇碱性溶液变红
【实验探究】
(1)为确定是否含有HCl,将气体通入酸化的AgNO3溶液中,无沉淀产生,则该气体中无HCl。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
A中的观察到现象是_________________,证明有NH3;
B中玻璃管内观察到______________________,证明有H2;
硫酸的作用是__________________。
【实验结论】 Mg与NH4Cl溶液反应生成MgCl2,NH3和H2。写出化学方程式_________________。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验HCl,就能证明HCl不存在。请评价这种说法是否合理______填“是”或“否”),理由是___________________________。
四、计算题
21.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
实 验 一 二 三 四
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)上表中m的数值是 ;
(2)这种石灰石矿中碳酸钙的质量分数是多少?
(3)稀盐酸中溶质的质量分数是多少?
PAGE
1
一、选择题
1.下列物质中属于溶液的是( )
A.石灰水 B.液氧 C.牛奶 D.冰水
2.市场上有一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前
摇动饮料罐使它们混合,罐内饮料温度就会降低,这种固体物质可能是( )
A.硝酸铵 B.烧碱 C.食盐 D.熟石灰
3.有一瓶密封保存长期放置的氯化钠溶液,下列说法正确的是( )
A.瓶口附近的溶液较稀 B.瓶底附近的溶液较浓
C.瓶底会有固体析出 D.瓶内各部分溶液的浓度都相同
4.在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则( )
A.晶体质量不变 B. 晶体质量减少
C.氯化钠溶解度增大 D. 溶质质量分数增大
5.打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随( )
A.压强增大而减小 B.压强减小而减小
C.温度升高而升高 D.温度降低而减小
6.生活中的洗涤问题大都与化学知识有关.下列说法中不正确的是( )
A.洗涤剂能够除去油污的原因是因为洗涤剂具有乳化作用
B.汽油能够除去油污的原因是汽油能够溶解油污从而挥发除去
C.食醋能够除去热水瓶中水垢的原因是二者发生了化学反应
D.盐酸能够除去铁制品表面上的铁锈的原因是二者发生了物理变化
7.将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列有关量随时间变化趋势的图像不正确的是 ( )
8.实验室要配制50g 10%的氯化钠溶液,其中操作方法不正确的是( )
A.计算所需氯化钠的质量为5g,水的体积为45mL
B.在托盘天平左盘加5g砝码,然后在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.用50mL量筒量取45mL水,倒入上述烧杯中
D.用玻璃棒搅拌,使氯化钠完全溶解
9.右图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )
A.甲物质的溶解度为60g
B.t℃时,甲、乙两物质的溶解度相等
C.升高温度可使不饱和的甲溶液变为饱和
D.乙物质的溶解度随温度的升高而增大
10、某温度下,向一定量饱和石灰水中加入适量生石灰,充分反应后,恢复到原来温度,则溶液的质量( )
A.增大 B.减小 C.不变 D.无法判断
11.将80g质量分数为35%的浓盐酸,稀释成10%的稀盐酸,需加水的质量为( )
A.80g B. 100g C.200g D.280g
12.如右图所示,试管中盛有无色液体A,气球中装有固体B,将气球中的固体B倒入液体A中,观察到装置中的小气球鼓起来,则使用的固体和液体可以是( )
①石灰石和稀盐酸 ②镁和稀硫酸 ③氯化钠固体和水 ④生石灰和水.
A.①②③ B.①③④ C.①②④ D.②③④
13.室温时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质的质量分数为40%),另一瓶为10% 的溶液。下列实验操作中,无法区分这两种溶液的是( )
A.加一定量的水 B. 加入少量硝酸钾晶体
C. 略降低温度 D. 室温时,蒸发少量水
14.如图是 A、B、C三种固体物质(均不含结晶水)的溶解度曲线,下列说法不正确的是( )
A.t1℃时,取50gA的饱和溶液,将温度升高到t2℃,此时溶
液中A的质量分数变大(假设升温时溶剂没有损失)
B.t1℃,将A、B、C各a g放入100g水中,充分搅拌,
所得溶液溶质质量分数均相等
C.t3℃时,取相同质量的A、B、C三种饱和溶液降温到t1℃,
析出晶体最多的是A,没有晶体析出并变成不饱和溶液的是C
D.从A与少量C的混合物中提纯A,可用降温结晶的方法
二、填空题
15.现有20℃时10%的碳酸钠溶液150g,则:
(1)从该溶液中取出50g,其中含溶质 g
(2)将剩余溶液蒸发20g水后,其溶液的溶质质量分数是 。(蒸发过程中无晶体析出)
16.有A、B、C、D四个烧杯中分别盛有质量相等的同种溶剂,在相同的温度下,向四个小烧杯中分别加入200 g、150 g、100 g、50 g某溶质,充分溶解后,如图所示。请回答:
(1) (填序号,下同)中盛的可能是饱和溶液; 中盛的一定是不饱和溶液。
(2)四个烧杯中溶液的溶质质量分数由小到大的顺序是: 。
(3)若固体溶质是硝酸钾,对A、B两个烧杯同时升高温度(均匀进行),固体物质先消失的是 。
17.右图是a、b、c 三种固体物质的溶解度曲线,请回答下列问题:
(1)若使a、c 的饱和溶液同时析出晶体,方法是 。
(2) ℃时,a、c 两物质的溶解度相等。气体溶解度随温度的变化规律与 (填a、b或c)相似。
(3)在t2℃时,a、b、c 三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是 ,析出晶体最多的是 (填“a”、“b”或“无法确定”)。
(4)在t2℃时,将150 克a 的饱和溶液稀释成质量分数为20%的溶液需加水 克。
18.黄铜是Zn以主要添加元素的铜合金。黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4=ZnSO4+H2O; CuO+H2SO4=CuSO4+H2O
步骤Ⅰ中产生气体的化学方程式为 。
(2) 溶液A中的金属阳离子有 (填化学式)
(3) 步骤Ⅰ、Ⅱ中均包含的操作名称为 ,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是 。
(4)溶液A (填“大于”、“小于”或“等于”)溶液C的质量。
19.根据下列装置图填写有关空格:
A B C D
E F G H I
(1)装置A中仪器①的名称为 ;装置D中仪器②的名称为 。
(2)用稀硫酸和锌粒制氢气的发生装置可选用上述 或 (填序号)装置;收集氢气可用 或 (填序号)装置。
(3)用氢氧化钠固体和水配制100 g质量分数为5%的氢氧化钠溶液,其实验步骤是 、称量、量取、 、装瓶贴标签,用到上图装置中的 (填序号)。还必须用下列玻璃仪器组合中的 (填序号)才能完成实验。
①滴管、量筒、试剂瓶、玻璃棒 ②滴管、量筒、试管、玻璃棒
③集气瓶、表面皿、广口瓶、量筒
(4)若配制过程中,在已经有少量水的烧杯中加入5g氢氧化钠和95mL水,其他操作均规范,则所得溶液中氢氧化钠的质量分数 (填“>”或“<”,或“=”)5%。
三、实验探究题
20. Mg与NH4Cl溶液反应,除生成MgCl2外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是HCl,NH3,H2中的一种或几种。猜想的依据是________________。
【查阅资料】
NH3+HCl=NH4Cl ② NH3+H2SO4=(NH4)2SO4
④NH3溶于水呈碱性,酚酞遇碱性溶液变红
【实验探究】
(1)为确定是否含有HCl,将气体通入酸化的AgNO3溶液中,无沉淀产生,则该气体中无HCl。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
A中的观察到现象是_________________,证明有NH3;
B中玻璃管内观察到______________________,证明有H2;
硫酸的作用是__________________。
【实验结论】 Mg与NH4Cl溶液反应生成MgCl2,NH3和H2。写出化学方程式_________________。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验HCl,就能证明HCl不存在。请评价这种说法是否合理______填“是”或“否”),理由是___________________________。
四、计算题
21.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
实 验 一 二 三 四
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)上表中m的数值是 ;
(2)这种石灰石矿中碳酸钙的质量分数是多少?
(3)稀盐酸中溶质的质量分数是多少?
PAGE
1
同课章节目录
