(5)海洋化学资源——2021-2022学年化学鲁教版九年级下册同步课时作业(word版 含解析)
文档属性
| 名称 | (5)海洋化学资源——2021-2022学年化学鲁教版九年级下册同步课时作业(word版 含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 254.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-20 09:51:08 | ||
图片预览




文档简介
(5)海洋化学资源
——2021-2022学年化学鲁教版九年级下册同步课时作业
1.海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是( )
A.纯碱 B.单质镁 C.烧碱 D.粗盐
2.下列与海洋资源相关的叙述中,不正确的是( )
A.海洋中的主要物质是氯化钠
B.从海水中制取镁的过程发生了化学变化
C.海水中含量最多的元素是氧元素
D.海水制镁过程中能量转化形式包含将电能转化成化学能
3.如图8-1-4所示,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加
B.溶剂质量减少
C.溶液质量不变
D.溶质质量分数减少
4.在淡水缺乏的海岛上,可利用如图所示简易装置从海水中获取淡水。下列说法不正确的是( )
A.水杯中的水是淡水 B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水 D.获取淡水的快慢与温度有关
5.下列有关海水综合利用的说法正确的是( )
A.电解氯化镁溶液可得到金属镁
B.海水晒盐得到食盐后的母液可用于提取多种化工原料
C.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
D.利用潮汐发电是将化学能转化为电能
6.海洋是人类巨大的资源宝库,海洋资源的开发前景十分广阔。下列有关海洋资源的叙述正确的是( )
A.近年来海水因二氧化碳等非金属氧化物的增加而酸化,因为这些氧化物溶于海水中会使海水pH增大
B.海水中质量最多的元素是氯元素
C.海水“制碱”时析出晶体后的溶液中只含有两种物质
D.利用海水可以提取镁盐制取镁
7.海水综合利用流程如下,有关说法错误的是( )
A.从母液中可进一步制得金属镁
B.①处操作是溶解、过滤、蒸发结晶
C.海水“晒盐”得到的粗盐还含有杂质
D.析出粗盐后的母液是氯化钠的不饱和溶液
8.下列有关海洋资源及其综合利用的说法错误的是( )
A.海水制镁应用了富集提纯的思想
B.蒸馏法淡化海水是利用了海水中各组分的颗粒大小不同
C.海底的可燃冰大量燃烧后,也会造成温室效应
D.侯氏制碱法生产过程需要同合成氨厂联合,故称联合制碱法
9.利用蒸发、冷凝的方法可以从海水中获取淡水,下列叙述正确的是( )
A.蒸发时,水分子的运动速率加快 B.蒸发时,海水的质量变大
C.冷凝时,水分子之间的间隔不变 D.冷凝时,淡水的体积不变
10.我国海域可燃冰开采取得重大突破。下列有关可燃冰的叙述正确的是( )
A.可燃冰是一种纯净物
B.可燃冰在常温常压下不易长久保存
C.可燃冰的成功开发利用使“水变油”成为可能
D.可燃冰作为一种清洁能源对环境没有任何危害
11.从海水中得到的粗盐中往往含有可溶性杂质(主要有)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图8-2-8。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是搅拌,以便加快过滤速度
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为溶液、NaOH溶液、溶液
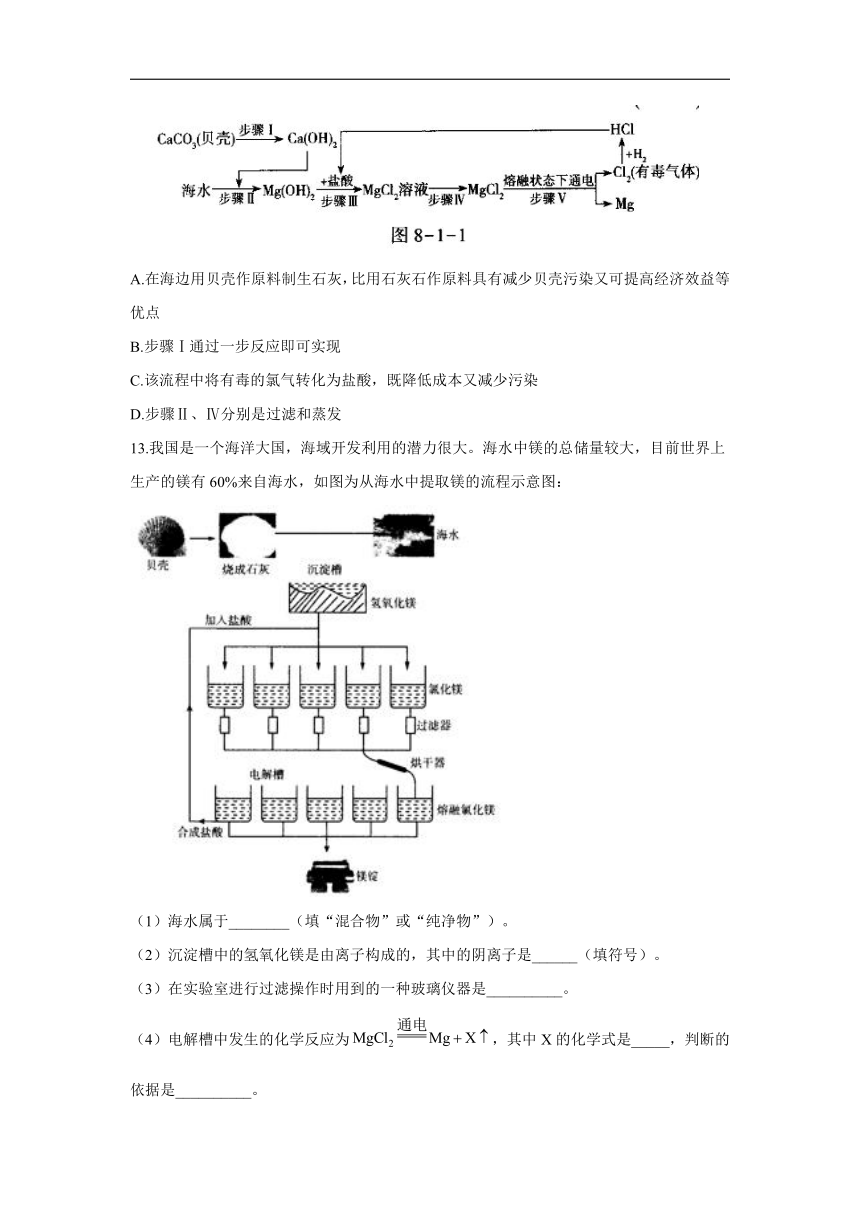
12.海水是一种重要资源,利用海水可制取镁等物质,某化学兴趣小组的同学设计了如下实验流程进行实验。分析该流程图,下列说法错误的是( )
A.在海边用贝壳作原料制生石灰,比用石灰石作原料具有减少贝壳污染又可提高经济效益等优点
B.步骤Ⅰ通过一步反应即可实现
C.该流程中将有毒的氯气转化为盐酸,既降低成本又减少污染
D.步骤Ⅱ、Ⅳ分别是过滤和蒸发
13.我国是一个海洋大国,海域开发利用的潜力很大。海水中镁的总储量较大,目前世界上生产的镁有60%来自海水,如图为从海水中提取镁的流程示意图:
(1)海水属于________(填“混合物”或“纯净物”)。
(2)沉淀槽中的氢氧化镁是由离子构成的,其中的阴离子是______(填符号)。
(3)在实验室进行过滤操作时用到的一种玻璃仪器是__________。
(4)电解槽中发生的化学反应为,其中X的化学式是_____,判断的依据是__________。
(5)该流程中可循环使用的物质是___________。
14.综合利用海洋资源将是未来的发展趋势,我们的家乡是座美丽的滨海小城,这里的海洋蕴含着丰富的资源,如图8-1-11是某设计院设计的综合利用海水的流程图。请据图回答问题:
(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质的_________或__________不同进行分离。证明所得淡水中不含氯化钠的化学方法是_________。
(2)如果要充分利用海边的贝壳资源,过程④生成氢氧化镁的化学方程式是_________,该反应的基本反应类型是_________。
(3)离子交换膜是对特定离子的选择性透过膜,可以使带特定电量的离子透过。过程②中“某种离子交换膜”选择透过的离子特点是___________。
15.2019年12月17日,我国首艘国产航母山东舰正式入列,它和辽宁舰一起组成了我国首支双航母编队,共同守卫我国绵长的海岸线及丰富的海洋资源。
(1)可燃冰被科学家誉为“未来能源”“21世纪能源”。我国在南海海域试采可燃冰已获得成功,成为全球第一个在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰是一种海底新型矿产资源,它是由天然气和水在低温、高压条件下形成的冰状固体,其中甲烷占80%~99.9%(可表示为),能直接点燃,所以称为“可燃冰”。
①甲烷充分燃烧的化学方程式为__________________。
②为什么说可燃冰是清洁能源?__________________。
(2)金属镁广泛应用于国防工业和生产生活。如图8-1-5所示为从卤水(或海水)中提取镁的工艺流程:
①在上述工艺流程中,步骤①中所发生的反应属于_________反应(选填“化合”“分解”“复分解”或“中和”)。
②从海水中提取时,经历了“”的转化过程,请分析这样做的目的是什么?_________。
答案以及解析
1.答案:D
解析:物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化;反之,则是物理变化。A、把从海水中获得的氯化钠配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,氢氧化钠和二氧化碳反应得到碳酸钠,属化学变化;B、通过电解熔融的氯化镁得到镁,是化学变化;C、把从海水中获得的氯化钠配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化;D、把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得。故选D。
2.答案:A
解析:海洋中最多的物质是水,不是氯化钠,故A错误;从海水中制得金属镁生成了新物质,发生了化学变化,故B正确;海水中含量最多的物质是水,水中含量最多的元素是氧,故C正确;海水制镁过程中,电解氯化镁制取镁是将电能转化成化学能,故D正确。
3.答案:B
解析:由题图知,水分子可以透过淡化膜到左侧淡水池,而右侧海水中的各种离子不能通过淡化膜,所以右侧海水中溶质质量不变,故A错误;右侧海水中溶剂质量减少,故B正确;右侧海水中溶液质量减少,故C错误;右侧海水中溶质质量分数增大,故D错误。
4.答案:C
解析:利用该装置得到淡水的原理是海水中的水变成水蒸气,然后水蒸气在塑料膜上凝结成水,滴落到水杯中,水杯中的水属于淡水,A正确;从海水中获取淡水的过程中没有新物质生成,是物理变化,B正确;活性炭具有吸附性,只能除去水中的色素和异味,不能将海水淡化,C错误;温度越高,海水中的水蒸发得越快,获取淡水越快,所以获取淡水的快慢与温度有关,D正确。
5.答案:B
解析:A. 电解氯化镁溶液可得到氢氧化镁,错误;B. 海水晒盐得到食盐后的母液中含有多种物质,可用于提取多种化工原料,正确;C. 海水中的碘以化合物的形式存在,升华出来的还是碘的化合物,不是碘单质,错误;D. 利用潮汐发电是将动能和势能转化为电能,错误。故选B。
6.答案:D
解析:近年来海水因二氧化碳等非金属氧化物的增加而酸化,这些氧化物溶于海水中会使海水pH减小,A错误。海水中质量最多的元素是氧元素,B错误。海水“制碱”时析出晶体后的溶液中含有水、氯化钠、碳酸氢钠、氯化铵等多种物质,C错误。利用海水可以提取镁盐(如氯化镁、硫酸镁)制取镁,D正确。
7.答案:D
解析:析出晶体后的溶液一定是该物质的饱和溶液,析出粗盐后的母液是氯化钠的饱和溶液。
8.答案:B
解析:海水制镁应用了富集提纯的思想,A正确。蒸馏法淡化海水是利用海水中各成份的沸点不同进行分离的,B错误。可燃冰主要成分是甲烷,大量燃烧后会生成二氧化碳,也会造成温室效应,C正确。侯氏制碱法生产过程中需要通入氨气,需要同合成氨厂联合,故称联合制碱法,D正确。
9.答案:A
解析:分子是不断运动的,温度升高,分子的运动速率加快;蒸发时,由于水分子不断运动到空气中,因此海水的质量会减小;冷凝时,水分子之间的间隔会变小,淡水的体积缩小。
10.答案:B
解析:可燃冰的主要成分是甲烷,还含有其他多种物质,是混合物,故A错误;可燃冰常温常压下易由固态变成液态或气态,不易长久保存,故B正确;化学变化前后元素的种类不变,水中只有氢、氧元素,而油中含有碳元素,所以水变油是伪科学,故C错误;可燃冰分解产生甲烷,燃烧生成物中有二氧化碳,甲烷和二氧化碳在空气中含量增多会造成温室效应,危害环境,故D错误。
11.答案:B
解析:由题意可知,粗盐中不溶性杂质主要是泥沙,故A正确;过滤时玻璃棒的作用是引流,故B错误;蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将滤液蒸干,故C正确;加入过量的氢氧化钠溶液可以将镁离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀,加入过量的碳酸钠溶液可以将钙离子转化为沉淀,但是加入碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠还会除去反应剩余的氯化钡,操作①②③依次加入的试剂可以为溶液、NaOH溶液、溶液,故D正确。
12.答案:B
解析:在海边用贝壳作原料制生石灰,比用石灰石作原料具有减少贝壳污染,又可减少运输成本提高经济效益等优点,故A正确;步骤Ⅰ需通过两步反应实现,首先高温煅烧贝壳制取氧化钙,然后氧化钙与水反应生成氢氧化钙,故B错误;该流程中将有毒的氯气转化为盐酸,既降低成本又减少污染,故C正确;步骤Ⅱ是采用过滤的方法将固体氢氧化镁从液体中分离出来,步骤Ⅳ是通过蒸发得到氯化镁固体,故D正确。
13.答案:(1)混合物(2)(3)烧杯(或漏斗或玻璃棒)
(4);化学反应前后,原子的种类和个数不变(5)盐酸
解析: (5)由题图可知,氢氧化镁变成氯化镁需要消耗盐酸,电解熔融氯化镁时产生的氯气又可以合成盐酸重新利用,所以盐酸可以循环使用。
14.答案:(1)颗粒大小;沸点;取少量淡水于试管中,加入硝酸银溶液,不产生白色沉淀
(2)或
(3)带有一个单位电荷的离子
解析:本题考查学生宏观辨识与微观探析能力的素养。(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质的颗粒大小或沸点不同进行分离。证明所得淡水中不含氯化钠的化学方法:取少量淡水于试管中,加入硝酸银溶液,不产生白色沉淀。
(2)根据溶液B中的离子可知,溶液中的氯化镁或硫酸镁能与氢氧化钙反应生成氢氧化镁和氯化钙或硫酸钙,反应的化学方程式为或,以上反应都是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应。
(3)由溶液A、B中的离子的成分可知,只有带有一个单位电荷的离子可以通过“某种离子交换膜”,而带有两个以上电荷的离子不能通过。
15.答案:(1)①;②可燃冰完全燃烧的产物是水和二氧化碳
(2)①复分解;②富集提纯
解析:(1)①在点燃的条件下,甲烷和氧气反应生成二氧化碳和水;②可燃冰完全燃烧的产物是水和二氧化碳,因此属于清洁能源。
(2)①卤水(或海水)中提取镁的工艺流程中,氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,该反应是由两种化合物相互交换成分生成两种新的化合物,属于复分解反应;②海水中氯化镁的浓度较低,从海水中提取时,经历了“”的转化过程,这样做的目的是富集提纯氯化镁。
——2021-2022学年化学鲁教版九年级下册同步课时作业
1.海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是( )
A.纯碱 B.单质镁 C.烧碱 D.粗盐
2.下列与海洋资源相关的叙述中,不正确的是( )
A.海洋中的主要物质是氯化钠
B.从海水中制取镁的过程发生了化学变化
C.海水中含量最多的元素是氧元素
D.海水制镁过程中能量转化形式包含将电能转化成化学能
3.如图8-1-4所示,海水淡化可采用膜分离技术,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加
B.溶剂质量减少
C.溶液质量不变
D.溶质质量分数减少
4.在淡水缺乏的海岛上,可利用如图所示简易装置从海水中获取淡水。下列说法不正确的是( )
A.水杯中的水是淡水 B.从海水中获取淡水是物理变化
C.海水通过活性炭吸附也能获取淡水 D.获取淡水的快慢与温度有关
5.下列有关海水综合利用的说法正确的是( )
A.电解氯化镁溶液可得到金属镁
B.海水晒盐得到食盐后的母液可用于提取多种化工原料
C.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
D.利用潮汐发电是将化学能转化为电能
6.海洋是人类巨大的资源宝库,海洋资源的开发前景十分广阔。下列有关海洋资源的叙述正确的是( )
A.近年来海水因二氧化碳等非金属氧化物的增加而酸化,因为这些氧化物溶于海水中会使海水pH增大
B.海水中质量最多的元素是氯元素
C.海水“制碱”时析出晶体后的溶液中只含有两种物质
D.利用海水可以提取镁盐制取镁
7.海水综合利用流程如下,有关说法错误的是( )
A.从母液中可进一步制得金属镁
B.①处操作是溶解、过滤、蒸发结晶
C.海水“晒盐”得到的粗盐还含有杂质
D.析出粗盐后的母液是氯化钠的不饱和溶液
8.下列有关海洋资源及其综合利用的说法错误的是( )
A.海水制镁应用了富集提纯的思想
B.蒸馏法淡化海水是利用了海水中各组分的颗粒大小不同
C.海底的可燃冰大量燃烧后,也会造成温室效应
D.侯氏制碱法生产过程需要同合成氨厂联合,故称联合制碱法
9.利用蒸发、冷凝的方法可以从海水中获取淡水,下列叙述正确的是( )
A.蒸发时,水分子的运动速率加快 B.蒸发时,海水的质量变大
C.冷凝时,水分子之间的间隔不变 D.冷凝时,淡水的体积不变
10.我国海域可燃冰开采取得重大突破。下列有关可燃冰的叙述正确的是( )
A.可燃冰是一种纯净物
B.可燃冰在常温常压下不易长久保存
C.可燃冰的成功开发利用使“水变油”成为可能
D.可燃冰作为一种清洁能源对环境没有任何危害
11.从海水中得到的粗盐中往往含有可溶性杂质(主要有)和不溶性杂质(泥沙等),必须进行分离和提纯后才能使用。粗盐提纯的部分流程如图8-2-8。有关该流程说法错误的是( )
A.不溶性杂质主要是泥沙
B.过滤时玻璃棒的作用是搅拌,以便加快过滤速度
C.蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D.操作①②③依次加入的试剂可以为溶液、NaOH溶液、溶液
12.海水是一种重要资源,利用海水可制取镁等物质,某化学兴趣小组的同学设计了如下实验流程进行实验。分析该流程图,下列说法错误的是( )
A.在海边用贝壳作原料制生石灰,比用石灰石作原料具有减少贝壳污染又可提高经济效益等优点
B.步骤Ⅰ通过一步反应即可实现
C.该流程中将有毒的氯气转化为盐酸,既降低成本又减少污染
D.步骤Ⅱ、Ⅳ分别是过滤和蒸发
13.我国是一个海洋大国,海域开发利用的潜力很大。海水中镁的总储量较大,目前世界上生产的镁有60%来自海水,如图为从海水中提取镁的流程示意图:
(1)海水属于________(填“混合物”或“纯净物”)。
(2)沉淀槽中的氢氧化镁是由离子构成的,其中的阴离子是______(填符号)。
(3)在实验室进行过滤操作时用到的一种玻璃仪器是__________。
(4)电解槽中发生的化学反应为,其中X的化学式是_____,判断的依据是__________。
(5)该流程中可循环使用的物质是___________。
14.综合利用海洋资源将是未来的发展趋势,我们的家乡是座美丽的滨海小城,这里的海洋蕴含着丰富的资源,如图8-1-11是某设计院设计的综合利用海水的流程图。请据图回答问题:
(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质的_________或__________不同进行分离。证明所得淡水中不含氯化钠的化学方法是_________。
(2)如果要充分利用海边的贝壳资源,过程④生成氢氧化镁的化学方程式是_________,该反应的基本反应类型是_________。
(3)离子交换膜是对特定离子的选择性透过膜,可以使带特定电量的离子透过。过程②中“某种离子交换膜”选择透过的离子特点是___________。
15.2019年12月17日,我国首艘国产航母山东舰正式入列,它和辽宁舰一起组成了我国首支双航母编队,共同守卫我国绵长的海岸线及丰富的海洋资源。
(1)可燃冰被科学家誉为“未来能源”“21世纪能源”。我国在南海海域试采可燃冰已获得成功,成为全球第一个在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰是一种海底新型矿产资源,它是由天然气和水在低温、高压条件下形成的冰状固体,其中甲烷占80%~99.9%(可表示为),能直接点燃,所以称为“可燃冰”。
①甲烷充分燃烧的化学方程式为__________________。
②为什么说可燃冰是清洁能源?__________________。
(2)金属镁广泛应用于国防工业和生产生活。如图8-1-5所示为从卤水(或海水)中提取镁的工艺流程:
①在上述工艺流程中,步骤①中所发生的反应属于_________反应(选填“化合”“分解”“复分解”或“中和”)。
②从海水中提取时,经历了“”的转化过程,请分析这样做的目的是什么?_________。
答案以及解析
1.答案:D
解析:物理变化和化学变化的根本区别在于是否有新物质生成,如果有新物质生成,则属于化学变化;反之,则是物理变化。A、把从海水中获得的氯化钠配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,氢氧化钠和二氧化碳反应得到碳酸钠,属化学变化;B、通过电解熔融的氯化镁得到镁,是化学变化;C、把从海水中获得的氯化钠配制成饱和食盐水,然后电解,即得烧碱、氢气和氯气,是化学变化;D、把海水经太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得。故选D。
2.答案:A
解析:海洋中最多的物质是水,不是氯化钠,故A错误;从海水中制得金属镁生成了新物质,发生了化学变化,故B正确;海水中含量最多的物质是水,水中含量最多的元素是氧,故C正确;海水制镁过程中,电解氯化镁制取镁是将电能转化成化学能,故D正确。
3.答案:B
解析:由题图知,水分子可以透过淡化膜到左侧淡水池,而右侧海水中的各种离子不能通过淡化膜,所以右侧海水中溶质质量不变,故A错误;右侧海水中溶剂质量减少,故B正确;右侧海水中溶液质量减少,故C错误;右侧海水中溶质质量分数增大,故D错误。
4.答案:C
解析:利用该装置得到淡水的原理是海水中的水变成水蒸气,然后水蒸气在塑料膜上凝结成水,滴落到水杯中,水杯中的水属于淡水,A正确;从海水中获取淡水的过程中没有新物质生成,是物理变化,B正确;活性炭具有吸附性,只能除去水中的色素和异味,不能将海水淡化,C错误;温度越高,海水中的水蒸发得越快,获取淡水越快,所以获取淡水的快慢与温度有关,D正确。
5.答案:B
解析:A. 电解氯化镁溶液可得到氢氧化镁,错误;B. 海水晒盐得到食盐后的母液中含有多种物质,可用于提取多种化工原料,正确;C. 海水中的碘以化合物的形式存在,升华出来的还是碘的化合物,不是碘单质,错误;D. 利用潮汐发电是将动能和势能转化为电能,错误。故选B。
6.答案:D
解析:近年来海水因二氧化碳等非金属氧化物的增加而酸化,这些氧化物溶于海水中会使海水pH减小,A错误。海水中质量最多的元素是氧元素,B错误。海水“制碱”时析出晶体后的溶液中含有水、氯化钠、碳酸氢钠、氯化铵等多种物质,C错误。利用海水可以提取镁盐(如氯化镁、硫酸镁)制取镁,D正确。
7.答案:D
解析:析出晶体后的溶液一定是该物质的饱和溶液,析出粗盐后的母液是氯化钠的饱和溶液。
8.答案:B
解析:海水制镁应用了富集提纯的思想,A正确。蒸馏法淡化海水是利用海水中各成份的沸点不同进行分离的,B错误。可燃冰主要成分是甲烷,大量燃烧后会生成二氧化碳,也会造成温室效应,C正确。侯氏制碱法生产过程中需要通入氨气,需要同合成氨厂联合,故称联合制碱法,D正确。
9.答案:A
解析:分子是不断运动的,温度升高,分子的运动速率加快;蒸发时,由于水分子不断运动到空气中,因此海水的质量会减小;冷凝时,水分子之间的间隔会变小,淡水的体积缩小。
10.答案:B
解析:可燃冰的主要成分是甲烷,还含有其他多种物质,是混合物,故A错误;可燃冰常温常压下易由固态变成液态或气态,不易长久保存,故B正确;化学变化前后元素的种类不变,水中只有氢、氧元素,而油中含有碳元素,所以水变油是伪科学,故C错误;可燃冰分解产生甲烷,燃烧生成物中有二氧化碳,甲烷和二氧化碳在空气中含量增多会造成温室效应,危害环境,故D错误。
11.答案:B
解析:由题意可知,粗盐中不溶性杂质主要是泥沙,故A正确;过滤时玻璃棒的作用是引流,故B错误;蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热将滤液蒸干,故C正确;加入过量的氢氧化钠溶液可以将镁离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀,加入过量的碳酸钠溶液可以将钙离子转化为沉淀,但是加入碳酸钠溶液要放在加入氯化钡溶液之后,这样碳酸钠还会除去反应剩余的氯化钡,操作①②③依次加入的试剂可以为溶液、NaOH溶液、溶液,故D正确。
12.答案:B
解析:在海边用贝壳作原料制生石灰,比用石灰石作原料具有减少贝壳污染,又可减少运输成本提高经济效益等优点,故A正确;步骤Ⅰ需通过两步反应实现,首先高温煅烧贝壳制取氧化钙,然后氧化钙与水反应生成氢氧化钙,故B错误;该流程中将有毒的氯气转化为盐酸,既降低成本又减少污染,故C正确;步骤Ⅱ是采用过滤的方法将固体氢氧化镁从液体中分离出来,步骤Ⅳ是通过蒸发得到氯化镁固体,故D正确。
13.答案:(1)混合物(2)(3)烧杯(或漏斗或玻璃棒)
(4);化学反应前后,原子的种类和个数不变(5)盐酸
解析: (5)由题图可知,氢氧化镁变成氯化镁需要消耗盐酸,电解熔融氯化镁时产生的氯气又可以合成盐酸重新利用,所以盐酸可以循环使用。
14.答案:(1)颗粒大小;沸点;取少量淡水于试管中,加入硝酸银溶液,不产生白色沉淀
(2)或
(3)带有一个单位电荷的离子
解析:本题考查学生宏观辨识与微观探析能力的素养。(1)步骤①是从海水中获得淡水的过程,工业上常采用的方法是膜法或多级闪急蒸馏法,分别是利用了混合体系中各物质的颗粒大小或沸点不同进行分离。证明所得淡水中不含氯化钠的化学方法:取少量淡水于试管中,加入硝酸银溶液,不产生白色沉淀。
(2)根据溶液B中的离子可知,溶液中的氯化镁或硫酸镁能与氢氧化钙反应生成氢氧化镁和氯化钙或硫酸钙,反应的化学方程式为或,以上反应都是两种化合物相互交换成分生成另外两种化合物的反应,属于复分解反应。
(3)由溶液A、B中的离子的成分可知,只有带有一个单位电荷的离子可以通过“某种离子交换膜”,而带有两个以上电荷的离子不能通过。
15.答案:(1)①;②可燃冰完全燃烧的产物是水和二氧化碳
(2)①复分解;②富集提纯
解析:(1)①在点燃的条件下,甲烷和氧气反应生成二氧化碳和水;②可燃冰完全燃烧的产物是水和二氧化碳,因此属于清洁能源。
(2)①卤水(或海水)中提取镁的工艺流程中,氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,该反应是由两种化合物相互交换成分生成两种新的化合物,属于复分解反应;②海水中氯化镁的浓度较低,从海水中提取时,经历了“”的转化过程,这样做的目的是富集提纯氯化镁。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
