山东省济宁市邹城市平阳东路第二中学2021-2022学年高二上学期12月月考化学试题(Word版含答案)
文档属性
| 名称 | 山东省济宁市邹城市平阳东路第二中学2021-2022学年高二上学期12月月考化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 704.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-21 12:38:33 | ||
图片预览

文档简介
邹城市平阳东路第二中学2021-2022学年高二上学期12月月考
化学试题
常见元素的相对原子质量:H 1 O 16 C 12 S 32 Cl 35.5 P 31 Fe 56 Cu 64 Li 7
Na 23 Ca 40 K39 Mg 24
第Ⅰ卷 (共 48 分)
一、单选题(每个小题只有 1 个正确答案,每个小题 2 分)
1. 某核素核外共有 15 个不同运动状态的电子,以下说法正确的( )
A. 若将该原子的电子排布式写成 1s22s22p63s23p 2 3p 1 ,它违背了泡利原理
x y
B. 原子中所有的电子占有 3 个能级,9 个轨道
C. 该元素的最高价氧化物的水化物为两性氢氧化物
D.基态原子中能量最高的电子的电子云的形状为哑铃形
2.下列说法错误的是( )
A. 2Px 所代表的含义是第二能层沿x 轴方向伸展的p 轨道
B. 节日里燃放的烟花焰火是金属原子受热从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨 道时,将能量以光能的形式释放出来
C. 某原子的电子排布式为 1s22s22p63s23p63d54s2,则该元素原子核外有 4 个能级
D. 在电子云示意图中,小黑点密表示电子在核外空间单位体积内出现的机会多
3. 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al 作阳极、Pb 作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2 Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 电解池
A H+移向 Pb 电极 H+移向 Pb 电极
B 每消耗 3molPb 生成 2molAl2O3
C 正极:PbO2+4H++2e— =Pb2++2H2O 阳极:2Al+3H2O-6e—=Al2O3+6H+
D
4. 下列设备工作时,可以实现化学能转化为电能的是( )
A B C D
太阳能集热器 锂离子电池 电饭煲 风力发电机
5. 下列说法正确的是( )
A. 通过构成原电池将反应的化学能全部转化为电能
B. 钢铁在潮湿的环境中易腐蚀,是因为钢铁里的铁和少量的碳与表面的水膜形成了无数微小原电池,其中负极发生的反应为Fe 3e =Fe3
C. 在电解池中电子由阳极流向外接电源的正极,从外接电源的负极流向阴极D.电解精炼铜时,若阳极质量减少 64g,则转移到阴极的电子等于 2 NA
6. 化学与生活、生产、能源、环境和社会可持续发展等密切相关。下列说法正确的是( )
A. 废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理B.钙钛矿太阳能电池和锂离子电池的工作原理相同
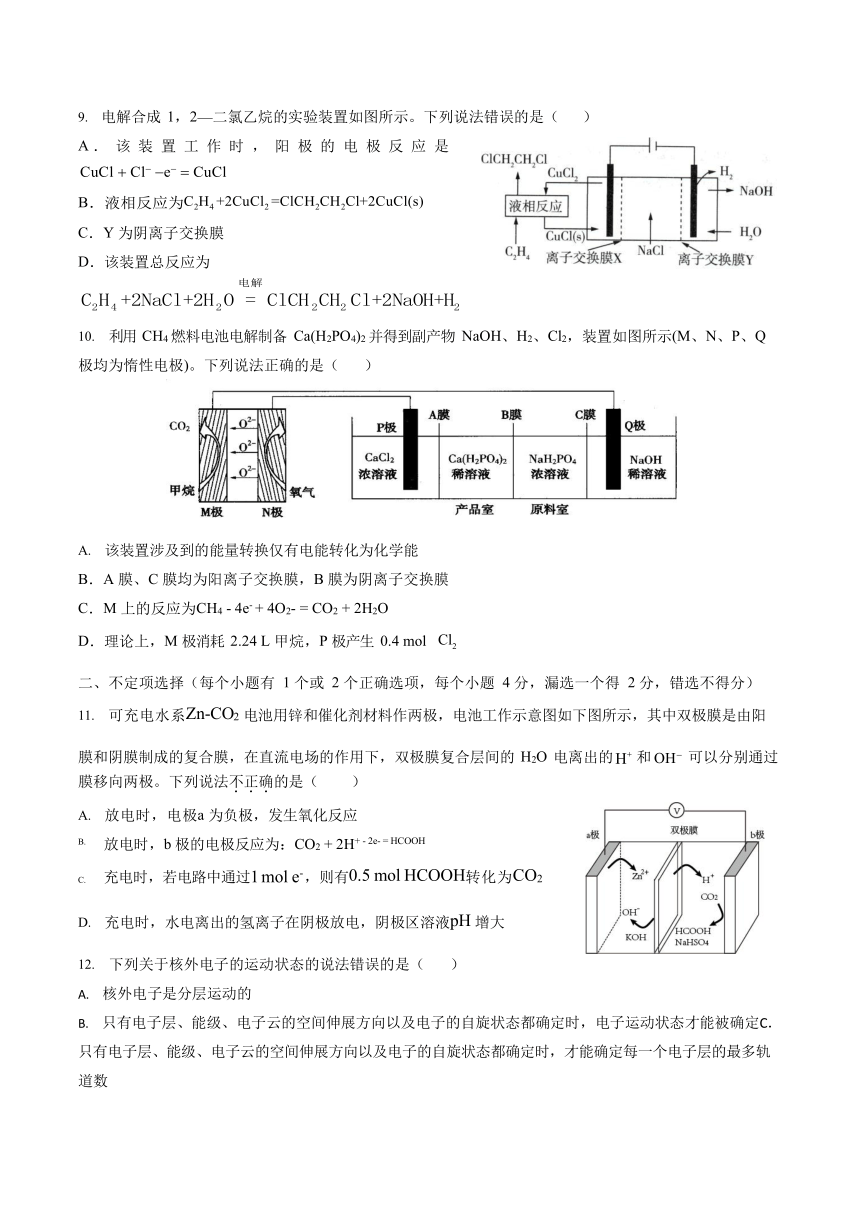
C.工业上常采取电解熔融氯化物制备活泼金属(如 Na、Mg、Al 等) D.燃料电池是利用燃料和氧气反应,将化学能转化为电能的化学电源7.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由 a 极流向 b 极 D.装置④中的离子交换膜允许阳离子、阴离子、水分子自由通过8.南京大学开发出一种以太阳能驱动的恒流电解装置,成功实现了从海水中提取金属锂,其工作原理如图。下列说法错误的是( )
A.工作时的能量转化形式:太阳能→化学能→电能B.铜箔为阴极,发生还原反应
C.阳极区可能有Cl2 和O2 生成
D.固体陶瓷膜可让海水中Li+ 选择性通过
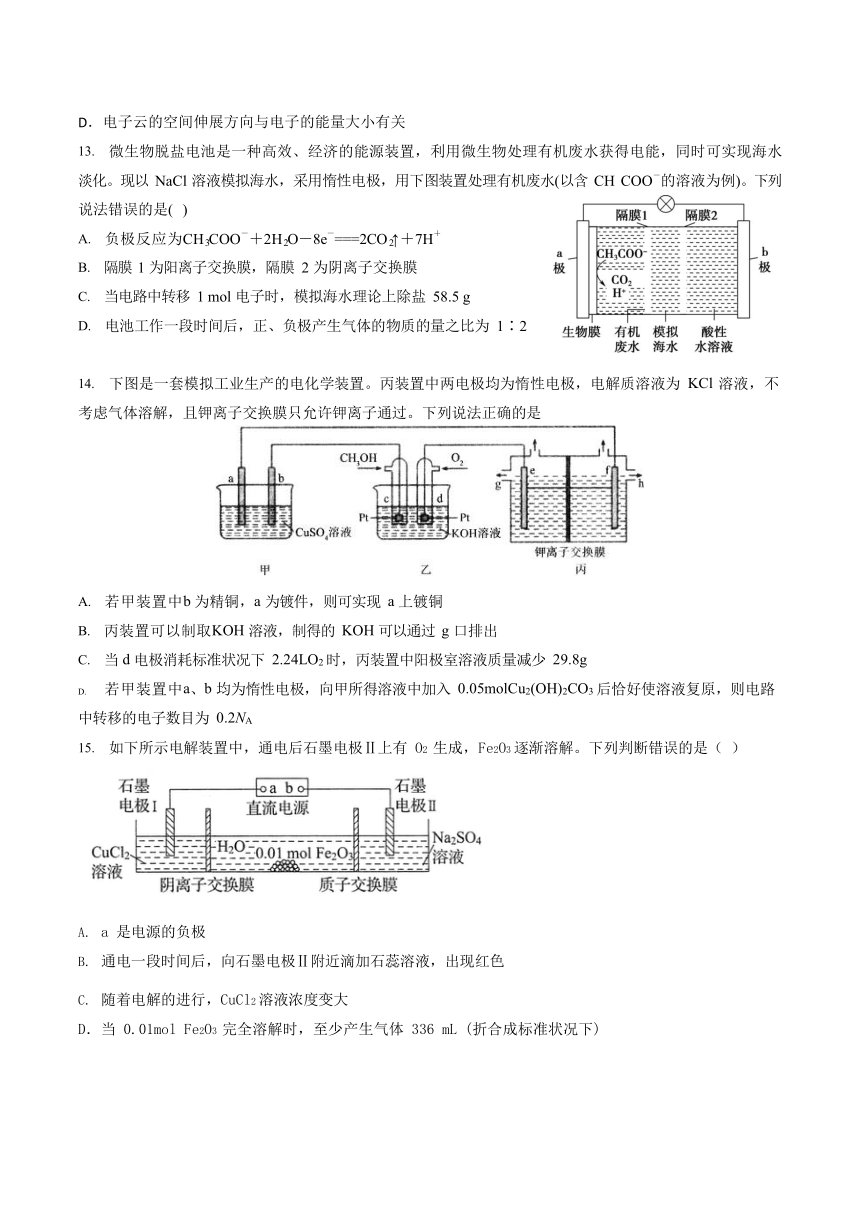
9. 电解合成 1,2—二氯乙烷的实验装置如图所示。下列说法错误的是( )
A . 该 装 置 工 作 时 , 阳 极 的 电 极 反 应 是
CuCl Cl e CuCl
B.液相反应为C2H4 +2CuCl2 =ClCH2CH2Cl+2CuCl(s)
C.Y 为阴离子交换膜
D.该装置总反应为
电解
C H +2NaCl+2H O = ClCH CH Cl+2NaOH+H
10. 利用 CH4 燃料电池电解制备 Ca(H2PO4)2 并得到副产物 NaOH、H2、Cl2,装置如图所示(M、N、P、Q
极均为惰性电极)。下列说法正确的是( )
A. 该装置涉及到的能量转换仅有电能转化为化学能
B.A 膜、C 膜均为阳离子交换膜,B 膜为阴离子交换膜
C.M 上的反应为CH4 - 4e- + 4O2- = CO2 + 2H2O
D.理论上,M 极消耗 2.24 L 甲烷,P 极产生 0.4 mol
Cl2
二、不定项选择(每个小题有 1 个或 2 个正确选项,每个小题 4 分,漏选一个得 2 分,错选不得分)
11. 可充电水系Zn-CO2 电池用锌和催化剂材料作两极,电池工作示意图如下图所示,其中双极膜是由阳
膜和阴膜制成的复合膜,在直流电场的作用下,双极膜复合层间的 H2O 电离出的H 和OH 可以分别通过膜移向两极。下列说法不.正.确.的是( )
A. 放电时,电极a 为负极,发生氧化反应
B. 放电时,b 极的电极反应为:CO2 + 2H+ - 2e- = HCOOH
C. 充电时,若电路中通过1 mol e- ,则有0.5 mol HCOOH转化为CO2
D. 充电时,水电离出的氢离子在阴极放电,阴极区溶液pH 增大
12. 下列关于核外电子的运动状态的说法错误的是( )
A. 核外电子是分层运动的
B. 只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,电子运动状态才能被确定C.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,才能确定每一个电子层的最多轨道数
C.
D.电子云的空间伸展方向与电子的能量大小有关
13. 微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH COO-的溶液为例)。下列说法错误的是( )
A. 负极反应为CH COO-+2H O-8e-===2CO ↑+7H+
B. 隔膜 1 为阳离子交换膜,隔膜 2 为阴离子交换膜
C. 当电路中转移 1 mol 电子时,模拟海水理论上除盐 58.5 g
D. 电池工作一段时间后,正、负极产生气体的物质的量之比为 1∶2
14. 下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为 KCl 溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是
A. 若甲装置中b 为精铜,a 为镀件,则可实现 a 上镀铜
B. 丙装置可以制取KOH 溶液,制得的 KOH 可以通过 g 口排出
C. 当 d 电极消耗标准状况下 2.24LO2 时,丙装置中阳极室溶液质量减少 29.8g
D. 若甲装置中a、b 均为惰性电极,向甲所得溶液中加入 0.05molCu2(OH)2CO3 后恰好使溶液复原,则电路中转移的电子数目为 0.2NA
15. 如下所示电解装置中,通电后石墨电极Ⅱ上有 O2 生成,Fe2O3 逐渐溶解。下列判断错误的是( )
A. a 是电源的负极
B. 通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C. 随着电解的进行,CuCl2 溶液浓度变大
D.当 0.01mol Fe2O3 完全溶解时,至少产生气体 336 mL (折合成标准状况下)
第Ⅱ卷 (共 52 分)
16.(10 分)A、B、C、D、E 代表前 4 周期的五种元素,原子序数依次增大。请填空:
(1) A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其电子轨道表示式为 。其原子核外共有 种不同运动状态的电子;其基态原子中最高能量能级轮廓图形状 ,其最
高能量能级的电子云在空间有 种伸展方向。
(2) B 元素的负一价离子的电子层结构与氩相同,B 离子的结构示意图为 。
(3) C 元素的正三价离子的 3d 能级为半充满,C 的元素符号为 ,该元素在周期表中的位置为
。
(4) D 元素基态原子的M 层全充满,N 层没有成对电子,只有一个未成对电子,D 的元素基态原子的电子排布式为 ,在元素周期表中的位置为 。
(5) E 元素基态原子中没有未成对电子,E 的价层电子排布式是 。
17.(17 分)回答下列问题:
(1) 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是 。
(2) 要实现铁上镀银,则阳极为 ,电极反应式为 ,阴极为 ,
电极反应式为 ,电镀液为 。
(3) 电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:
①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为 ,Y 电极上的电极反应式是 ,检验该电极反应产物的方法是 :
。
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4 溶液,则X 电极的材料是 ,电极反应式
是 ,Y 电极的材料是 ,电极反应式是 。(假设粗
铜中含铁、锌、银、金)
(4) 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO2-
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是 ;电解液中 H2SO4 的浓度将变 ;当外电
路通过 1 mol 电子时,理论上负极板的质量增加 _g。
充电时:阴极的电极反应式是 。
18.(10 分)Ⅰ、某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)
(1) 利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分 NaClO,则c 为电源的 极;该发生器中反应的总离子方程式为 。(2 分)
(2) 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取 ClO2的新工艺。
①阳极产生ClO2 的电极反应式: 。
②当阴极产生标准状况下 112mL 气体时,通过阳离子交换膜离子的物质的量为 。(2 分)
Ⅱ、化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解 NO -的原理如图所示。
①电源正极为 (填A 或 B),阴极反应式为 。
②若电解过程中转移了 2mol 电子,则膜两侧电解液的质量变化差
(Δm 左-Δm 右)为 g。(2 分)
19、(9 分)Ⅰ、电化学原理在工业生产中发挥着巨大的作用。Na2FeO4 是制造高铁电池的重要原料,同时
也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4 。
(1) 阳极的电极反应为 。
(2) 阴极产生的气体为 (填物质名称)。
(3) 左侧的离子交换膜为 (填“阴”或“阳”)离子交换膜, a% (填“>”“<”或“=”) b% 。
Ⅱ、氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。氨电解法制氢气,利用电解原理,将氨转化为高纯氢气,其装置如图所
示。
(1) 电解过程中OH 的移动方向为 (填“从左往右”或“从右往左”);
(2) 阳极的电极反应式为 。
Ⅲ、H2O2 是一种重要的化学品,其合成方法不断发展。电化学制备方法:已知反应 2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O 和O2 为原料制备H2O2,如图为制备装置示意图。
(1)a 极的电极反应式是 。
(2)下列说法正确的是 。(2 分)
A.该装置可以实现电能转化为化学能B.电极b 连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
20.(6 分)⑴ 氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的 H2O 解离成 H+和 OH-;A、B 为离子交换膜。
1 B 膜 最 佳 应 选 择 。
2 阳 极 的 电 极 反 应 式 是 。
3 少量的I-因浓度差通过 BPM 膜,若撤去 A 膜,其 缺 点 。
⑵如图为相互串联的甲、乙两个电解池(溶液足量),试回答下列问
①乙池中若滴入少量酚酞溶液,开始一段时间后,Fe 极附近呈 色。
②若甲池阴极增重 12.8 g,则乙池阳极放出气体在标准状况下的体积为 (不考虑气体溶解情况)。
CuSO4 溶液
邹城市平阳东路第二中学2021-2022学年高二上学期12月月考
化学试题答案
1. D 2. C 3. D 4. B 5. C 6. D 7、 C 8. A 9. C 10. B 二、不定项选择(每个小题有 1 个或 2 个正确选项,每个小题 4 分,漏选一个得 2 分,错选不得分) 11. BD 12. CD 13、 BD 14. C 15. C
16. 【答案】(1) 7 哑铃形 3(2) (3) Fe 第四周
期Ⅷ族 (4)1s22s22p63s23p63d104s1(或[Ar]3d104s1) 第 4 周期ⅠB 族 (5)3d104s2 或 4s24p6
17. 17.
电解
【答案】Ⅰ、(1) 负 Cl-+H2O ClO-+H2↑ (2) Cl--5e-+2H2O=ClO2↑+4H+ 0.01mol
Ⅱ、【答案】(1) ① A 2NO -+6H O+10e-=N ↑+12OH- ②14.4
19、Ⅰ、【答案】Fe 8OH 6e FeO2 4H O
氢气 阳 <
Ⅱ、【答案】(1)从右往左 (2)2NH3-6e-+6OH-= N2+6H2O
Ⅲ、【答案】① O2+2H++2e-= H2O2 ②AC
20.
⑵【答案】 红 4.48L
① ② ③ ④
电解溶液装置 电镀铜实验装置 氢氧燃料电池示意图 离子交换膜法电解原理示意图
铜箔
有机电解质固体陶瓷膜海水
催化电极
2 4 2 2 2 2
3 2 2
高选择性催化剂 质子交换膜
题。
3 2 2
4 2
化学试题
常见元素的相对原子质量:H 1 O 16 C 12 S 32 Cl 35.5 P 31 Fe 56 Cu 64 Li 7
Na 23 Ca 40 K39 Mg 24
第Ⅰ卷 (共 48 分)
一、单选题(每个小题只有 1 个正确答案,每个小题 2 分)
1. 某核素核外共有 15 个不同运动状态的电子,以下说法正确的( )
A. 若将该原子的电子排布式写成 1s22s22p63s23p 2 3p 1 ,它违背了泡利原理
x y
B. 原子中所有的电子占有 3 个能级,9 个轨道
C. 该元素的最高价氧化物的水化物为两性氢氧化物
D.基态原子中能量最高的电子的电子云的形状为哑铃形
2.下列说法错误的是( )
A. 2Px 所代表的含义是第二能层沿x 轴方向伸展的p 轨道
B. 节日里燃放的烟花焰火是金属原子受热从基态跃迁到激发态后,电子从高能级轨道跃迁回到低能级轨 道时,将能量以光能的形式释放出来
C. 某原子的电子排布式为 1s22s22p63s23p63d54s2,则该元素原子核外有 4 个能级
D. 在电子云示意图中,小黑点密表示电子在核外空间单位体积内出现的机会多
3. 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al 作阳极、Pb 作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2 Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 电解池
A H+移向 Pb 电极 H+移向 Pb 电极
B 每消耗 3molPb 生成 2molAl2O3
C 正极:PbO2+4H++2e— =Pb2++2H2O 阳极:2Al+3H2O-6e—=Al2O3+6H+
D
4. 下列设备工作时,可以实现化学能转化为电能的是( )
A B C D
太阳能集热器 锂离子电池 电饭煲 风力发电机
5. 下列说法正确的是( )
A. 通过构成原电池将反应的化学能全部转化为电能
B. 钢铁在潮湿的环境中易腐蚀,是因为钢铁里的铁和少量的碳与表面的水膜形成了无数微小原电池,其中负极发生的反应为Fe 3e =Fe3
C. 在电解池中电子由阳极流向外接电源的正极,从外接电源的负极流向阴极D.电解精炼铜时,若阳极质量减少 64g,则转移到阴极的电子等于 2 NA
6. 化学与生活、生产、能源、环境和社会可持续发展等密切相关。下列说法正确的是( )
A. 废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理B.钙钛矿太阳能电池和锂离子电池的工作原理相同
C.工业上常采取电解熔融氯化物制备活泼金属(如 Na、Mg、Al 等) D.燃料电池是利用燃料和氧气反应,将化学能转化为电能的化学电源7.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由 a 极流向 b 极 D.装置④中的离子交换膜允许阳离子、阴离子、水分子自由通过8.南京大学开发出一种以太阳能驱动的恒流电解装置,成功实现了从海水中提取金属锂,其工作原理如图。下列说法错误的是( )
A.工作时的能量转化形式:太阳能→化学能→电能B.铜箔为阴极,发生还原反应
C.阳极区可能有Cl2 和O2 生成
D.固体陶瓷膜可让海水中Li+ 选择性通过
9. 电解合成 1,2—二氯乙烷的实验装置如图所示。下列说法错误的是( )
A . 该 装 置 工 作 时 , 阳 极 的 电 极 反 应 是
CuCl Cl e CuCl
B.液相反应为C2H4 +2CuCl2 =ClCH2CH2Cl+2CuCl(s)
C.Y 为阴离子交换膜
D.该装置总反应为
电解
C H +2NaCl+2H O = ClCH CH Cl+2NaOH+H
10. 利用 CH4 燃料电池电解制备 Ca(H2PO4)2 并得到副产物 NaOH、H2、Cl2,装置如图所示(M、N、P、Q
极均为惰性电极)。下列说法正确的是( )
A. 该装置涉及到的能量转换仅有电能转化为化学能
B.A 膜、C 膜均为阳离子交换膜,B 膜为阴离子交换膜
C.M 上的反应为CH4 - 4e- + 4O2- = CO2 + 2H2O
D.理论上,M 极消耗 2.24 L 甲烷,P 极产生 0.4 mol
Cl2
二、不定项选择(每个小题有 1 个或 2 个正确选项,每个小题 4 分,漏选一个得 2 分,错选不得分)
11. 可充电水系Zn-CO2 电池用锌和催化剂材料作两极,电池工作示意图如下图所示,其中双极膜是由阳
膜和阴膜制成的复合膜,在直流电场的作用下,双极膜复合层间的 H2O 电离出的H 和OH 可以分别通过膜移向两极。下列说法不.正.确.的是( )
A. 放电时,电极a 为负极,发生氧化反应
B. 放电时,b 极的电极反应为:CO2 + 2H+ - 2e- = HCOOH
C. 充电时,若电路中通过1 mol e- ,则有0.5 mol HCOOH转化为CO2
D. 充电时,水电离出的氢离子在阴极放电,阴极区溶液pH 增大
12. 下列关于核外电子的运动状态的说法错误的是( )
A. 核外电子是分层运动的
B. 只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,电子运动状态才能被确定C.只有电子层、能级、电子云的空间伸展方向以及电子的自旋状态都确定时,才能确定每一个电子层的最多轨道数
C.
D.电子云的空间伸展方向与电子的能量大小有关
13. 微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH COO-的溶液为例)。下列说法错误的是( )
A. 负极反应为CH COO-+2H O-8e-===2CO ↑+7H+
B. 隔膜 1 为阳离子交换膜,隔膜 2 为阴离子交换膜
C. 当电路中转移 1 mol 电子时,模拟海水理论上除盐 58.5 g
D. 电池工作一段时间后,正、负极产生气体的物质的量之比为 1∶2
14. 下图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为 KCl 溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是
A. 若甲装置中b 为精铜,a 为镀件,则可实现 a 上镀铜
B. 丙装置可以制取KOH 溶液,制得的 KOH 可以通过 g 口排出
C. 当 d 电极消耗标准状况下 2.24LO2 时,丙装置中阳极室溶液质量减少 29.8g
D. 若甲装置中a、b 均为惰性电极,向甲所得溶液中加入 0.05molCu2(OH)2CO3 后恰好使溶液复原,则电路中转移的电子数目为 0.2NA
15. 如下所示电解装置中,通电后石墨电极Ⅱ上有 O2 生成,Fe2O3 逐渐溶解。下列判断错误的是( )
A. a 是电源的负极
B. 通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C. 随着电解的进行,CuCl2 溶液浓度变大
D.当 0.01mol Fe2O3 完全溶解时,至少产生气体 336 mL (折合成标准状况下)
第Ⅱ卷 (共 52 分)
16.(10 分)A、B、C、D、E 代表前 4 周期的五种元素,原子序数依次增大。请填空:
(1) A 元素基态原子的最外层有 3 个未成对电子,次外层有 2 个电子,其电子轨道表示式为 。其原子核外共有 种不同运动状态的电子;其基态原子中最高能量能级轮廓图形状 ,其最
高能量能级的电子云在空间有 种伸展方向。
(2) B 元素的负一价离子的电子层结构与氩相同,B 离子的结构示意图为 。
(3) C 元素的正三价离子的 3d 能级为半充满,C 的元素符号为 ,该元素在周期表中的位置为
。
(4) D 元素基态原子的M 层全充满,N 层没有成对电子,只有一个未成对电子,D 的元素基态原子的电子排布式为 ,在元素周期表中的位置为 。
(5) E 元素基态原子中没有未成对电子,E 的价层电子排布式是 。
17.(17 分)回答下列问题:
(1) 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是 。
(2) 要实现铁上镀银,则阳极为 ,电极反应式为 ,阴极为 ,
电极反应式为 ,电镀液为 。
(3) 电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:
①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为 ,Y 电极上的电极反应式是 ,检验该电极反应产物的方法是 :
。
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4 溶液,则X 电极的材料是 ,电极反应式
是 ,Y 电极的材料是 ,电极反应式是 。(假设粗
铜中含铁、锌、银、金)
(4) 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO2-
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是 ;电解液中 H2SO4 的浓度将变 ;当外电
路通过 1 mol 电子时,理论上负极板的质量增加 _g。
充电时:阴极的电极反应式是 。
18.(10 分)Ⅰ、某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)
(1) 利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分 NaClO,则c 为电源的 极;该发生器中反应的总离子方程式为 。(2 分)
(2) 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取 ClO2的新工艺。
①阳极产生ClO2 的电极反应式: 。
②当阴极产生标准状况下 112mL 气体时,通过阳离子交换膜离子的物质的量为 。(2 分)
Ⅱ、化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解 NO -的原理如图所示。
①电源正极为 (填A 或 B),阴极反应式为 。
②若电解过程中转移了 2mol 电子,则膜两侧电解液的质量变化差
(Δm 左-Δm 右)为 g。(2 分)
19、(9 分)Ⅰ、电化学原理在工业生产中发挥着巨大的作用。Na2FeO4 是制造高铁电池的重要原料,同时
也是一种新型的高效净水剂。在工业上通常利用如图装置生产Na2FeO4 。
(1) 阳极的电极反应为 。
(2) 阴极产生的气体为 (填物质名称)。
(3) 左侧的离子交换膜为 (填“阴”或“阳”)离子交换膜, a% (填“>”“<”或“=”) b% 。
Ⅱ、氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。氨电解法制氢气,利用电解原理,将氨转化为高纯氢气,其装置如图所
示。
(1) 电解过程中OH 的移动方向为 (填“从左往右”或“从右往左”);
(2) 阳极的电极反应式为 。
Ⅲ、H2O2 是一种重要的化学品,其合成方法不断发展。电化学制备方法:已知反应 2H2O2=2H2O+O2↑能自发进行,反向不能自发进行,通过电解可以实现由H2O 和O2 为原料制备H2O2,如图为制备装置示意图。
(1)a 极的电极反应式是 。
(2)下列说法正确的是 。(2 分)
A.该装置可以实现电能转化为化学能B.电极b 连接电源负极
C.该方法相较于早期剂备方法具有原料廉价,对环境友好等优点
20.(6 分)⑴ 氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的 H2O 解离成 H+和 OH-;A、B 为离子交换膜。
1 B 膜 最 佳 应 选 择 。
2 阳 极 的 电 极 反 应 式 是 。
3 少量的I-因浓度差通过 BPM 膜,若撤去 A 膜,其 缺 点 。
⑵如图为相互串联的甲、乙两个电解池(溶液足量),试回答下列问
①乙池中若滴入少量酚酞溶液,开始一段时间后,Fe 极附近呈 色。
②若甲池阴极增重 12.8 g,则乙池阳极放出气体在标准状况下的体积为 (不考虑气体溶解情况)。
CuSO4 溶液
邹城市平阳东路第二中学2021-2022学年高二上学期12月月考
化学试题答案
1. D 2. C 3. D 4. B 5. C 6. D 7、 C 8. A 9. C 10. B 二、不定项选择(每个小题有 1 个或 2 个正确选项,每个小题 4 分,漏选一个得 2 分,错选不得分) 11. BD 12. CD 13、 BD 14. C 15. C
16. 【答案】(1) 7 哑铃形 3(2) (3) Fe 第四周
期Ⅷ族 (4)1s22s22p63s23p63d104s1(或[Ar]3d104s1) 第 4 周期ⅠB 族 (5)3d104s2 或 4s24p6
17. 17.
电解
【答案】Ⅰ、(1) 负 Cl-+H2O ClO-+H2↑ (2) Cl--5e-+2H2O=ClO2↑+4H+ 0.01mol
Ⅱ、【答案】(1) ① A 2NO -+6H O+10e-=N ↑+12OH- ②14.4
19、Ⅰ、【答案】Fe 8OH 6e FeO2 4H O
氢气 阳 <
Ⅱ、【答案】(1)从右往左 (2)2NH3-6e-+6OH-= N2+6H2O
Ⅲ、【答案】① O2+2H++2e-= H2O2 ②AC
20.
⑵【答案】 红 4.48L
① ② ③ ④
电解溶液装置 电镀铜实验装置 氢氧燃料电池示意图 离子交换膜法电解原理示意图
铜箔
有机电解质固体陶瓷膜海水
催化电极
2 4 2 2 2 2
3 2 2
高选择性催化剂 质子交换膜
题。
3 2 2
4 2
同课章节目录
