第五单元课题2如何正确书写化学方程式同步练习—2021-2022学年九年级化学人教版上册(word版 含详解)
文档属性
| 名称 | 第五单元课题2如何正确书写化学方程式同步练习—2021-2022学年九年级化学人教版上册(word版 含详解) |  | |
| 格式 | docx | ||
| 文件大小 | 119.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-21 08:31:36 | ||
图片预览

文档简介
第五单元化学方程式课题2如何正确书写化学方程式
一、单选题,共12小题
1.下列现象不能用质量守恒定律解释的是
A.木材燃烧,余下灰烬的质量小于原木材质量 B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加
C.加热高锰酸钾,剩余固体质量减少 D.将一定质量的水冷凝后结成冰,质量不变
2.下列化学方程式书写正确的是
A.2P+5O2P2O5
B.2KMnO4K2MnO4 + MnO2 + O2
C.2CO + O22CO2
D.H2SO4+NaOH=NaSO4+H2O
3.张家口市一辆满载甲醇的罐车侧翻,甲醇大量外泄。已知可以用氨气处理含有甲醇的废水,X代表甲醇的化学式,有关反应的化学方程式为5X+12O2+6NH3=3N2+5CO2+19H2O,则甲醇的化学式为
A.C2H6OH B.CH4 C.NO2 D.CH3OH
4.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,得反应前后各物质的质量如下表。请根据质量守恒定律判断x的值为
物质 甲 乙 丙 丁
反应前的质量(g) 20 50 80 30
反应后的质量(g) 0 100 10 x
A.50 B.40 C.10 D.70
5.“银针验毒”其反应原理之一是4Ag+2X+O2= 2Ag2S+2H2O。则X的化学式为
A.S B.H2S C.SO2 D.SO3
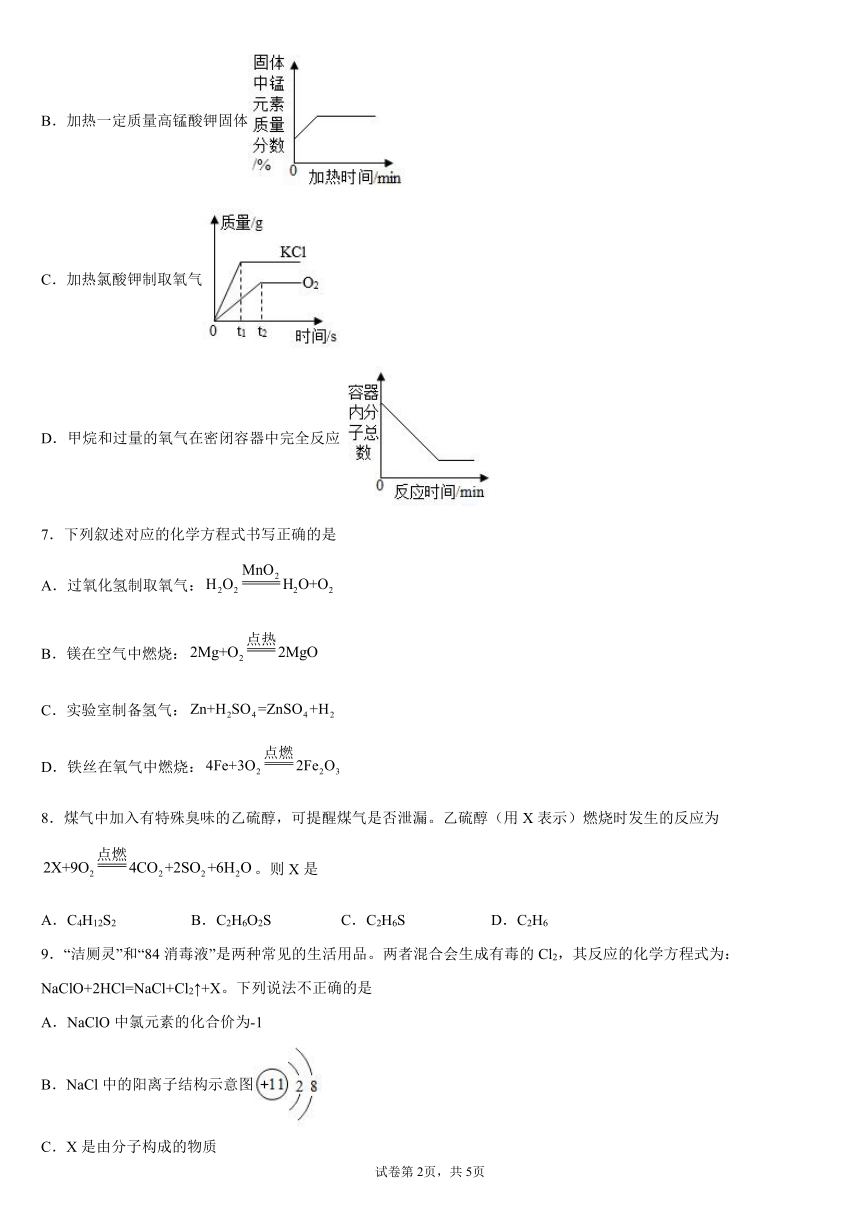
6.如图,能正确反映对应关系的是
A.利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
B.加热一定质量高锰酸钾固体
C.加热氯酸钾制取氧气
D.甲烷和过量的氧气在密闭容器中完全反应
7.下列叙述对应的化学方程式书写正确的是
A.过氧化氢制取氧气:
B.镁在空气中燃烧:
C.实验室制备氢气:
D.铁丝在氧气中燃烧:
8.煤气中加入有特殊臭味的乙硫醇,可提醒煤气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为。则X是
A.C4H12S2 B.C2H6O2S C.C2H6S D.C2H6
9.“洁厕灵”和“84消毒液”是两种常见的生活用品。两者混合会生成有毒的Cl2,其反应的化学方程式为:NaClO+2HCl=NaCl+Cl2↑+X。下列说法不正确的是
A.NaClO中氯元素的化合价为-1
B.NaCl中的阳离子结构示意图
C.X是由分子构成的物质
D.“洁厕灵”和“84消毒液”不能混合使用
10.化学方程式不能揭示化学反应中
A.反应条件 B.哪些物质是反应物,哪些物质是生成物
C.反应的快慢 D.反应物和生成物的质量关系
11.根据化学方程式:2H2+O22H2O不能获取的信息是
A.氢气具有可燃性
B.该反应属于化合反应
C.氧气的密度比空气大
D.每2mol氢气和1mol氧气在点燃的条件下反应生成了2mol水
12.如图是某化学反应的微观过程,下列说法正确的是
A.该反应中涉及三种氧化物
B.生成丙和丁的分子个数比为2∶3
C.反应前后有两种元素化合价发生改变
D.反应前后氢原子个数之比为2∶1
二、非选择题,共5小题
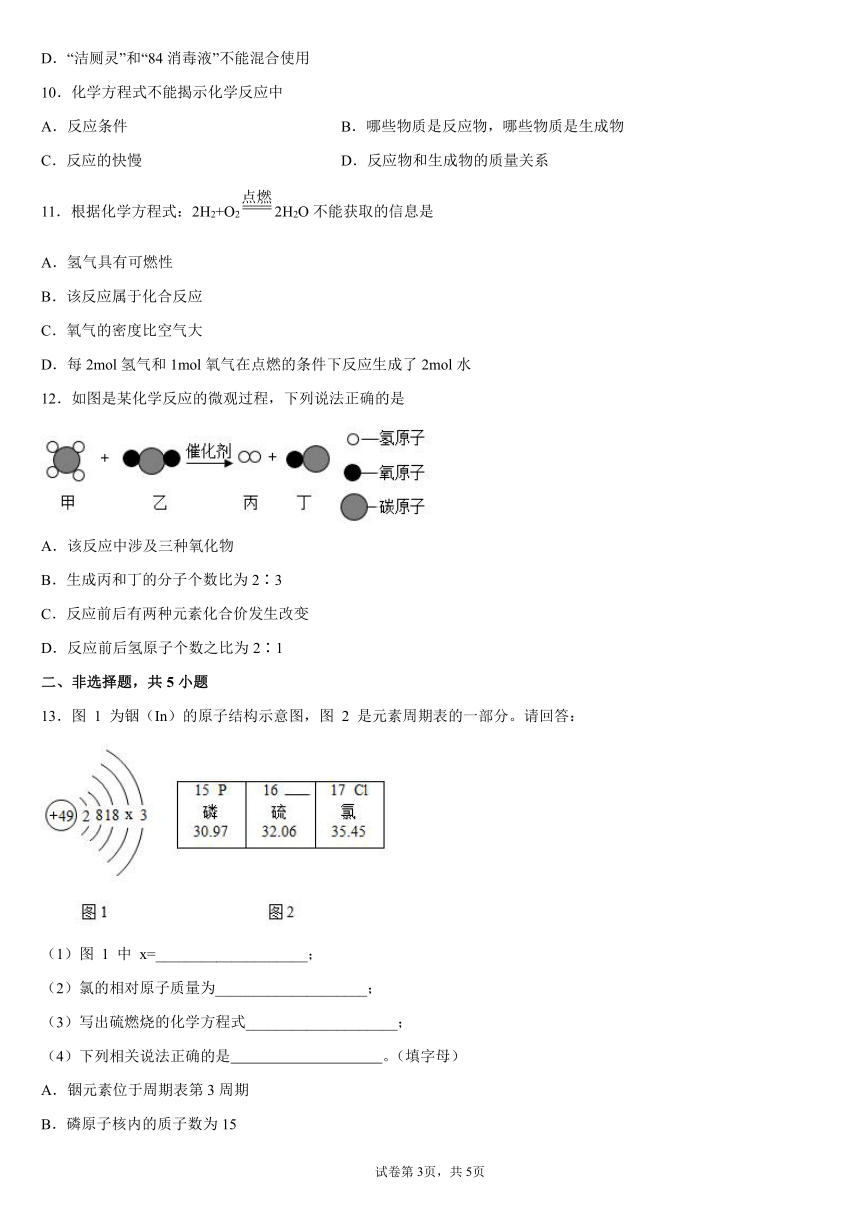
13.图 1 为铟(In)的原子结构示意图,图 2 是元素周期表的一部分。请回答:
(1)图 1 中 x=____________________;
(2)氯的相对原子质量为____________________;
(3)写出硫燃烧的化学方程式____________________;
(4)下列相关说法正确的是 。(填字母)
A.铟元素位于周期表第3周期
B.磷原子核内的质子数为15
C.图2中三种元素的原子的最外层电子数均大于 4
D.根据上图可推测氧化铟的化学式为 In3O2
14.根据CuO + H2H2O + Cu 填空
CuO H2 H2O Cu
1 80g ______ ______ ______
2 _______ 1g ______ ______
3 ______ ______ ______ 3.2g
4 ______ ______ 180g ______
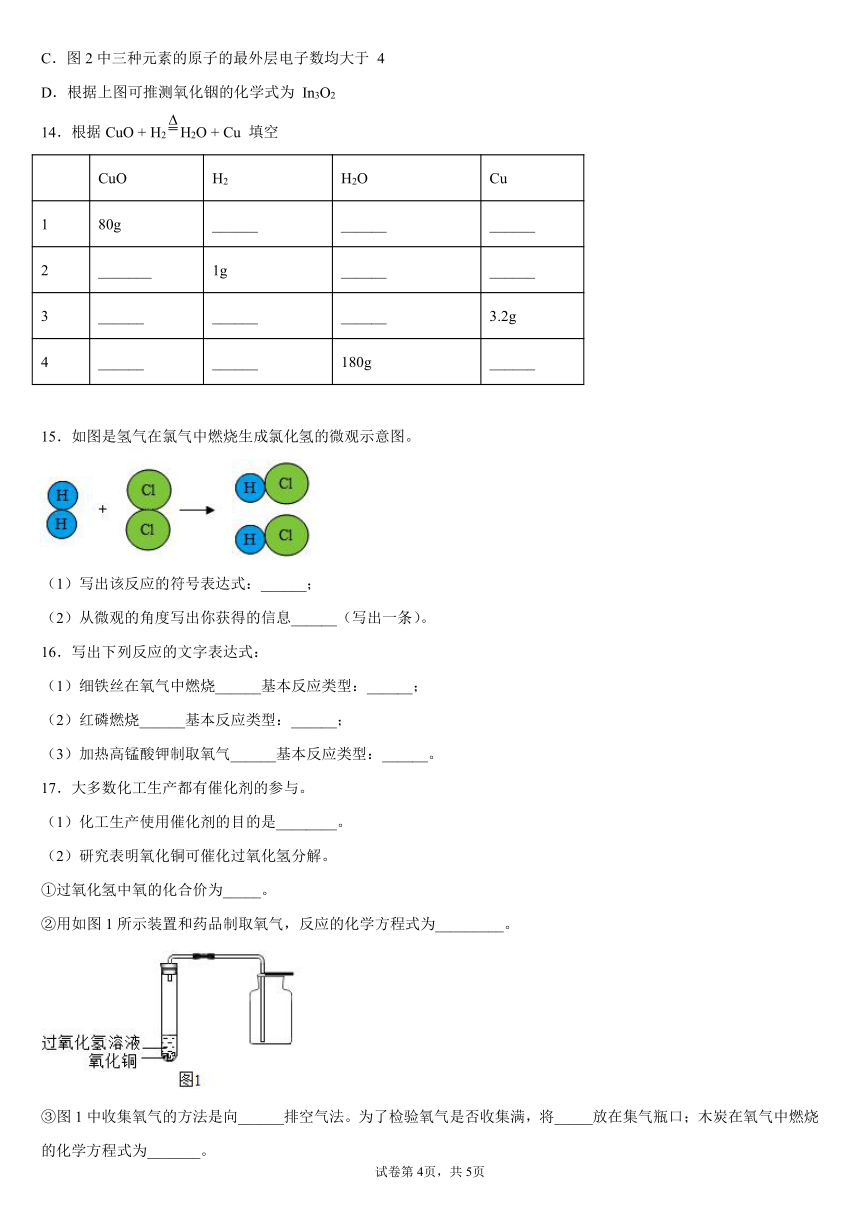
15.如图是氢气在氯气中燃烧生成氯化氢的微观示意图。
(1)写出该反应的符号表达式:______;
(2)从微观的角度写出你获得的信息______(写出一条)。
16.写出下列反应的文字表达式:
(1)细铁丝在氧气中燃烧______基本反应类型:______;
(2)红磷燃烧______基本反应类型:______;
(3)加热高锰酸钾制取氧气______基本反应类型:______。
17.大多数化工生产都有催化剂的参与。
(1)化工生产使用催化剂的目的是________。
(2)研究表明氧化铜可催化过氧化氢分解。
①过氧化氢中氧的化合价为_____。
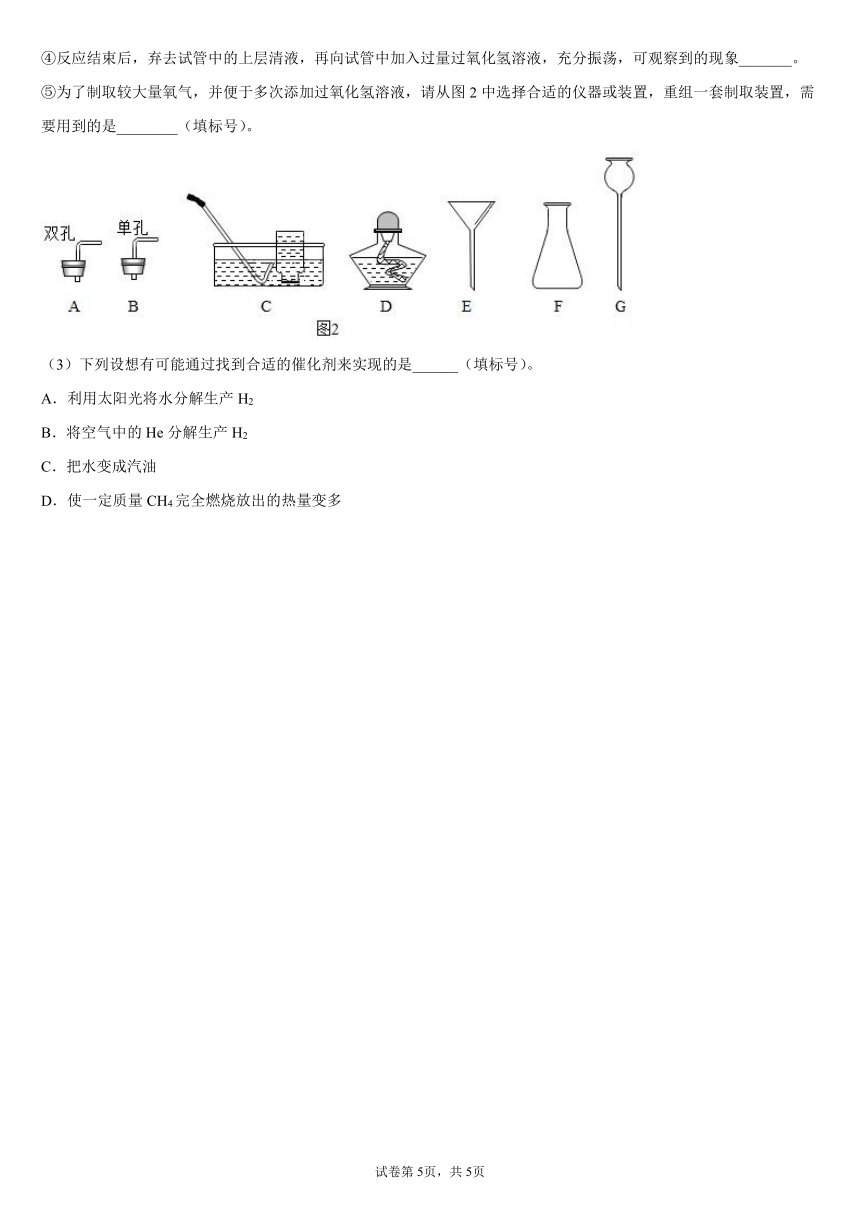
②用如图1所示装置和药品制取氧气,反应的化学方程式为_________。
③图1中收集氧气的方法是向______排空气法。为了检验氧气是否收集满,将_____放在集气瓶口;木炭在氧气中燃烧的化学方程式为_______。
④反应结束后,弃去试管中的上层清液,再向试管中加入过量过氧化氢溶液,充分振荡,可观察到的现象_______。
⑤为了制取较大量氧气,并便于多次添加过氧化氢溶液,请从图2中选择合适的仪器或装置,重组一套制取装置,需要用到的是________(填标号)。
(3)下列设想有可能通过找到合适的催化剂来实现的是______(填标号)。
A.利用太阳光将水分解生产H2
B.将空气中的He分解生产H2
C.把水变成汽油
D.使一定质量CH4完全燃烧放出的热量变多
试卷第2页,共2页
试卷第1页,共3页
参考答案
1.D
【详解】
A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;
B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;
C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;
D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2.C
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【详解】
A.化学方程式没有配平,正确的是;
B.气体状态符号没有标注,正确的是;
C.化学方程式正确;
D.生成物硫酸钠的化学式错误,正确的是:。
故选C。
3.D
4.D
【详解】
根据质量守恒定律,密闭容器中反应前后物质的质量总和不变,则:20g+50g +80g +30g =0g +100g +10g+x,x =70g;
故选D。
5.B
【详解】
根据化学反应前后原子个数不变,生成物中有4个银原子、2个硫原子、4个氢原子、2个氧原子,反应物中有4个银原子、2个氧原子,所以X是H2S。
故选:B。
6.B
【详解】
A、红磷燃烧放热,气压增大,完全反应后温度降低,氧气消耗,气压减小,该选项对应关系不正确;
B、高锰酸钾分解生成锰酸钾、二氧化锰和氧气。根据质量守恒定律化学反应前后元素的质量不变,故反应后固体中的锰元素的质量不变,但由于反应后固体的总质量减少,故锰元素的质量分数变大,完全反应后锰元素质量分数不再变化,该选项对应关系正确;
C、一定条件下氯酸钾分解生成氯化钾和氧气,随着反应进行,氯化钾和氧气质量增大,氯化钾和氧气质量不再变化的时间应该是同一时间,该选项对应关系不正确;
D、甲烷燃烧生成水和二氧化碳,反应的化学方程式:CH4+2O2 CO2+2H2O,反应前后分子总数不变,该选项对应关系不正确。
故选:B。
7.B
【详解】
A、过氧化氢制取氧气的方程式未配平,未标气体符号,正确的化学方程式为:,选项错误,不符合题意;
B、镁在空气中燃烧生成氧化镁,方程式书写完整,选项正确,符合题意;
C、实验室制备氢气的方程式中氢气后未标气体符号,正确的化学方程式为:,选项错误,不符合题意;
D、铁丝在氧气中燃烧的产物是四氧化三铁,正确的化学方程式为:,选项错误,不符合题意。
故选B。
8.C
【详解】
反应后生成物4CO2、2SO2、6H2O中,共有4个碳原子、2个硫原子、18个氧原子、12个氢原子,反应物中除2X外还有18个氧原子,根据质量守恒定律,反应前物质中原子的种类和数目不变,2X中应含有4个碳原子、2个硫原子、12个氢原子,因此一个X分子的组成为2个碳原子、1个硫原子、6个氢原子。故选:C。
9.A
【详解】
A、NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价,故选项说法错误。
B、NaCl中的阳离子为钠离子,带一个单位正电荷,结构示意图为,故选项说法正确。
C、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前钠、氯、氧、氢原子个数分别为1、3、1、2,反应后的生成物中钠、氯、氧、氢原子个数分别为1、3、0、0,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为,水是由水分子构成的,故选项说法正确。
D、“洁厕灵”和“84消毒液”两者混合会生成有毒的Cl2,“洁厕灵”和“84”消毒液不能混合使用,故选项说法正确。
故选:A。
10.C
【详解】
根据化学方程式的含义判断,化学方程式的含义主要有以下几点:①表示反应物、②表示生成物、③表示反应条件、④反映各物质间量的关系、⑤如生成物的状态等,不能体现反应的快慢。
故选:C。
11.C
【详解】
A、氢气能燃烧生成水,说明氢气具有可燃性,不符合题意;
B、由化学方程式可知,该反应符合“多变一”的特点,属于化合反应,不符合题意;
C、由化学方程式无法得出氧气的密度比空气大,符合题意;
D、由化学方程式可知,每2mol氢气和1mol氧气在点燃的条件下反应生成了2mol水,不符合题意。
故选C。
12.C
【分析】
根据图例,甲的化学式是CH4,乙的化学式是CO2,丙的化学式是H2,丁的化学式是CO,反应的化学方程式是。
【详解】
A、氧化物是两种元素组成且其中一种是氧元素的化合物,根据分析,该反应中只涉及两种氧化物,分别是CO2和CO,选项A不正确;
B、由该反应的化学方程式中可知,生成丙和丁的分子个数比为2∶2,选项B不正确;
C、甲烷中碳显-4价,氢显+1价,二氧化碳中碳显+4价,氧显-2价,氢气中氢显0价,一氧化碳中碳显+2价,氧显-2价,因此反应前后碳、氢两种元素化合价发生改变,选项C正确;
D、根据质量守恒定律,反应前后氢原子个数不变,选项D不正确。
故选C。
13.
(1)18
(2)35.45
(3)S+O2SO2
(4)BC
【分析】
(1)
原子中,质子数=核外电子数,则有2+8+18+x+3=49,得x=18,故填:18;
(2)
由元素周期表一格信息可知,元素名称下方的数字表示相对原子质量,氯的相对原子质量为35.45,故填:35.45;
(3)
硫在氧气中燃烧生成二氧化硫,反应的化学方程式为S+O2SO2,故填:S+O2SO2;
(4)
A、周期数=原子核外电子层数,由原子结构示意图可知,铟(In)的原子核外有五个电子层,所以铟元素位于周期表第五周期,选项说法不正确;
B、由元素周期表一格信息可知,左上角的数字表示原子序数,磷的原子序数为15,原子中原子序数=核外电子数=质子数=15,选项说法正确;
C、由上述分析可知,三种元素的原子的核外电子数分别为15、16、17,则最外层电子数分别为5、6、7,都大于4,选项说法正确;
D、铟元素的最外层电子数为3,在化合物中显+3价,氧元素显-2价,两者形成的化合物化学式为In2O3,选项说法不正确。
故选BC。
14.2g 18g 64g 40g 9g 32g 4g 0.1g 0.9g 800g 20g 640g
【详解】
由化学方程式体现的质量关系可知,反应氧化铜、氢气、水、铜的质量比为80:2:18:64,该质量关系的是固定的,故:
当氧化铜为80g时,氧化铜、氢气、水、铜的质量分别为80g、2g、18g、64g;
当氧氢气为1g时,氧化铜、氢气、水、铜的质量分别为40g、1g、9g、32g;
当铜为3.2g时,氧化铜、氢气、水、铜的质量分别为4g、0.1g、0.9g、3.2g;
当水为180g时,氧化铜、氢气、水、铜的质量分别为800g、20g、180g、640g;
15.
(1)
(2)化学变化就是分子分裂成原子,原子又重新组合成新的分子的过程
【分析】
(1)
由氢气在氯气中燃烧的微观过程图可得知:反应后生成物的分子由1个H原子和1个Cl原子构成的1个HCl分子,因此反应的符号表达式为:,故填: 。
(2)
根据氢气在氯气中燃烧的微观过程图可获得:反应前后原子种类、数目均不变;化学变化的本质特征是:在化学变化中,分子分裂成原子,原子又重新组合成新的分子的过程。故填:化学变化就是分子分裂成原子,原子又重新组合成新的分子的过程。
16.
(1) 铁+氧气四氧化三铁 化合反应
(2) 红磷+氧气五氧化二磷 化合反应
(3) 高锰酸钾锰酸钾 +二氧化锰 + 氧气 分解反应
【解析】
(1)
铁与氧气在点燃的条件下反应生成四氧化三铁,故反应的文字表达式写为:铁+氧气四氧化三铁;
由文字表达式可知,该反应是两种物质生成一种新物质的反应,符合化合反应的特点,属于化合反应,故填化合反应。
(2)
红磷与氧气在点燃的条件下反应生成五氧化二磷,故反应的文字表达式写为:红磷+氧气五氧化二磷;
由文字表达式可知,该反应是两种物质生成一种新物质的反应,符合化合反应的特点,属于化合反应,故填化合反应。
(3)
高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故反应的文字表达式写为:高锰酸钾锰酸钾 +二氧化锰 + 氧气;
由文字表达式可知,该反应是一种物质生成三种新物质的反应,符合分解反应的特点,属于分解反应,故填分解反应。
17.
(1)改变化学反应速率
(2) -1
上 带火星的木条
产生大量气泡 ACFG
(3)A
【分析】
(1)
化工生产使用催化剂的目的是:改变化学反应速率;
(2)
①过氧化氢中氢元素显+1价,设氧的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)×2+2x=0,x=-1;
②过氧化氢在氧化铜的催化下分解为水和氧气,该反应的化学方程式为:;
③图1中收集氧气的方法是向上排空气法;
氧气具有助燃性,为了检验氧气是否收集满,将带火星的木条放在集气瓶口,木条复燃,说明已经集满;
木炭在氧气中燃烧生成二氧化碳,该反应的化学方程式为:;
④反应结束后,弃去试管中的上层清液,再向试管中加入过量过氧化氢溶液,在该反应中,氧化铜是催化剂,化学反应前后,催化剂的质量和化学性质不变,故充分振荡,可观察到的现象:产生大量气泡;
⑤为了制取较大量氧气,应选择锥形瓶做反应容器,便于多次添加过氧化氢溶液,需要长颈漏斗,故选择双孔塞,根据图中仪器,选择排水法收集氧气,故选择C,故需要用到的是ACFG;
(3)
A、根据质量守恒定律,化学反应前后,元素的种类不变,水中含氢元素,可能利用太阳光和合适的催化剂分解产生氢气,符合题意;
B、根据质量守恒定律,化学反应前后,元素的种类不变,He中不含氢元素,不可能分解生产H2,不符合题意;
C、根据质量守恒定律, 化学反应前后,元素的种类不变,水中不含碳元素,不能把水变成汽油,不符合题意;
D、催化剂只能改变化学反应速率,不能增加生成物的质量和燃烧产生的热量,故使用催化剂不能使一定质量CH4完全燃烧放出的热量变多,不符合题意。
故选A。答案第1页,共2页
答案第1页,共2页
一、单选题,共12小题
1.下列现象不能用质量守恒定律解释的是
A.木材燃烧,余下灰烬的质量小于原木材质量 B.铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加
C.加热高锰酸钾,剩余固体质量减少 D.将一定质量的水冷凝后结成冰,质量不变
2.下列化学方程式书写正确的是
A.2P+5O2P2O5
B.2KMnO4K2MnO4 + MnO2 + O2
C.2CO + O22CO2
D.H2SO4+NaOH=NaSO4+H2O
3.张家口市一辆满载甲醇的罐车侧翻,甲醇大量外泄。已知可以用氨气处理含有甲醇的废水,X代表甲醇的化学式,有关反应的化学方程式为5X+12O2+6NH3=3N2+5CO2+19H2O,则甲醇的化学式为
A.C2H6OH B.CH4 C.NO2 D.CH3OH
4.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,得反应前后各物质的质量如下表。请根据质量守恒定律判断x的值为
物质 甲 乙 丙 丁
反应前的质量(g) 20 50 80 30
反应后的质量(g) 0 100 10 x
A.50 B.40 C.10 D.70
5.“银针验毒”其反应原理之一是4Ag+2X+O2= 2Ag2S+2H2O。则X的化学式为
A.S B.H2S C.SO2 D.SO3
6.如图,能正确反映对应关系的是
A.利用红磷燃烧测定空气中氧气的含量(打开止水夹前)
B.加热一定质量高锰酸钾固体
C.加热氯酸钾制取氧气
D.甲烷和过量的氧气在密闭容器中完全反应
7.下列叙述对应的化学方程式书写正确的是
A.过氧化氢制取氧气:
B.镁在空气中燃烧:
C.实验室制备氢气:
D.铁丝在氧气中燃烧:
8.煤气中加入有特殊臭味的乙硫醇,可提醒煤气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为。则X是
A.C4H12S2 B.C2H6O2S C.C2H6S D.C2H6
9.“洁厕灵”和“84消毒液”是两种常见的生活用品。两者混合会生成有毒的Cl2,其反应的化学方程式为:NaClO+2HCl=NaCl+Cl2↑+X。下列说法不正确的是
A.NaClO中氯元素的化合价为-1
B.NaCl中的阳离子结构示意图
C.X是由分子构成的物质
D.“洁厕灵”和“84消毒液”不能混合使用
10.化学方程式不能揭示化学反应中
A.反应条件 B.哪些物质是反应物,哪些物质是生成物
C.反应的快慢 D.反应物和生成物的质量关系
11.根据化学方程式:2H2+O22H2O不能获取的信息是
A.氢气具有可燃性
B.该反应属于化合反应
C.氧气的密度比空气大
D.每2mol氢气和1mol氧气在点燃的条件下反应生成了2mol水
12.如图是某化学反应的微观过程,下列说法正确的是
A.该反应中涉及三种氧化物
B.生成丙和丁的分子个数比为2∶3
C.反应前后有两种元素化合价发生改变
D.反应前后氢原子个数之比为2∶1
二、非选择题,共5小题
13.图 1 为铟(In)的原子结构示意图,图 2 是元素周期表的一部分。请回答:
(1)图 1 中 x=____________________;
(2)氯的相对原子质量为____________________;
(3)写出硫燃烧的化学方程式____________________;
(4)下列相关说法正确的是 。(填字母)
A.铟元素位于周期表第3周期
B.磷原子核内的质子数为15
C.图2中三种元素的原子的最外层电子数均大于 4
D.根据上图可推测氧化铟的化学式为 In3O2
14.根据CuO + H2H2O + Cu 填空
CuO H2 H2O Cu
1 80g ______ ______ ______
2 _______ 1g ______ ______
3 ______ ______ ______ 3.2g
4 ______ ______ 180g ______
15.如图是氢气在氯气中燃烧生成氯化氢的微观示意图。
(1)写出该反应的符号表达式:______;
(2)从微观的角度写出你获得的信息______(写出一条)。
16.写出下列反应的文字表达式:
(1)细铁丝在氧气中燃烧______基本反应类型:______;
(2)红磷燃烧______基本反应类型:______;
(3)加热高锰酸钾制取氧气______基本反应类型:______。
17.大多数化工生产都有催化剂的参与。
(1)化工生产使用催化剂的目的是________。
(2)研究表明氧化铜可催化过氧化氢分解。
①过氧化氢中氧的化合价为_____。
②用如图1所示装置和药品制取氧气,反应的化学方程式为_________。
③图1中收集氧气的方法是向______排空气法。为了检验氧气是否收集满,将_____放在集气瓶口;木炭在氧气中燃烧的化学方程式为_______。
④反应结束后,弃去试管中的上层清液,再向试管中加入过量过氧化氢溶液,充分振荡,可观察到的现象_______。
⑤为了制取较大量氧气,并便于多次添加过氧化氢溶液,请从图2中选择合适的仪器或装置,重组一套制取装置,需要用到的是________(填标号)。
(3)下列设想有可能通过找到合适的催化剂来实现的是______(填标号)。
A.利用太阳光将水分解生产H2
B.将空气中的He分解生产H2
C.把水变成汽油
D.使一定质量CH4完全燃烧放出的热量变多
试卷第2页,共2页
试卷第1页,共3页
参考答案
1.D
【详解】
A、木材燃烧,余下灰烬的质量小于原木材质量,是因为生成的二氧化碳逸散到了空气中,该选项遵循质量守恒定律;
B、铜丝在火焰上灼烧,灼烧后的“铜丝”质量增加,是因为铜和空气中的氧气反应生成了氧化铜,该选项遵循质量守恒定律;
C、加热高锰酸钾,剩余固体质量减少,是因为反应生成的氧气逸出,该选项遵循质量守恒定律;
D、水冷凝后结成冰的过程没有发生化学变化,不能用质量守恒定律解释。
故选:D。
2.C
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。
【详解】
A.化学方程式没有配平,正确的是;
B.气体状态符号没有标注,正确的是;
C.化学方程式正确;
D.生成物硫酸钠的化学式错误,正确的是:。
故选C。
3.D
4.D
【详解】
根据质量守恒定律,密闭容器中反应前后物质的质量总和不变,则:20g+50g +80g +30g =0g +100g +10g+x,x =70g;
故选D。
5.B
【详解】
根据化学反应前后原子个数不变,生成物中有4个银原子、2个硫原子、4个氢原子、2个氧原子,反应物中有4个银原子、2个氧原子,所以X是H2S。
故选:B。
6.B
【详解】
A、红磷燃烧放热,气压增大,完全反应后温度降低,氧气消耗,气压减小,该选项对应关系不正确;
B、高锰酸钾分解生成锰酸钾、二氧化锰和氧气。根据质量守恒定律化学反应前后元素的质量不变,故反应后固体中的锰元素的质量不变,但由于反应后固体的总质量减少,故锰元素的质量分数变大,完全反应后锰元素质量分数不再变化,该选项对应关系正确;
C、一定条件下氯酸钾分解生成氯化钾和氧气,随着反应进行,氯化钾和氧气质量增大,氯化钾和氧气质量不再变化的时间应该是同一时间,该选项对应关系不正确;
D、甲烷燃烧生成水和二氧化碳,反应的化学方程式:CH4+2O2 CO2+2H2O,反应前后分子总数不变,该选项对应关系不正确。
故选:B。
7.B
【详解】
A、过氧化氢制取氧气的方程式未配平,未标气体符号,正确的化学方程式为:,选项错误,不符合题意;
B、镁在空气中燃烧生成氧化镁,方程式书写完整,选项正确,符合题意;
C、实验室制备氢气的方程式中氢气后未标气体符号,正确的化学方程式为:,选项错误,不符合题意;
D、铁丝在氧气中燃烧的产物是四氧化三铁,正确的化学方程式为:,选项错误,不符合题意。
故选B。
8.C
【详解】
反应后生成物4CO2、2SO2、6H2O中,共有4个碳原子、2个硫原子、18个氧原子、12个氢原子,反应物中除2X外还有18个氧原子,根据质量守恒定律,反应前物质中原子的种类和数目不变,2X中应含有4个碳原子、2个硫原子、12个氢原子,因此一个X分子的组成为2个碳原子、1个硫原子、6个氢原子。故选:C。
9.A
【详解】
A、NaClO中钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价,故选项说法错误。
B、NaCl中的阳离子为钠离子,带一个单位正电荷,结构示意图为,故选项说法正确。
C、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前钠、氯、氧、氢原子个数分别为1、3、1、2,反应后的生成物中钠、氯、氧、氢原子个数分别为1、3、0、0,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为,水是由水分子构成的,故选项说法正确。
D、“洁厕灵”和“84消毒液”两者混合会生成有毒的Cl2,“洁厕灵”和“84”消毒液不能混合使用,故选项说法正确。
故选:A。
10.C
【详解】
根据化学方程式的含义判断,化学方程式的含义主要有以下几点:①表示反应物、②表示生成物、③表示反应条件、④反映各物质间量的关系、⑤如生成物的状态等,不能体现反应的快慢。
故选:C。
11.C
【详解】
A、氢气能燃烧生成水,说明氢气具有可燃性,不符合题意;
B、由化学方程式可知,该反应符合“多变一”的特点,属于化合反应,不符合题意;
C、由化学方程式无法得出氧气的密度比空气大,符合题意;
D、由化学方程式可知,每2mol氢气和1mol氧气在点燃的条件下反应生成了2mol水,不符合题意。
故选C。
12.C
【分析】
根据图例,甲的化学式是CH4,乙的化学式是CO2,丙的化学式是H2,丁的化学式是CO,反应的化学方程式是。
【详解】
A、氧化物是两种元素组成且其中一种是氧元素的化合物,根据分析,该反应中只涉及两种氧化物,分别是CO2和CO,选项A不正确;
B、由该反应的化学方程式中可知,生成丙和丁的分子个数比为2∶2,选项B不正确;
C、甲烷中碳显-4价,氢显+1价,二氧化碳中碳显+4价,氧显-2价,氢气中氢显0价,一氧化碳中碳显+2价,氧显-2价,因此反应前后碳、氢两种元素化合价发生改变,选项C正确;
D、根据质量守恒定律,反应前后氢原子个数不变,选项D不正确。
故选C。
13.
(1)18
(2)35.45
(3)S+O2SO2
(4)BC
【分析】
(1)
原子中,质子数=核外电子数,则有2+8+18+x+3=49,得x=18,故填:18;
(2)
由元素周期表一格信息可知,元素名称下方的数字表示相对原子质量,氯的相对原子质量为35.45,故填:35.45;
(3)
硫在氧气中燃烧生成二氧化硫,反应的化学方程式为S+O2SO2,故填:S+O2SO2;
(4)
A、周期数=原子核外电子层数,由原子结构示意图可知,铟(In)的原子核外有五个电子层,所以铟元素位于周期表第五周期,选项说法不正确;
B、由元素周期表一格信息可知,左上角的数字表示原子序数,磷的原子序数为15,原子中原子序数=核外电子数=质子数=15,选项说法正确;
C、由上述分析可知,三种元素的原子的核外电子数分别为15、16、17,则最外层电子数分别为5、6、7,都大于4,选项说法正确;
D、铟元素的最外层电子数为3,在化合物中显+3价,氧元素显-2价,两者形成的化合物化学式为In2O3,选项说法不正确。
故选BC。
14.2g 18g 64g 40g 9g 32g 4g 0.1g 0.9g 800g 20g 640g
【详解】
由化学方程式体现的质量关系可知,反应氧化铜、氢气、水、铜的质量比为80:2:18:64,该质量关系的是固定的,故:
当氧化铜为80g时,氧化铜、氢气、水、铜的质量分别为80g、2g、18g、64g;
当氧氢气为1g时,氧化铜、氢气、水、铜的质量分别为40g、1g、9g、32g;
当铜为3.2g时,氧化铜、氢气、水、铜的质量分别为4g、0.1g、0.9g、3.2g;
当水为180g时,氧化铜、氢气、水、铜的质量分别为800g、20g、180g、640g;
15.
(1)
(2)化学变化就是分子分裂成原子,原子又重新组合成新的分子的过程
【分析】
(1)
由氢气在氯气中燃烧的微观过程图可得知:反应后生成物的分子由1个H原子和1个Cl原子构成的1个HCl分子,因此反应的符号表达式为:,故填: 。
(2)
根据氢气在氯气中燃烧的微观过程图可获得:反应前后原子种类、数目均不变;化学变化的本质特征是:在化学变化中,分子分裂成原子,原子又重新组合成新的分子的过程。故填:化学变化就是分子分裂成原子,原子又重新组合成新的分子的过程。
16.
(1) 铁+氧气四氧化三铁 化合反应
(2) 红磷+氧气五氧化二磷 化合反应
(3) 高锰酸钾锰酸钾 +二氧化锰 + 氧气 分解反应
【解析】
(1)
铁与氧气在点燃的条件下反应生成四氧化三铁,故反应的文字表达式写为:铁+氧气四氧化三铁;
由文字表达式可知,该反应是两种物质生成一种新物质的反应,符合化合反应的特点,属于化合反应,故填化合反应。
(2)
红磷与氧气在点燃的条件下反应生成五氧化二磷,故反应的文字表达式写为:红磷+氧气五氧化二磷;
由文字表达式可知,该反应是两种物质生成一种新物质的反应,符合化合反应的特点,属于化合反应,故填化合反应。
(3)
高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故反应的文字表达式写为:高锰酸钾锰酸钾 +二氧化锰 + 氧气;
由文字表达式可知,该反应是一种物质生成三种新物质的反应,符合分解反应的特点,属于分解反应,故填分解反应。
17.
(1)改变化学反应速率
(2) -1
上 带火星的木条
产生大量气泡 ACFG
(3)A
【分析】
(1)
化工生产使用催化剂的目的是:改变化学反应速率;
(2)
①过氧化氢中氢元素显+1价,设氧的化合价为x,根据化合物中,正、负化合价的代数和为零,可得:(+1)×2+2x=0,x=-1;
②过氧化氢在氧化铜的催化下分解为水和氧气,该反应的化学方程式为:;
③图1中收集氧气的方法是向上排空气法;
氧气具有助燃性,为了检验氧气是否收集满,将带火星的木条放在集气瓶口,木条复燃,说明已经集满;
木炭在氧气中燃烧生成二氧化碳,该反应的化学方程式为:;
④反应结束后,弃去试管中的上层清液,再向试管中加入过量过氧化氢溶液,在该反应中,氧化铜是催化剂,化学反应前后,催化剂的质量和化学性质不变,故充分振荡,可观察到的现象:产生大量气泡;
⑤为了制取较大量氧气,应选择锥形瓶做反应容器,便于多次添加过氧化氢溶液,需要长颈漏斗,故选择双孔塞,根据图中仪器,选择排水法收集氧气,故选择C,故需要用到的是ACFG;
(3)
A、根据质量守恒定律,化学反应前后,元素的种类不变,水中含氢元素,可能利用太阳光和合适的催化剂分解产生氢气,符合题意;
B、根据质量守恒定律,化学反应前后,元素的种类不变,He中不含氢元素,不可能分解生产H2,不符合题意;
C、根据质量守恒定律, 化学反应前后,元素的种类不变,水中不含碳元素,不能把水变成汽油,不符合题意;
D、催化剂只能改变化学反应速率,不能增加生成物的质量和燃烧产生的热量,故使用催化剂不能使一定质量CH4完全燃烧放出的热量变多,不符合题意。
故选A。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
