人教版九年级化学下册 第九单元 溶液 课题2 溶解度 同步训练(WORD版,含答案)
文档属性
| 名称 | 人教版九年级化学下册 第九单元 溶液 课题2 溶解度 同步训练(WORD版,含答案) |

|
|
| 格式 | zip | ||
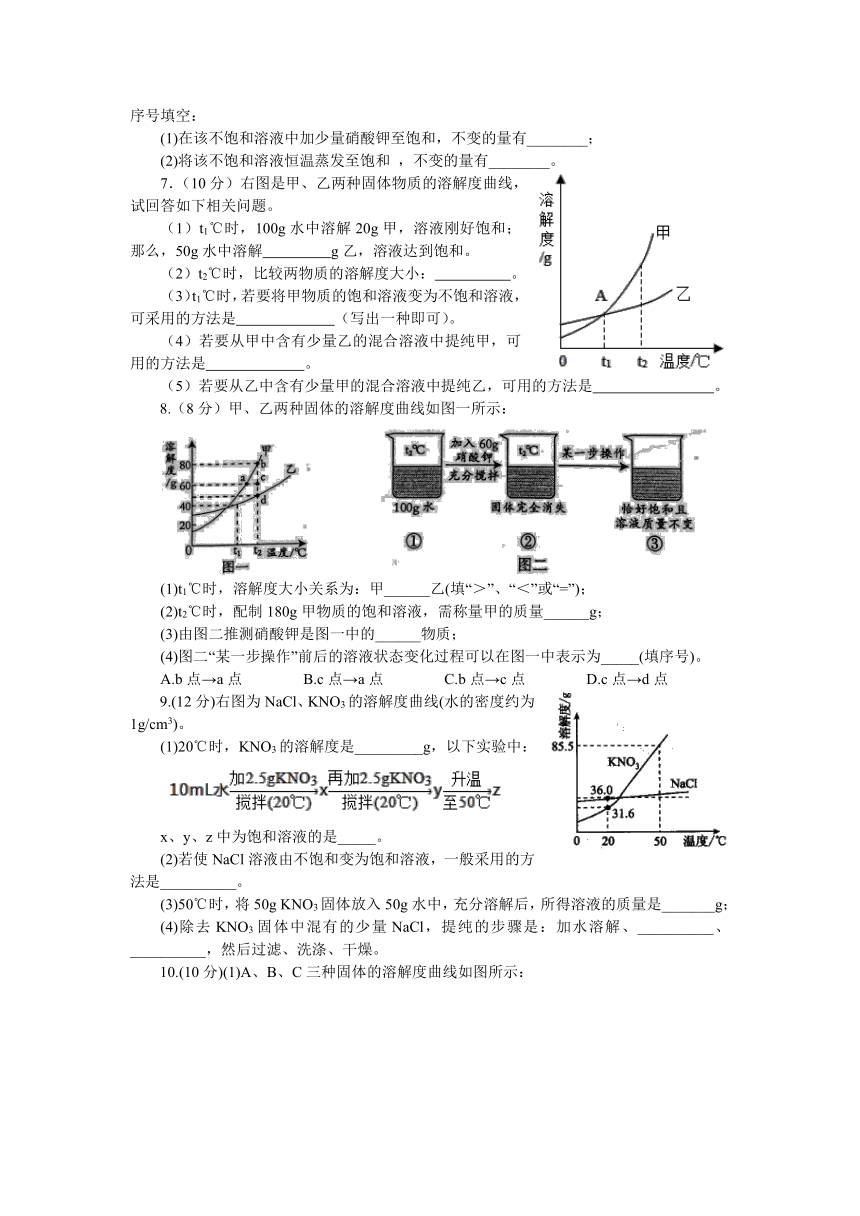
| 文件大小 | 296.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-22 11:17:52 | ||
图片预览


文档简介
第九单元 课题2同步训练
基础题
一、选择题(共15分)
1.将60℃的硝酸钾溶液降温至20℃,有晶体析出。有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20℃时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
2.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
3.高氯酸钾(KClO4)可用作火箭推进剂,下表是高氯酸钾在不同温度时的溶解度。下列说法正确的是( )
温度/℃ 20 40 60 80
溶解度/g 1.68 3.73 7.3 13.4
A.20℃时高氯酸钾的溶解度为1.68
B.40℃时,将4g高氯酸钾溶于100g水可得到104g溶液
C.80℃的高氯酸钾饱和溶液冷却至40℃有结晶现象
D.高氯酸钾的溶解度随温度升高而减小
4.小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出。有关此现象的说明,下列说法正确的是( )
A.因压力减小使气体的溶解度变小
B.因压力减小使气体的溶解度变大
C.因压力增大使气体的溶解度变小
D.因压力增大使气体的溶解度变大
5.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,三种物质的溶解度由大到小的顺序是A>B>C
B.t2℃时,A和B的溶解度相等
C.将C的饱和溶液变为不饱和溶液可采用升高温度的方法
D.A、B、C三种物质的溶解度都随温度的升高而增大
二、填空题(共44分)
6.(4分)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:①水的质量;②溶液中溶质KNO3的质量;③KNO3的质量分数;④30℃时KNO3的溶解度;⑤溶液的质量。用序号填空:
(1)在该不饱和溶液中加少量硝酸钾至饱和,不变的量有________;
(2)将该不饱和溶液恒温蒸发至饱和 ,不变的量有________。
7.(10分)右图是甲、乙两种固体物质的溶解度曲线,试回答如下相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解 g乙,溶液达到饱和。
(2)t2℃时,比较两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (写出一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
(5)若要从乙中含有少量甲的混合溶液中提纯乙,可用的方法是 。
8.(8分)甲、乙两种固体的溶解度曲线如图一所示:
(1)t1℃时,溶解度大小关系为:甲______乙(填“>”、“<”或“=”);
(2)t2℃时,配制180g甲物质的饱和溶液,需称量甲的质量______g;
(3)由图二推测硝酸钾是图一中的______物质;
(4)图二“某一步操作”前后的溶液状态变化过程可以在图一中表示为_____(填序号)。
A.b点→a点 B.c点→a点 C.b点→c点 D.c点→d点
9.(12分)右图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3)。
(1)20℃时,KNO3的溶解度是_________g,以下实验中:
x、y、z中为饱和溶液的是_____。
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是__________。
(3)50℃时,将50g KNO3固体放入50g水中,充分溶解后,所得溶液的质量是_______g;
(4)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、__________、__________,然后过滤、洗涤、干燥。
10.(10分)(1)A、B、C三种固体的溶解度曲线如图所示:
①P点的含义是___________;
②t2℃时,将15gA物质加入50g水中,充分溶解后,形成溶液的质量为___________g。
③若A物质中含有少量的B物质,提纯A物质的方法是___________(填降温”或“蒸发”)结晶。
(2)如表是CO2在水中的溶解度的几组数据:(单位:mL)
温度 溶解度 0 25 50 75 100
1 1.79 0.752 0.423 0.307 0.231
10 15.92 7.14 4.095 2.99 2.28
25 29.30 16.20 9.71 6.82 5.73
①根据数据分析:CO2在水中的溶解度随温度的升高而_________(填“增大“或“减小”)。
②打开代水瓶盖有气体溢出,说明原瓶内的气压_______(填”>”“=“或“<”)瓶外大气压。
提高题
一、选择题(共9分)
11.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9﹕25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
12.某小组用20mL一次性注射器吸取10mL某碳酸型饮料并用胶头封闭注射器针孔,分别进行了如右图实验。下列分析不合理的是( )
A.该实验用于探究压强对气体在水中溶解度的影响
B.图Ⅰ:用力向外拉动注射器,管中有许多小气泡出现
C.图Ⅱ:用力向里推注射器,压强增大,气体在水中的溶解度减小
D.该实验装置的优点是密封性好,压强较易改变
13.在t1℃时,将等质量的硝酸钾和氯化钾分別加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是( )
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
二、填空题(共18分)
14.如图为KNO3、NaCl两种固体物质的溶解度曲线,请回答下列问题:
(1)10℃时KNO3的溶解度______(填“<”、“=“或“>”)NaCl的溶解度。
(2)80℃时140g KNO3溶于100g水中形成的溶液是______(填“饱和”或“不饱和”)溶液。
(3)如图所示进行实验,再现结晶过程:
本实验条件下,影响析出晶体质量多少的主要因素是______、______。
15.以下是有关CO2溶解度的几组数据:
①一个标准大气压时CO2在某些溶剂中的溶解度(单位:mL/g)
(
溶解度
) (
溶剂
) (
温度
/
℃
) (
) -60 -40 -20 0 20 30
甲醇 66 24.5 11.4 6.3 4.1 3.6
丙酮 127 50 24 13 8.2 6.6
甲苯 8.7 4.4 4.0 3.5 3.0 2.8
②CO2在水中的溶解度(单位:m L/g)
压强 /大气压 温度/℃
0 25 50 75 100
1 1.79 0.752 0.423 0.307 0.231
10 15.92 7.14 4.095 2.99 2.28
25 29.30 16.20 9.71 6.82 5.73
请根据数据分析:
(1)影响CO2的溶解度的因素有_________、_________和_________。
(2)根据CO2在水中的溶解度表,简单说明外界条件是如何影响气体溶解度的?
(3)打开汽水瓶有CO2气体溢出,说明瓶中的压强_________(填:大于、小于或等于)瓶外大气压强。
(4)如果用排水集气法收集CO 2时,可采取__________________的措施。
三、实验探究题(共14分)
16.(14分)以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物中(其中氯化钠和氯化钾的质量和小于总质量的3%)分离出硝酸钾的实验步骤。三种物质的溶解度曲线如图所示。
Ⅰ.用托盘天平称得样品的总质量为87.5g;
Ⅱ.配制成80℃左右的饱和溶液;
Ⅲ.将热饱和溶液冷却至室温(20℃)后进行过滤,并用少量水洗涤2~3次;
Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:
(1)用天平称取87.5g样品时,游码位于_______g位置(1g以下用游码)。
(2)某同学发现,无论将称量物还是砝码放置于托盘中时,天平均不发生偏转,原因是_______。
A.天平未放置于水平桌面上 B.天平没有调零
C.托盘下的垫圈未取下 D.游码未归零
(3)将这些样品制成80℃左右的热饱和溶液,约需水_______ (填字母)。
A.12.5mL B.50 mL C.100 mL D.112.5mL
(4)该实验中,玻璃棒除了用于搅拌和引流外,还用于_______。
(5)步骤Ⅲ中,只能用少量水洗涤固体的原因是_______;过滤并洗涤后,氯化钾存在于_______中。
(6)如果实验中热饱和溶液未完全冷却至室温就过滤,将会影响晶体产量,理由是_______。
参考答案
1.A 解析 将60℃的硝酸钾溶液降温至20℃,结果有晶体析出,原溶液可能接近饱和,也可能是不饱和溶液,A错误;由于降温后有晶体析出,故20℃时的溶液一定是饱和溶液,B正确;60℃的硝酸钾溶液降温至20℃,有晶体析出,说明硝酸钾的溶解度随温度降低而减小,C正确;根据硝酸钾溶解度的变化特点,要得到硝酸钾的晶体可采用降温结晶的方法,D正确。
2.B 解析 20℃时,氯化钠的溶解度为36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和。因此,在20℃时,136g氯化钠饱和溶液中含氯化钠36g。
3.C 解析 溶解度的单位是克,20℃时高氯酸钾的溶解度为1.68g,A错误;40℃时,高氯酸钾的溶解度为3.73g,40℃时,将4g高氯酸钾溶于100g水,最多只能溶解3.73g,不能得到104g溶液,B错误;由高氯酸钾在不同温度时的溶解度,高氯酸钾的溶解度随着温度的升高而增大,80℃的高氯酸钾饱和溶液冷却至40℃,有晶体析出,有结晶现象,C正确、D错误。
4.A 解析 汽水是将二氧化碳气体加压之后制成的,拉开易拉罐汽水的拉环,有气体自汽水中冲出,是因为压力减小使二氧化碳气体的溶解度变小。
5.B 解析 通过分析溶解度曲线可知,t1℃时,三种物质的溶解度由大到小的顺序是C>B>A,A错误;t2℃时,A和B的溶解度相等,因为该温度下它们有交点,B正确;C的溶解度随温度的升高而减少,将C的饱和溶液变为不饱和溶液可采用降低温度的方法,C错误;A、B两种物质的溶解度随温度的升高而增大,而C的溶解度随温度的升高而减少,D错误。
6.(1)①④ (2)②④
7.(1)10 (2)甲>乙(3)升高温度或增加溶剂 (4)降温结晶 (5)蒸发结晶
8.(1)> (2)80 (3)甲 (4)B
9.(1)31.6 y (2)蒸发溶剂至饱和(或加NaCl固体至不再溶解) (3)92.75 (4)蒸发浓缩 降温结晶
10.(1)①t1℃时,A、C物质的溶解度相等 ②60 ③降温 (2)①减小 ②>
11.A 解析 由表格中的数据分析知,第一组中的15gNaCl在20℃时固体全部溶解,而第二、三、四组的NaCl固体,在20℃时均溶解了18g,所以20℃时,NaCl固体的溶解度是18g。20℃时,50g水中含有18gNaCl,A错误;用蒸发的方法减少溶剂,可以使不饱和溶液变成饱和溶液,B正确;第二组所得溶液的溶质与溶剂的质量比为18﹕50=9﹕25,C正确;该实验中,相同温度下,NaCl在水里的溶解度与水的质量无关,D正确。
12.C 解析 由于推拉注射器改变了压强的大小,故该实验可用于探究压强对气体在水中溶解度的影响,A正确;用力向外拉动注射器时压强变小,气体的溶解度变小,会出现气泡,B正确;用力向里推注射器,压强增大,气体在水中的溶解度应该增大,C错误;注射器密封性能很好,改变压强方式较为容易,D正确。
13.B 解析 烧杯②中有固体剩余,上层溶液一定是饱和溶液,A正确;t1℃时,氯化钾的溶解度大于硝酸钾的溶解度,所以将等质量的硝酸钾和氯化钾分別加入到各盛有100g水的两个烧杯中,烧杯①中没有固体剩余,溶液的溶质是氯化钾,B错误;烧杯①中的固体全部溶解,烧杯②中有固体剩余,所以烧杯①溶液质量比烧杯②中溶液质量大,C正确;t2℃时,硝酸钾、氯化钾的溶解度相等,所以将温度升高到t2℃,烧杯②中的固体全部溶解,D正确。
14.(1)< (2)不饱和 (3)热水的温度(其他合理答案均可) 热水的量(其他合理答案均可)
15.(1)溶剂种类 温度 压强 (2)溶解度随温度的升高而减小;溶解度随压强的增大而增大 (3)大于 (4)排热水收集
16.(1)0.5 (2)C (3)B (4)转移固体 (5)晶体易溶于水,洗涤用水越少,晶体损失越小 滤液 (6)硝酸钾饱和溶液在较高温度下结晶时,析出的晶体较少
基础题
一、选择题(共15分)
1.将60℃的硝酸钾溶液降温至20℃,有晶体析出。有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20℃时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
2.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
3.高氯酸钾(KClO4)可用作火箭推进剂,下表是高氯酸钾在不同温度时的溶解度。下列说法正确的是( )
温度/℃ 20 40 60 80
溶解度/g 1.68 3.73 7.3 13.4
A.20℃时高氯酸钾的溶解度为1.68
B.40℃时,将4g高氯酸钾溶于100g水可得到104g溶液
C.80℃的高氯酸钾饱和溶液冷却至40℃有结晶现象
D.高氯酸钾的溶解度随温度升高而减小
4.小欣拉开易拉罐汽水的拉环时,听到“啵”的一声,并有气体自汽水中冲出。有关此现象的说明,下列说法正确的是( )
A.因压力减小使气体的溶解度变小
B.因压力减小使气体的溶解度变大
C.因压力增大使气体的溶解度变小
D.因压力增大使气体的溶解度变大
5.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,三种物质的溶解度由大到小的顺序是A>B>C
B.t2℃时,A和B的溶解度相等
C.将C的饱和溶液变为不饱和溶液可采用升高温度的方法
D.A、B、C三种物质的溶解度都随温度的升高而增大
二、填空题(共44分)
6.(4分)现有30℃的不饱和KNO3溶液,与该溶液有关的量有:①水的质量;②溶液中溶质KNO3的质量;③KNO3的质量分数;④30℃时KNO3的溶解度;⑤溶液的质量。用序号填空:
(1)在该不饱和溶液中加少量硝酸钾至饱和,不变的量有________;
(2)将该不饱和溶液恒温蒸发至饱和 ,不变的量有________。
7.(10分)右图是甲、乙两种固体物质的溶解度曲线,试回答如下相关问题。
(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中溶解 g乙,溶液达到饱和。
(2)t2℃时,比较两物质的溶解度大小: 。
(3)t1℃时,若要将甲物质的饱和溶液变为不饱和溶液,可采用的方法是 (写出一种即可)。
(4)若要从甲中含有少量乙的混合溶液中提纯甲,可用的方法是 。
(5)若要从乙中含有少量甲的混合溶液中提纯乙,可用的方法是 。
8.(8分)甲、乙两种固体的溶解度曲线如图一所示:
(1)t1℃时,溶解度大小关系为:甲______乙(填“>”、“<”或“=”);
(2)t2℃时,配制180g甲物质的饱和溶液,需称量甲的质量______g;
(3)由图二推测硝酸钾是图一中的______物质;
(4)图二“某一步操作”前后的溶液状态变化过程可以在图一中表示为_____(填序号)。
A.b点→a点 B.c点→a点 C.b点→c点 D.c点→d点
9.(12分)右图为NaCl、KNO3的溶解度曲线(水的密度约为1g/cm3)。
(1)20℃时,KNO3的溶解度是_________g,以下实验中:
x、y、z中为饱和溶液的是_____。
(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是__________。
(3)50℃时,将50g KNO3固体放入50g水中,充分溶解后,所得溶液的质量是_______g;
(4)除去KNO3固体中混有的少量NaCl,提纯的步骤是:加水溶解、__________、__________,然后过滤、洗涤、干燥。
10.(10分)(1)A、B、C三种固体的溶解度曲线如图所示:
①P点的含义是___________;
②t2℃时,将15gA物质加入50g水中,充分溶解后,形成溶液的质量为___________g。
③若A物质中含有少量的B物质,提纯A物质的方法是___________(填降温”或“蒸发”)结晶。
(2)如表是CO2在水中的溶解度的几组数据:(单位:mL)
温度 溶解度 0 25 50 75 100
1 1.79 0.752 0.423 0.307 0.231
10 15.92 7.14 4.095 2.99 2.28
25 29.30 16.20 9.71 6.82 5.73
①根据数据分析:CO2在水中的溶解度随温度的升高而_________(填“增大“或“减小”)。
②打开代水瓶盖有气体溢出,说明原瓶内的气压_______(填”>”“=“或“<”)瓶外大气压。
提高题
一、选择题(共9分)
11.20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9﹕25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
12.某小组用20mL一次性注射器吸取10mL某碳酸型饮料并用胶头封闭注射器针孔,分别进行了如右图实验。下列分析不合理的是( )
A.该实验用于探究压强对气体在水中溶解度的影响
B.图Ⅰ:用力向外拉动注射器,管中有许多小气泡出现
C.图Ⅱ:用力向里推注射器,压强增大,气体在水中的溶解度减小
D.该实验装置的优点是密封性好,压强较易改变
13.在t1℃时,将等质量的硝酸钾和氯化钾分別加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是( )
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
二、填空题(共18分)
14.如图为KNO3、NaCl两种固体物质的溶解度曲线,请回答下列问题:
(1)10℃时KNO3的溶解度______(填“<”、“=“或“>”)NaCl的溶解度。
(2)80℃时140g KNO3溶于100g水中形成的溶液是______(填“饱和”或“不饱和”)溶液。
(3)如图所示进行实验,再现结晶过程:
本实验条件下,影响析出晶体质量多少的主要因素是______、______。
15.以下是有关CO2溶解度的几组数据:
①一个标准大气压时CO2在某些溶剂中的溶解度(单位:mL/g)
(
溶解度
) (
溶剂
) (
温度
/
℃
) (
) -60 -40 -20 0 20 30
甲醇 66 24.5 11.4 6.3 4.1 3.6
丙酮 127 50 24 13 8.2 6.6
甲苯 8.7 4.4 4.0 3.5 3.0 2.8
②CO2在水中的溶解度(单位:m L/g)
压强 /大气压 温度/℃
0 25 50 75 100
1 1.79 0.752 0.423 0.307 0.231
10 15.92 7.14 4.095 2.99 2.28
25 29.30 16.20 9.71 6.82 5.73
请根据数据分析:
(1)影响CO2的溶解度的因素有_________、_________和_________。
(2)根据CO2在水中的溶解度表,简单说明外界条件是如何影响气体溶解度的?
(3)打开汽水瓶有CO2气体溢出,说明瓶中的压强_________(填:大于、小于或等于)瓶外大气压强。
(4)如果用排水集气法收集CO 2时,可采取__________________的措施。
三、实验探究题(共14分)
16.(14分)以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物中(其中氯化钠和氯化钾的质量和小于总质量的3%)分离出硝酸钾的实验步骤。三种物质的溶解度曲线如图所示。
Ⅰ.用托盘天平称得样品的总质量为87.5g;
Ⅱ.配制成80℃左右的饱和溶液;
Ⅲ.将热饱和溶液冷却至室温(20℃)后进行过滤,并用少量水洗涤2~3次;
Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:
(1)用天平称取87.5g样品时,游码位于_______g位置(1g以下用游码)。
(2)某同学发现,无论将称量物还是砝码放置于托盘中时,天平均不发生偏转,原因是_______。
A.天平未放置于水平桌面上 B.天平没有调零
C.托盘下的垫圈未取下 D.游码未归零
(3)将这些样品制成80℃左右的热饱和溶液,约需水_______ (填字母)。
A.12.5mL B.50 mL C.100 mL D.112.5mL
(4)该实验中,玻璃棒除了用于搅拌和引流外,还用于_______。
(5)步骤Ⅲ中,只能用少量水洗涤固体的原因是_______;过滤并洗涤后,氯化钾存在于_______中。
(6)如果实验中热饱和溶液未完全冷却至室温就过滤,将会影响晶体产量,理由是_______。
参考答案
1.A 解析 将60℃的硝酸钾溶液降温至20℃,结果有晶体析出,原溶液可能接近饱和,也可能是不饱和溶液,A错误;由于降温后有晶体析出,故20℃时的溶液一定是饱和溶液,B正确;60℃的硝酸钾溶液降温至20℃,有晶体析出,说明硝酸钾的溶解度随温度降低而减小,C正确;根据硝酸钾溶解度的变化特点,要得到硝酸钾的晶体可采用降温结晶的方法,D正确。
2.B 解析 20℃时,氯化钠的溶解度为36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和。因此,在20℃时,136g氯化钠饱和溶液中含氯化钠36g。
3.C 解析 溶解度的单位是克,20℃时高氯酸钾的溶解度为1.68g,A错误;40℃时,高氯酸钾的溶解度为3.73g,40℃时,将4g高氯酸钾溶于100g水,最多只能溶解3.73g,不能得到104g溶液,B错误;由高氯酸钾在不同温度时的溶解度,高氯酸钾的溶解度随着温度的升高而增大,80℃的高氯酸钾饱和溶液冷却至40℃,有晶体析出,有结晶现象,C正确、D错误。
4.A 解析 汽水是将二氧化碳气体加压之后制成的,拉开易拉罐汽水的拉环,有气体自汽水中冲出,是因为压力减小使二氧化碳气体的溶解度变小。
5.B 解析 通过分析溶解度曲线可知,t1℃时,三种物质的溶解度由大到小的顺序是C>B>A,A错误;t2℃时,A和B的溶解度相等,因为该温度下它们有交点,B正确;C的溶解度随温度的升高而减少,将C的饱和溶液变为不饱和溶液可采用降低温度的方法,C错误;A、B两种物质的溶解度随温度的升高而增大,而C的溶解度随温度的升高而减少,D错误。
6.(1)①④ (2)②④
7.(1)10 (2)甲>乙(3)升高温度或增加溶剂 (4)降温结晶 (5)蒸发结晶
8.(1)> (2)80 (3)甲 (4)B
9.(1)31.6 y (2)蒸发溶剂至饱和(或加NaCl固体至不再溶解) (3)92.75 (4)蒸发浓缩 降温结晶
10.(1)①t1℃时,A、C物质的溶解度相等 ②60 ③降温 (2)①减小 ②>
11.A 解析 由表格中的数据分析知,第一组中的15gNaCl在20℃时固体全部溶解,而第二、三、四组的NaCl固体,在20℃时均溶解了18g,所以20℃时,NaCl固体的溶解度是18g。20℃时,50g水中含有18gNaCl,A错误;用蒸发的方法减少溶剂,可以使不饱和溶液变成饱和溶液,B正确;第二组所得溶液的溶质与溶剂的质量比为18﹕50=9﹕25,C正确;该实验中,相同温度下,NaCl在水里的溶解度与水的质量无关,D正确。
12.C 解析 由于推拉注射器改变了压强的大小,故该实验可用于探究压强对气体在水中溶解度的影响,A正确;用力向外拉动注射器时压强变小,气体的溶解度变小,会出现气泡,B正确;用力向里推注射器,压强增大,气体在水中的溶解度应该增大,C错误;注射器密封性能很好,改变压强方式较为容易,D正确。
13.B 解析 烧杯②中有固体剩余,上层溶液一定是饱和溶液,A正确;t1℃时,氯化钾的溶解度大于硝酸钾的溶解度,所以将等质量的硝酸钾和氯化钾分別加入到各盛有100g水的两个烧杯中,烧杯①中没有固体剩余,溶液的溶质是氯化钾,B错误;烧杯①中的固体全部溶解,烧杯②中有固体剩余,所以烧杯①溶液质量比烧杯②中溶液质量大,C正确;t2℃时,硝酸钾、氯化钾的溶解度相等,所以将温度升高到t2℃,烧杯②中的固体全部溶解,D正确。
14.(1)< (2)不饱和 (3)热水的温度(其他合理答案均可) 热水的量(其他合理答案均可)
15.(1)溶剂种类 温度 压强 (2)溶解度随温度的升高而减小;溶解度随压强的增大而增大 (3)大于 (4)排热水收集
16.(1)0.5 (2)C (3)B (4)转移固体 (5)晶体易溶于水,洗涤用水越少,晶体损失越小 滤液 (6)硝酸钾饱和溶液在较高温度下结晶时,析出的晶体较少
同课章节目录
