人教版九年级化学下册 第九单元 溶液 课题3 溶液的浓度 同步训练(WORD版,含答案)
文档属性
| 名称 | 人教版九年级化学下册 第九单元 溶液 课题3 溶液的浓度 同步训练(WORD版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-22 11:17:24 | ||
图片预览


文档简介
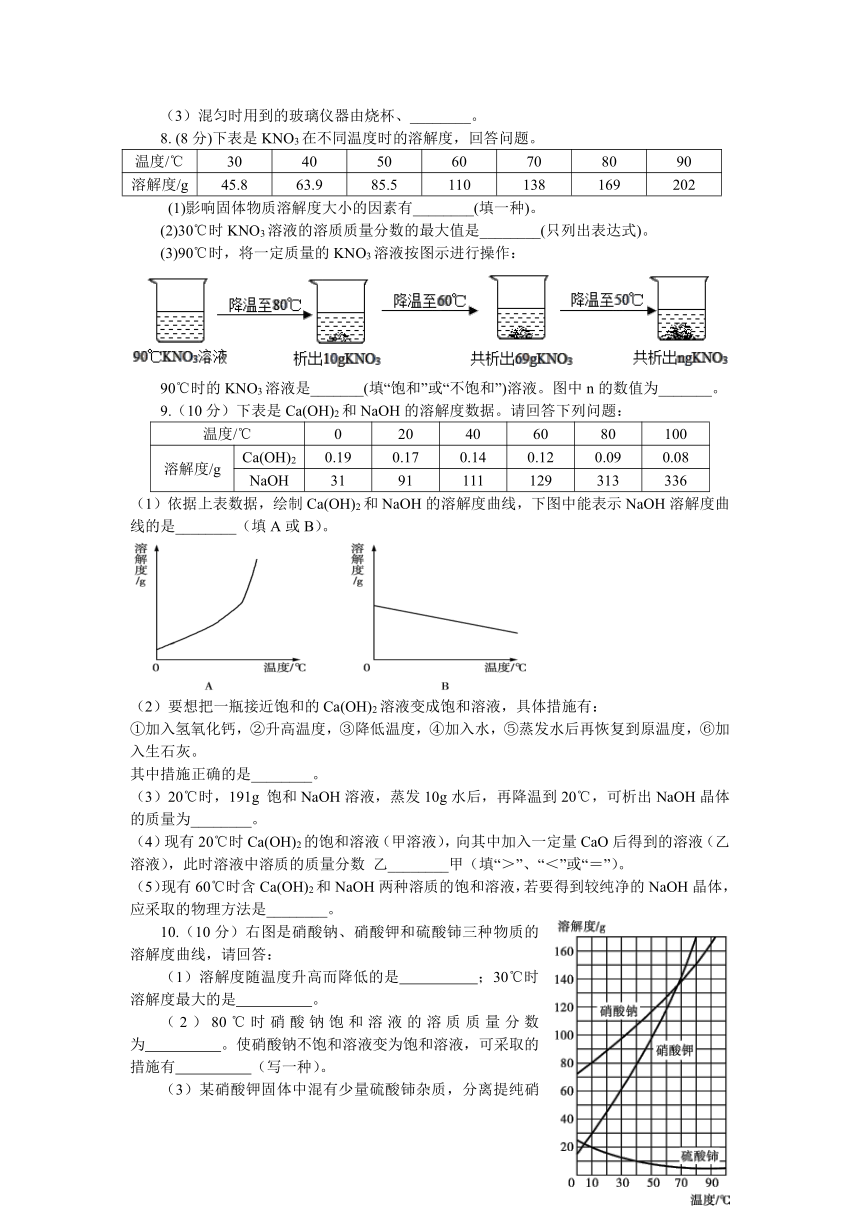
第九单元 课题3同步训练
基础题
一、选择题(共15分)
1.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
2.制药厂用质量分数为9%的氯化钠溶液100g配制质量分数为0.9%的生理盐水,需蒸馏水( )
A.90g B.100g C.900g D.200g
3.欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体 C.量取水 D.溶解
4.a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由t2℃降温到t1℃,一定有晶体析出
C. t2℃时,50g的a溶于50g水,溶液的质量分数为50%
D.c的饱和溶液由t2℃降温到t1℃,溶液的质量分数不变
5.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
二、填空题(共44分)
6.(10分)请根据图中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2)t2℃时,100g水中溶解_________g A物质恰好达到饱和,该饱和溶液中溶质的质量分数为_________,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水_________g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是__________。
7.(6分)在实验室,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,回答下列问题:
(1)需溶质质量分数为6%的氯化钠溶液________g。
(2)若用量筒量取水时仰视读数,而其它操作均正确,则所得溶液中溶质质量分数________(选填“大于”“小于”或“等于”)3%。
(3)混匀时用到的玻璃仪器由烧杯、________。
8. (8分)下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ 30 40 50 60 70 80 90
溶解度/g 45.8 63.9 85.5 110 138 169 202
(1)影响固体物质溶解度大小的因素有________(填一种)。
(2)30℃时KNO3溶液的溶质质量分数的最大值是________(只列出表达式)。
(3)90℃时,将一定质量的KNO3溶液按图示进行操作:
90℃时的KNO3溶液是_______(填“饱和”或“不饱和”)溶液。图中n的数值为_______。
9.(10分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ 0 20 40 60 80 100
溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
NaOH 31 91 111 129 313 336
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是________(填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是________。
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为________。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙________甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是________。
10.(10分)右图是硝酸钠、硝酸钾和硫酸铈三种物质的溶解度曲线,请回答:
(1)溶解度随温度升高而降低的是 ;30℃时溶解度最大的是 。
(2)80℃时硝酸钠饱和溶液的溶质质量分数为 。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有 (写一种)。
(3)某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、 、过滤、洗涤、干燥。
提高题
一、选择题(共9分)
11.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
A.①② B.③④ C.①③④ D.②③④
12.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少
D.①溶液中溶质的质量分数一定大于②溶液
13.小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为( )
A.12.4% B.17.2% C.16.9% D.12.5%
二、填空题(共8分)
14.(8分)下图是对某固体物质的溶液在一定温度下进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为________(填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为________。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是________。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而________(填“增大”或“减小”)。
三、实验探究题(共14分)
15.(14分)配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
四、计算题(共10分)
16.(10分)为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。
(1)碳酸钙完全反应用去稀盐酸的质量为_______g。
(2)该石灰石样品中碳酸钙的质量分数为_______。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少?
参考答案
1.B 解析 溶质的质量分数为20%,则溶质质量:溶剂质量:溶液质量=1:4:5。
2.C 解析 根据配制前后溶质的质量不变,高需蒸馏水的质量为x,则100g×9%=(100g+x)×0.9%,解得x=900g。
3.D 解析 取用固体药品时,应将瓶塞取下倒放在桌面上,A错误;称量药品时,应将药品放在左盘,砝码放在右盘,B错误;量筒读数时视线应与量筒内液体凹液面的最低处保持水平,C错误;溶解时应用玻璃棒不断搅拌,以加快物质溶解,D正确。
4.D 解析 比较物质的溶解度时,需要指明温度,A错误;将a的溶液由t2℃降温到t1℃,溶液的状态不能确定,所以不一定有晶体析出,B错误;t2℃时,a物质的溶解度是50g,所以50g的a溶于50g水,溶液的质量分数为×100%=33.3%,C错误;c的饱和溶液由t2℃降温到t1℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液的质量分数不变,D正确。
5.D 解析 量取水时量筒内事先有少量水,会造成实际量取的水的体积偏大,会使溶质质量分数偏小;所用氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;称量时砝码和药品的位置放反,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;将量筒中的水倒入烧杯时有水溅出,会造成实际所取的水的体积偏小,会使溶质质量分数偏大。
6.(1)t1 (2)25 20% 125 (3)B
7.(1)25 (2)小于 (3)玻璃棒
8.(1)温度(或溶质种类或溶剂种类或溶质性质或溶剂性质) (2)×100% (3)不饱和 (4)93.5
9.(1)A (2)①②⑤⑥ (3)9.1g (4)= (5)升高温度后,进行过滤
10.(1)硫酸铈 硝酸钠 (2)60% 降低温度(或加入硝酸钠或蒸发溶剂) (3)降温结晶
11.D 解析 在40℃之前,甲的溶解度随温度的升高而增大,而在40℃之后,甲的溶解度随温度的升高而减小,①错误;由于在40℃时甲的溶解度最大,因此升温、降温、蒸发溶剂都会使甲的饱和溶液中有晶体析出,②正确;根据图像可知,20℃时乙的溶解度为36g,125g20%的乙溶液中含有乙25g、水100g,最多还能溶解11g乙,③正确;乙物质的溶解度受温度变化影响较小,降温时乙析出晶体少,④正确。
12.C 解析 在比较物质的溶解度时,需要指明温度,A错误;甲物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小,所以升高温度,①试管中固体溶解,溶液质量增加,②试管中固体析出,溶液质量减少,B错误、C正确;溶液的温度不能确定,溶解度不能确定,所以无法比较两溶液中溶质的质量分数的大小,D错误。
13.A 解析 小芳用托盘天平称量时,将药品与砝码的位置放反了,使用的是10g和5g的砝码和2.7g的游码;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即药品质量=10g+5g-2.7g=12.3g;量取的水的实际体积为87mL(合87g);故小芳实际配制的氯化钠溶液的溶质质量分数=12.3/(12.3g+87g)×100%≈12.4%。
14.(1)不饱和 (2)15g (3)甲<乙<丙=丁(或丁=丙>乙>甲) (4)增大
15.(1)量筒 (2)7.5g 42.5g (3)左 (4)搅拌,加快溶解的速率 (5)AB (6)100
16.(1)84.32g
(2)设碳酸钙的质量为x,生成的氯化钙质量为y。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 3.52g
100:44=x:3.52g x=8g
111:44=y:3.52g y=8.88g
该石灰石样品中碳酸钙的质量分数=8g/10g×100%=80%
(3)反应后氯化钙溶液的质量为:84.32g+10g-3.52g-(10g-8g)=88.8g,所得溶液中溶质质量分数是:8.88g/88.8g×100%=10%。
答:(2)该石灰石样品中碳酸钙的质量分数为80%。(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少10%。
基础题
一、选择题(共15分)
1.某溶液中溶质的质量分数为20%,则下列质量比关系不正确的是( )
A.溶质:溶剂=1:4 B.溶质:溶剂=1:5
C.溶剂:溶液=4:5 D.溶质:溶液=1:5
2.制药厂用质量分数为9%的氯化钠溶液100g配制质量分数为0.9%的生理盐水,需蒸馏水( )
A.90g B.100g C.900g D.200g
3.欲配制质量分数为6%的NaCl溶液,下列有关操作正确的是( )
A.取固体 B.称固体 C.量取水 D.溶解
4.a、b、c三种不含结晶水的物质的溶解度曲线如图,下列说法正确的是( )
A.a的溶解度大于b的溶解度
B.将a的溶液由t2℃降温到t1℃,一定有晶体析出
C. t2℃时,50g的a溶于50g水,溶液的质量分数为50%
D.c的饱和溶液由t2℃降温到t1℃,溶液的质量分数不变
5.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
二、填空题(共44分)
6.(10分)请根据图中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2)t2℃时,100g水中溶解_________g A物质恰好达到饱和,该饱和溶液中溶质的质量分数为_________,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水_________g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是__________。
7.(6分)在实验室,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,回答下列问题:
(1)需溶质质量分数为6%的氯化钠溶液________g。
(2)若用量筒量取水时仰视读数,而其它操作均正确,则所得溶液中溶质质量分数________(选填“大于”“小于”或“等于”)3%。
(3)混匀时用到的玻璃仪器由烧杯、________。
8. (8分)下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ 30 40 50 60 70 80 90
溶解度/g 45.8 63.9 85.5 110 138 169 202
(1)影响固体物质溶解度大小的因素有________(填一种)。
(2)30℃时KNO3溶液的溶质质量分数的最大值是________(只列出表达式)。
(3)90℃时,将一定质量的KNO3溶液按图示进行操作:
90℃时的KNO3溶液是_______(填“饱和”或“不饱和”)溶液。图中n的数值为_______。
9.(10分)下表是Ca(OH)2和NaOH的溶解度数据。请回答下列问题:
温度/℃ 0 20 40 60 80 100
溶解度/g Ca(OH)2 0.19 0.17 0.14 0.12 0.09 0.08
NaOH 31 91 111 129 313 336
(1)依据上表数据,绘制Ca(OH)2和NaOH的溶解度曲线,下图中能表示NaOH溶解度曲线的是________(填A或B)。
(2)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体措施有:
①加入氢氧化钙,②升高温度,③降低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰。
其中措施正确的是________。
(3)20℃时,191g 饱和NaOH溶液,蒸发10g水后,再降温到20℃,可析出NaOH晶体的质量为________。
(4)现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液中溶质的质量分数 乙________甲(填“>”、“<”或“=”)。
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是________。
10.(10分)右图是硝酸钠、硝酸钾和硫酸铈三种物质的溶解度曲线,请回答:
(1)溶解度随温度升高而降低的是 ;30℃时溶解度最大的是 。
(2)80℃时硝酸钠饱和溶液的溶质质量分数为 。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有 (写一种)。
(3)某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、 、过滤、洗涤、干燥。
提高题
一、选择题(共9分)
11.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
A.①② B.③④ C.①③④ D.②③④
12.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少
D.①溶液中溶质的质量分数一定大于②溶液
13.小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为( )
A.12.4% B.17.2% C.16.9% D.12.5%
二、填空题(共8分)
14.(8分)下图是对某固体物质的溶液在一定温度下进行恒温蒸发操作的实验记录。
请回答:
(1)乙中的溶液为________(填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为________。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是________。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而________(填“增大”或“减小”)。
三、实验探究题(共14分)
15.(14分)配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称:_______。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠_______g,水_______g。
(3)称量氯化钠时,氯化钠应放在托盘天平的_______盘。(填“左”或“右”)
(4)溶解过程中玻璃棒的作用是_______。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有_______。(填序号)
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(6)把 50g 质量分数为 15%的氯化钠溶液稀释成 5%的氯化钠溶液,需要水的质量是_______g。
四、计算题(共10分)
16.(10分)为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图(见图)。
(1)碳酸钙完全反应用去稀盐酸的质量为_______g。
(2)该石灰石样品中碳酸钙的质量分数为_______。
(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少?
参考答案
1.B 解析 溶质的质量分数为20%,则溶质质量:溶剂质量:溶液质量=1:4:5。
2.C 解析 根据配制前后溶质的质量不变,高需蒸馏水的质量为x,则100g×9%=(100g+x)×0.9%,解得x=900g。
3.D 解析 取用固体药品时,应将瓶塞取下倒放在桌面上,A错误;称量药品时,应将药品放在左盘,砝码放在右盘,B错误;量筒读数时视线应与量筒内液体凹液面的最低处保持水平,C错误;溶解时应用玻璃棒不断搅拌,以加快物质溶解,D正确。
4.D 解析 比较物质的溶解度时,需要指明温度,A错误;将a的溶液由t2℃降温到t1℃,溶液的状态不能确定,所以不一定有晶体析出,B错误;t2℃时,a物质的溶解度是50g,所以50g的a溶于50g水,溶液的质量分数为×100%=33.3%,C错误;c的饱和溶液由t2℃降温到t1℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液的质量分数不变,D正确。
5.D 解析 量取水时量筒内事先有少量水,会造成实际量取的水的体积偏大,会使溶质质量分数偏小;所用氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;称量时砝码和药品的位置放反,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;将量筒中的水倒入烧杯时有水溅出,会造成实际所取的水的体积偏小,会使溶质质量分数偏大。
6.(1)t1 (2)25 20% 125 (3)B
7.(1)25 (2)小于 (3)玻璃棒
8.(1)温度(或溶质种类或溶剂种类或溶质性质或溶剂性质) (2)×100% (3)不饱和 (4)93.5
9.(1)A (2)①②⑤⑥ (3)9.1g (4)= (5)升高温度后,进行过滤
10.(1)硫酸铈 硝酸钠 (2)60% 降低温度(或加入硝酸钠或蒸发溶剂) (3)降温结晶
11.D 解析 在40℃之前,甲的溶解度随温度的升高而增大,而在40℃之后,甲的溶解度随温度的升高而减小,①错误;由于在40℃时甲的溶解度最大,因此升温、降温、蒸发溶剂都会使甲的饱和溶液中有晶体析出,②正确;根据图像可知,20℃时乙的溶解度为36g,125g20%的乙溶液中含有乙25g、水100g,最多还能溶解11g乙,③正确;乙物质的溶解度受温度变化影响较小,降温时乙析出晶体少,④正确。
12.C 解析 在比较物质的溶解度时,需要指明温度,A错误;甲物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小,所以升高温度,①试管中固体溶解,溶液质量增加,②试管中固体析出,溶液质量减少,B错误、C正确;溶液的温度不能确定,溶解度不能确定,所以无法比较两溶液中溶质的质量分数的大小,D错误。
13.A 解析 小芳用托盘天平称量时,将药品与砝码的位置放反了,使用的是10g和5g的砝码和2.7g的游码;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量-游码质量,即药品质量=10g+5g-2.7g=12.3g;量取的水的实际体积为87mL(合87g);故小芳实际配制的氯化钠溶液的溶质质量分数=12.3/(12.3g+87g)×100%≈12.4%。
14.(1)不饱和 (2)15g (3)甲<乙<丙=丁(或丁=丙>乙>甲) (4)增大
15.(1)量筒 (2)7.5g 42.5g (3)左 (4)搅拌,加快溶解的速率 (5)AB (6)100
16.(1)84.32g
(2)设碳酸钙的质量为x,生成的氯化钙质量为y。
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 3.52g
100:44=x:3.52g x=8g
111:44=y:3.52g y=8.88g
该石灰石样品中碳酸钙的质量分数=8g/10g×100%=80%
(3)反应后氯化钙溶液的质量为:84.32g+10g-3.52g-(10g-8g)=88.8g,所得溶液中溶质质量分数是:8.88g/88.8g×100%=10%。
答:(2)该石灰石样品中碳酸钙的质量分数为80%。(3)当盐酸和石灰石恰好完全反应,所得溶液中溶质质量分数是多少10%。
同课章节目录
