备战2022 浙教版科学 中考一轮复习 第32课时 水和溶液 课件(共64张PPT)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮复习 第32课时 水和溶液 课件(共64张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-24 15:10:18 | ||
图片预览







文档简介
(共64张PPT)
第32课时 水和溶液
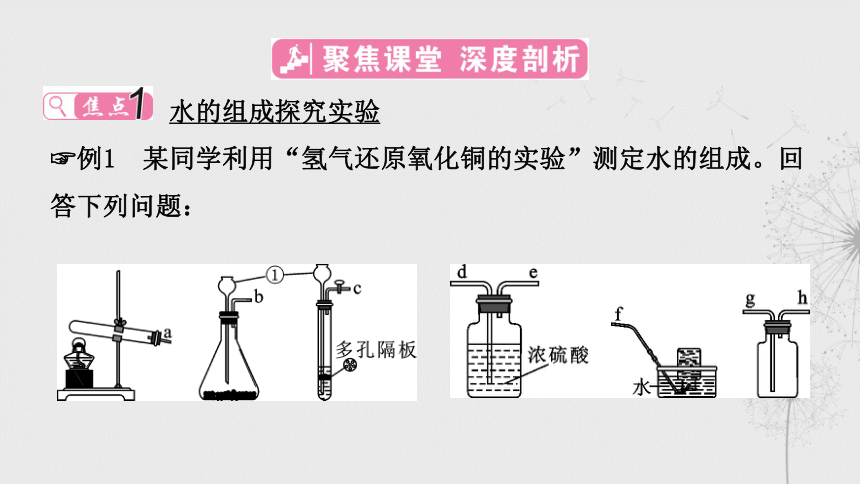
水的组成探究实验
例1 某同学利用“氢气还原氧化铜的实验”测定水的组成。回答下列问题:
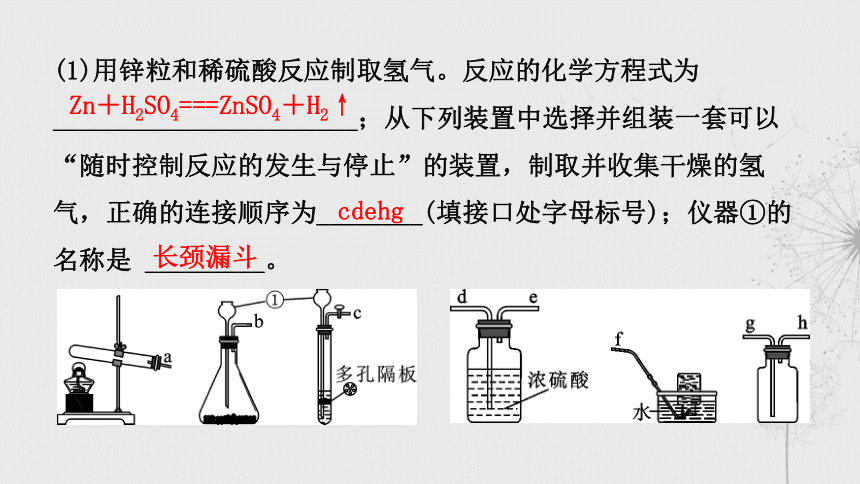
(1)用锌粒和稀硫酸反应制取氢气。反应的化学方程式为
_______________________;从下列装置中选择并组装一套可以
“随时控制反应的发生与停止”的装置,制取并收集干燥的氢
气,正确的连接顺序为________(填接口处字母标号);仪器①的
名称是 _________。
Zn+H2SO4===ZnSO4+H2↑
cdehg
长颈漏斗
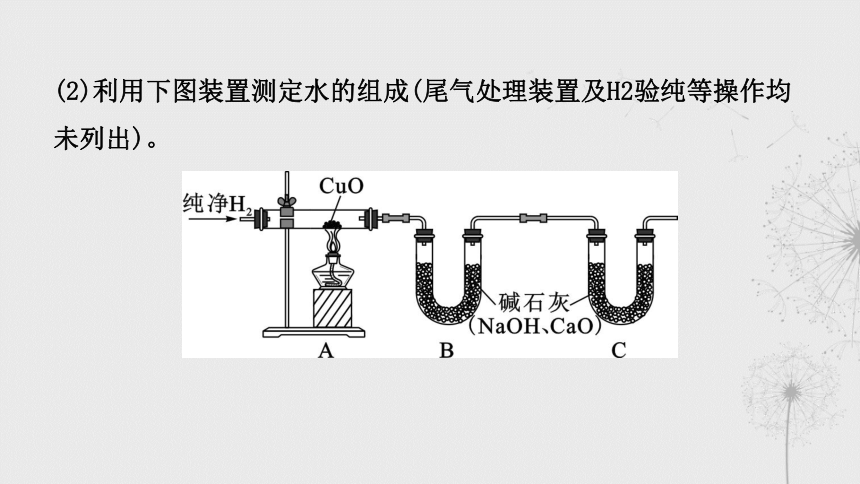
(2)利用下图装置测定水的组成(尾气处理装置及H2验纯等操作均未列出)。
①下列操作的正确顺序为_______(填字母序号)。
a.点燃酒精灯 b.通入H2
c.停止通入H2 d.熄灭酒精灯
②装置C的作用是 _____________________________。
(3)若装置A中的玻璃管和其中的物质在反应前后的质量差为m1,
装置B和其中的物质在反应前后的质量差为m2,则水中H、O元素的
质量比为 ___________(用含m1、m2的代数式表示)。
badc
防止空气中的水蒸气对实验干扰
(m2-m1)/m1
【解析】(1)锌粒和稀硫酸反应生成硫酸锌和氢气,化学方程式为Zn+H2SO4===ZnSO4+H2↑;选择并组装一套可以“随时控制反应的发生与停止”的装置,制取并收集干燥的氢气,那么应先制取,再干燥,后收集。多孔塑料隔板与长颈漏斗和活塞的组合可以达到“随时控制反应的发生与停止”的目的,浓硫酸可以起到干燥的作用,收集干燥的氢气应采用向下排空气法收集;仪器①的名称是长颈漏斗;(2) ①由于氢气属于可燃性气体,与空气混合加热有可能发生爆炸,故反应前应先通入氢气,待空气排尽后再点燃酒精灯,反应结束后,为防止刚生成的灼热的铜被重新氧
化,故应先熄灭酒精灯,继续通入氢气直至装置冷却到室温;②如果没有装置C,则B装置也会吸收空气中的水蒸气,故装置C的作用是防止空气中的水蒸气对实验的干扰;(3) 装置A中的玻璃管和其中的物质在反应前后的质量差为m1,即为氧化铜中氧元素的质量。装置B和其中的物质在反应前后的质量差为m2,即为反应生成水的质量。故氢元素的质量为(m2- m1),那么水中H、O元素的质量比为:(m2-m1)/m1。
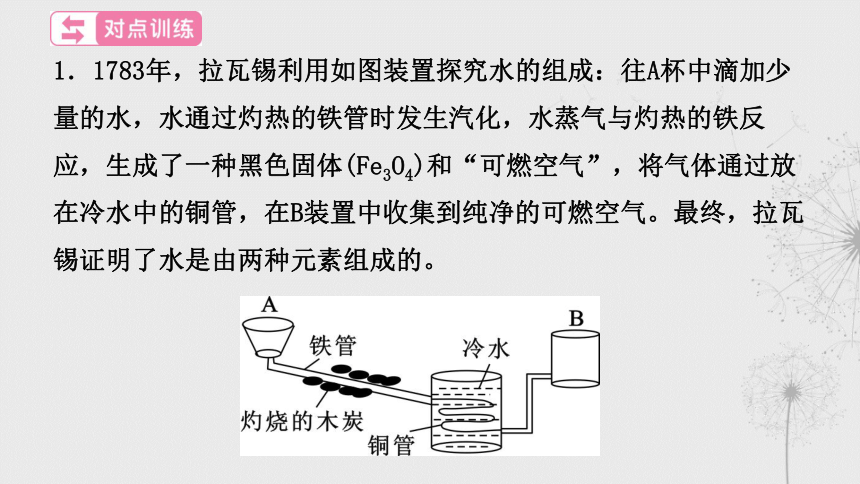
1.1783年,拉瓦锡利用如图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(Fe3O4)和“可燃空气”,将气体通过放在冷水中的铜管,在B装置中收集到纯净的可燃空气。最终,拉瓦锡证明了水是由两种元素组成的。
(1)将气体通过放在冷水中的铜管,目的是除去_________。
(2)将B装置收集到的可燃空气在氧气中点燃,生成了水。可燃
空气的名称是_______。
(3)若该实验中生成的黑色固体质量为m1, 可燃空气的质量为m2,
可燃空气完全燃烧生成水的质量为m3,如果水是由“氧元素”和
“可燃空气元素”组成的,则m1、m2、m3三者应满足的关系是
_____________。
水蒸气
氢气
水与氧化物的反应
例2 将5克下列物质分别放入95克水中,充分搅拌后静置,
所得四种溶液中溶质质量分数大小关系是 ___________。
A.氯化钠 B.氧化钠
C.氧化钙 D.硫酸铜晶体
B>A>D>C
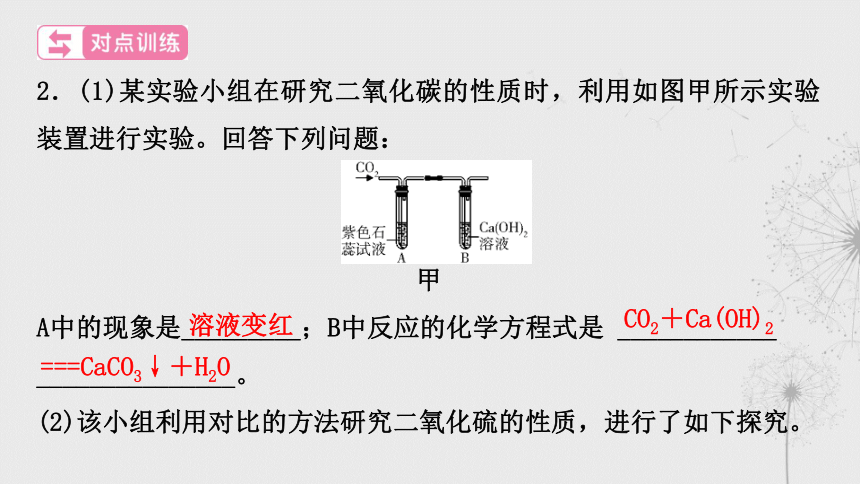
2.(1)某实验小组在研究二氧化碳的性质时,利用如图甲所示实验装置进行实验。回答下列问题:
甲
A中的现象是_________;B中反应的化学方程式是 ____________
_______________。
(2)该小组利用对比的方法研究二氧化硫的性质,进行了如下探究。
溶液变红
CO2+Ca(OH)2
===CaCO3↓+H2O
【提出问题】二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在。
【实验探究】实验装置如图乙所示。
乙
①装置C中紫色石蕊试液变红,是由于二氧化硫与水反应生成了亚
硫酸(H2SO3),反应的方程式为 _______________。装置D中澄清
石灰水变浑浊,反应的化学方程式为 ________________________
___。
SO2+H2O===H2SO3
SO2+Ca(OH)2===CaSO3↓+
H2O
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为红色,
其原因是_________________________________________________
_______________。
③此装置有一个明显的不足之处是 _________________。
二氧化硫与品红溶液反应生成不稳定的无色物质,加热
又分解生成了SO2
没有进行尾气处理
【反思提高】某同学将二氧化硫通入到紫色的酸性高锰酸钾溶液
中,观察到溶液由紫色变为无色,由此他得出的结论是:二氧化
硫能将酸性高锰酸钾溶液漂白。请你设计实验证明此结论是否正
确(要求写出操作、现象和结论): _________________________
_________________________________________________________
___________________________。
【实验结论】二氧化硫与二氧化碳有相似的化学性质,但二氧化
硫还具有某些特殊的化学性质。
将褪色后的溶液加热,观察
溶液颜色变化,若溶液恢复为紫色,则此结论正确;若溶液不能
恢复为紫色,则此结论不正确
识别溶液、悬浊液、乳浊液
例3 下列物质中,属于溶液的是( )
A.矿泉水 B.冰水 C.石灰乳 D.液氧
【解析】溶液的特征是均一、稳定,但大前提是混合物。矿泉水是均一、稳定的混合物,属于溶液;冰水是纯净物,不属于混合物,不是溶液;石灰乳是不均一、不稳定的混合物,不是溶液;液氧是纯净物,不属于混合物,不是溶液。
3.厨房中很多调味品,其中放入水中不能形成溶液的是( )
A.食盐 B.味精 C.淀粉 D.食用碱
溶液的特征及稀释、浓缩过程中变化量与不变量
例4 台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于___________。
(2)渣汁的分离与图中的____(填“A”“B”或“C”)实验原理相同。
物理变化
B
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化?
_______。
【解析】(1)甘蔗在压榨过程中没有新的物质生成,发生的变化属于物理变化。(2)渣汁的分离是将不溶性物质与液体分离的过程,跟过滤的原理相同。(3)糖汁在蒸发浓缩过程中,溶剂蒸发,溶质不变,所以溶质质量分数将会变大
变大
4.将某温度下热的硝酸钾饱和溶液逐渐冷却,下列有关量随时间变化趋势的图象不正确的是( )
区别饱和与不饱和溶液及温度对物质溶解度的影响
例5 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析不正确的是( )
A.甲烧杯中,硝酸钾溶液是饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变小
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变小
【解析】A.甲烧杯中,硝酸钾未完全溶解,一定是硝酸钾的饱和溶液; B.丁烧杯中的溶液是由丙烧杯中溶液再加25克水形成,一定是硝酸钾的不饱和溶液 ;C.乙→丙过程中,若固体刚好溶解,即丙恰好是饱和溶液时,相同温度下同一种溶质,溶质质量分数都相等,加水过程中硝酸钾溶液的溶质质量分数不变;若丙已经成为不饱和溶液,则溶质质量分数变小,所以乙→丙过程中溶质质量分数变化情况是要分类讨论的; D.丙→丁过程中,硝酸钾溶液的溶质质量分数变小。
5.(1)作为粽子品质改良剂、防腐剂的灰汤富含碳酸钾。碳酸钾
水溶液呈碱性,这是碳酸钾的___________(选填“物理性质”或
“化学性质”)
(2)制作灰汤时,用沸水浇淋草木灰(如图),比
用冷水浇淋可得到溶质质量分数更大的碳酸钾
溶液。这说明物质的溶解性受 _____影响。
(3)灰汤粽是将糯米用棕叶包裹,放在灰汤中煮制而成。灰汤粽中
为人体提供能量的主要营养素是 _____。
化学性质
温度
糖类
配制一定溶质质量分数的溶液
例6 图甲是一种稀释瓶,用户可以根据需求用它以一定体积比对原液进行稀释,图乙是它的7种不同比例的稀释方式。小科用该稀释瓶按1∶2的比例稀释原液,原液是密度为1.5 g/mL、溶质质量分数为50%的NaOH溶液。稀释过程中,不考虑温度变化和混合前后的体积变化。
(1)当水加到1∶1刻度线时,水对稀释瓶底的压强为p1,当水加到
1∶2的刻度线时,水对稀释瓶底的压强为p2,则p1____(填“>”
“<”或“=”)p2。
(2)稀释得到的NaOH溶液的密度为______g/mL,溶质质量分数为
______。(计算结果分别精确到0.1g/mL和0.1%)
<
1.2
21.4%
例7 某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)判断原硫酸铜溶液已饱和的方法是____。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
D
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和
溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时
硫酸铜饱和溶液的溶质质量分数。
解:析出晶体中无水硫酸铜的质量=50克× ×100%=32克,
溶液中剩余溶质的质量=49克-32克=17克,溶液的质量=150克
-50克=100克。所以,溶质质量分数= ×100%=17%。
【解析】(1)饱和溶液是指在一定温度下,一定量的溶剂中不能继续溶解该溶质的溶液,由此可知D的判断方法是有科学依据的。(2)计算溶液中溶质质量分数,需明确溶质质量与溶液质量,硫酸铜溶液的溶质是CuSO4,是原来加进去的49克无水硫酸铜减去析出的晶体中的无水硫酸铜;溶液质量用守恒的方法计算,即总质量减去析出部分的质量为剩余溶液的质量。
6.“84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
解:Cl% =Cl/NaClO×100%
=35.5/74.5×100%
=47.7%
答:次氯酸钠中氯元素的质量分数为47.7%。
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配制,需加水多少升?(忽略混合前后溶液体积的变化)
解:5L×500mg/L=V浓×50000mg/L
V浓 = 0.05L
V水 = V稀-V浓=5L -0.05L= 4.95L
答:需加水4.95L。
(3)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
浓度(mg/m3) 对人体的影响
3000 可立即麻痹呼吸中枢, 导致瞬间死亡
120~170 极为危险, 会引起急性肺水肿及肺炎
40~60 在1小时内便可致人严重中毒
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响? (次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl===NaCl+Cl2↑+H2O)
7.下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
(1)10℃时,100克水中最多可溶解硝酸钾的质量为_______克。
温度/℃ 0 10 20 30 40
溶解度/克 13.3 20.9 31.6 45.8 63.9
20.9
(2)20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分
数为 ____。
(3)如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方
法。(写出计算过程)
20%
解:方法一:设要加入硝酸钾的质量为x。
100克×10%+x=(100克+x)×25%
x=20克
答:可向烧杯中加入20克硝酸钾。
方法二:设蒸发水的质量为y。
100克×10%=(100克-y)×25% y=60克
答:可恒温蒸发60克水。
认识水净化过程的变化本质
例8 科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是( )
A.该过程属于物理变化
B.该过程可应用于海水淡化
C.“筛掉”氯化钠过程类似于过滤操作
D.“筛掉”氯化钠后的海水溶质质量分数增大
【解析】用石墨烯膜“筛掉”海水中的钠离子和氯离子的方法与过滤类似,物质没有发生变化,只是将它们进行了分离。该过程没有新物质生成,属于物理变化;该过程可应用于海水淡化,海水中含的盐主要是氯化钠,“筛掉”水中盐分后形成淡水;过滤也是将一部分不能通过滤纸的物质筛选掉,“筛掉”氯化钠过程也是让部分物质通过,部分物质不能通过而被筛选掉,所以两者类似;“筛掉”氯化钠后的海水中氯化钠减少,故质量分数减小了。
8.为了解决人们在野外生活和工作时的饮水问题,小金开展了便
携式野外净水器的设计和制作。设计方案如图所示(其中箭头表示
预设的水流方向)。为了使水质符合饮用水标准,小金选择了三种
滤料去除原水中的杂质,三种滤料的用途如表所示,则滤料甲、
乙、丙分别为 _______(按序填写编号)。
滤料编号 用途
① 去除水中的泥沙、悬浮物等大颗粒污染物
② 去除大分子有机物、重金属离子和细菌等
③ 去除残留的细菌、小分子有机物、重金属离子和异味等
①②③
树立节约用水和防止水污染的意识
例9 2022年3月22日是第三十届“世界水日”。水是一种重要的自然资源,节约用水、防治水污染应成为我们的自觉行为。下列做法错误的是( )
A.随手关闭水龙头
B.往河流里倾倒垃圾
C.农业上采用滴灌技术
D.工业废水经处理达标后排放
【解析】随手关闭水龙头,养成节约用水的好习惯;往河里倾倒生活垃圾,破坏环境,这种做法是错误的;农业上采用滴灌技术,通过科学技术的进步,达到节约用水保护环境,提高人类的生产、生活水平;工业废水随意排放是造成环境污染的重要原因,必须经处理达标才可排放。
9.火电厂发电需要燃烧大量的煤,由于煤中含有硫元素,未经脱
硫的煤燃烧后,产生的气体会导致严重的大气污染,进入水体,
也会加剧水污染。
(1)硫能在空气中燃烧,燃烧后生成的气体排放到空气中,吸收空
气中的水蒸气,经过复杂的变化最终会被氧气氧化成硫酸,形成
酸雨,大气污染物最终会转移到土壤、水体中。此过程的两个化
学反应方程式为:______________;______________________。
====
点燃
2S+O2 SO2
2SO2+2H2O+O2===2H2SO4
(2)“坚持节水优先,强化水资源管理”。保护水环境、珍惜水资源,是每个公民应尽的责任和义务。为了保护水资源,下列做法不可行的是 。(填字母编号)
A.节约用水
B.抑制水中所有动、植物的生长
C.不任意排放生活污水
D.工业污水净化处理后排放
粗盐提纯及混合物的分离
例10 以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒的作用
是_______。
引流
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列
是所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量
的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液。能达到
目的的顺序是____。
A.⑤③②①④
B.③⑤①④②
C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是 ___________________
___________________________________________________。
C
用洁净的玻璃棒蘸取
少量溶液,滴在pH试纸上,显示的颜色与标准比色卡对照
【解析】(1)过滤要用玻璃棒引流,使液体沿玻璃棒流入过滤器中;(2)加入过量的氢氧化钠溶液可以除去氯化镁,加入过量的氯化钡溶液可以除去硫酸钠,加入过量的碳酸钠溶液可以除去过量的氯化钙和氯化钡;过滤将沉淀与溶液分离;加入稀盐酸可以除去过量的氢氧化钠和过量的碳酸钠,加盐酸除氢氧化钠与碳酸钠之前必须要先将固液分离,否则沉淀又重新溶解,达不到除杂质的目的。(3)用pH试纸检验溶液是否呈中性的操作是用洁净的玻璃棒蘸取少量溶液,滴在pH试纸上,显示的颜色与标准比色卡对照,注意pH试纸要放在玻璃片或白瓷板上。
10.用下列实验操作可分别完成“粗盐中难溶性杂质的去除”和“一定溶质质量分数的氯化钠溶液的配制”两个实验。
(1)操作E中得到的滤液仍浑浊,其原因可能是 ________________
____________________________(答出一点即可)。
(2)若图B所用的烧杯内壁沾有水,导致配制溶液中溶质的质量分
数会 _____(填“偏大”“偏小”或“不变”)。
(3)图D中玻璃棒的作用是 _________________________________
_____。
(4)图C中有一处明显的错误,请你改正: ___________________
___________。
滤纸破损(或液面
高于滤纸边缘或仪器不干净等)
偏小
搅拌,防止局部温度过高,造成液滴
飞溅
视线应与凹液面最低
处保持水平
第32课时 水和溶液
水的组成探究实验
例1 某同学利用“氢气还原氧化铜的实验”测定水的组成。回答下列问题:
(1)用锌粒和稀硫酸反应制取氢气。反应的化学方程式为
_______________________;从下列装置中选择并组装一套可以
“随时控制反应的发生与停止”的装置,制取并收集干燥的氢
气,正确的连接顺序为________(填接口处字母标号);仪器①的
名称是 _________。
Zn+H2SO4===ZnSO4+H2↑
cdehg
长颈漏斗
(2)利用下图装置测定水的组成(尾气处理装置及H2验纯等操作均未列出)。
①下列操作的正确顺序为_______(填字母序号)。
a.点燃酒精灯 b.通入H2
c.停止通入H2 d.熄灭酒精灯
②装置C的作用是 _____________________________。
(3)若装置A中的玻璃管和其中的物质在反应前后的质量差为m1,
装置B和其中的物质在反应前后的质量差为m2,则水中H、O元素的
质量比为 ___________(用含m1、m2的代数式表示)。
badc
防止空气中的水蒸气对实验干扰
(m2-m1)/m1
【解析】(1)锌粒和稀硫酸反应生成硫酸锌和氢气,化学方程式为Zn+H2SO4===ZnSO4+H2↑;选择并组装一套可以“随时控制反应的发生与停止”的装置,制取并收集干燥的氢气,那么应先制取,再干燥,后收集。多孔塑料隔板与长颈漏斗和活塞的组合可以达到“随时控制反应的发生与停止”的目的,浓硫酸可以起到干燥的作用,收集干燥的氢气应采用向下排空气法收集;仪器①的名称是长颈漏斗;(2) ①由于氢气属于可燃性气体,与空气混合加热有可能发生爆炸,故反应前应先通入氢气,待空气排尽后再点燃酒精灯,反应结束后,为防止刚生成的灼热的铜被重新氧
化,故应先熄灭酒精灯,继续通入氢气直至装置冷却到室温;②如果没有装置C,则B装置也会吸收空气中的水蒸气,故装置C的作用是防止空气中的水蒸气对实验的干扰;(3) 装置A中的玻璃管和其中的物质在反应前后的质量差为m1,即为氧化铜中氧元素的质量。装置B和其中的物质在反应前后的质量差为m2,即为反应生成水的质量。故氢元素的质量为(m2- m1),那么水中H、O元素的质量比为:(m2-m1)/m1。
1.1783年,拉瓦锡利用如图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(Fe3O4)和“可燃空气”,将气体通过放在冷水中的铜管,在B装置中收集到纯净的可燃空气。最终,拉瓦锡证明了水是由两种元素组成的。
(1)将气体通过放在冷水中的铜管,目的是除去_________。
(2)将B装置收集到的可燃空气在氧气中点燃,生成了水。可燃
空气的名称是_______。
(3)若该实验中生成的黑色固体质量为m1, 可燃空气的质量为m2,
可燃空气完全燃烧生成水的质量为m3,如果水是由“氧元素”和
“可燃空气元素”组成的,则m1、m2、m3三者应满足的关系是
_____________。
水蒸气
氢气
水与氧化物的反应
例2 将5克下列物质分别放入95克水中,充分搅拌后静置,
所得四种溶液中溶质质量分数大小关系是 ___________。
A.氯化钠 B.氧化钠
C.氧化钙 D.硫酸铜晶体
B>A>D>C
2.(1)某实验小组在研究二氧化碳的性质时,利用如图甲所示实验装置进行实验。回答下列问题:
甲
A中的现象是_________;B中反应的化学方程式是 ____________
_______________。
(2)该小组利用对比的方法研究二氧化硫的性质,进行了如下探究。
溶液变红
CO2+Ca(OH)2
===CaCO3↓+H2O
【提出问题】二氧化硫与二氧化碳均属于非金属氧化物,是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在。
【实验探究】实验装置如图乙所示。
乙
①装置C中紫色石蕊试液变红,是由于二氧化硫与水反应生成了亚
硫酸(H2SO3),反应的方程式为 _______________。装置D中澄清
石灰水变浑浊,反应的化学方程式为 ________________________
___。
SO2+H2O===H2SO3
SO2+Ca(OH)2===CaSO3↓+
H2O
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为红色,
其原因是_________________________________________________
_______________。
③此装置有一个明显的不足之处是 _________________。
二氧化硫与品红溶液反应生成不稳定的无色物质,加热
又分解生成了SO2
没有进行尾气处理
【反思提高】某同学将二氧化硫通入到紫色的酸性高锰酸钾溶液
中,观察到溶液由紫色变为无色,由此他得出的结论是:二氧化
硫能将酸性高锰酸钾溶液漂白。请你设计实验证明此结论是否正
确(要求写出操作、现象和结论): _________________________
_________________________________________________________
___________________________。
【实验结论】二氧化硫与二氧化碳有相似的化学性质,但二氧化
硫还具有某些特殊的化学性质。
将褪色后的溶液加热,观察
溶液颜色变化,若溶液恢复为紫色,则此结论正确;若溶液不能
恢复为紫色,则此结论不正确
识别溶液、悬浊液、乳浊液
例3 下列物质中,属于溶液的是( )
A.矿泉水 B.冰水 C.石灰乳 D.液氧
【解析】溶液的特征是均一、稳定,但大前提是混合物。矿泉水是均一、稳定的混合物,属于溶液;冰水是纯净物,不属于混合物,不是溶液;石灰乳是不均一、不稳定的混合物,不是溶液;液氧是纯净物,不属于混合物,不是溶液。
3.厨房中很多调味品,其中放入水中不能形成溶液的是( )
A.食盐 B.味精 C.淀粉 D.食用碱
溶液的特征及稀释、浓缩过程中变化量与不变量
例4 台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于___________。
(2)渣汁的分离与图中的____(填“A”“B”或“C”)实验原理相同。
物理变化
B
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化?
_______。
【解析】(1)甘蔗在压榨过程中没有新的物质生成,发生的变化属于物理变化。(2)渣汁的分离是将不溶性物质与液体分离的过程,跟过滤的原理相同。(3)糖汁在蒸发浓缩过程中,溶剂蒸发,溶质不变,所以溶质质量分数将会变大
变大
4.将某温度下热的硝酸钾饱和溶液逐渐冷却,下列有关量随时间变化趋势的图象不正确的是( )
区别饱和与不饱和溶液及温度对物质溶解度的影响
例5 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析不正确的是( )
A.甲烧杯中,硝酸钾溶液是饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变小
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变小
【解析】A.甲烧杯中,硝酸钾未完全溶解,一定是硝酸钾的饱和溶液; B.丁烧杯中的溶液是由丙烧杯中溶液再加25克水形成,一定是硝酸钾的不饱和溶液 ;C.乙→丙过程中,若固体刚好溶解,即丙恰好是饱和溶液时,相同温度下同一种溶质,溶质质量分数都相等,加水过程中硝酸钾溶液的溶质质量分数不变;若丙已经成为不饱和溶液,则溶质质量分数变小,所以乙→丙过程中溶质质量分数变化情况是要分类讨论的; D.丙→丁过程中,硝酸钾溶液的溶质质量分数变小。
5.(1)作为粽子品质改良剂、防腐剂的灰汤富含碳酸钾。碳酸钾
水溶液呈碱性,这是碳酸钾的___________(选填“物理性质”或
“化学性质”)
(2)制作灰汤时,用沸水浇淋草木灰(如图),比
用冷水浇淋可得到溶质质量分数更大的碳酸钾
溶液。这说明物质的溶解性受 _____影响。
(3)灰汤粽是将糯米用棕叶包裹,放在灰汤中煮制而成。灰汤粽中
为人体提供能量的主要营养素是 _____。
化学性质
温度
糖类
配制一定溶质质量分数的溶液
例6 图甲是一种稀释瓶,用户可以根据需求用它以一定体积比对原液进行稀释,图乙是它的7种不同比例的稀释方式。小科用该稀释瓶按1∶2的比例稀释原液,原液是密度为1.5 g/mL、溶质质量分数为50%的NaOH溶液。稀释过程中,不考虑温度变化和混合前后的体积变化。
(1)当水加到1∶1刻度线时,水对稀释瓶底的压强为p1,当水加到
1∶2的刻度线时,水对稀释瓶底的压强为p2,则p1____(填“>”
“<”或“=”)p2。
(2)稀释得到的NaOH溶液的密度为______g/mL,溶质质量分数为
______。(计算结果分别精确到0.1g/mL和0.1%)
<
1.2
21.4%
例7 某同学进行硫酸铜晶体(化学式为CuSO4·5H2O)的制备和生长实验,配制了某温度时的硫酸铜饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)判断原硫酸铜溶液已饱和的方法是____。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
D
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和
溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时
硫酸铜饱和溶液的溶质质量分数。
解:析出晶体中无水硫酸铜的质量=50克× ×100%=32克,
溶液中剩余溶质的质量=49克-32克=17克,溶液的质量=150克
-50克=100克。所以,溶质质量分数= ×100%=17%。
【解析】(1)饱和溶液是指在一定温度下,一定量的溶剂中不能继续溶解该溶质的溶液,由此可知D的判断方法是有科学依据的。(2)计算溶液中溶质质量分数,需明确溶质质量与溶液质量,硫酸铜溶液的溶质是CuSO4,是原来加进去的49克无水硫酸铜减去析出的晶体中的无水硫酸铜;溶液质量用守恒的方法计算,即总质量减去析出部分的质量为剩余溶液的质量。
6.“84消毒液”是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)“84消毒液”中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
解:Cl% =Cl/NaClO×100%
=35.5/74.5×100%
=47.7%
答:次氯酸钠中氯元素的质量分数为47.7%。
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌“84消毒液”进行配制,需加水多少升?(忽略混合前后溶液体积的变化)
解:5L×500mg/L=V浓×50000mg/L
V浓 = 0.05L
V水 = V稀-V浓=5L -0.05L= 4.95L
答:需加水4.95L。
(3)“84消毒液”不能与洁厕灵混合使用,因为“84消毒液”里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
浓度(mg/m3) 对人体的影响
3000 可立即麻痹呼吸中枢, 导致瞬间死亡
120~170 极为危险, 会引起急性肺水肿及肺炎
40~60 在1小时内便可致人严重中毒
通过计算分析,在10米3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响? (次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl===NaCl+Cl2↑+H2O)
7.下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
(1)10℃时,100克水中最多可溶解硝酸钾的质量为_______克。
温度/℃ 0 10 20 30 40
溶解度/克 13.3 20.9 31.6 45.8 63.9
20.9
(2)20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分
数为 ____。
(3)如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方
法。(写出计算过程)
20%
解:方法一:设要加入硝酸钾的质量为x。
100克×10%+x=(100克+x)×25%
x=20克
答:可向烧杯中加入20克硝酸钾。
方法二:设蒸发水的质量为y。
100克×10%=(100克-y)×25% y=60克
答:可恒温蒸发60克水。
认识水净化过程的变化本质
例8 科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是( )
A.该过程属于物理变化
B.该过程可应用于海水淡化
C.“筛掉”氯化钠过程类似于过滤操作
D.“筛掉”氯化钠后的海水溶质质量分数增大
【解析】用石墨烯膜“筛掉”海水中的钠离子和氯离子的方法与过滤类似,物质没有发生变化,只是将它们进行了分离。该过程没有新物质生成,属于物理变化;该过程可应用于海水淡化,海水中含的盐主要是氯化钠,“筛掉”水中盐分后形成淡水;过滤也是将一部分不能通过滤纸的物质筛选掉,“筛掉”氯化钠过程也是让部分物质通过,部分物质不能通过而被筛选掉,所以两者类似;“筛掉”氯化钠后的海水中氯化钠减少,故质量分数减小了。
8.为了解决人们在野外生活和工作时的饮水问题,小金开展了便
携式野外净水器的设计和制作。设计方案如图所示(其中箭头表示
预设的水流方向)。为了使水质符合饮用水标准,小金选择了三种
滤料去除原水中的杂质,三种滤料的用途如表所示,则滤料甲、
乙、丙分别为 _______(按序填写编号)。
滤料编号 用途
① 去除水中的泥沙、悬浮物等大颗粒污染物
② 去除大分子有机物、重金属离子和细菌等
③ 去除残留的细菌、小分子有机物、重金属离子和异味等
①②③
树立节约用水和防止水污染的意识
例9 2022年3月22日是第三十届“世界水日”。水是一种重要的自然资源,节约用水、防治水污染应成为我们的自觉行为。下列做法错误的是( )
A.随手关闭水龙头
B.往河流里倾倒垃圾
C.农业上采用滴灌技术
D.工业废水经处理达标后排放
【解析】随手关闭水龙头,养成节约用水的好习惯;往河里倾倒生活垃圾,破坏环境,这种做法是错误的;农业上采用滴灌技术,通过科学技术的进步,达到节约用水保护环境,提高人类的生产、生活水平;工业废水随意排放是造成环境污染的重要原因,必须经处理达标才可排放。
9.火电厂发电需要燃烧大量的煤,由于煤中含有硫元素,未经脱
硫的煤燃烧后,产生的气体会导致严重的大气污染,进入水体,
也会加剧水污染。
(1)硫能在空气中燃烧,燃烧后生成的气体排放到空气中,吸收空
气中的水蒸气,经过复杂的变化最终会被氧气氧化成硫酸,形成
酸雨,大气污染物最终会转移到土壤、水体中。此过程的两个化
学反应方程式为:______________;______________________。
====
点燃
2S+O2 SO2
2SO2+2H2O+O2===2H2SO4
(2)“坚持节水优先,强化水资源管理”。保护水环境、珍惜水资源,是每个公民应尽的责任和义务。为了保护水资源,下列做法不可行的是 。(填字母编号)
A.节约用水
B.抑制水中所有动、植物的生长
C.不任意排放生活污水
D.工业污水净化处理后排放
粗盐提纯及混合物的分离
例10 以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒的作用
是_______。
引流
(2)为除去Na2SO4、MgCl2、CaCl2,并得到中性的食盐溶液,下列
是所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量
的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液。能达到
目的的顺序是____。
A.⑤③②①④
B.③⑤①④②
C.③⑤①②④
(3)用pH试纸检验溶液是否呈中性的操作是 ___________________
___________________________________________________。
C
用洁净的玻璃棒蘸取
少量溶液,滴在pH试纸上,显示的颜色与标准比色卡对照
【解析】(1)过滤要用玻璃棒引流,使液体沿玻璃棒流入过滤器中;(2)加入过量的氢氧化钠溶液可以除去氯化镁,加入过量的氯化钡溶液可以除去硫酸钠,加入过量的碳酸钠溶液可以除去过量的氯化钙和氯化钡;过滤将沉淀与溶液分离;加入稀盐酸可以除去过量的氢氧化钠和过量的碳酸钠,加盐酸除氢氧化钠与碳酸钠之前必须要先将固液分离,否则沉淀又重新溶解,达不到除杂质的目的。(3)用pH试纸检验溶液是否呈中性的操作是用洁净的玻璃棒蘸取少量溶液,滴在pH试纸上,显示的颜色与标准比色卡对照,注意pH试纸要放在玻璃片或白瓷板上。
10.用下列实验操作可分别完成“粗盐中难溶性杂质的去除”和“一定溶质质量分数的氯化钠溶液的配制”两个实验。
(1)操作E中得到的滤液仍浑浊,其原因可能是 ________________
____________________________(答出一点即可)。
(2)若图B所用的烧杯内壁沾有水,导致配制溶液中溶质的质量分
数会 _____(填“偏大”“偏小”或“不变”)。
(3)图D中玻璃棒的作用是 _________________________________
_____。
(4)图C中有一处明显的错误,请你改正: ___________________
___________。
滤纸破损(或液面
高于滤纸边缘或仪器不干净等)
偏小
搅拌,防止局部温度过高,造成液滴
飞溅
视线应与凹液面最低
处保持水平
同课章节目录
