备战2022 浙教版科学 中考一轮复习 第36课时 物质间的循环与转化 课件(共65张PPT)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮复习 第36课时 物质间的循环与转化 课件(共65张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-24 15:12:29 | ||
图片预览










文档简介
(共65张PPT)
第36课时 物质间的循环与转化
自然界中的碳循环
例1 在2013年的国际气候大会上,以CO2为主的温室气体排放
再次成为各国关注的焦点。
(1)近年来,空气中CO2含量不断上升的主要原因是 ___________
_________________________。
(2)2019年世界环境日的主题:“蓝天保卫战,我是行动者”。
环保是从源头上消除或减少对环境的破坏,其重要原则有:
化石燃料的
大量燃烧、森林面积的减少
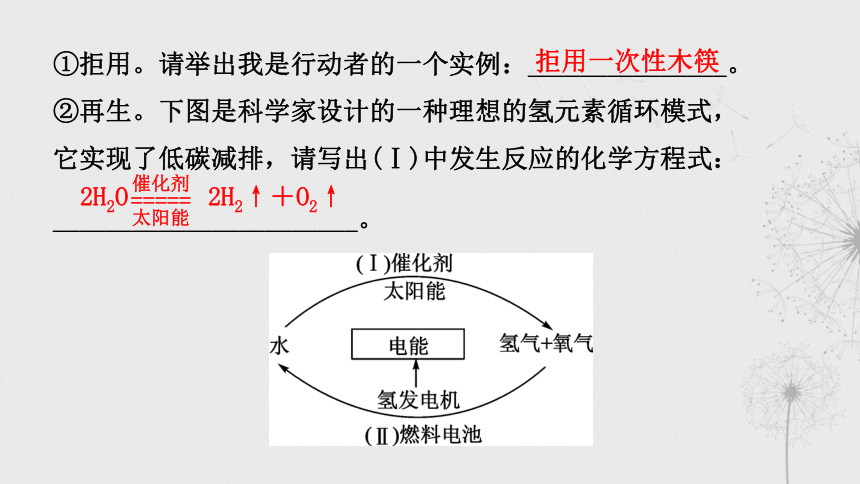
①拒用。请举出我是行动者的一个实例:_______________。
②再生。下图是科学家设计的一种理想的氢元素循环模式,
它实现了低碳减排,请写出(Ⅰ)中发生反应的化学方程式:
_______________________。
催化剂
太阳能
=====
拒用一次性木筷
2H2O 2H2↑+O2↑
③回收。目前使用膜分离法从空气中分离出CO2,这个过程二氧化
碳发生的是 _____(填“物理”或“化学”)变化。这些CO2可作为
气体肥料,还可制造 _____用于人工降雨。
(3)大气中的CO2是不是越少越好?为什么?
_________________________________________________________
_____________________。
物理
干冰
不是。空气中各种成分的含量都是相对稳定的,过多或过少都会
对环境产生不利的影响
【解析】大气中二氧化碳浓度的升高,可以从两个方面思考:一是排放量增加,二是吸收量减弱。我是行动者的例子很多,回答时紧扣自己有所感受的比较好。第②小题是一个信息题,要写好反应发生的条件。第③小题从物质变化角度分析,因变化过程中无新物质生成,所以是一个物理变化。对于二氧化碳的认识要全面,二氧化碳的作用是多方面的,适度的温室效应也是维持地球生态系统正常的一个重要条件,只不过温室效应加剧会带来一系列的不良后果。
1.二氧化碳气体既是使温室效应加强的气体,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是( )
A.如何提高催化剂的催化效率
B.新型塑料是否可降解
C.新型塑料的化学性质是否稳定
D.新型塑料生产是否影响碳循环
非金属—非金属氧化物—酸—盐间的相互转化
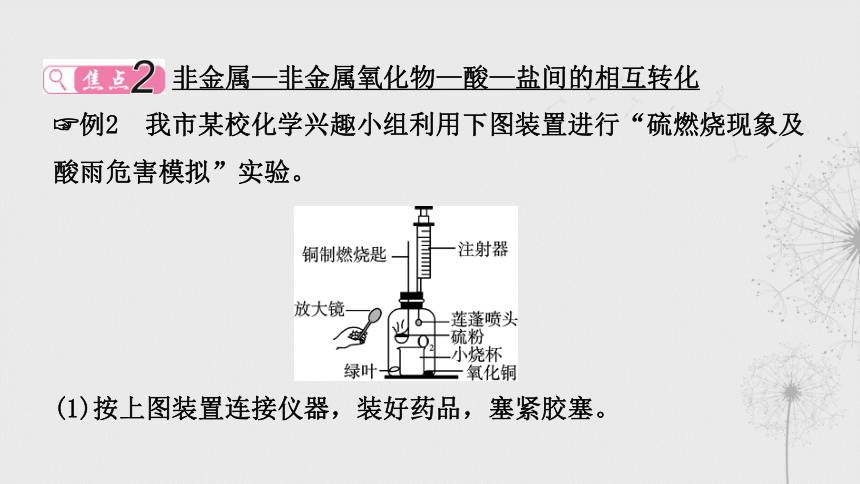
例2 我市某校化学兴趣小组利用下图装置进行“硫燃烧现象及酸雨危害模拟”实验。
(1)按上图装置连接仪器,装好药品,塞紧胶塞。
(2)用放大镜聚强光引燃硫粉,可观察到_____________________
_____________________________。
(3)冷却后,用注射器向广口瓶中喷水,可观察到:
①绿叶变黄;
②小烧杯里收集到一定量的液体;
③氧化铜粉末逐渐消失,溶液变成蓝色。
(4)取出小烧杯里收集到的液体进行检验,结果该溶液为酸性(样品)。
【提出问题】小烧杯里刚收集到的样品中溶质是什么?
硫粉剧烈燃烧,发出明
亮的蓝紫色火焰,产生大量的热
【查阅资料】
①SO2易溶于水,化学性质与二氧化碳有相似之处;
②H2SO3易被氧化物为H2SO4;
③BaSO3不溶于水,能与盐酸反应;BaSO4既不溶于水,也不溶于盐酸。
【作出猜想】
猜想Ⅰ:样品中溶质含有H2SO3;
猜想Ⅱ:样品中溶质含有H2SO4;
猜想Ⅲ:样品中溶质含有 ___________。
H2SO3和H2SO4
【实验探究】
实验操作 实验现象 实验结论
向刚收集到的样品中滴加过量的Ba(OH)2溶液,过滤 有白色沉淀生成 猜想_____正确
向白色沉淀中加入足量的 稀盐酸 沉淀不溶解
Ⅱ
【交流讨论】
(1)向刚收集到的样品中滴加过量的Ba(OH)2溶液的目的是_____
___________________________。
(2)酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
___________。
【拓展延伸】
SO2气体可用氢氧化钠溶液吸收,反应原理是_____________
___________(用化学方程式表示)。
让样
品中的溶质完全反应生成沉淀
置换反应
2NaOH+SO2===
Na2SO3+H2O
【解析】(2)硫在氧气中燃烧时,反应剧烈,发出明亮的蓝紫色火焰,并放出热量,注意不要写产生刺激性气味的气体,因为在密闭容器中,这点现象是感受不到的。
【作出猜想】酸雨中的溶质可能是H2SO4;也可能是H2SO3;还可能既有H2SO3又有H2SO4。
【实验探究】H2SO3和H2SO4都能与Ba(OH)2反应生成白色沉淀,但BaSO3不溶于水,能与盐酸反应;BaSO4既不溶于水,也不溶于盐酸;所以可向样品中加入Ba(OH)2生成白色沉淀,再用盐酸验证白色沉淀是BaSO3还是BaSO4,或者两种都有,从而验证样品中溶质的成分。向沉淀中加入足量稀盐酸,沉淀不溶解说明沉淀中只有硫酸钡。
【交流讨论】
(1)向刚收集到的样品中滴加过量的Ba(OH)2溶液的目的是让样品中的溶质完全反应生成沉淀。
(2)酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于置换反应。
【拓展延伸】
二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应的化学方程式为:2NaOH+SO2===Na2SO3+H2O。
(1)模仿碳及碳的化合物间转化反应方程式的书写,写出硫及硫的化合物转化反应中指定反应的化学方程式。
反应①: _____________;
反应③: _______________。
====
点燃
S+O2 SO2
SO3+H2O===H2SO4
(2)反应②中,V2O5在反应前后的质量均为m,则V2O5在该反应中
起_______作用。
(3)上述反应中,属于化合反应的有 _______(填反应序号)。
(4)实验室因操作不当,将浓硫酸滴在书页上,一会书页出现了
黑色,且由糊状至烂洞状,这是因为浓硫酸具有_____________
___。
催化
①②③
脱水性、腐蚀
性
金属—金属氧化物—碱—盐之间的转化
例3 如图所示是小科建构的铜及其化合物之间相互转化的关系图。
(1)写出由Cu转化为图中“?”处物质的化学反应式____________
_______。
(2)要一步实现图中“Cu→Cu2+”的转化可将铜加入适量的某种盐
溶液中,则该溶液的溶质是_______________________________。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。
请设计一个实验方案,要求写出主要操作步骤及所需要的试剂。
====
△
2Cu+O2
2CuO
硝酸银(AgNO3)或硝酸汞[Hg(NO3)2]
【解析】(1)从图中可以知道,“?”处物质是铜元素正二价的氧化物,就是氧化铜。故由Cu转化为CuO,是金属转化为金属氧化物,与氧气反应,条件需要加热。(2)金属与盐发生置换反应,要满足“前换后,盐可溶,K、Ca、Na等活泼金属除外”,所以能与铜发生置换反应的盐常见的有硝酸银、硝酸汞等,反应的化学方程式:Cu+2AgNO3===2Ag+Cu(NO3)2; Cu+Hg(NO3)2===Hg+Cu(NO3)2。(3)由硝酸铜一步转化为硫酸铜是不能实现的,因为盐转化为盐,一步转化是加酸、加盐,但针对本题,都行不通,从
盐的十种制取方法,结合图中的转化关系去考虑。可通过两步转化。【方案一】在硝酸铜溶液中加入氢氧化钠溶液沉淀后过滤、洗涤,并将适量稀硫酸加入到固体中,充分反应后并结晶。【方案二】在硝酸铜溶液中加入适量铁粉,反应后过滤、洗涤,取所得固体在空气中充分加热,再将适量稀硫酸加入该固体中,充分反应后并结晶。
例4 某同学对Fe2O3做了如图探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是( )
A.无色气体可以使澄清石灰水变浑浊
B.黑色粉末是Fe3O4
C.①过程Fe2O3中的氧元素全部转入无色气体
D.②过程中有置换反应发生
3.使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
(1)镁元素在自然界中是以 _______ (填“单质”或“化合物”)形式存在。
(2)工业制镁的一种原理是2MgO+Si+2CaO 2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气
中的物质与Mg反应使产品混有_____ (填化学式)。
======
1600℃
化合物
MgO
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体,共消耗8.4gCaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g。
①步骤2中Mg(OH)2受热分解的化学方程式为 _________________
___。
②通过所得MgO的质量计算上述废液中含MgCl2的质量为______g。
③分析实验数据,可知步骤1中发生的化学反应有: ________
__________;
___________________________________;
________________________。
====
△
Mg(OH)2 MgO+
H2O
9.5
CaO+H2O
===Ca(OH)2
Ca(OH)2+MgCl2===CaCl2+Mg(OH)2↓
CaO+2HCl===CaCl2+H2O
4.含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途。以含锌
废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下:
(1)粉碎的目的是增大接触面积,加快反应速率,_________。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要
的玻璃仪器有胶头滴管、玻璃棒、细口瓶和_____,此处玻璃棒
的作用是 _______________________。
(3)物质X是锌,滤渣中含有的金属单质有锌和铜,除铜时发生的
反应属于_______(填基本反应类型)反应。
(4)流程中获得七水硫酸锌前省略的操作是加热浓缩、_________、
过滤、洗涤和低温烘干。
充分反应
烧杯
搅拌,将热量及时地扩散
置换
冷却结晶
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化
物,该氧化物的化学式为 _____。
(6)除铁过程中,温度、pH对除铁效果的影响分别如图所示。由图
可知,除铁时温度应控制在_____℃为宜,pH应控制在_____为宜。
Fe3O4
3.5
83
考查无机物之间相互反应的条件
例5 下列选项所示的物质转化均能一步实现的是( )
【解析】A.铁生锈生成的铁锈主要成分是Fe2O3,Fe2O3对应的碱是不溶性的Fe(OH)3,故不能与水反应生成Fe(OH)3,不符合题意;B.CuO+H2SO4===CuSO4+H2O,CuSO4与稀盐酸不符合复分解反应发生的条件,不能反应,不符合题意;C.S+O2 SO2,SO2+H2O===H2SO3,生成物是亚硫酸而不是硫酸,不符合题意;D.2NaOH+CO2===Na2CO3+H2O,Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,符合题意。
====
点燃
例6 “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛的过程记录如下(“—”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O 乙同学:HCl→H2O→
乙同学在方框中应填物质的化学式是____________________
________________(写一种即可)。
H2[或NaOH或Ca(OH)2或
H2CO3,合理即可]
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4下列能使丁同学获胜的方案有
_____(填字母)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
BC
【解析】(1)水中通电可得H2;水中加氧化钠可得NaOH;水中通入二氧化碳可生成H2CO3……所以乙同学在方框中应填物质的化学式可以是H2或NaOH或Ca(OH)2或H2CO3等。(2)A.硫酸钡不溶于水,也不溶于酸液中,不能转化成氢氧化钡;B.氧化钡和盐酸反应生成氯化钡和水,氯化钡和硝酸银反应生成氯化银沉淀和硝酸钡,硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠;C.氧化钡和水反应生成氢氧化钡,氢氧化钡和二氧化碳反应生成碳酸钡和水,碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,氯化钡和硝酸银反应
生成氯化银沉淀和硝酸钡,硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠;D.硝酸钡不能转化成氢氧化钡,因为Ba(OH)2是可溶的,硝酸盐也都是可溶的,生成物中没有沉淀,反应不能发生。
5.扑克是生活中用来休闲的娱乐项目之一,聪明的小华发明了一种扑克新玩法——“化学扑克”。“化学扑克”的玩法是:上家出牌,如果下家牌中的物质能与上家的发生反应,即可出牌,按此规则,出完牌的为赢家。下图表示的是某局牌的最后一轮。桌面上是一张图甲的“盐酸”牌,A、B、C、D四位玩家手中都剩下一张牌(如图)。
(1)如果本局每一位玩家的牌都能出掉,则四位玩家的出牌顺序
为:(填标号)甲→ ___________。
(2)如果本局只有一位玩家的牌出不掉,你认为该玩家是____(填
字母)。
C→D→B→A
A
6.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀 1.9 4.2 9.1
完全沉淀 3.2 6.7 11.1
(1)熟石灰主要成分的化学式是_________。
(2)溶液A中的阳离子是 _____________________(填离子符号)。
(3)沉淀C的成分是 ________________。
(4)溶液B与熟石灰反应的化学方程式是 _________________
________________。
Ca(OH)2
Mg2+、Fe3+、Cu2+、H+
Fe(OH)3、Cu(OH)2
MgCl2+Ca(OH)2===
Mg(OH)2↓+CaCl2
物质推断
例7 小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:
(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过
滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无
明显现象,___________________________________(填写正确
的实验操作及现象),证明滤液中含有Cl-,在老师的指导下通
过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
滴加适量的硝酸银溶液,出现白色沉淀
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑
色物质也有可能是四氧化三铁。小明通过如下装置探究黑色物质
是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2
3Fe+4H2O,当观察到_____________________这一现象时,排除
了四氧化三铁存在的可能性。
====
高温
无水硫酸铜粉末不变蓝
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,
钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查
阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试
管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过
氧化氢溶液(能将Fe2+转化为Fe3+) ,然后滴加硫氰化钾溶液,
当观察到_______________这一现象时,证明溶液中有Fe3+,得
出加热棒中含有铁粉这一结论。
溶液变为血红色
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰
水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此
操作过程中确认炭粉存在的化学方程式: ____________、
___________________________。
综合上述实验,小明验证了加热棒内的主要成分。加热棒为什么
能够起到加热作用呢?小明还将进一步探究。
====
点燃
C+O2 CO2
Ca(OH)2+CO2===CaCO3 ↓+H2O
【解析】(1)要证明氯离子,先向溶液中加适量硝酸钡溶液和稀硝酸,排除硫酸根离子的干扰,然后加硝酸银溶液,出现白色沉淀,即含有氯离子。(2)四氧化三铁与氢气反应生成铁和水,所以反应发生时若无水硫酸铜粉末不变蓝色,即没有水生成,则可排除四氧化三铁的可能性;用硫氰化钾溶液检验Fe3+的存在,现象是溶液变为血红色。(3)碳充分燃烧时生成二氧化碳,二氧化碳能使澄清石灰水浑浊,反应方程式为C+O2 CO2;Ca(OH)2+CO2===CaCO3 ↓+H2O 。
====
点燃
7.某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。
(1)操作Ⅰ、Ⅱ的名称是_____。
(2)无色气体的质量是____克。
(3)固体甲的成分是 _______________。
(4)这种白色粉末中一定不含有 _______ 。
(5)求白色粉末中肯定含有的物质总质量。
过滤
2.2
碳酸钙与硫酸钡
硫酸铜
物质鉴别
例8 小明想利用厨房用品完成以下实验:
A.检验鸡蛋壳中是否含有碳酸钙
B.检验自来水中是否含有氯离子
C.测定蔬菜中农药的残留量
D.比较食用油与水的密度大小
E.区分纯碱与食盐
你认为小明能顺利完成的实验有______。
ADE
【解析】碳酸钙能与稀盐酸反应生成二氧化碳气体,检验鸡蛋壳中是否含有碳酸钙,可用食醋完成实验;实验室用硝酸酸化的硝酸银溶液检验氯离子,故利用厨房用品不能完成;测定蔬菜中农药的残留量,需用特定的药品,故利用厨房用品不能完成;比较食用油与水的密度大小,利用食用油和水混合即可完成;纯碱是碳酸钠的俗称,能与酸反应产生二氧化碳,可用食醋完成实验,而食盐不与食醋反应,故利用厨房用品能区分纯碱和食盐。
例9 一包白色固体A,可能含有CuCl2、CaCO3、NaOH、NaCl、Ba(OH)2、Na2SO4中的几种,取少量做如图实验,主要现象如图所示:
(1)白色沉淀B是_________(填名称)。
(2)白色固体A一定不存在的物质是 _____________;一定存在
的是 ______________。
(3)写出产生白色沉淀D的化学方程式:______________________
_____。
碳酸钙
Na2SO4、CuCl2
CaCO3、Ba(OH)2
Ba(OH)2+CO2===BaCO3↓
+H2O
【解析】CuCl2在溶液中显蓝色,CaCO3难溶于水,但是溶于酸,SO42-和Ba2+反应生成不溶于酸的BaSO4沉淀,CO2和Ba(OH)2反应生成BaCO3沉淀和H2O,CO2和NaOH反应生成Na2CO3和H2O,Na2CO3和Ba(OH)2反应会生成BaCO3沉淀和NaOH。白色固体A加水过滤得到的白色沉淀B全部溶于硝酸,所以B是CaCO3,样品中一定含有CaCO3,一定不含Na2SO4。无色溶液C中通入CO2,生成白色沉淀D,所以D是BaCO3沉淀,样品中一定不含CuCl2,一定含有Ba(OH)2,可能含有NaCl、NaOH。产生白色沉淀D的反应是Ba(OH)2和CO2反应生成BaCO3沉淀和水,化学方程式为Ba(OH)2+CO2===BaCO3↓+H2O。
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有( )
A.盐酸
B.碳酸钠
C.硫酸钠
D.氯化钠
9.牙是人体口腔内的消化器官,而龋齿(俗称蛀牙)是青少年中
发生率很高的牙病。
(1)下列龋齿形成的过程中,哪一环节会导致患者感觉到剧烈牙
疼?____。
D
(2)使用含氟牙膏是预防龋齿的一种有效途径,但过量摄入氟化
物,也会引起氟斑牙等疾病,因此在含氟牙膏上往往标明:六岁
及以下儿童使用豌豆大小牙膏,在成人指导下刷牙。估测豌豆大
小牙膏的体积约为____。
A.0.3mm3 B.0.3cm3
C.0.3dm3 D.0.3m3
B
(3)含氟牙膏中摩擦剂的种类对氟化物能否有效预防龋齿有较大影响。假如某含氟牙膏中使用的摩擦剂成分可能为碳酸钙、水合硅石(不溶于水且不与盐酸反应)中的一种或两种,而牙膏的其他成分均能溶于水且不与盐酸反应。请设计实验探究此牙膏中摩擦剂的成分。(写出实验思路即可)
答:①取一定量的牙膏样品,加蒸馏水溶解; ②过滤,分离滤液与沉淀;③取沉淀加过量盐酸,观察其溶解的情况:a.若全部溶解,则摩擦剂的成分是CaCO3,b.若全部不溶解则摩擦剂的成分是水合硅石。
物质制备
例10 一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH以按恰好完全反应的比例加料。
(1)写出步骤c中发生反应的化学方程式: _______________
________________。
(2)x= ____。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是
_______________。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁
的是_____。(填序号)
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
MgCl2+2NaOH===
Mg(OH)2↓+2NaCl
280
氯化钠(或NaCl)
③
(3)根据MgCl2+2NaOH===Mg(OH)2↓+2NaCl,可知过滤得到的粗产品表面会附着氯化钠溶液,所以洗涤时主要除去的杂质是反应生成的氯化钠。
(4)如图流程中,氢氧化钠作为可溶性碱,在反应中提供氢氧根离子,与镁离子结合成氢氧化镁沉淀。氨水是碱,也提供氢氧根离子,和氯化镁反应生成氢氧化镁沉淀。
10.小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如下:
资料:
① Fe2(SO4)3+Fe===3FeSO4;
②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为
98%的浓硫酸_____克。
(2)写出该实验中的一个化学反应方程式(除资料①中的反应外):
_______________________________________________________。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目
的是_____________________________________________________
_______。
10
Fe+H2SO4===FeSO4+H2↑[或Fe2O3+3H2SO4===Fe2(SO4)3+3H2O]
使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁
被氧化
第36课时 物质间的循环与转化
自然界中的碳循环
例1 在2013年的国际气候大会上,以CO2为主的温室气体排放
再次成为各国关注的焦点。
(1)近年来,空气中CO2含量不断上升的主要原因是 ___________
_________________________。
(2)2019年世界环境日的主题:“蓝天保卫战,我是行动者”。
环保是从源头上消除或减少对环境的破坏,其重要原则有:
化石燃料的
大量燃烧、森林面积的减少
①拒用。请举出我是行动者的一个实例:_______________。
②再生。下图是科学家设计的一种理想的氢元素循环模式,
它实现了低碳减排,请写出(Ⅰ)中发生反应的化学方程式:
_______________________。
催化剂
太阳能
=====
拒用一次性木筷
2H2O 2H2↑+O2↑
③回收。目前使用膜分离法从空气中分离出CO2,这个过程二氧化
碳发生的是 _____(填“物理”或“化学”)变化。这些CO2可作为
气体肥料,还可制造 _____用于人工降雨。
(3)大气中的CO2是不是越少越好?为什么?
_________________________________________________________
_____________________。
物理
干冰
不是。空气中各种成分的含量都是相对稳定的,过多或过少都会
对环境产生不利的影响
【解析】大气中二氧化碳浓度的升高,可以从两个方面思考:一是排放量增加,二是吸收量减弱。我是行动者的例子很多,回答时紧扣自己有所感受的比较好。第②小题是一个信息题,要写好反应发生的条件。第③小题从物质变化角度分析,因变化过程中无新物质生成,所以是一个物理变化。对于二氧化碳的认识要全面,二氧化碳的作用是多方面的,适度的温室效应也是维持地球生态系统正常的一个重要条件,只不过温室效应加剧会带来一系列的不良后果。
1.二氧化碳气体既是使温室效应加强的气体,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是( )
A.如何提高催化剂的催化效率
B.新型塑料是否可降解
C.新型塑料的化学性质是否稳定
D.新型塑料生产是否影响碳循环
非金属—非金属氧化物—酸—盐间的相互转化
例2 我市某校化学兴趣小组利用下图装置进行“硫燃烧现象及酸雨危害模拟”实验。
(1)按上图装置连接仪器,装好药品,塞紧胶塞。
(2)用放大镜聚强光引燃硫粉,可观察到_____________________
_____________________________。
(3)冷却后,用注射器向广口瓶中喷水,可观察到:
①绿叶变黄;
②小烧杯里收集到一定量的液体;
③氧化铜粉末逐渐消失,溶液变成蓝色。
(4)取出小烧杯里收集到的液体进行检验,结果该溶液为酸性(样品)。
【提出问题】小烧杯里刚收集到的样品中溶质是什么?
硫粉剧烈燃烧,发出明
亮的蓝紫色火焰,产生大量的热
【查阅资料】
①SO2易溶于水,化学性质与二氧化碳有相似之处;
②H2SO3易被氧化物为H2SO4;
③BaSO3不溶于水,能与盐酸反应;BaSO4既不溶于水,也不溶于盐酸。
【作出猜想】
猜想Ⅰ:样品中溶质含有H2SO3;
猜想Ⅱ:样品中溶质含有H2SO4;
猜想Ⅲ:样品中溶质含有 ___________。
H2SO3和H2SO4
【实验探究】
实验操作 实验现象 实验结论
向刚收集到的样品中滴加过量的Ba(OH)2溶液,过滤 有白色沉淀生成 猜想_____正确
向白色沉淀中加入足量的 稀盐酸 沉淀不溶解
Ⅱ
【交流讨论】
(1)向刚收集到的样品中滴加过量的Ba(OH)2溶液的目的是_____
___________________________。
(2)酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于
___________。
【拓展延伸】
SO2气体可用氢氧化钠溶液吸收,反应原理是_____________
___________(用化学方程式表示)。
让样
品中的溶质完全反应生成沉淀
置换反应
2NaOH+SO2===
Na2SO3+H2O
【解析】(2)硫在氧气中燃烧时,反应剧烈,发出明亮的蓝紫色火焰,并放出热量,注意不要写产生刺激性气味的气体,因为在密闭容器中,这点现象是感受不到的。
【作出猜想】酸雨中的溶质可能是H2SO4;也可能是H2SO3;还可能既有H2SO3又有H2SO4。
【实验探究】H2SO3和H2SO4都能与Ba(OH)2反应生成白色沉淀,但BaSO3不溶于水,能与盐酸反应;BaSO4既不溶于水,也不溶于盐酸;所以可向样品中加入Ba(OH)2生成白色沉淀,再用盐酸验证白色沉淀是BaSO3还是BaSO4,或者两种都有,从而验证样品中溶质的成分。向沉淀中加入足量稀盐酸,沉淀不溶解说明沉淀中只有硫酸钡。
【交流讨论】
(1)向刚收集到的样品中滴加过量的Ba(OH)2溶液的目的是让样品中的溶质完全反应生成沉淀。
(2)酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于置换反应。
【拓展延伸】
二氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应的化学方程式为:2NaOH+SO2===Na2SO3+H2O。
(1)模仿碳及碳的化合物间转化反应方程式的书写,写出硫及硫的化合物转化反应中指定反应的化学方程式。
反应①: _____________;
反应③: _______________。
====
点燃
S+O2 SO2
SO3+H2O===H2SO4
(2)反应②中,V2O5在反应前后的质量均为m,则V2O5在该反应中
起_______作用。
(3)上述反应中,属于化合反应的有 _______(填反应序号)。
(4)实验室因操作不当,将浓硫酸滴在书页上,一会书页出现了
黑色,且由糊状至烂洞状,这是因为浓硫酸具有_____________
___。
催化
①②③
脱水性、腐蚀
性
金属—金属氧化物—碱—盐之间的转化
例3 如图所示是小科建构的铜及其化合物之间相互转化的关系图。
(1)写出由Cu转化为图中“?”处物质的化学反应式____________
_______。
(2)要一步实现图中“Cu→Cu2+”的转化可将铜加入适量的某种盐
溶液中,则该溶液的溶质是_______________________________。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。
请设计一个实验方案,要求写出主要操作步骤及所需要的试剂。
====
△
2Cu+O2
2CuO
硝酸银(AgNO3)或硝酸汞[Hg(NO3)2]
【解析】(1)从图中可以知道,“?”处物质是铜元素正二价的氧化物,就是氧化铜。故由Cu转化为CuO,是金属转化为金属氧化物,与氧气反应,条件需要加热。(2)金属与盐发生置换反应,要满足“前换后,盐可溶,K、Ca、Na等活泼金属除外”,所以能与铜发生置换反应的盐常见的有硝酸银、硝酸汞等,反应的化学方程式:Cu+2AgNO3===2Ag+Cu(NO3)2; Cu+Hg(NO3)2===Hg+Cu(NO3)2。(3)由硝酸铜一步转化为硫酸铜是不能实现的,因为盐转化为盐,一步转化是加酸、加盐,但针对本题,都行不通,从
盐的十种制取方法,结合图中的转化关系去考虑。可通过两步转化。【方案一】在硝酸铜溶液中加入氢氧化钠溶液沉淀后过滤、洗涤,并将适量稀硫酸加入到固体中,充分反应后并结晶。【方案二】在硝酸铜溶液中加入适量铁粉,反应后过滤、洗涤,取所得固体在空气中充分加热,再将适量稀硫酸加入该固体中,充分反应后并结晶。
例4 某同学对Fe2O3做了如图探究活动,已知氯气在水溶液中能将Fe2+转变为Fe3+,且每一步都充分反应。下列分析正确的是( )
A.无色气体可以使澄清石灰水变浑浊
B.黑色粉末是Fe3O4
C.①过程Fe2O3中的氧元素全部转入无色气体
D.②过程中有置换反应发生
3.使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
(1)镁元素在自然界中是以 _______ (填“单质”或“化合物”)形式存在。
(2)工业制镁的一种原理是2MgO+Si+2CaO 2Mg↑+Ca2SiO4,抽走容器中的空气对反应有促进作用,且能防止空气
中的物质与Mg反应使产品混有_____ (填化学式)。
======
1600℃
化合物
MgO
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体,共消耗8.4gCaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g。
①步骤2中Mg(OH)2受热分解的化学方程式为 _________________
___。
②通过所得MgO的质量计算上述废液中含MgCl2的质量为______g。
③分析实验数据,可知步骤1中发生的化学反应有: ________
__________;
___________________________________;
________________________。
====
△
Mg(OH)2 MgO+
H2O
9.5
CaO+H2O
===Ca(OH)2
Ca(OH)2+MgCl2===CaCl2+Mg(OH)2↓
CaO+2HCl===CaCl2+H2O
4.含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途。以含锌
废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下:
(1)粉碎的目的是增大接触面积,加快反应速率,_________。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要
的玻璃仪器有胶头滴管、玻璃棒、细口瓶和_____,此处玻璃棒
的作用是 _______________________。
(3)物质X是锌,滤渣中含有的金属单质有锌和铜,除铜时发生的
反应属于_______(填基本反应类型)反应。
(4)流程中获得七水硫酸锌前省略的操作是加热浓缩、_________、
过滤、洗涤和低温烘干。
充分反应
烧杯
搅拌,将热量及时地扩散
置换
冷却结晶
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化
物,该氧化物的化学式为 _____。
(6)除铁过程中,温度、pH对除铁效果的影响分别如图所示。由图
可知,除铁时温度应控制在_____℃为宜,pH应控制在_____为宜。
Fe3O4
3.5
83
考查无机物之间相互反应的条件
例5 下列选项所示的物质转化均能一步实现的是( )
【解析】A.铁生锈生成的铁锈主要成分是Fe2O3,Fe2O3对应的碱是不溶性的Fe(OH)3,故不能与水反应生成Fe(OH)3,不符合题意;B.CuO+H2SO4===CuSO4+H2O,CuSO4与稀盐酸不符合复分解反应发生的条件,不能反应,不符合题意;C.S+O2 SO2,SO2+H2O===H2SO3,生成物是亚硫酸而不是硫酸,不符合题意;D.2NaOH+CO2===Na2CO3+H2O,Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,符合题意。
====
点燃
例6 “飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛的过程记录如下(“—”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O 乙同学:HCl→H2O→
乙同学在方框中应填物质的化学式是____________________
________________(写一种即可)。
H2[或NaOH或Ca(OH)2或
H2CO3,合理即可]
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4下列能使丁同学获胜的方案有
_____(填字母)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
BC
【解析】(1)水中通电可得H2;水中加氧化钠可得NaOH;水中通入二氧化碳可生成H2CO3……所以乙同学在方框中应填物质的化学式可以是H2或NaOH或Ca(OH)2或H2CO3等。(2)A.硫酸钡不溶于水,也不溶于酸液中,不能转化成氢氧化钡;B.氧化钡和盐酸反应生成氯化钡和水,氯化钡和硝酸银反应生成氯化银沉淀和硝酸钡,硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠;C.氧化钡和水反应生成氢氧化钡,氢氧化钡和二氧化碳反应生成碳酸钡和水,碳酸钡和盐酸反应生成氯化钡、水和二氧化碳,氯化钡和硝酸银反应
生成氯化银沉淀和硝酸钡,硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠;D.硝酸钡不能转化成氢氧化钡,因为Ba(OH)2是可溶的,硝酸盐也都是可溶的,生成物中没有沉淀,反应不能发生。
5.扑克是生活中用来休闲的娱乐项目之一,聪明的小华发明了一种扑克新玩法——“化学扑克”。“化学扑克”的玩法是:上家出牌,如果下家牌中的物质能与上家的发生反应,即可出牌,按此规则,出完牌的为赢家。下图表示的是某局牌的最后一轮。桌面上是一张图甲的“盐酸”牌,A、B、C、D四位玩家手中都剩下一张牌(如图)。
(1)如果本局每一位玩家的牌都能出掉,则四位玩家的出牌顺序
为:(填标号)甲→ ___________。
(2)如果本局只有一位玩家的牌出不掉,你认为该玩家是____(填
字母)。
C→D→B→A
A
6.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀 1.9 4.2 9.1
完全沉淀 3.2 6.7 11.1
(1)熟石灰主要成分的化学式是_________。
(2)溶液A中的阳离子是 _____________________(填离子符号)。
(3)沉淀C的成分是 ________________。
(4)溶液B与熟石灰反应的化学方程式是 _________________
________________。
Ca(OH)2
Mg2+、Fe3+、Cu2+、H+
Fe(OH)3、Cu(OH)2
MgCl2+Ca(OH)2===
Mg(OH)2↓+CaCl2
物质推断
例7 小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:
(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过
滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无
明显现象,___________________________________(填写正确
的实验操作及现象),证明滤液中含有Cl-,在老师的指导下通
过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
滴加适量的硝酸银溶液,出现白色沉淀
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑
色物质也有可能是四氧化三铁。小明通过如下装置探究黑色物质
是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2
3Fe+4H2O,当观察到_____________________这一现象时,排除
了四氧化三铁存在的可能性。
====
高温
无水硫酸铜粉末不变蓝
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,
钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查
阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试
管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过
氧化氢溶液(能将Fe2+转化为Fe3+) ,然后滴加硫氰化钾溶液,
当观察到_______________这一现象时,证明溶液中有Fe3+,得
出加热棒中含有铁粉这一结论。
溶液变为血红色
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰
水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此
操作过程中确认炭粉存在的化学方程式: ____________、
___________________________。
综合上述实验,小明验证了加热棒内的主要成分。加热棒为什么
能够起到加热作用呢?小明还将进一步探究。
====
点燃
C+O2 CO2
Ca(OH)2+CO2===CaCO3 ↓+H2O
【解析】(1)要证明氯离子,先向溶液中加适量硝酸钡溶液和稀硝酸,排除硫酸根离子的干扰,然后加硝酸银溶液,出现白色沉淀,即含有氯离子。(2)四氧化三铁与氢气反应生成铁和水,所以反应发生时若无水硫酸铜粉末不变蓝色,即没有水生成,则可排除四氧化三铁的可能性;用硫氰化钾溶液检验Fe3+的存在,现象是溶液变为血红色。(3)碳充分燃烧时生成二氧化碳,二氧化碳能使澄清石灰水浑浊,反应方程式为C+O2 CO2;Ca(OH)2+CO2===CaCO3 ↓+H2O 。
====
点燃
7.某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。
(1)操作Ⅰ、Ⅱ的名称是_____。
(2)无色气体的质量是____克。
(3)固体甲的成分是 _______________。
(4)这种白色粉末中一定不含有 _______ 。
(5)求白色粉末中肯定含有的物质总质量。
过滤
2.2
碳酸钙与硫酸钡
硫酸铜
物质鉴别
例8 小明想利用厨房用品完成以下实验:
A.检验鸡蛋壳中是否含有碳酸钙
B.检验自来水中是否含有氯离子
C.测定蔬菜中农药的残留量
D.比较食用油与水的密度大小
E.区分纯碱与食盐
你认为小明能顺利完成的实验有______。
ADE
【解析】碳酸钙能与稀盐酸反应生成二氧化碳气体,检验鸡蛋壳中是否含有碳酸钙,可用食醋完成实验;实验室用硝酸酸化的硝酸银溶液检验氯离子,故利用厨房用品不能完成;测定蔬菜中农药的残留量,需用特定的药品,故利用厨房用品不能完成;比较食用油与水的密度大小,利用食用油和水混合即可完成;纯碱是碳酸钠的俗称,能与酸反应产生二氧化碳,可用食醋完成实验,而食盐不与食醋反应,故利用厨房用品能区分纯碱和食盐。
例9 一包白色固体A,可能含有CuCl2、CaCO3、NaOH、NaCl、Ba(OH)2、Na2SO4中的几种,取少量做如图实验,主要现象如图所示:
(1)白色沉淀B是_________(填名称)。
(2)白色固体A一定不存在的物质是 _____________;一定存在
的是 ______________。
(3)写出产生白色沉淀D的化学方程式:______________________
_____。
碳酸钙
Na2SO4、CuCl2
CaCO3、Ba(OH)2
Ba(OH)2+CO2===BaCO3↓
+H2O
【解析】CuCl2在溶液中显蓝色,CaCO3难溶于水,但是溶于酸,SO42-和Ba2+反应生成不溶于酸的BaSO4沉淀,CO2和Ba(OH)2反应生成BaCO3沉淀和H2O,CO2和NaOH反应生成Na2CO3和H2O,Na2CO3和Ba(OH)2反应会生成BaCO3沉淀和NaOH。白色固体A加水过滤得到的白色沉淀B全部溶于硝酸,所以B是CaCO3,样品中一定含有CaCO3,一定不含Na2SO4。无色溶液C中通入CO2,生成白色沉淀D,所以D是BaCO3沉淀,样品中一定不含CuCl2,一定含有Ba(OH)2,可能含有NaCl、NaOH。产生白色沉淀D的反应是Ba(OH)2和CO2反应生成BaCO3沉淀和水,化学方程式为Ba(OH)2+CO2===BaCO3↓+H2O。
8.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有( )
A.盐酸
B.碳酸钠
C.硫酸钠
D.氯化钠
9.牙是人体口腔内的消化器官,而龋齿(俗称蛀牙)是青少年中
发生率很高的牙病。
(1)下列龋齿形成的过程中,哪一环节会导致患者感觉到剧烈牙
疼?____。
D
(2)使用含氟牙膏是预防龋齿的一种有效途径,但过量摄入氟化
物,也会引起氟斑牙等疾病,因此在含氟牙膏上往往标明:六岁
及以下儿童使用豌豆大小牙膏,在成人指导下刷牙。估测豌豆大
小牙膏的体积约为____。
A.0.3mm3 B.0.3cm3
C.0.3dm3 D.0.3m3
B
(3)含氟牙膏中摩擦剂的种类对氟化物能否有效预防龋齿有较大影响。假如某含氟牙膏中使用的摩擦剂成分可能为碳酸钙、水合硅石(不溶于水且不与盐酸反应)中的一种或两种,而牙膏的其他成分均能溶于水且不与盐酸反应。请设计实验探究此牙膏中摩擦剂的成分。(写出实验思路即可)
答:①取一定量的牙膏样品,加蒸馏水溶解; ②过滤,分离滤液与沉淀;③取沉淀加过量盐酸,观察其溶解的情况:a.若全部溶解,则摩擦剂的成分是CaCO3,b.若全部不溶解则摩擦剂的成分是水合硅石。
物质制备
例10 一种制备氢氧化镁的生产流程如图所示,MgCl2和NaOH以按恰好完全反应的比例加料。
(1)写出步骤c中发生反应的化学方程式: _______________
________________。
(2)x= ____。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是
_______________。
(4)上述流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁
的是_____。(填序号)
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
MgCl2+2NaOH===
Mg(OH)2↓+2NaCl
280
氯化钠(或NaCl)
③
(3)根据MgCl2+2NaOH===Mg(OH)2↓+2NaCl,可知过滤得到的粗产品表面会附着氯化钠溶液,所以洗涤时主要除去的杂质是反应生成的氯化钠。
(4)如图流程中,氢氧化钠作为可溶性碱,在反应中提供氢氧根离子,与镁离子结合成氢氧化镁沉淀。氨水是碱,也提供氢氧根离子,和氯化镁反应生成氢氧化镁沉淀。
10.小明利用稀硫酸与生锈的铁屑反应制取硫酸亚铁,实验流程如下:
资料:
① Fe2(SO4)3+Fe===3FeSO4;
②硫酸亚铁容易被氧化为硫酸铁等物质。
(1)配制50克溶质质量分数为19.6%的稀硫酸,需溶质质量分数为
98%的浓硫酸_____克。
(2)写出该实验中的一个化学反应方程式(除资料①中的反应外):
_______________________________________________________。
(3)稀硫酸与生锈的铁屑充分反应后,要确保铁有少量剩余,其目
的是_____________________________________________________
_______。
10
Fe+H2SO4===FeSO4+H2↑[或Fe2O3+3H2SO4===Fe2(SO4)3+3H2O]
使生成的硫酸铁完全转化为硫酸亚铁;防止生成的硫酸亚铁
被氧化
同课章节目录
