2021-2022学年高一上学期化学苏教版(2019)必修第一册 专题1 物质的分类及计量 期末综合培优卷 (word版含解析)
文档属性
| 名称 | 2021-2022学年高一上学期化学苏教版(2019)必修第一册 专题1 物质的分类及计量 期末综合培优卷 (word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 187.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 11:16:13 | ||
图片预览




文档简介
专题1 物质的分类及计量 期末综合培优卷
一、选择题(本大题共15小题,每小题3分,共45分)
1.下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
2.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性。下列叙述正确的是( )
A.“碳纳米泡沫”是一种新型的碳化合物
B.“碳纳米泡沫”中的碳原子是胶体
C.“碳纳米泡沫”既不是电解质也不是非电解质
D.“碳纳米泡沫”和金刚石的性质完全相同
3.下列关于物质的分类中, 正确的是( )
选项 酸性氧化物 酸 碱 盐 混合物 电解质
A SiO2 HClO 纯碱 明矾 CuSO4·5H2O CO2
B Na2O2 HNO3 生石灰 NaHSO4 盐酸 Mg
C SO3 H2SiO3 烧碱 碳酸氢钠 澄清石灰水 NaCl
D NO Al(OH)3 熟石灰 BaCO3 液氯 NH3
A.A B.B C.C D.D
4.下列对于“摩尔”的理解正确的是
A.摩尔是一个物理量,它表示含有一定数目粒子的集合体
B.摩尔是物质的量的单位,简称摩,符号为mol
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
D.1摩尔任何物质均含有6.02×1023个原子
5.判断下列有关化学基本概念的依据正确的是( )
A.溶液与胶体:属于不同分散系的本质原因是能否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
6.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2Fe+3CO2
D.MgCl2(熔融)Mg+Cl2↑
7.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②和③ C.④和⑤ D.①②③④⑤
8.下列说法正确的是
A.1molH2O中含有2mol氢和1mol氧
B.CH4的摩尔质量为16g
C.32gSO2含有的分子数约为3.01×1023个
D.1mol任何物质含有的微粒数都相同
9.下列叙述中不正确的是
A.1 mol CO的质量是28 g
B.硝酸的摩尔质量为63 g/mol
C.磷酸(H3PO4)的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
D.1 mol H2O含有1 mol H2
10.NA代表阿伏加德罗常数,下列说法正确的是
A.2.3 g钠离子中含有的电子数为0.1NA
B.0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数
C.28 g氮气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8∶1
11.一定温度和压强下,用mg的H2、CH4、CO2、O2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是 ( )
A.气球④中装的是CO2
B.气球②和气球③中气体密度之比为2:1
C.气球①和气球④中气体分子数相等
D.气球③和气球④中气体物质的量之比为1:4
12.设阿伏加德罗常数为NA,标准状况下,某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在标准状况下所占体积( )
A.L B.L C.L D.L
13.已知硫有多种同素异形体,其中一种同素异形体的分子式为S8。下列关于S8的说法中,正确的是
A.1个这种硫分子的质量为256 g,是硫原子质量的8倍
B.在标准状况下,1mol S8的体积约为22.4 L
C.1mol S8和1molH2O所含分子数相同
D.1 molS8与NA个H2O所含原子数相同
14.下列说法中正确的是
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖属于非电解质,硫酸钡和水都属于电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1 nm到100 nm之间
A.3个 B.4个 C.5个 D.6个
15.下列说法中,正确的是
A.酸性氧化物是指在一定条件下能和碱发生反应生成盐和水的氧化物,所以酸性氧化物一定不能与酸发生反应
B.根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
C.纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子
D.电解质导电一定发生了化学变化
二、非选择题(本大题共4小题,共55分)
16.C、N、O、S、H、Na都是中学化学中常见的元素。按要求完成下列填空。
(1)2molC2H6O分子中含___________mol碳原子、___________个氢原子。
(2)0.5molH2SO4分子的质量为___________;0.1NA个Al2(SO4)3所含SO的物质的量为___________,
(3)等物质的量的NH3和N2两种气体,所含原子数之比为___________,等质量的NH3和N2物质的量之比为___________。
(4)24.8gNa2R含Na+0.8mol,则Na2R物质的量为___________,摩尔质量为___________。
(5)现有ag某气体,该气体分子为双原子分子。它的摩尔质量为bg·mol-1.若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为___________mol;
②该气体所含原子总数为___________个。
17.现有下列9种物质:①Na2CO3固体,②CO2固体,③Ca(OH)2固体,④NH4HCO3固体,⑤葡萄糖,⑥Al,⑦食盐水,⑧CH3COOH,⑨熔融氯化钾。
请回答下列问题:
(1)上述物质中属于电解质的是___________(填序号),属于非电解质的是___________ (填序号),能导电的是___________(填序号)。
(2)上述物质中①可用作洗涤剂,其原因是___________ ,写出其电离方程式:___________ 。
(3)下图为一定量③的饱和溶液中通人②气体后,溶液的导电能力与二氧化碳体积之间的关系曲线,由图___________。(填“能”或“不能”)确定B处生成的除水外的物质是电解质。在AB段曲线某一处,若通人的CO2的体积为3.36L(标准状况)时,写出反应的化学方程式:___________ ,得到沉淀的质量为___________g。
18.现有以下物质:①NaOH溶液;②液氨;③BaCO3固体;④熔融KHSO4;⑤Fe(OH)3 胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖;⑩冰水混合物
(1)以上物质中属于混合物的是___________(填序号),以上物质中属于电解质的是___________(填序号) ;以上纯净物中能导电的是___________(填序号)。
(2)写出制备物质⑤的化学方程式___________,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈___________色,即制得Fe(OH)3胶体。证明制备出Fe(OH)3胶体的操作方法是___________
(3)写出④的电离方程式___________。
(4)在足量④的水溶液中加入少量③,发生反应的化学方程式为___________。
(5)在含40 g溶质的①溶液中缓缓通入标准状况下66 g CO2,则反应后溶液的溶质有___________(填化学式),该过程的化学反应方程式为___________
19.某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:
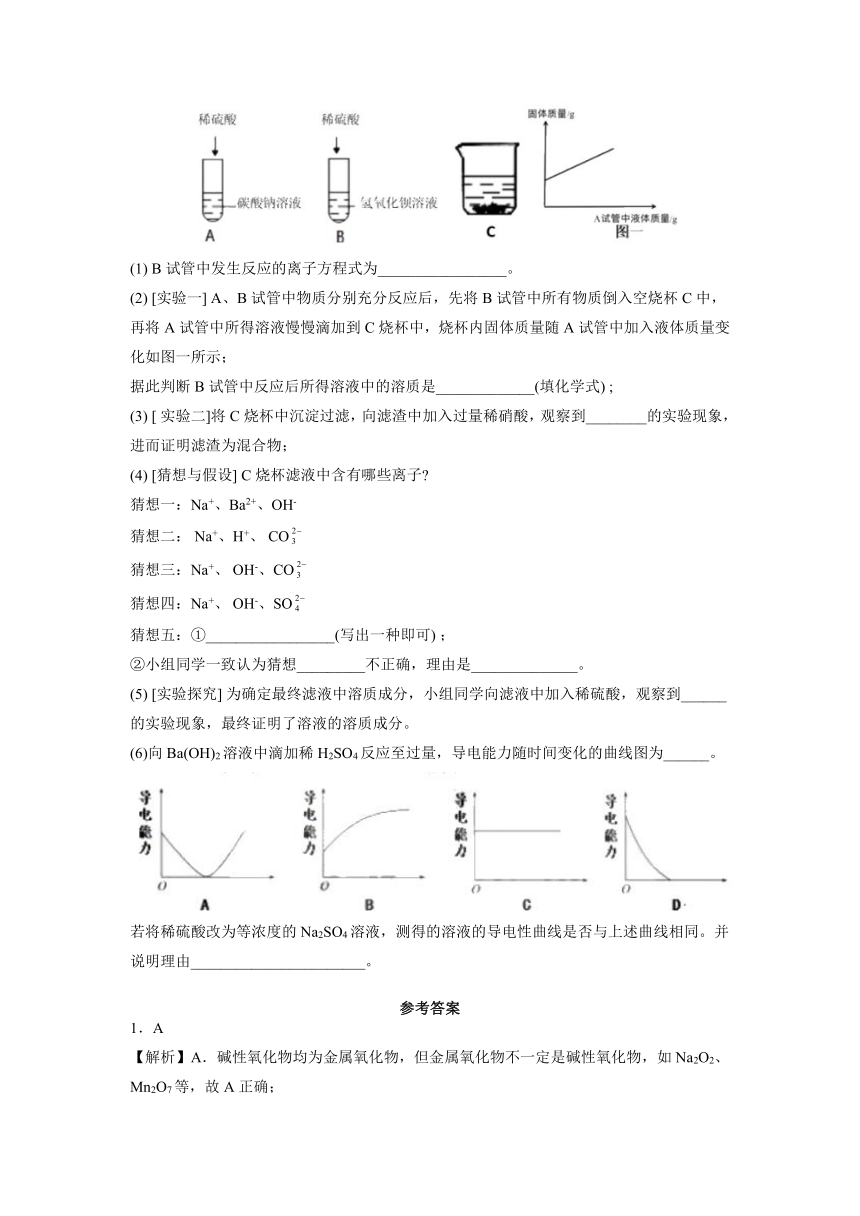
(1) B试管中发生反应的离子方程式为_________________。
(2) [实验一] A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;
据此判断B试管中反应后所得溶液中的溶质是_____________(填化学式) ;
(3) [ 实验二]将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到________的实验现象,进而证明滤渣为混合物;
(4) [猜想与假设] C烧杯滤液中含有哪些离子
猜想一:Na+、Ba2+、OH-
猜想二: Na+、H+、 CO
猜想三:Na+、 OH-、CO
猜想四:Na+、 OH-、SO
猜想五:①_________________(写出一种即可) ;
②小组同学一致认为猜想_________不正确,理由是______________。
(5) [实验探究] 为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到______的实验现象,最终证明了溶液的溶质成分。
(6)向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为______。
若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同。并说明理由_______________________。
参考答案
1.A
【解析】A.碱性氧化物均为金属氧化物,但金属氧化物不一定是碱性氧化物,如Na2O2、Mn2O7等,故A正确;
B.二氧化碳等非电解质溶于水也能导电,则溶于水能导电的化合物不一定是电解质,故B错误;
C.冰和水是状态不同的同一种物质,二者的转化属于物理变化,故C错误;
D.同素异形体之间的转化,如3O2→2O3,化合价没有改变,不是氧化还原反应,故D错误;
故答案为A。
2.C
【解析】A.“碳纳米泡沫”中,每个泡沫含有约4000个碳原子,一种新型的碳单质,A叙述错误;
B.“碳纳米泡沫”中的碳原子颗粒直径约6到9nm,溶于水形成的分散系是胶体,B叙述错误;
C.“碳纳米泡沫”为单质,既不是电解质也不是非电解质,C叙述正确;
D.“碳纳米泡沫”为分子形式,金刚石为原子晶体,性质不相同,D叙述错误;
答案为C。
3.C
【解析】A. 纯碱是碳酸钠,属于盐,不是碱,硫酸铜晶体属于纯净物,二氧化碳属于非电解质,A项错误;
B. Na2O2不是酸性氧化物,属于过氧化物,生石灰属于氧化物,不属于碱,金属镁属于单质,不是电解质,B项错误;
C. SO3是酸性氧化物,H2SiO3是酸,烧碱是NaOH属于碱,碳酸氢钠是盐,澄清石灰水为混合物,NaCl为电解质,C项正确;
D. NO不是酸性氧化物,属于中性氧化物,液氯为纯净物,氨气为非电解质,D项错误;
答案选C。
4.B
【解析】A. 物质的量是一个物理量,它表示含有一定数目粒子的集合体,摩尔是物质的量的单位,故A错误;
B. 摩尔是物质的量的单位,简称摩,符号为mol,故B正确;
C. 国际上规定,0.012kg原子所含有的碳原子数目为1摩尔,故C错误;
D. 1摩尔物质大约含有6.02×1023个该物质的微粒,必须指明是何种物质,如1mol H2含有6.02×1023个H2分子,1mol H含有6.02×1023个H原子,故D错误;
答案选B。
5.C
【解析】A.分散系根据分散质粒子直径的大小可以分为溶液、胶体和浊液,所以溶液和胶体的本质区别是分散质粒子直径的大小;故A错误;
B. 纯净物只由一种物质组成的,混合物由两种或两种以上物质组成,故B错误;
C.氧化还原反应的本质是有电子的得失或偏移,特征为有元素化合价的升降,故根据反应前后元素化合价是否变化可以判断是否是氧化还原反应,故C正确;
D 电解质指在水溶液中或熔融状态下能导电的化合物,非电解质指在水溶液中和熔融状态下均不能导电的化合物,根据定义可以看出,电解质、非电解质的判断并不是看物质本身是否导电,而是看化合物在水溶液中或熔融状态下是否能导电,故D错误;
答案:C。
6.C
【解析】A.该反应是氧化还原反应,但属于置换反应,故A错误;
B.该反应属于复分解反应,不是氧化还原反应,故B错误;
C.该反应中,C元素化合价由+2价变为+4价、Fe元素化合价由+3价变为0价,所以属于氧化还原反应,但不属于四种基本反应类型,故C正确;
D.该反应是氧化还原反应,但属于分解反应,故D错误;
答案选C。
7.D
【解析】根据化学式可知,如果CO和CO2的物质的量相等,则二者的分子数相等,所含的氧原子数是1︰2的。而原子总数是2︰3的,碳原子数是1︰1的,含有的电子数是14︰22,所以正确的答案选D。
8.C
【解析】A.1molH2O中含有2mol氢原子和1mol氧原子,A错误;
B.CH4的摩尔质量为16g mol 1,B错误;
C.32g SO2的物质的量为0.5mol,含有的分子数约为3.01×1023,C正确;
D.由于“微粒”包括分子、原子、离子等,相同物质的量的物质含有的微粒数不一定相同,D错误;
故选C。
9.D
【解析】A.1 mol CO的质量为,故A正确;
B.硝酸(HNO3)的相对分子质量为63,则摩尔质量为63g/mol,故B正确;
C.磷酸(H3PO4)的摩尔质量为98g/mol,6.02×1023个磷酸分子的质量为98g,二者在数值上相等,故C正确;
D.水分子中没有氢气分子,故D错误。
故选:D。
10.B
【解析】A.1个钠离子中含有10个电子,2.3g钠离子物质的量为==0.1mol,含有的电子数为,故A错误;
B.0.2个硫酸分子中含有的氧原子数为=0.8;19.6g磷酸的物质的量为==0.2mol,其中含氧原子的物质的量为=0.8mol,两者所含氧原子数相同,故B正确;
C.28g氮气的物质的量为==1mol,其中所含原子数为2,故C错误;
D.个氧气分子的质量为==32g;个氢气分子的质量为==2g,其质量比为,故D错误;
故选B。
11.B
【解析】A.根据分析可知④中装的是H2,A说法错误;
B.根据ρ=mV=,即ρ与M成正比,所以气球②和气球③中气体密度之比为32:16=2:1,B说法正确;
C.根据相同质量,,可知气体的分子数与摩尔质量成反比,所以气球①和气球④中气体分子不相等,C说法错误;
D.相同质量下,,物质的量与摩尔质量成反比,所以气球③和气球④中气体物质的量之比为: =1:8,D说法错误;
答案为:B。
12.A
【解析】O2和N2的混合气体mg含有b个分子,则ng该混合气体含个分子,根据,个分子的物质的量为,根据,标准状况下的体积为V=nVm=L,故选A。
13.C
【解析】A.1个这种硫分子的质量为,1个这种硫分子由8个硫原子构成,则1个这种分子的质量是硫原子质量的8倍,A错误;
B.S8在标准状态下为固体,1mol S8的体积原因小于22.4L,B错误;
C.1mol S8和1molH2O所含分子数相同,均为6.02×1023,C正确;
D.1 molS8含8mol原子,NA个H2O含3mol原子,1 molS8与NA个H2O所含原子数不相同,D错误;
选C。
14.A
【解析】①酸性氧化物是与碱反应产生盐和水的氧化物,因此酸性氧化物在一定条件下均能与碱发生反应,①正确;
②金属氧化物可能是碱性氧化物,也可能是酸性氧化物、两性氧化物、过氧化物等,因此不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物,②正确;
③蔗糖是化合物,在水溶液和熔融状态下都不能导电,因此属于非电解质;硫酸钡和水都会发生电离,因此二者都属于电解质,③正确;
④纯碱是Na2CO3的俗称,属于盐,而不属于碱,④错误;
⑤胶粒比溶液中溶质粒子大,但也能够透过滤纸,所以胶体不能用过滤的方法把胶粒分离出来,⑤错误;
⑥氢氧化铁胶体稳定存在的主要原因是胶粒能够选择性吸附正电荷,由于同种电荷相互排斥,因此比较稳定,⑥错误;
综上所述可知:说法正确的是①②③,共3个故合理选项是A。
15.D
【解析】A. 酸性氧化物是指在一定条件下能和碱发生反应生成盐和水的氧化物,酸性氧化物也可能与酸发生反应,如二氧化硅和氢氟酸,故A错误;
B. 根据是分散质粒子直径的大小,将分散系分为溶液、胶体和浊液,故B错误;
C. 铁单质能还原某些金属离子,纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉与重金属离子发生置换反应,不是吸附,故C错误;
D.电解质导电的过程就是电解质电解的过程,阴阳离子分别在阳极、阴极发生氧化反应和还原反应,生成新物质,故D正确;
故选D。
16.4 12NA 49g 0.3mol 2:1 28:17 0.4mol 62g/mol
【解析】(1) 1个C2H6O分子中含有2个C原子、6个氢原子,2molC2H6O分子中含4mol碳原子、2mol ×6×NA=12NA个氢原子。
(2)0.5molH2SO4分子的质量为0.5mol×98g/mol=49g;0.1NA个Al2(SO4)3含0.3NA个SO,SO的物质的量为mol;
(3)等物质的量的NH3和N2两种气体,所含原子数之比为(n×4×NA):( n×2×NA)=2:1;等质量的NH3和N2物质的量分别是、,物质的量之比为: =28:17。
(4)1个 Na2R中含有2个Na+,24.8gNa2R含Na+0.8mol,则Na2R物质的量为0.4mol,摩尔质量为;
(5)①ag某气体,摩尔质量为bg·mol-1,该气体的物质的量为;
②该气体分子为双原子分子,所含原子总数为个。
17.①③④⑧⑨ ②⑤ ⑥⑦⑨ Na2CO3水溶液呈碱性 不能 15
【解析】(1)常见的酸、碱、盐是电解质,故①③④⑧⑨是电解质;常见的非金属氧化物、大多数有机物、部分气态氢化物是非电解质,故②⑤是非电解质;能导电的物质需要有自由移动的电子或离子,故⑥⑦⑨能导电,故答案为:①③④⑧⑨;②⑤;⑥⑦⑨;
(2) Na2CO3的俗名是纯碱,其水溶液呈碱性,可用作洗涤剂,电离方程式为,故答案为:Na2CO3水溶液呈碱性;;
(3)B处只能说明CaCO3在水溶液中不导电,不能确定其在熔融状态下是否导电,故不能确定其是否是电解质。该反应的化学方程式,3.36 L CO2的物质的量为0.15mol,故反应生成0.15mol CaCO3,质量为15 g,故答案为:不能;;15。
18.
(1) ①⑤ ③④⑧⑩ ④⑥⑩
(2) FeCl3+3H2OFe(OH)3 (胶体) +3HCl 红褐色 用一束光照射所得的液体,从侧面观察是否有-条光亮的“通路”出现
(3)
(4)
(5) NaHCO3
19.SO42- +2H++Ba2++2OH- =BaSO4↓+2H2O Ba(OH)2 沉淀部分溶解,有气泡产生 Na+、OH-或(Na+、OH-、SO42-、CO32-) 二 H+与 CO32-不能共存且BaCO3能溶于强酸,滤液中不含有H+ 白色沉淀 A 否;Na2SO4+ Ba(OH)2= BaSO4↓ + 2NaOH,反应后溶液中有钠离子和氢氧根离子导电,恰好完全反应时,电流不会接近于0
【解析】(1) B试管中氢氧化钡与硫酸反应生成硫酸钡沉淀和水,发生反应的离子方程式为SO42- +2H++Ba2++2OH- =BaSO4↓+2H2O;
(2) 先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量增大而增加,说明有碳酸钡沉淀生成;由此可知,B试管中反应后所得溶液中的溶质是Ba(OH)2;
(3) 将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,碳酸钡与硝酸发生反应生成氯化钡、二氧化碳、水,观察到沉淀部分溶解,有气泡产生,进而证明滤渣为混合物;
(4) ①A、B试管内加入碳酸钠、硫酸、氢氧化钡,所以C烧杯滤液中含的离子可能是Na+、OH-或(Na+、OH-、SO42-、CO32-);
②H+、 CO反应生成二氧化碳气体,所以H+、 CO不能共存, BaCO3能溶于强酸,滤液中不含有H+,故猜想二不正确;
(5)硫酸根离子和钡离子反应生成硫酸钡沉淀,向滤液中加入稀硫酸,观察到有白色沉淀生成,最终证明了溶液的溶质成分;
(6)氢氧化钡与硫酸反应生成硫酸钡沉淀和水,向Ba(OH)2溶液中滴加稀H2SO4反应至过量,恰好完全反应时,离子浓度接近为0,H2SO4过量后离子浓度增大,离子浓度先减后增,导电能力先减后增,故选A;
(7) 若将稀硫酸改为等浓度的Na2SO4溶液,发生反应Na2SO4+ Ba(OH)2= BaSO4↓ + 2NaOH,反应后溶液中有钠离子和氢氧根离子导电,恰好完全反应时,电流不会接近于0,测得的溶液的导电性曲线与上述曲线不相同。
一、选择题(本大题共15小题,每小题3分,共45分)
1.下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
2.澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性。下列叙述正确的是( )
A.“碳纳米泡沫”是一种新型的碳化合物
B.“碳纳米泡沫”中的碳原子是胶体
C.“碳纳米泡沫”既不是电解质也不是非电解质
D.“碳纳米泡沫”和金刚石的性质完全相同
3.下列关于物质的分类中, 正确的是( )
选项 酸性氧化物 酸 碱 盐 混合物 电解质
A SiO2 HClO 纯碱 明矾 CuSO4·5H2O CO2
B Na2O2 HNO3 生石灰 NaHSO4 盐酸 Mg
C SO3 H2SiO3 烧碱 碳酸氢钠 澄清石灰水 NaCl
D NO Al(OH)3 熟石灰 BaCO3 液氯 NH3
A.A B.B C.C D.D
4.下列对于“摩尔”的理解正确的是
A.摩尔是一个物理量,它表示含有一定数目粒子的集合体
B.摩尔是物质的量的单位,简称摩,符号为mol
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
D.1摩尔任何物质均含有6.02×1023个原子
5.判断下列有关化学基本概念的依据正确的是( )
A.溶液与胶体:属于不同分散系的本质原因是能否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
6.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2Fe+3CO2
D.MgCl2(熔融)Mg+Cl2↑
7.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1; ②它们所含的O原子数目之比为1∶2; ③它们所含的原子总数目之比为2∶3; ④它们所含的C原子数目之比为1∶1;⑤它们所含的电子数目之比为7∶11
A.①②③④ B.②和③ C.④和⑤ D.①②③④⑤
8.下列说法正确的是
A.1molH2O中含有2mol氢和1mol氧
B.CH4的摩尔质量为16g
C.32gSO2含有的分子数约为3.01×1023个
D.1mol任何物质含有的微粒数都相同
9.下列叙述中不正确的是
A.1 mol CO的质量是28 g
B.硝酸的摩尔质量为63 g/mol
C.磷酸(H3PO4)的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
D.1 mol H2O含有1 mol H2
10.NA代表阿伏加德罗常数,下列说法正确的是
A.2.3 g钠离子中含有的电子数为0.1NA
B.0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数
C.28 g氮气所含的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8∶1
11.一定温度和压强下,用mg的H2、CH4、CO2、O2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是 ( )
A.气球④中装的是CO2
B.气球②和气球③中气体密度之比为2:1
C.气球①和气球④中气体分子数相等
D.气球③和气球④中气体物质的量之比为1:4
12.设阿伏加德罗常数为NA,标准状况下,某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在标准状况下所占体积( )
A.L B.L C.L D.L
13.已知硫有多种同素异形体,其中一种同素异形体的分子式为S8。下列关于S8的说法中,正确的是
A.1个这种硫分子的质量为256 g,是硫原子质量的8倍
B.在标准状况下,1mol S8的体积约为22.4 L
C.1mol S8和1molH2O所含分子数相同
D.1 molS8与NA个H2O所含原子数相同
14.下列说法中正确的是
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖属于非电解质,硫酸钡和水都属于电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1 nm到100 nm之间
A.3个 B.4个 C.5个 D.6个
15.下列说法中,正确的是
A.酸性氧化物是指在一定条件下能和碱发生反应生成盐和水的氧化物,所以酸性氧化物一定不能与酸发生反应
B.根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
C.纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子
D.电解质导电一定发生了化学变化
二、非选择题(本大题共4小题,共55分)
16.C、N、O、S、H、Na都是中学化学中常见的元素。按要求完成下列填空。
(1)2molC2H6O分子中含___________mol碳原子、___________个氢原子。
(2)0.5molH2SO4分子的质量为___________;0.1NA个Al2(SO4)3所含SO的物质的量为___________,
(3)等物质的量的NH3和N2两种气体,所含原子数之比为___________,等质量的NH3和N2物质的量之比为___________。
(4)24.8gNa2R含Na+0.8mol,则Na2R物质的量为___________,摩尔质量为___________。
(5)现有ag某气体,该气体分子为双原子分子。它的摩尔质量为bg·mol-1.若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为___________mol;
②该气体所含原子总数为___________个。
17.现有下列9种物质:①Na2CO3固体,②CO2固体,③Ca(OH)2固体,④NH4HCO3固体,⑤葡萄糖,⑥Al,⑦食盐水,⑧CH3COOH,⑨熔融氯化钾。
请回答下列问题:
(1)上述物质中属于电解质的是___________(填序号),属于非电解质的是___________ (填序号),能导电的是___________(填序号)。
(2)上述物质中①可用作洗涤剂,其原因是___________ ,写出其电离方程式:___________ 。
(3)下图为一定量③的饱和溶液中通人②气体后,溶液的导电能力与二氧化碳体积之间的关系曲线,由图___________。(填“能”或“不能”)确定B处生成的除水外的物质是电解质。在AB段曲线某一处,若通人的CO2的体积为3.36L(标准状况)时,写出反应的化学方程式:___________ ,得到沉淀的质量为___________g。
18.现有以下物质:①NaOH溶液;②液氨;③BaCO3固体;④熔融KHSO4;⑤Fe(OH)3 胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖;⑩冰水混合物
(1)以上物质中属于混合物的是___________(填序号),以上物质中属于电解质的是___________(填序号) ;以上纯净物中能导电的是___________(填序号)。
(2)写出制备物质⑤的化学方程式___________,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈___________色,即制得Fe(OH)3胶体。证明制备出Fe(OH)3胶体的操作方法是___________
(3)写出④的电离方程式___________。
(4)在足量④的水溶液中加入少量③,发生反应的化学方程式为___________。
(5)在含40 g溶质的①溶液中缓缓通入标准状况下66 g CO2,则反应后溶液的溶质有___________(填化学式),该过程的化学反应方程式为___________
19.某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:
(1) B试管中发生反应的离子方程式为_________________。
(2) [实验一] A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;
据此判断B试管中反应后所得溶液中的溶质是_____________(填化学式) ;
(3) [ 实验二]将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到________的实验现象,进而证明滤渣为混合物;
(4) [猜想与假设] C烧杯滤液中含有哪些离子
猜想一:Na+、Ba2+、OH-
猜想二: Na+、H+、 CO
猜想三:Na+、 OH-、CO
猜想四:Na+、 OH-、SO
猜想五:①_________________(写出一种即可) ;
②小组同学一致认为猜想_________不正确,理由是______________。
(5) [实验探究] 为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到______的实验现象,最终证明了溶液的溶质成分。
(6)向Ba(OH)2溶液中滴加稀H2SO4反应至过量,导电能力随时间变化的曲线图为______。
若将稀硫酸改为等浓度的Na2SO4溶液,测得的溶液的导电性曲线是否与上述曲线相同。并说明理由_______________________。
参考答案
1.A
【解析】A.碱性氧化物均为金属氧化物,但金属氧化物不一定是碱性氧化物,如Na2O2、Mn2O7等,故A正确;
B.二氧化碳等非电解质溶于水也能导电,则溶于水能导电的化合物不一定是电解质,故B错误;
C.冰和水是状态不同的同一种物质,二者的转化属于物理变化,故C错误;
D.同素异形体之间的转化,如3O2→2O3,化合价没有改变,不是氧化还原反应,故D错误;
故答案为A。
2.C
【解析】A.“碳纳米泡沫”中,每个泡沫含有约4000个碳原子,一种新型的碳单质,A叙述错误;
B.“碳纳米泡沫”中的碳原子颗粒直径约6到9nm,溶于水形成的分散系是胶体,B叙述错误;
C.“碳纳米泡沫”为单质,既不是电解质也不是非电解质,C叙述正确;
D.“碳纳米泡沫”为分子形式,金刚石为原子晶体,性质不相同,D叙述错误;
答案为C。
3.C
【解析】A. 纯碱是碳酸钠,属于盐,不是碱,硫酸铜晶体属于纯净物,二氧化碳属于非电解质,A项错误;
B. Na2O2不是酸性氧化物,属于过氧化物,生石灰属于氧化物,不属于碱,金属镁属于单质,不是电解质,B项错误;
C. SO3是酸性氧化物,H2SiO3是酸,烧碱是NaOH属于碱,碳酸氢钠是盐,澄清石灰水为混合物,NaCl为电解质,C项正确;
D. NO不是酸性氧化物,属于中性氧化物,液氯为纯净物,氨气为非电解质,D项错误;
答案选C。
4.B
【解析】A. 物质的量是一个物理量,它表示含有一定数目粒子的集合体,摩尔是物质的量的单位,故A错误;
B. 摩尔是物质的量的单位,简称摩,符号为mol,故B正确;
C. 国际上规定,0.012kg原子所含有的碳原子数目为1摩尔,故C错误;
D. 1摩尔物质大约含有6.02×1023个该物质的微粒,必须指明是何种物质,如1mol H2含有6.02×1023个H2分子,1mol H含有6.02×1023个H原子,故D错误;
答案选B。
5.C
【解析】A.分散系根据分散质粒子直径的大小可以分为溶液、胶体和浊液,所以溶液和胶体的本质区别是分散质粒子直径的大小;故A错误;
B. 纯净物只由一种物质组成的,混合物由两种或两种以上物质组成,故B错误;
C.氧化还原反应的本质是有电子的得失或偏移,特征为有元素化合价的升降,故根据反应前后元素化合价是否变化可以判断是否是氧化还原反应,故C正确;
D 电解质指在水溶液中或熔融状态下能导电的化合物,非电解质指在水溶液中和熔融状态下均不能导电的化合物,根据定义可以看出,电解质、非电解质的判断并不是看物质本身是否导电,而是看化合物在水溶液中或熔融状态下是否能导电,故D错误;
答案:C。
6.C
【解析】A.该反应是氧化还原反应,但属于置换反应,故A错误;
B.该反应属于复分解反应,不是氧化还原反应,故B错误;
C.该反应中,C元素化合价由+2价变为+4价、Fe元素化合价由+3价变为0价,所以属于氧化还原反应,但不属于四种基本反应类型,故C正确;
D.该反应是氧化还原反应,但属于分解反应,故D错误;
答案选C。
7.D
【解析】根据化学式可知,如果CO和CO2的物质的量相等,则二者的分子数相等,所含的氧原子数是1︰2的。而原子总数是2︰3的,碳原子数是1︰1的,含有的电子数是14︰22,所以正确的答案选D。
8.C
【解析】A.1molH2O中含有2mol氢原子和1mol氧原子,A错误;
B.CH4的摩尔质量为16g mol 1,B错误;
C.32g SO2的物质的量为0.5mol,含有的分子数约为3.01×1023,C正确;
D.由于“微粒”包括分子、原子、离子等,相同物质的量的物质含有的微粒数不一定相同,D错误;
故选C。
9.D
【解析】A.1 mol CO的质量为,故A正确;
B.硝酸(HNO3)的相对分子质量为63,则摩尔质量为63g/mol,故B正确;
C.磷酸(H3PO4)的摩尔质量为98g/mol,6.02×1023个磷酸分子的质量为98g,二者在数值上相等,故C正确;
D.水分子中没有氢气分子,故D错误。
故选:D。
10.B
【解析】A.1个钠离子中含有10个电子,2.3g钠离子物质的量为==0.1mol,含有的电子数为,故A错误;
B.0.2个硫酸分子中含有的氧原子数为=0.8;19.6g磷酸的物质的量为==0.2mol,其中含氧原子的物质的量为=0.8mol,两者所含氧原子数相同,故B正确;
C.28g氮气的物质的量为==1mol,其中所含原子数为2,故C错误;
D.个氧气分子的质量为==32g;个氢气分子的质量为==2g,其质量比为,故D错误;
故选B。
11.B
【解析】A.根据分析可知④中装的是H2,A说法错误;
B.根据ρ=mV=,即ρ与M成正比,所以气球②和气球③中气体密度之比为32:16=2:1,B说法正确;
C.根据相同质量,,可知气体的分子数与摩尔质量成反比,所以气球①和气球④中气体分子不相等,C说法错误;
D.相同质量下,,物质的量与摩尔质量成反比,所以气球③和气球④中气体物质的量之比为: =1:8,D说法错误;
答案为:B。
12.A
【解析】O2和N2的混合气体mg含有b个分子,则ng该混合气体含个分子,根据,个分子的物质的量为,根据,标准状况下的体积为V=nVm=L,故选A。
13.C
【解析】A.1个这种硫分子的质量为,1个这种硫分子由8个硫原子构成,则1个这种分子的质量是硫原子质量的8倍,A错误;
B.S8在标准状态下为固体,1mol S8的体积原因小于22.4L,B错误;
C.1mol S8和1molH2O所含分子数相同,均为6.02×1023,C正确;
D.1 molS8含8mol原子,NA个H2O含3mol原子,1 molS8与NA个H2O所含原子数不相同,D错误;
选C。
14.A
【解析】①酸性氧化物是与碱反应产生盐和水的氧化物,因此酸性氧化物在一定条件下均能与碱发生反应,①正确;
②金属氧化物可能是碱性氧化物,也可能是酸性氧化物、两性氧化物、过氧化物等,因此不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物,②正确;
③蔗糖是化合物,在水溶液和熔融状态下都不能导电,因此属于非电解质;硫酸钡和水都会发生电离,因此二者都属于电解质,③正确;
④纯碱是Na2CO3的俗称,属于盐,而不属于碱,④错误;
⑤胶粒比溶液中溶质粒子大,但也能够透过滤纸,所以胶体不能用过滤的方法把胶粒分离出来,⑤错误;
⑥氢氧化铁胶体稳定存在的主要原因是胶粒能够选择性吸附正电荷,由于同种电荷相互排斥,因此比较稳定,⑥错误;
综上所述可知:说法正确的是①②③,共3个故合理选项是A。
15.D
【解析】A. 酸性氧化物是指在一定条件下能和碱发生反应生成盐和水的氧化物,酸性氧化物也可能与酸发生反应,如二氧化硅和氢氟酸,故A错误;
B. 根据是分散质粒子直径的大小,将分散系分为溶液、胶体和浊液,故B错误;
C. 铁单质能还原某些金属离子,纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉与重金属离子发生置换反应,不是吸附,故C错误;
D.电解质导电的过程就是电解质电解的过程,阴阳离子分别在阳极、阴极发生氧化反应和还原反应,生成新物质,故D正确;
故选D。
16.4 12NA 49g 0.3mol 2:1 28:17 0.4mol 62g/mol
【解析】(1) 1个C2H6O分子中含有2个C原子、6个氢原子,2molC2H6O分子中含4mol碳原子、2mol ×6×NA=12NA个氢原子。
(2)0.5molH2SO4分子的质量为0.5mol×98g/mol=49g;0.1NA个Al2(SO4)3含0.3NA个SO,SO的物质的量为mol;
(3)等物质的量的NH3和N2两种气体,所含原子数之比为(n×4×NA):( n×2×NA)=2:1;等质量的NH3和N2物质的量分别是、,物质的量之比为: =28:17。
(4)1个 Na2R中含有2个Na+,24.8gNa2R含Na+0.8mol,则Na2R物质的量为0.4mol,摩尔质量为;
(5)①ag某气体,摩尔质量为bg·mol-1,该气体的物质的量为;
②该气体分子为双原子分子,所含原子总数为个。
17.①③④⑧⑨ ②⑤ ⑥⑦⑨ Na2CO3水溶液呈碱性 不能 15
【解析】(1)常见的酸、碱、盐是电解质,故①③④⑧⑨是电解质;常见的非金属氧化物、大多数有机物、部分气态氢化物是非电解质,故②⑤是非电解质;能导电的物质需要有自由移动的电子或离子,故⑥⑦⑨能导电,故答案为:①③④⑧⑨;②⑤;⑥⑦⑨;
(2) Na2CO3的俗名是纯碱,其水溶液呈碱性,可用作洗涤剂,电离方程式为,故答案为:Na2CO3水溶液呈碱性;;
(3)B处只能说明CaCO3在水溶液中不导电,不能确定其在熔融状态下是否导电,故不能确定其是否是电解质。该反应的化学方程式,3.36 L CO2的物质的量为0.15mol,故反应生成0.15mol CaCO3,质量为15 g,故答案为:不能;;15。
18.
(1) ①⑤ ③④⑧⑩ ④⑥⑩
(2) FeCl3+3H2OFe(OH)3 (胶体) +3HCl 红褐色 用一束光照射所得的液体,从侧面观察是否有-条光亮的“通路”出现
(3)
(4)
(5) NaHCO3
19.SO42- +2H++Ba2++2OH- =BaSO4↓+2H2O Ba(OH)2 沉淀部分溶解,有气泡产生 Na+、OH-或(Na+、OH-、SO42-、CO32-) 二 H+与 CO32-不能共存且BaCO3能溶于强酸,滤液中不含有H+ 白色沉淀 A 否;Na2SO4+ Ba(OH)2= BaSO4↓ + 2NaOH,反应后溶液中有钠离子和氢氧根离子导电,恰好完全反应时,电流不会接近于0
【解析】(1) B试管中氢氧化钡与硫酸反应生成硫酸钡沉淀和水,发生反应的离子方程式为SO42- +2H++Ba2++2OH- =BaSO4↓+2H2O;
(2) 先将B试管中所有物质倒入空烧杯C中,再将A试管中所得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量增大而增加,说明有碳酸钡沉淀生成;由此可知,B试管中反应后所得溶液中的溶质是Ba(OH)2;
(3) 将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,碳酸钡与硝酸发生反应生成氯化钡、二氧化碳、水,观察到沉淀部分溶解,有气泡产生,进而证明滤渣为混合物;
(4) ①A、B试管内加入碳酸钠、硫酸、氢氧化钡,所以C烧杯滤液中含的离子可能是Na+、OH-或(Na+、OH-、SO42-、CO32-);
②H+、 CO反应生成二氧化碳气体,所以H+、 CO不能共存, BaCO3能溶于强酸,滤液中不含有H+,故猜想二不正确;
(5)硫酸根离子和钡离子反应生成硫酸钡沉淀,向滤液中加入稀硫酸,观察到有白色沉淀生成,最终证明了溶液的溶质成分;
(6)氢氧化钡与硫酸反应生成硫酸钡沉淀和水,向Ba(OH)2溶液中滴加稀H2SO4反应至过量,恰好完全反应时,离子浓度接近为0,H2SO4过量后离子浓度增大,离子浓度先减后增,导电能力先减后增,故选A;
(7) 若将稀硫酸改为等浓度的Na2SO4溶液,发生反应Na2SO4+ Ba(OH)2= BaSO4↓ + 2NaOH,反应后溶液中有钠离子和氢氧根离子导电,恰好完全反应时,电流不会接近于0,测得的溶液的导电性曲线与上述曲线不相同。
