湖北省十堰市竹溪县第二高中2021-2022学年高二上学期12月月考化学试题(Word版含答案)
文档属性
| 名称 | 湖北省十堰市竹溪县第二高中2021-2022学年高二上学期12月月考化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 165.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 15:23:03 | ||
图片预览


文档简介
竹溪县第二高中2021-2022学年高二上学期12月月考
化学试题
以下数据可供解题时参考:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Fe:56
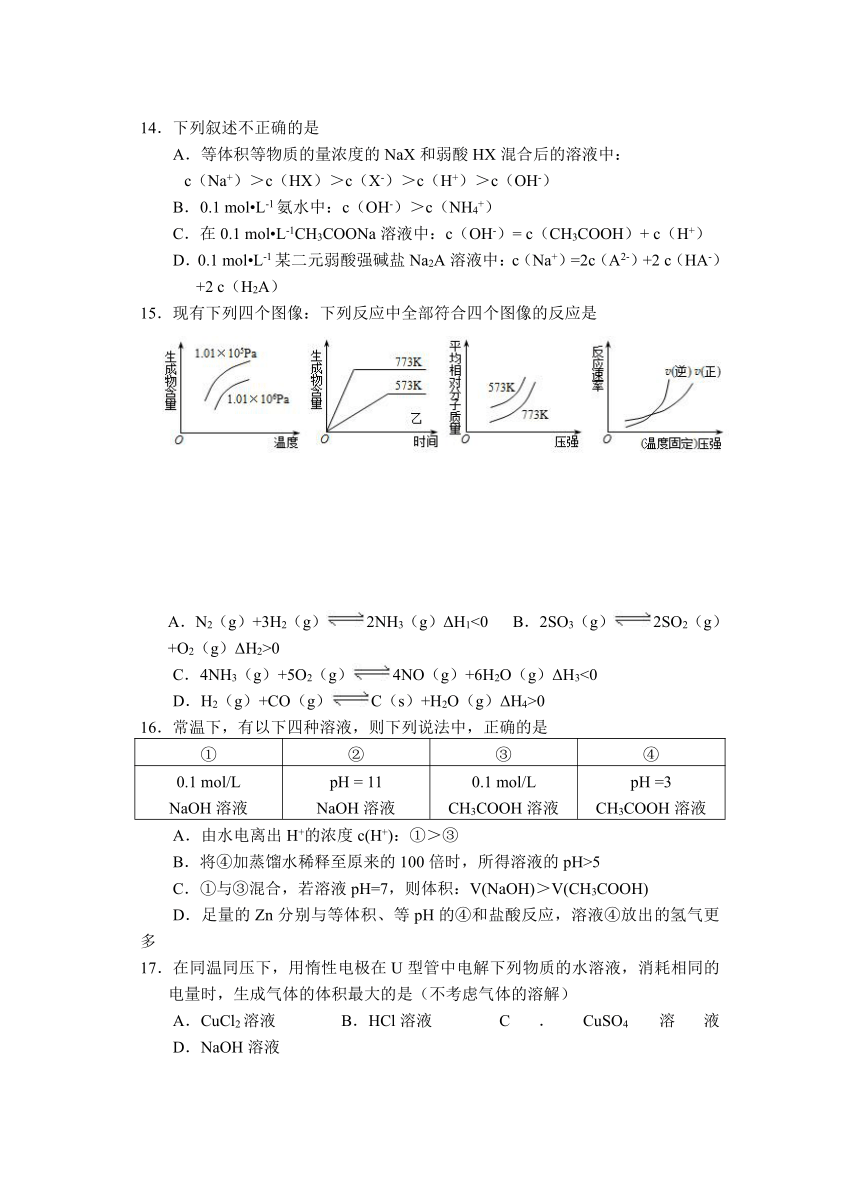
一、选择题(每小题3分,每小题只有一个正确选项。)
1.暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当
A.正极 B.负极
C.阴极 D.阳极
2.在25℃时,0.1 mol·L-1 的硫酸中,水的KW值为
A.大于1×10-14 B.小于1×10-14 C.无法确定 D.等于1×10-14
3.下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液 B.Na2SO4 C.KOH溶液 D.NH4Cl溶液
4、对于300mL1mol·L-1盐酸与铁的反应,其中能使反应速率加快的措施是
A.改用100mL98%的硫酸 B.再加入300mL1mol·L-1盐酸
C.用等量铁片代替铁粉 D.升高温度
5.25℃时,1 mol/L醋酸加水稀释至0.01 mol/L,关于稀释前后的下列变化正确的是
A.溶液中c(OH-)减小 B. pH的变化值等于2
C.溶液中c(H+)/c(CH3COOH)的值增大 D. Kw的值减小
6.COCl2(g)CO(g)+Cl2(g) ΔH>0,当反应达平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①④⑥ B.①②④ C.②③⑤ D.③⑤⑥
7.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是
A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SO42-
B.b点对应的溶液中大量存在:Na+、Fe3+、HCO3-、I-
C.c点对应的溶液中大量存在:Na+、Ca2+、Cl-、CO32—
D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl-
8.下列用来表示物质变化的化学用语中,正确的是
A.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu–2e-=Cu2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.电解饱和食盐水时,阴极的电极反应式为:2H++2e-=H2↑
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
9.下列用来表示物质变化的化学用语中,正确的是
A.CO32-的水解方程式:CO32﹣+H2OHCO3﹣+OH﹣
B.NaHCO3的水溶液:NaHCO3=Na++H++CO32-
C.HS﹣的水解方程式:HS﹣+H2OS2﹣+H3O+
D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
10.把A、B、C、D四块金属片用导线两两相连,浸入稀硫酸中组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为
A.A>C>D>B B.A>B>C>D C.C>A>B>D D.B>A>C>D
11.在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
A.反应进行到3min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.0-3min,氢气的平均反应速率为1.5mol/(L·min)
D.该温度下,反应的平衡常数的值为5.33
12.下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.对2HI(g)H2(g)+I2(g)平衡体系增加压强使颜色变深
C.黄绿色的氯水光照后颜色变浅 D.高压比常压有利于合成SO3的反应
13.从下列事实所得出的解释或结论正确的是
选项 实验事实 解释或结论
A 2N2O5 (g)=4NO2 (g)+O2(g) ΔH>0在室温下能自发进行 这是一个熵减的反应
B 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
C 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 该反应是放热反应
D 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 反应物的浓度一定降低
14.下列叙述不正确的是
A.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B.0.1 mol L-1氨水中:c(OH-)>c(NH4+)
C.在0.1 mol L-1CH3COONa溶液中:c(OH-)= c(CH3COOH)+ c(H+)
D.0.1 mol L-1某二元弱酸强碱盐Na2A溶液中:c(Na+)=2c(A2-)+2 c(HA-)+2 c(H2A)
15.现有下列四个图像:下列反应中全部符合四个图像的反应是
A.N2(g)+3H2(g)2NH3(g)ΔH1<0 B.2SO3(g)2SO2(g)+O2(g)ΔH2>0
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH3<0
D.H2(g)+CO(g)C(s)+H2O(g)ΔH4>0
16.常温下,有以下四种溶液,则下列说法中,正确的是
① ② ③ ④
0.1 mol/LNaOH溶液 pH = 11NaOH溶液 0.1 mol/L CH3COOH溶液 pH =3CH3COOH溶液
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH>5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.足量的Zn分别与等体积、等pH的④和盐酸反应,溶液④放出的氢气更多
17.在同温同压下,用惰性电极在U型管中电解下列物质的水溶液,消耗相同的电量时,生成气体的体积最大的是(不考虑气体的溶解)
A.CuCl2溶液 B.HCl溶液 C.CuSO4溶液 D.NaOH溶液
18.下列热化学方程式正确的是
A.已知甲烷的燃烧热ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.已知:H2(g)+1/2O2(g)=H2O(g) ΔH=-Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g) ΔH=2Q1kJ/mol
C.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,
则:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)ΔH=-641.6kJ·mol-1
D.已知强酸和强碱稀溶液中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
则:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
19.瓦斯分析仪(图甲)能够测量煤矿巷道中甲烷的浓度。该瓦斯分析仪工作原理类似燃料电池,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.当固体电解质中有1 mol O2-通过时,电子转移4 mol
D.电极a的反应式为:CH4+4O2---8e-=CO2+2H2O
20.25℃时,在等体积的①pH=0的H2SO4溶液,②0.05mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1∶10∶104∶109 B.1∶5∶5×109∶5×108
C.1∶10∶1010∶109 D.1∶20∶1010∶109
非选择题(共5小题,50分。)
(每空3分,计21分)
(1) 工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:___________
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(3)NaHSO3溶液显酸性的原因是 (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为________。
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
22.(10分) 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 。
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”).
23.(每空2分,计8分)
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)2NO2(g)ΔH<0,反应体系中,
n(NO)随时间t的变化如下表
时间t(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)如图表示NO2浓度变化曲线的是________。(填字母)。用O2的浓度变化表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
e.等温等容时,充入氦气
高二化学参考答案及评分说明
(每小题3分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B D B D C A D C A A
题号 11 12 13 14 15 16 17 18 19 20
答案 D B C A B D B C D C
21、(共21分,每空3分)
(1)2NH3(g)+CO2(g)H2O(g)+CO(NH2)2 (s) ΔH=-134kJ/mol
(2)c(CH3COOH)>c(HCl)>c(H2SO4); a﹤b=c
(3)HSO3-H++SO32- ,HSO3-+H2OH2SO3+OH-,HSO3-的电离程度大于HSO3-的水解程度,所以溶液显酸性
(4)1.2×10-7mol/L(或1.234×10-7)
(5)b
(6)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
22.(共11分,除一个电解方程式2分外,其余每空各1分)
(1)负; Zn﹣2e﹣=Zn2+; O2+2H2O+4e﹣=4OH﹣;
(2)有无色气体产生,电极附近溶液变红; A; 2Cl﹣﹣2e﹣=Cl2↑;
2NaCl+2H2O2NaOH+H2↑+Cl2↑;(2分)
(3)纯铜; Cu2++2e﹣=Cu; 减小。
23.(每空2分,共8分)
(1)b;(2分) 1.5×10-3 mol·L-1·s-1 (1分)
(2)bc(2分)
(3)c(2分)
化学试题
以下数据可供解题时参考:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Fe:56
一、选择题(每小题3分,每小题只有一个正确选项。)
1.暖宝宝(如图所示)采用的是铁的“氧化放热”原理,使其发生原电池反应,铁粉在原电池中充当
A.正极 B.负极
C.阴极 D.阳极
2.在25℃时,0.1 mol·L-1 的硫酸中,水的KW值为
A.大于1×10-14 B.小于1×10-14 C.无法确定 D.等于1×10-14
3.下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液 B.Na2SO4 C.KOH溶液 D.NH4Cl溶液
4、对于300mL1mol·L-1盐酸与铁的反应,其中能使反应速率加快的措施是
A.改用100mL98%的硫酸 B.再加入300mL1mol·L-1盐酸
C.用等量铁片代替铁粉 D.升高温度
5.25℃时,1 mol/L醋酸加水稀释至0.01 mol/L,关于稀释前后的下列变化正确的是
A.溶液中c(OH-)减小 B. pH的变化值等于2
C.溶液中c(H+)/c(CH3COOH)的值增大 D. Kw的值减小
6.COCl2(g)CO(g)+Cl2(g) ΔH>0,当反应达平衡时,下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①④⑥ B.①②④ C.②③⑤ D.③⑤⑥
7.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是
A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SO42-
B.b点对应的溶液中大量存在:Na+、Fe3+、HCO3-、I-
C.c点对应的溶液中大量存在:Na+、Ca2+、Cl-、CO32—
D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl-
8.下列用来表示物质变化的化学用语中,正确的是
A.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu–2e-=Cu2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.电解饱和食盐水时,阴极的电极反应式为:2H++2e-=H2↑
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
9.下列用来表示物质变化的化学用语中,正确的是
A.CO32-的水解方程式:CO32﹣+H2OHCO3﹣+OH﹣
B.NaHCO3的水溶液:NaHCO3=Na++H++CO32-
C.HS﹣的水解方程式:HS﹣+H2OS2﹣+H3O+
D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
10.把A、B、C、D四块金属片用导线两两相连,浸入稀硫酸中组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,电子由D经导线流向B,则此4种金属的活动性由强到弱的顺序为
A.A>C>D>B B.A>B>C>D C.C>A>B>D D.B>A>C>D
11.在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
A.反应进行到3min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.0-3min,氢气的平均反应速率为1.5mol/(L·min)
D.该温度下,反应的平衡常数的值为5.33
12.下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.对2HI(g)H2(g)+I2(g)平衡体系增加压强使颜色变深
C.黄绿色的氯水光照后颜色变浅 D.高压比常压有利于合成SO3的反应
13.从下列事实所得出的解释或结论正确的是
选项 实验事实 解释或结论
A 2N2O5 (g)=4NO2 (g)+O2(g) ΔH>0在室温下能自发进行 这是一个熵减的反应
B 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小
C 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 该反应是放热反应
D 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 反应物的浓度一定降低
14.下列叙述不正确的是
A.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B.0.1 mol L-1氨水中:c(OH-)>c(NH4+)
C.在0.1 mol L-1CH3COONa溶液中:c(OH-)= c(CH3COOH)+ c(H+)
D.0.1 mol L-1某二元弱酸强碱盐Na2A溶液中:c(Na+)=2c(A2-)+2 c(HA-)+2 c(H2A)
15.现有下列四个图像:下列反应中全部符合四个图像的反应是
A.N2(g)+3H2(g)2NH3(g)ΔH1<0 B.2SO3(g)2SO2(g)+O2(g)ΔH2>0
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH3<0
D.H2(g)+CO(g)C(s)+H2O(g)ΔH4>0
16.常温下,有以下四种溶液,则下列说法中,正确的是
① ② ③ ④
0.1 mol/LNaOH溶液 pH = 11NaOH溶液 0.1 mol/L CH3COOH溶液 pH =3CH3COOH溶液
A.由水电离出H+的浓度c(H+):①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH>5
C.①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH)
D.足量的Zn分别与等体积、等pH的④和盐酸反应,溶液④放出的氢气更多
17.在同温同压下,用惰性电极在U型管中电解下列物质的水溶液,消耗相同的电量时,生成气体的体积最大的是(不考虑气体的溶解)
A.CuCl2溶液 B.HCl溶液 C.CuSO4溶液 D.NaOH溶液
18.下列热化学方程式正确的是
A.已知甲烷的燃烧热ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.已知:H2(g)+1/2O2(g)=H2O(g) ΔH=-Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g) ΔH=2Q1kJ/mol
C.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,
则:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)ΔH=-641.6kJ·mol-1
D.已知强酸和强碱稀溶液中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
则:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
19.瓦斯分析仪(图甲)能够测量煤矿巷道中甲烷的浓度。该瓦斯分析仪工作原理类似燃料电池,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.当固体电解质中有1 mol O2-通过时,电子转移4 mol
D.电极a的反应式为:CH4+4O2---8e-=CO2+2H2O
20.25℃时,在等体积的①pH=0的H2SO4溶液,②0.05mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1∶10∶104∶109 B.1∶5∶5×109∶5×108
C.1∶10∶1010∶109 D.1∶20∶1010∶109
非选择题(共5小题,50分。)
(每空3分,计21分)
(1) 工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:___________
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(3)NaHSO3溶液显酸性的原因是 (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为________。
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
22.(10分) 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 。
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);B电极上的电极反应式为 ,总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),电极反应式是 ,反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”).
23.(每空2分,计8分)
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)2NO2(g)ΔH<0,反应体系中,
n(NO)随时间t的变化如下表
时间t(s) 0 1 2 3 4 5
n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)如图表示NO2浓度变化曲线的是________。(填字母)。用O2的浓度变化表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
e.等温等容时,充入氦气
高二化学参考答案及评分说明
(每小题3分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B D B D C A D C A A
题号 11 12 13 14 15 16 17 18 19 20
答案 D B C A B D B C D C
21、(共21分,每空3分)
(1)2NH3(g)+CO2(g)H2O(g)+CO(NH2)2 (s) ΔH=-134kJ/mol
(2)c(CH3COOH)>c(HCl)>c(H2SO4); a﹤b=c
(3)HSO3-H++SO32- ,HSO3-+H2OH2SO3+OH-,HSO3-的电离程度大于HSO3-的水解程度,所以溶液显酸性
(4)1.2×10-7mol/L(或1.234×10-7)
(5)b
(6)c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
22.(共11分,除一个电解方程式2分外,其余每空各1分)
(1)负; Zn﹣2e﹣=Zn2+; O2+2H2O+4e﹣=4OH﹣;
(2)有无色气体产生,电极附近溶液变红; A; 2Cl﹣﹣2e﹣=Cl2↑;
2NaCl+2H2O2NaOH+H2↑+Cl2↑;(2分)
(3)纯铜; Cu2++2e﹣=Cu; 减小。
23.(每空2分,共8分)
(1)b;(2分) 1.5×10-3 mol·L-1·s-1 (1分)
(2)bc(2分)
(3)c(2分)
同课章节目录
