人教版九年级化学下册 第九单元《溶液》复习测试题 (WORD版,含答案)
文档属性
| 名称 | 人教版九年级化学下册 第九单元《溶液》复习测试题 (WORD版,含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 348.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-23 00:00:00 | ||
图片预览

文档简介
第九单元 溶液 复习测试题
可能用到的相对原子质量:Ca—40 C—12 O—16 H—1 Cl—35.5
一、选择题(本题包括16小题,每小题只有一个正确答案,每小题2分,共32分)
1.把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A. 碘 B. 汽油 C. 高锰酸钾 D. 面粉
2.人们在高山上煮鸡蛋时,常在水中加.一些食盐以使鸡赁快些煮熟,这是由于固体溶于水,可以使溶液 ( )
A.密度变大 B.凝固点下降 C.沸点升高 D.沸点降低
3.能证实A物质的溶液是20℃时的饱和溶液的事实是 ( )
A.降温到10℃有A晶体析出
B.蒸发掉10 g水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20 ℃时.向上述溶液中加入少量A晶体,溶液质量不变
4.由固体溶解度曲线可知 ( )
A.在任何温度下溶质溶饼的质量 B.能溶解溶质的物质
C.溶解溶质所需溶剂的质量 D.溶质溶解度随温度变化的情况
5.利用海水晒盐的原理是 ( )
A.日晒可使氯化钠蒸发 B.日晒可使水分蒸发
C.日晒可使海水分解 D.日晒可使氯化钠的溶解使变小
6.把400克质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水 ( )
A.100克 B.200克 C.400克 D.800克
7.20℃时食盐的溶解度是36 g,则20℃时食盐的不饱和溶液中溶质的质量分数可能是( )
A.36% B.27% C.10% D.30%
8.将浓度为38%、密度为1.19 g·cm-3的浓盐酸稀释成10%的稀盐酸,需用到 ( )
A.托盘天平、烧杯、玻璃捧、量筒 B.量筒、漏斗、烧杯、胶头滴管
C.量简、烧杯、玻璃棒、胶头滴管 D.量筒、托盘天平、烧杯、玻璃棒
9.下列各组物质,只用结晶法即可分离的是 ( )
A.酒精和水 B.KNO3和NaCl C.MnO2和KCl D.CaCO3和河沙
10.现有a、b两种物质在室温下的饱和溶液,升高温度后,a溶液有晶体析出,而b溶液还可以再溶解b晶体.则能正确表示a、b两种物质溶解度曲线的是 ( )
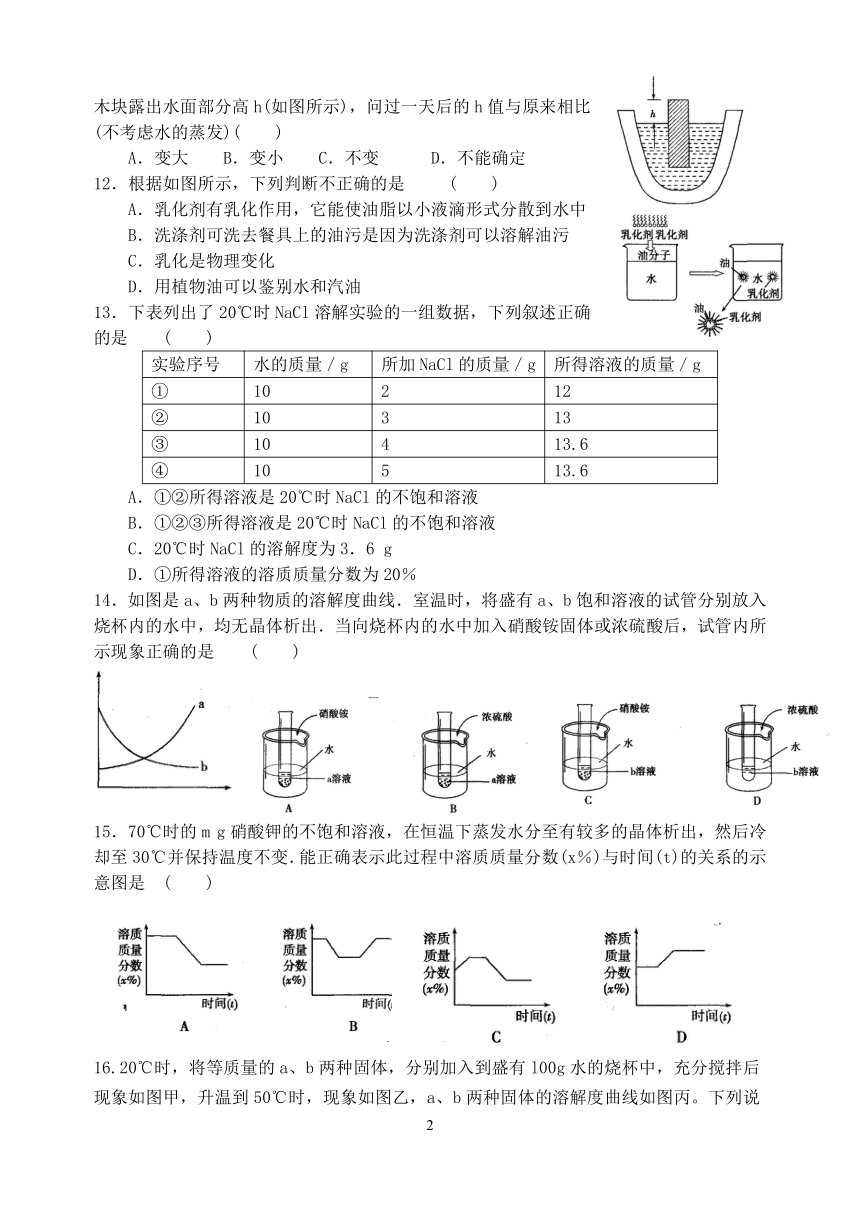
11.新鲜的冬瓜内盛有5%的NaCl溶液,现将一木块放入这种溶液中,木块处于漂浮状态,木块露出水面部分高h(如图所示),问过一天后的h值与原来相比(不考虑水的蒸发)( )
A.变大 B.变小 C.不变 D.不能确定
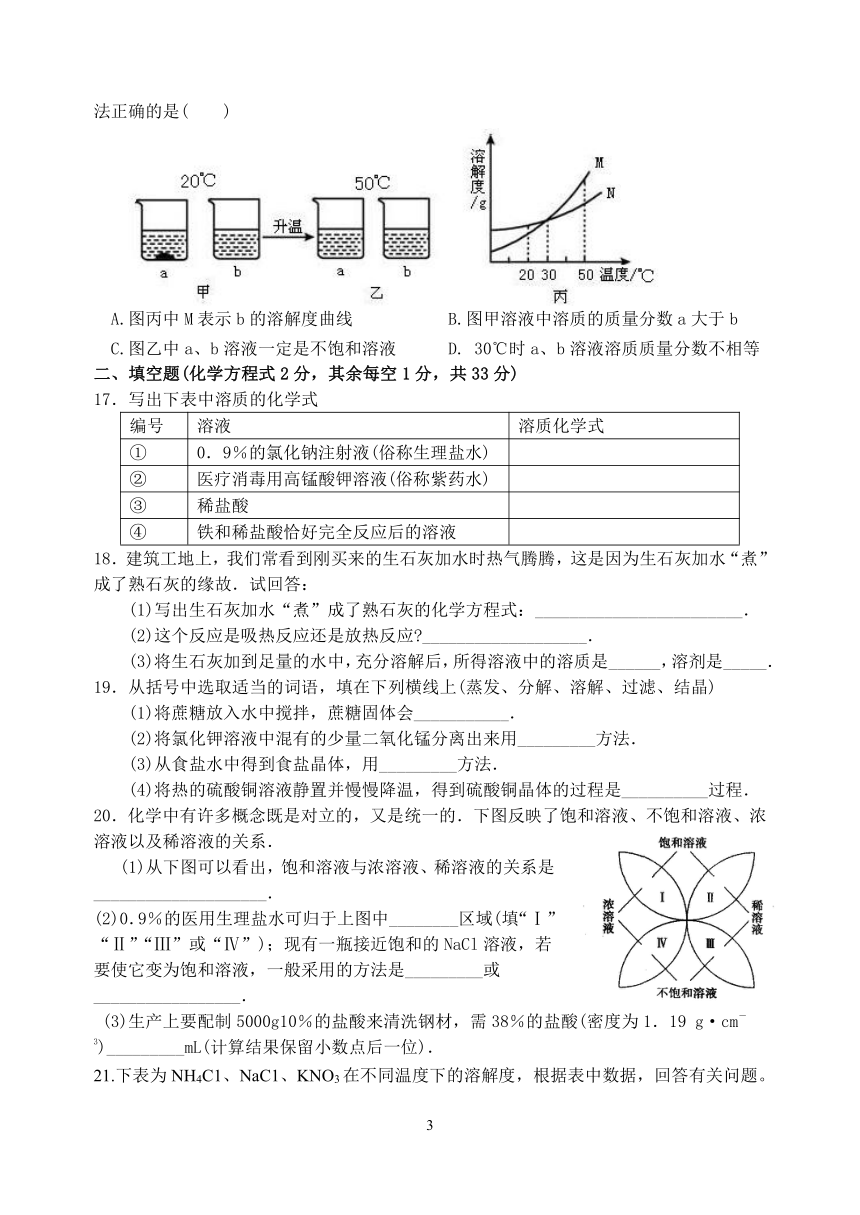
12.根据如图所示,下列判断不正确的是 ( )
A.乳化剂有乳化作用,它能使油脂以小液滴形式分散到水中
B.洗涤剂可洗去餐具上的油污是因为洗涤剂可以溶解油污
C.乳化是物理变化
D.用植物油可以鉴别水和汽油
13.下表列出了20℃时NaCl溶解实验的一组数据,下列叙述正确的是 ( )
实验序号 水的质量/g 所加NaCl的质量/g 所得溶液的质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①②所得溶液是20℃时NaCl的不饱和溶液
B.①②③所得溶液是20℃时NaCl的不饱和溶液
C.20℃时NaCl的溶解度为3.6 g
D.①所得溶液的溶质质量分数为20%
14.如图是a、b两种物质的溶解度曲线.室温时,将盛有a、b饱和溶液的试管分别放入烧杯内的水中,均无晶体析出.当向烧杯内的水中加入硝酸铵固体或浓硫酸后,试管内所示现象正确的是 ( )
15.70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是 ( )
16.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( )
A.图丙中M表示b的溶解度曲线 B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液 D. 30℃时a、b溶液溶质质量分数不相等
二、填空题(化学方程式2分,其余每空1分,共33分)
17.写出下表中溶质的化学式
编号 溶液 溶质化学式
① 0.9%的氯化钠注射液(俗称生理盐水)
② 医疗消毒用高锰酸钾溶液(俗称紫药水)
③ 稀盐酸
④ 铁和稀盐酸恰好完全反应后的溶液
18.建筑工地上,我们常看到刚买来的生石灰加水时热气腾腾,这是因为生石灰加水“煮”成了熟石灰的缘故.试回答:
(1)写出生石灰加水“煮”成了熟石灰的化学方程式:________________________.
(2)这个反应是吸热反应还是放热反应 ___________________.
(3)将生石灰加到足量的水中,充分溶解后,所得溶液中的溶质是______,溶剂是_____.
19.从括号中选取适当的词语,填在下列横线上(蒸发、分解、溶解、过滤、结晶)
(1)将蔗糖放入水中搅拌,蔗糖固体会___________.
(2)将氯化钾溶液中混有的少量二氧化锰分离出来用_________方法.
(3)从食盐水中得到食盐晶体,用_________方法.
(4)将热的硫酸铜溶液静置并慢慢降温,得到硫酸铜晶体的过程是__________过程.
20.化学中有许多概念既是对立的,又是统一的.下图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.
(1)从下图可以看出,饱和溶液与浓溶液、稀溶液的关系是____________________.
(2)0.9%的医用生理盐水可归于上图中________区域(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是_________或_________________.
(3)生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19 g·cm-3)_________mL(计算结果保留小数点后一位).
21.下表为NH4C1、NaC1、KNO3在不同温度下的溶解度,根据表中数据,回答有关问题。
(1)写出NH4C1和NaCl具有相同溶解度的温度范围 (限相邻两个温度之间): 。
(2)50℃时,50 g水中溶解 g的NaCl即成该温度下NaCl的饱和溶液。此温度时,向100 g水中加入90 g硝酸钾,充分溶解后,得到硝酸钾溶液 g。
(3) 60℃时,配制硝酸钾溶液的溶质质量分数最大为 。
22.根据下面的溶解度表与溶解度曲线回答下列问题:
(1)B是 的溶解度曲线。
(2)40℃时,氯化钠的溶解度 (填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是 。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 。
(5)如右图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是 (填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
23.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)硬水是指含有较多 的水,在生活中常采用 的方法降低水的硬度。
(2) NaC1、KNO3两种物质的溶解度曲线如图甲所示。
在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是 (填字母,下同),在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是 。
A.大于 B.小于 C.等于 D.无法确定
(3)不同温度下,氧气的溶解度随压强的变化如图乙所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40℃ C.无法确定
(4)若用溶质质量分数为16%的NaCl溶液和蒸馏水配制100 g溶质质量分数为l0%的NaCl溶液,则所需16%的NaCl溶液与蒸馏水的质量之比为 。
三、实验探究题(共26分)
24.(11分)小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如下图。
试回答下列问题:
(1)写出图中有标号仪器的名称:a ,b 。
(2)图示实验中有一处明显的错误是 ;图示实验中玻璃棒的作用是 。
(3)小刚同学要配制90 g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为 g,需要量取水的体积为 mL(水的密度近似为1g·cm-3)。
(4)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量 (填“大于”或“小于”)配制溶液所需的质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数 (填“偏大” “偏小”或“不变”)。
25.(9分)小玉帮助老师配制KNO3的饱和溶液,以备全班实验使用。此时实验室温度为25 ℃,老师提供的药品是含有少量NaCl的KNO3固体。
(1)他查阅了两种物质的溶解度曲线,如图甲所示。25℃时,KNO3的溶解度是 g,经分析KNO3中混有少量NaCl的的提纯方法是 ,用此方法获得了足量KNO3固体。
(2)小玉在25℃下配制700 g KNO3饱和溶液的过程如下:
①计算;
②称量:准确称量KNO3固体 g;
③量取:用 (填“100 mL”“500 mL”或 “ 1 000 Ml”)量筒量取蒸馏水,操作如图2所示;
④溶解:将KNO3和水分别加入大烧杯中,搅拌使固体完全溶解。
请指出小玉在配制溶液过程中的操作错误: 。由于以上错误操作他配得的不是KNO3饱和溶液,要得到该温度下的饱和溶液,他可能采用的方法是 。最后小玉将配得的饱和溶液装瓶,贴上标签备用。
26.(6分)食盐(氯化钠)是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号).
(2)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到 等仪器.该操作中出现大量晶体析出,应停止加热,用余热蒸发余水,并继续用玻璃棒搅拌,目的是 .
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
四、计算题(共9分)
27.某化学研究小组对当地的石灰石样品进行了研究.进行下列实验:取4份质量不同的石灰石样品,分别与27.0 g相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质既不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示.
实验序号 石灰石样品的质量/g 稀盐酸的质量/g 剩余固体的质量/g
1 1.0 27.0 0.1
2 2.0 27.0 0.2
3 3.0 27.0 0.3
4 4.0 27.0 1.3
试计算:
(1)石灰石样品中碳酸钙的质量分数.(2)所用稀盐酸中溶质的质量分数.
参考答案
1.C 2.C 3.D 4.D 5.B 6.C 7.C 8.C 9.B 10.B 11.B 12.B
13.A 14.A 15.C 16.C
17.①NaCl ②KMnO4 ③HCl ④FeCl2
18.(1)CaO+H2O===Ca(OH)2 (2)放热反应 (3)Ca(OH)2 H2O
19.(1)溶解 (2)过滤 (3)蒸发 (4)结晶
20.(1)饱和溶液既可能是浓溶液,也可能是稀溶液 (2)Ⅲ 加入NaCl固体至不再继续溶解 蒸发溶剂至刚好有晶体析出 (3)1105.7
21.(1)10 ~20℃ (2)18.5 185.5 (3)52.4%
22.(1)NaCl(或食盐) (2)小于 (3)(重)结晶(或冷却热饱和溶液法) (4)加KNO3(固体)(或蒸发水分或降低温度) (5)B
23.(1)可溶性钙、镁化合物 煮沸 (2)C D (3)A (4)5:3
24. (1)药匙 烧杯 (2)试剂瓶塞正放 搅拌 加速溶解(3)9 81 (4)小于 偏大
25. (1)40 冷却热饱和溶液(或降温结晶) (2)② 200 ③500 mL,仰视读取水的体积 (其他合理表述均可) 蒸发水(溶剂)
26.(1)D (2)蒸发皿 防止精盐飞溅,造成损失(3)ABD
27.解:(1)石灰石样品中碳酸钙的质量分数为
(2)与27.0 g稀盐酸恰好完全反应的CaCO3的质量为:4.0 g-1.3 g=2.7 g
设稀盐酸中溶质的质量分数为x
CaCO3+2HCl===CaCl2+CO2 ↑+H2O
100 73
2.7g x×27 g
x=7.3%
答:(1)石灰石样品中碳酸钙的质量分数为90%;
(2)稀盐酸中溶质的质量分数为7.3%.
4
可能用到的相对原子质量:Ca—40 C—12 O—16 H—1 Cl—35.5
一、选择题(本题包括16小题,每小题只有一个正确答案,每小题2分,共32分)
1.把少量下列物质分别放入水中,充分搅拌,可以形成溶液的是( )
A. 碘 B. 汽油 C. 高锰酸钾 D. 面粉
2.人们在高山上煮鸡蛋时,常在水中加.一些食盐以使鸡赁快些煮熟,这是由于固体溶于水,可以使溶液 ( )
A.密度变大 B.凝固点下降 C.沸点升高 D.沸点降低
3.能证实A物质的溶液是20℃时的饱和溶液的事实是 ( )
A.降温到10℃有A晶体析出
B.蒸发掉10 g水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20 ℃时.向上述溶液中加入少量A晶体,溶液质量不变
4.由固体溶解度曲线可知 ( )
A.在任何温度下溶质溶饼的质量 B.能溶解溶质的物质
C.溶解溶质所需溶剂的质量 D.溶质溶解度随温度变化的情况
5.利用海水晒盐的原理是 ( )
A.日晒可使氯化钠蒸发 B.日晒可使水分蒸发
C.日晒可使海水分解 D.日晒可使氯化钠的溶解使变小
6.把400克质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水 ( )
A.100克 B.200克 C.400克 D.800克
7.20℃时食盐的溶解度是36 g,则20℃时食盐的不饱和溶液中溶质的质量分数可能是( )
A.36% B.27% C.10% D.30%
8.将浓度为38%、密度为1.19 g·cm-3的浓盐酸稀释成10%的稀盐酸,需用到 ( )
A.托盘天平、烧杯、玻璃捧、量筒 B.量筒、漏斗、烧杯、胶头滴管
C.量简、烧杯、玻璃棒、胶头滴管 D.量筒、托盘天平、烧杯、玻璃棒
9.下列各组物质,只用结晶法即可分离的是 ( )
A.酒精和水 B.KNO3和NaCl C.MnO2和KCl D.CaCO3和河沙
10.现有a、b两种物质在室温下的饱和溶液,升高温度后,a溶液有晶体析出,而b溶液还可以再溶解b晶体.则能正确表示a、b两种物质溶解度曲线的是 ( )
11.新鲜的冬瓜内盛有5%的NaCl溶液,现将一木块放入这种溶液中,木块处于漂浮状态,木块露出水面部分高h(如图所示),问过一天后的h值与原来相比(不考虑水的蒸发)( )
A.变大 B.变小 C.不变 D.不能确定
12.根据如图所示,下列判断不正确的是 ( )
A.乳化剂有乳化作用,它能使油脂以小液滴形式分散到水中
B.洗涤剂可洗去餐具上的油污是因为洗涤剂可以溶解油污
C.乳化是物理变化
D.用植物油可以鉴别水和汽油
13.下表列出了20℃时NaCl溶解实验的一组数据,下列叙述正确的是 ( )
实验序号 水的质量/g 所加NaCl的质量/g 所得溶液的质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①②所得溶液是20℃时NaCl的不饱和溶液
B.①②③所得溶液是20℃时NaCl的不饱和溶液
C.20℃时NaCl的溶解度为3.6 g
D.①所得溶液的溶质质量分数为20%
14.如图是a、b两种物质的溶解度曲线.室温时,将盛有a、b饱和溶液的试管分别放入烧杯内的水中,均无晶体析出.当向烧杯内的水中加入硝酸铵固体或浓硫酸后,试管内所示现象正确的是 ( )
15.70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是 ( )
16.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是( )
A.图丙中M表示b的溶解度曲线 B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液 D. 30℃时a、b溶液溶质质量分数不相等
二、填空题(化学方程式2分,其余每空1分,共33分)
17.写出下表中溶质的化学式
编号 溶液 溶质化学式
① 0.9%的氯化钠注射液(俗称生理盐水)
② 医疗消毒用高锰酸钾溶液(俗称紫药水)
③ 稀盐酸
④ 铁和稀盐酸恰好完全反应后的溶液
18.建筑工地上,我们常看到刚买来的生石灰加水时热气腾腾,这是因为生石灰加水“煮”成了熟石灰的缘故.试回答:
(1)写出生石灰加水“煮”成了熟石灰的化学方程式:________________________.
(2)这个反应是吸热反应还是放热反应 ___________________.
(3)将生石灰加到足量的水中,充分溶解后,所得溶液中的溶质是______,溶剂是_____.
19.从括号中选取适当的词语,填在下列横线上(蒸发、分解、溶解、过滤、结晶)
(1)将蔗糖放入水中搅拌,蔗糖固体会___________.
(2)将氯化钾溶液中混有的少量二氧化锰分离出来用_________方法.
(3)从食盐水中得到食盐晶体,用_________方法.
(4)将热的硫酸铜溶液静置并慢慢降温,得到硫酸铜晶体的过程是__________过程.
20.化学中有许多概念既是对立的,又是统一的.下图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.
(1)从下图可以看出,饱和溶液与浓溶液、稀溶液的关系是____________________.
(2)0.9%的医用生理盐水可归于上图中________区域(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是_________或_________________.
(3)生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19 g·cm-3)_________mL(计算结果保留小数点后一位).
21.下表为NH4C1、NaC1、KNO3在不同温度下的溶解度,根据表中数据,回答有关问题。
(1)写出NH4C1和NaCl具有相同溶解度的温度范围 (限相邻两个温度之间): 。
(2)50℃时,50 g水中溶解 g的NaCl即成该温度下NaCl的饱和溶液。此温度时,向100 g水中加入90 g硝酸钾,充分溶解后,得到硝酸钾溶液 g。
(3) 60℃时,配制硝酸钾溶液的溶质质量分数最大为 。
22.根据下面的溶解度表与溶解度曲线回答下列问题:
(1)B是 的溶解度曲线。
(2)40℃时,氯化钠的溶解度 (填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是 。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 。
(5)如右图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是 (填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
23.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)硬水是指含有较多 的水,在生活中常采用 的方法降低水的硬度。
(2) NaC1、KNO3两种物质的溶解度曲线如图甲所示。
在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是 (填字母,下同),在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是 。
A.大于 B.小于 C.等于 D.无法确定
(3)不同温度下,氧气的溶解度随压强的变化如图乙所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40℃ C.无法确定
(4)若用溶质质量分数为16%的NaCl溶液和蒸馏水配制100 g溶质质量分数为l0%的NaCl溶液,则所需16%的NaCl溶液与蒸馏水的质量之比为 。
三、实验探究题(共26分)
24.(11分)小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如下图。
试回答下列问题:
(1)写出图中有标号仪器的名称:a ,b 。
(2)图示实验中有一处明显的错误是 ;图示实验中玻璃棒的作用是 。
(3)小刚同学要配制90 g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为 g,需要量取水的体积为 mL(水的密度近似为1g·cm-3)。
(4)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量 (填“大于”或“小于”)配制溶液所需的质量。在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数 (填“偏大” “偏小”或“不变”)。
25.(9分)小玉帮助老师配制KNO3的饱和溶液,以备全班实验使用。此时实验室温度为25 ℃,老师提供的药品是含有少量NaCl的KNO3固体。
(1)他查阅了两种物质的溶解度曲线,如图甲所示。25℃时,KNO3的溶解度是 g,经分析KNO3中混有少量NaCl的的提纯方法是 ,用此方法获得了足量KNO3固体。
(2)小玉在25℃下配制700 g KNO3饱和溶液的过程如下:
①计算;
②称量:准确称量KNO3固体 g;
③量取:用 (填“100 mL”“500 mL”或 “ 1 000 Ml”)量筒量取蒸馏水,操作如图2所示;
④溶解:将KNO3和水分别加入大烧杯中,搅拌使固体完全溶解。
请指出小玉在配制溶液过程中的操作错误: 。由于以上错误操作他配得的不是KNO3饱和溶液,要得到该温度下的饱和溶液,他可能采用的方法是 。最后小玉将配得的饱和溶液装瓶,贴上标签备用。
26.(6分)食盐(氯化钠)是生活必需品,也是重要的化工原料.提纯含少量泥沙的粗盐,一般经过以下操作流程:
(1)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 (填序号).
(2)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到 等仪器.该操作中出现大量晶体析出,应停止加热,用余热蒸发余水,并继续用玻璃棒搅拌,目的是 .
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 (填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
四、计算题(共9分)
27.某化学研究小组对当地的石灰石样品进行了研究.进行下列实验:取4份质量不同的石灰石样品,分别与27.0 g相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质既不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量.剩余固体的质量与所取样品质量的关系如下表所示.
实验序号 石灰石样品的质量/g 稀盐酸的质量/g 剩余固体的质量/g
1 1.0 27.0 0.1
2 2.0 27.0 0.2
3 3.0 27.0 0.3
4 4.0 27.0 1.3
试计算:
(1)石灰石样品中碳酸钙的质量分数.(2)所用稀盐酸中溶质的质量分数.
参考答案
1.C 2.C 3.D 4.D 5.B 6.C 7.C 8.C 9.B 10.B 11.B 12.B
13.A 14.A 15.C 16.C
17.①NaCl ②KMnO4 ③HCl ④FeCl2
18.(1)CaO+H2O===Ca(OH)2 (2)放热反应 (3)Ca(OH)2 H2O
19.(1)溶解 (2)过滤 (3)蒸发 (4)结晶
20.(1)饱和溶液既可能是浓溶液,也可能是稀溶液 (2)Ⅲ 加入NaCl固体至不再继续溶解 蒸发溶剂至刚好有晶体析出 (3)1105.7
21.(1)10 ~20℃ (2)18.5 185.5 (3)52.4%
22.(1)NaCl(或食盐) (2)小于 (3)(重)结晶(或冷却热饱和溶液法) (4)加KNO3(固体)(或蒸发水分或降低温度) (5)B
23.(1)可溶性钙、镁化合物 煮沸 (2)C D (3)A (4)5:3
24. (1)药匙 烧杯 (2)试剂瓶塞正放 搅拌 加速溶解(3)9 81 (4)小于 偏大
25. (1)40 冷却热饱和溶液(或降温结晶) (2)② 200 ③500 mL,仰视读取水的体积 (其他合理表述均可) 蒸发水(溶剂)
26.(1)D (2)蒸发皿 防止精盐飞溅,造成损失(3)ABD
27.解:(1)石灰石样品中碳酸钙的质量分数为
(2)与27.0 g稀盐酸恰好完全反应的CaCO3的质量为:4.0 g-1.3 g=2.7 g
设稀盐酸中溶质的质量分数为x
CaCO3+2HCl===CaCl2+CO2 ↑+H2O
100 73
2.7g x×27 g
x=7.3%
答:(1)石灰石样品中碳酸钙的质量分数为90%;
(2)稀盐酸中溶质的质量分数为7.3%.
4
同课章节目录
