【名师导航】中考化学一轮复习学案 :第二章 物质的变化 第6讲质量守恒定律和化学方程式
文档属性
| 名称 | 【名师导航】中考化学一轮复习学案 :第二章 物质的变化 第6讲质量守恒定律和化学方程式 |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 17:35:29 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
【名师导航】中考化学一轮复习学案
第二章 物质变化
第6讲 质量守恒定律和化学方程式
考点分布 考察频率 考点内容 命题趋势
1.质量守恒定律 ★★★★★ 1.质量守恒定律的内容、验证和应用 2.化学方程式的书写和意义 3.四大基本反应类型、氧化反应的特征和判断 对质量守恒定律和反应类型的考察多出现在选择题中和填空题中。化学方程式的书写通常出现在填空题中。
2.化学方程式 ★★★★★
3.化学反应类型 ★★★★
一、质量守恒定律
1.内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【特别提醒】①质量守恒定律只适用于化学变化,而不能解释物理变化。
②质量守恒定律只强调“质量守恒”,不包括分子个数、体积等方面的守恒;
③“质量守恒”指参加化学反应的各物质的质量总和与生成的各物质的质量总和相等,不包括未参加反应的物质的质量,也不包括杂质。
2.微观解释
化学反应前后,原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以化学反应前后各物质的质量总和必然相等。
对质量守恒定律的理解,可归纳为“六个不变,两个一定变和两个可能变”。
宏观 微观
一定不变 反应物、生成物总质量 原子的种类、数目和质量
元素的种类和质量
一定改变 物质的种类 分子的种类
可能改变 元素的化合价 分子的数目
3.应用
(1)判断反应物或生成物的元素组成;
(2)推断化学方程式中某物质的化学式;
(3)解释反应前后质量的变化或用质量差确定某一物质的质量;
(4)书写化学方程式或判断正误。
4.质量守恒定律的验证
(1)实验原则:必须发生化学变化,且现象明显;有气体参与或生成的反应必须在密闭容器中进行。
(2)实验方案设计
装置
原理 Fe+CuSO4=Cu+FeSO4
现象 红磷燃烧,产生大量白烟,放出热量,气球先膨胀后收缩,天平平衡 铁钉表面有红色物质析出,溶液由蓝色变为浅绿色,天平平衡
分析 m反应前=m反应后
结论 参加反应的各物质的质量总和等于反应后生成的各物质的质量总和
二、化学方程式
1.定义:用化学式来表示化学反应的式子。
2.意义
(1)宏观:表示反应物、生成物以及反应条件
(2)微观:表示反应物、生成物之间的粒子个数比
(3)质量:表示反应物、生成物之间的质量比
【注意】①反应中的“粒子个数”,即化学方程式中化学式前面的化学计量数;②计算反应中的“质量关系”时,要乘以化学式前面的化学计量数。
3.书写原则:以客观事实为依据,遵守质量守恒定律。
4.书写步骤
①写:写出反应物和生成物的化学式
②配:配平化学方程式,使等号两边各元素原子个数相等
③注:注明反应条件,注明生成物状态,将短线改为等号
④查:化学式是否正确;是否配平,反应条件、生成物状态是否标注,是否恰当。
【注意】①若反应物中无气体,生成物中有气体时,需用“↑”标出;
②在溶液中进行的反应,若反应物中没有不溶性固体,生成物中有不溶性固体则用“↓”符号标明。
三、化学反应类型
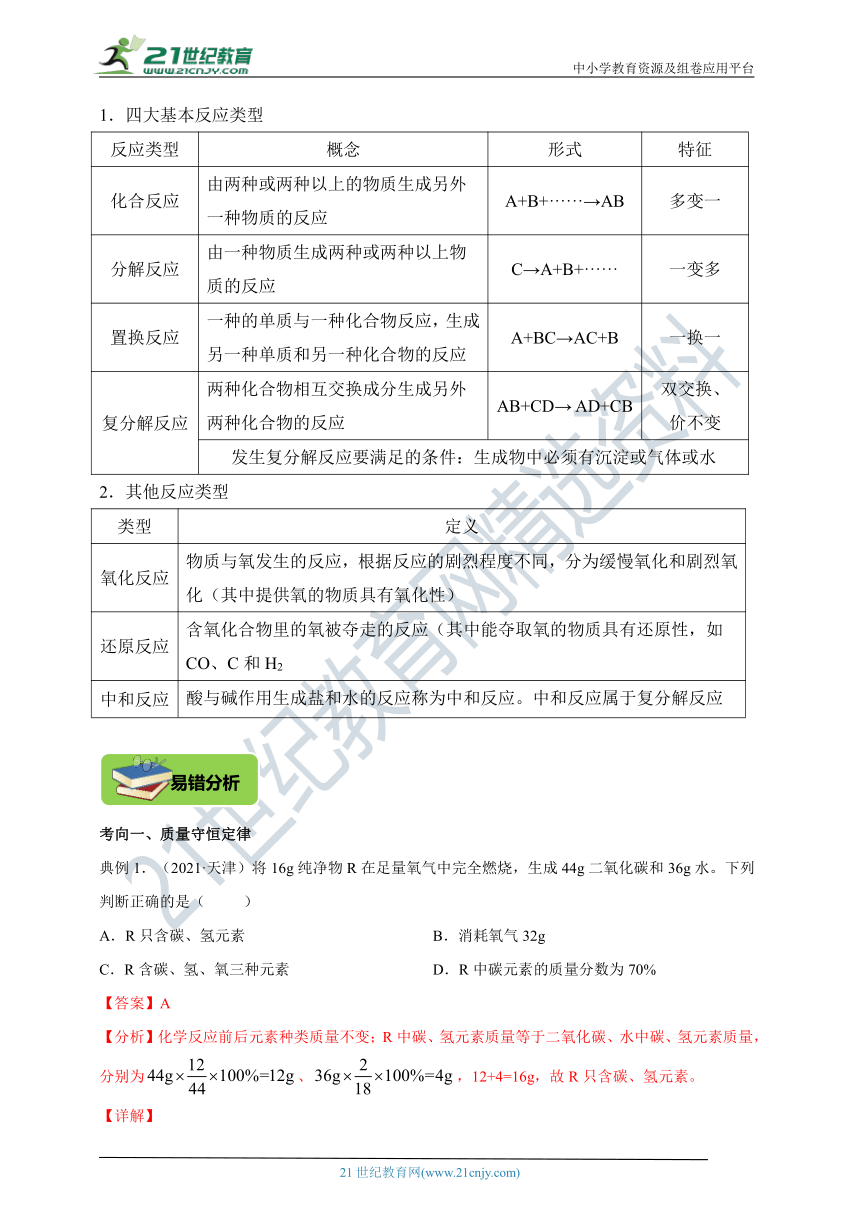
1.四大基本反应类型
反应类型 概念 形式 特征
化合反应 由两种或两种以上的物质生成另外一种物质的反应 A+B+······→AB 多变一
分解反应 由一种物质生成两种或两种以上物质的反应 C→A+B+······ 一变多
置换反应 一种的单质与一种化合物反应,生成另一种单质和另一种化合物的反应 A+BC→AC+B 一换一
复分解反应 两种化合物相互交换成分生成另外两种化合物的反应 AB+CD→ AD+CB 双交换、 价不变
发生复分解反应要满足的条件:生成物中必须有沉淀或气体或水
2.其他反应类型
类型 定义
氧化反应 物质与氧发生的反应,根据反应的剧烈程度不同,分为缓慢氧化和剧烈氧化(其中提供氧的物质具有氧化性)
还原反应 含氧化合物里的氧被夺走的反应(其中能夺取氧的物质具有还原性,如CO、C和H2
中和反应 酸与碱作用生成盐和水的反应称为中和反应。中和反应属于复分解反应
考向一、质量守恒定律
典例1.(2021·天津)将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
A.R只含碳、氢元素 B.消耗氧气32g
C.R含碳、氢、氧三种元素 D.R中碳元素的质量分数为70%
【答案】A
【分析】化学反应前后元素种类质量不变;R中碳、氢元素质量等于二氧化碳、水中碳、氢元素质量,分别为、,12+4=16g,故R只含碳、氢元素。
【详解】
A. R只含碳、氢元素,正确;
B. 根据质量守恒定律,消耗氧气为44+36-16=64g,错误;
C. R含碳、氢、氧三种元素,错误;
D. R中碳元素的质量分数为,错误。
考向二、化学方程式
典例2.(2021·湖北黄石)下列反应的化学方程式书写正确的是( )
A.高炉炼铁:
B.盐酸除铁锈:
C.小苏打治疗胃酸过多:
D.铝制品耐腐蚀:
【答案】A
【详解】
A、高炉炼铁:,A正确。
B、铁锈主要成分是氧化铁,化学方程式,B错误。
C、小苏打是碳酸氢钠,化学方程式,C错误。
D、铝和氧气反应生成氧化铝,,D错误。
考向三、化学反应类型
典例3.(2021·山东济宁)下列化学方程式的书写和对反应类型的判断,都正确的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
【答案】A
【详解】
A、该化学方程式中化学式书写、配平等都正确,该反应反应物是两种,生成物是一种,符合“多变一”的特征,属于化合反应,符合题意;
B、该化学方程式没有配平,化学方程式书写不正确,但反应物是一种,生成物是两种,符合“一变多”的特征,属于分解反应,反应类型判断正确,不符合题意;
C、该化学方程式书写正确,但反应物是两种化合物,不属于置换反应,反应类型判断错误,不符合题意;
D、假设氯化钾和硝酸“互相交换成分”,得到的是硝酸钾和盐酸,因为没有沉淀、气体或水生成,不符合复分解反应发生的条件,所以不能发生反应,该化学方程式是错误的。不能发生的反应也无反应类型可言,不符合题意。故选A。
1.(2021·湖北随州)化学学习常用化学思维去认识和理解世界,下列说法错误的个数有( )
物质 甲 乙 丙 丁
反应前质量/g 10 5 12 20
反应后质量/g 8 5 30 x
(1)反应中甲和丙的质量比为1:8
(2)x=4
(3)该反应为化合反应
(4)乙可能是催化剂
(5)若甲与丁的化学计量数之比为2:3;则其相对分子质量之比为3:16。
A.1个 B.2个 C.3个 D.4个
2.(2021·湖南湘潭)将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 1 10 27 4
反应后质量/g 1 a 0 23
A.a的值是8 B.甲物质一定是该反应的催化剂
C.该反应属于分解反应 D.反应过程中乙、丁的质量比是5:2
3.(2021·湖南湘潭)根据如下微观示意图分析,下列结论正确的是( )
A.反应前后原子种类不变 B.丙物质的相对分子质量是18g
C.参加反应的甲与乙分子个数比为1:1 D.反应前后各元素的化合价均不变
4.(2021·湖北荆州)物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
5.(2021·湖南株洲)下图是某反应前后的微观示意图,“”和“”表示两种不同元素的原子。下列有关说法正确的是( )
A.该反应没有单质生成 B.该反应属于复分解反应
C.该反应中,原子个数发生了改变 D.参加反应的两种分子(和)的个数比为1:1
6.(2021·湖南怀化)已知某纯净物2.3g在足量的氧气中充分燃烧后,生成4.4g二氧化碳和2.7g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
7.(2021·江苏盐城)铜制品长期暴露在空气中表面生成铜锈(主要成分Cu2(OH)2CO3),下列物质与铜制品生锈无关的是( )
A.N2 B.O2 C.H2O D.CO2
8.(2021·四川成都)工业上用CH4和CO2制取合成气会产生积碳,如图是抗积碳示意图。有关说法错误的是( )
A.Ni基双金属催化剂可重复使用
B.反应前后元素的化合价均改变
C.反应前后原子种类和数目不变
D.合成气可合成多种化工产品,价值大
9.(2021·山东潍坊)在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:丙的质量为5g,丁的质量为3g),充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应 B.丙一定是催化剂
C.反应后丁的质量为8g D.反应生成的乙和丁的质量比为1∶1
10.(2021·重庆)2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是( )
A.属于置换反应 B.反应前后原子种类改变
C.反应中涉及2种氧化物 D.参加反应的反应物分子个数比为1:1
11.(2021·湖南湘潭)石笋和钟乳石的形成蕴含许多化学原理,其反应之一为: 则X的化学式为( )
A.CaCO3 B.Ca(OH)2 C.CaO D.CaH2
12.(2021·四川广安)下列化学方程式书写完全正确的是( )
A. B.
C. D.
13.(2021·河北)利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2X+H2O,X的化学式为( )
A.CO B.CH4 C.CH3OH D.C2H5OH
14.(2021·湖南永州)工业法生产硝酸的一个中间反应可用微观模型表示如下,下列说法正确的是( )
A.该反应前后分子的数目无变化
B.该反应前后元素种类没有变化
C.该反应过程中氧气分子全部参与了反应
D.该反应的化学方程式可表示为:
15.如图表示两种物质发生的化学反应,其中相同的球代表同种原子,根据图示判断,反应类型是( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
16.(2021·四川遂宁)在宏观、微观与符号之间建立联系是化学学科的特点。天然气是广泛使用的燃料,其主要成分还可能发生的化学反应微观示意图如下:
(1)写出乙物质的化学式___________。
(2)请写出工业上用丙物质从赤铁矿中冶炼铁的反应化学方程式___________。
17.(2021·湖北恩施土家族苗族自治州·)“宏微结合”是化学学科核心素养之一。某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示。
物质序号 微观示意图 反应前质量/g 反应后质量/g
甲 16 0
乙 100 x
丙 1 45
丁 0 y
(1)由构成的物质中,所代表的元素的化合价为______。
(2)表中的四种物质,属于有机物的是______(填化学式)。
(3)上述反应的化学方程式为_____________________________________。
(4)某同学在计算反应物和生成物之间的质量关系时,可得出x+y=______。
18.(2021·四川南充)碱性甲烷燃料电池具有低污染、高效率等特点,是一种很有前途的能源利用方式。电池总反应方程式为 ,则X的化学式为______。
19.(2021·四川南充)在农业生产中,改良酸性土壤(硫酸型酸雨所致),通常加入______,以中和其酸性,反应的化学方程式为_________________,该反应属于______________(填基本反应类型)。
20.(2021·湖北荆州)我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:,则X的化学式为__________,B(OH)3中B的化合价为_________。
(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为________________________________。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图所示:该反应的化学方程式为___________________________________________________。
答案解析部分
1.D
【解析】(1)反应中甲和丙的质量比为(10-8):(30-12)=1:9,错误;
(2)根据质量守恒定律,10+5+12+20=8+5+30+x,x=4,正确;
(3)该反应中甲、丁质量减少为反应物,丙质量增加为生成物,反应符合多变一特点,为化合反应,正确;
(4)乙质量反应前后不变,可能不参与反应、可能是催化剂,正确;
(5)反应的甲与丁质量比为(10-8):(20-4)=1:8;若甲与丁的化学计量数之比为2:3;设甲、丁相对分子质量分别为a、b,则有=,解得=,正确。
2.C
【解析】根据表格信息可知,丙从27g变成0g,是反应物,丁从4g增加到23g,是生成物,由于反应前后物质的质量是守恒的,所以推算出乙的质量应该是27g-19g=8g,写出该反应的方程式为:丙→丁+乙。
A、因为生成乙的质量为8g,所以a应该是8+10=18,故A不符合题意;
B、甲反应前后质量不变,可能是催化剂,也可能是不参与反应的杂质,故B不符合题意;
C、该反应由一种物质生成两种物质,是分解反应,故C符合题意;
D、反应中乙生成了8g,丁生成了19g,所以质量比为8:19,故D不符合题意。
3.A
【解析】A、由图可知,反应前后原子种类数目不变,A正确。
B、相对分子质量单位是“1”不是“g”,B错误。
C、由微观示意图可知,反应化学方程式2C2H6+7O24CO2+6H2O,故参加反应的甲与乙分子个数比为2:7,C错误。
D、反应前氧气为单质,氧元素0价,反应后氧元素-2价,化合价改变,D错误。
4.D
【解析】A、根据生成物中有硫酸钡生成,故X中一定含有硫酸根,该说法错误;
B、反应生成硫酸钡,X可以为硫酸也可以是可硫酸钠、硫酸钾等化合物,故该说法错误;
C、因为生成的Y为可溶性物质,而氢氧化铜在水中不溶解,则不可能为氢氧化铜,故说法错误;
D、若X是硫酸,则生成的Y为水,若X是硫酸钠、硫酸钾等化合物,则生成的Y是碱,故Y不一定是水,说法正确
5.A
【解析】A、反应后增加的是生成物,减少的是反应物,由图可知,反应后没有单质生成,A正确。
B、反应后增加的是生成物,减少的是反应物,由图可知,生成物只有一种,不属于复分解反应,B错误。
C、由图可知,该反应中,原子个数没有发生改变,C错误。
D、反应后增加的是生成物,减少的是反应物,参加反应的两种分子(和 )的个数比为2:1,D错误。
6.B
【解析】已知某纯净物2.3g在足量的氧气中充分燃烧后,生成4.4g二氧化碳和2.7g水。根据质量守恒定律,化学反应前后,元素的种类和质量不变,故该纯净物中一定含C、H元素,碳元素的质量为:,氢元素的质量为: ,1.2g+0.3g=1.5g<2.3g,故该纯净物中一定含氧元素。
7.A
【解析】表面生成铜锈主要成分Cu2(OH)2CO3,由Cu、O、H、C元素组成,不含氮元素,故与铜制品生锈无关的是氮气
8.B
【解析】A、Ni基双金属在反应中作为催化剂,催化剂在反应前后质量和化学性质不发生变化,可重复使用,正确;
B、该反应为,反应后碳元素的化合价有+4价变为+2价,氧元素的化合价在反应前后都是-2价,未发生变化,氢元素的化合价由+1价变为0价,因此错误;
C、根据质量守恒定律反应前后原子种类和数目不变,正确;
D、合成气为一氧化碳和氢气混合气体,可合成多种化工产品,价值大,正确。
9.D
【解析】A、根据分析,反应中甲物质的质量减少16g,乙物质的质量增加8g,丙物质的质量没有发生变化,丁物质的质量增加8g。化学反应中反应物的质量减少,生成物的质量增加,因此该反应的反应物是甲,生成物是乙和丁,符合“一变多”的特点,属于分解反应,选项A不正确;B、该反应中丙物质的质量没有发生变化,化学反应中,质量不变的物质可能是催化剂,也可能是不参加反应的其他物质,因此丙不一定是催化剂,选项B不正确;
C、反应中生成丁的质量为8g,反应前丁的质量为3g,因此反应后丁的质量为11g,选项C不正确;
D、该反应中生成的乙和丁质量都是8g,因此反应生成的乙和丁的质量比为:8g∶8g=1∶1,选项D正确。
10.B
【解析】由图可知,该反应为二氧化碳和水在催化剂和光照的作用下反应生成甲烷和氧气,该反应的化学方程式为:
A、该反应的反应物都是化合物,不属于置换反应,不符合题意;
B、根据质量守恒定律,化学反应前后,原子的种类和数目不变,不符合题意;
C、二氧化碳是由C、O元素组成的化合物,属于氧化物,水是由H、O元素组成的化合物,属于氧化物,甲烷是由C、H元素组成的化合物,不属于氧化物,氧气是由氧元素组成的纯净物,属于单质,共涉及2种氧化物,符合题意;
D、由化学方程式可知,参加反应的反应物的分子个数比为:1:2,不符合题意。
11.A
【解析】根据质量守恒,反应前后原子个数不变,反应前碳原子为1个,氢原子为2个,氧原子为3个,反应后钙原子为1个,氢原子为2个,碳原子为2个,氧原子为6个,所以左侧少了1个钙原子,1个碳原子,3个氧原子,所以化学式为CaCO3。
12.C
【解析】A、铁在氧气中燃烧生成四氧化三铁,该反应的化学方程式为:,不符合题意;
B、铁和稀盐酸反应生成氯化亚铁和氢气,该反应的化学方程式为:,不符合题意;
C、氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:,符合题意;
D、铝和硫酸铜反应生成硫酸铝和铜,该反应的化学方程式为:,不符合题意。
13.C
【解析】根据质量守恒定律,反应前后原子的种类、数目不变,反应前C、H、O的原子个数分别为1、6、2,反应后C、H、O的原子个数分别为0、2、1,所以1个X分子中含有1个碳原子、4个氢原子和1个氧原子,X的化学式为CH3OH。
14.B
【解析】由图示可知,一氧化氮和氧气反应生成二氧化氮,反应为;
A. 该反应前后分子的数目发生改变,错误;
B. 该反应前后元素种类没有变化,正确;
C. 该反应过程中氧气分子没有全部参与反应,错误
D. 该反应的化学方程式可表示为:,错误。
15.D
【解析】由分子结构模型可知,反应前有两种分子,其中一种分子是由同种原子构成的,该物质属于单质,另一种是由不同种原子构成的,该物质属于化合物;反应后生成两种新分子,其中一种是单质,另一种属于化合物,因此该反应属于置换反应。
16.H2O
【解析】(1)化学反应前后原子中了数目不变,反应后碳、氧、氢原子数目分别为1、1、6,反应前碳、氧、氢原子数目分别为1、0、4,故乙物质的化学式为H2O。
(2)丙物质是一氧化碳,赤铁矿的主要成分是氧化铁, 一氧化碳在高温下和氧化铁反应生成二氧化碳和铁。
17.0价 CH4 CH4+2O2CO2+2H2O 72
【解析】(1)构成的物质属于单质,单质中元素化合价为0价,故填:0价。
(2)含碳元素的化合物,属于有机物,CH4、CO2含碳元素,但是CO2化学性质和无机物非常接近,我们称之为无机物,故填:CH4。
(3)甲质量减少是反应物,丙质量增加是生成物,根据质量守恒反应前后元素种类不变,为了维持反应前后都有氧元素,反应物中一定有氧气,为了维持反应前后都有氢元素,生成物中一定有水,甲烷和氧气生成二氧化碳和水,化学方程式CH4+2O2CO2+2H2O,故填:CH4+2O2CO2+2H2O。
(4)根据质量守恒,反应前后物质总质量不变,故16+100+1=x+45+y,x+y=72,故填:72。
18.H2O
【解析】化学反应前后原子种类数目不变;反应前碳、氢、氧、钾原子数目分别为1、6、6、2,反应后碳、氢、氧、钾原子数目分别为1、0、3、2,3个X分子中含6个氢原子和3氧原子,则X的化学式为H2O。
19.熟石灰 复分解反应
【解析】氢氧化钙显弱碱性,能和酸反应,在农业生产中,改良酸性土壤(硫酸型酸雨所致),通常加入熟石灰氢氧化钙,以中和其酸性;硫酸和氢氧化钙反应生成硫酸钙和水,反应的化学方程式为,该反应是两种化合物交换成分生成另外两种化合物的反应,属于复分解反应。
20.H2O +3
【解析】(1)化学反应前后原子种类数目 不变;反应后硼、氧、氢原子数目分别为2、6、12,反应前硼、氧、氢原子数目分别为2、0、0,故X的化学式为H2O;B(OH)3中氢氧根化合价为负一价,设硼元素化合价为x,化合物中正负化合价代数和为零;则x +(-1)×3=0,x=+3。
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水:。
(3)由图示可知,氢气和二氧化碳在催化剂作用下生成水和CH4O,方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
【名师导航】中考化学一轮复习学案
第二章 物质变化
第6讲 质量守恒定律和化学方程式
考点分布 考察频率 考点内容 命题趋势
1.质量守恒定律 ★★★★★ 1.质量守恒定律的内容、验证和应用 2.化学方程式的书写和意义 3.四大基本反应类型、氧化反应的特征和判断 对质量守恒定律和反应类型的考察多出现在选择题中和填空题中。化学方程式的书写通常出现在填空题中。
2.化学方程式 ★★★★★
3.化学反应类型 ★★★★
一、质量守恒定律
1.内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【特别提醒】①质量守恒定律只适用于化学变化,而不能解释物理变化。
②质量守恒定律只强调“质量守恒”,不包括分子个数、体积等方面的守恒;
③“质量守恒”指参加化学反应的各物质的质量总和与生成的各物质的质量总和相等,不包括未参加反应的物质的质量,也不包括杂质。
2.微观解释
化学反应前后,原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。所以化学反应前后各物质的质量总和必然相等。
对质量守恒定律的理解,可归纳为“六个不变,两个一定变和两个可能变”。
宏观 微观
一定不变 反应物、生成物总质量 原子的种类、数目和质量
元素的种类和质量
一定改变 物质的种类 分子的种类
可能改变 元素的化合价 分子的数目
3.应用
(1)判断反应物或生成物的元素组成;
(2)推断化学方程式中某物质的化学式;
(3)解释反应前后质量的变化或用质量差确定某一物质的质量;
(4)书写化学方程式或判断正误。
4.质量守恒定律的验证
(1)实验原则:必须发生化学变化,且现象明显;有气体参与或生成的反应必须在密闭容器中进行。
(2)实验方案设计
装置
原理 Fe+CuSO4=Cu+FeSO4
现象 红磷燃烧,产生大量白烟,放出热量,气球先膨胀后收缩,天平平衡 铁钉表面有红色物质析出,溶液由蓝色变为浅绿色,天平平衡
分析 m反应前=m反应后
结论 参加反应的各物质的质量总和等于反应后生成的各物质的质量总和
二、化学方程式
1.定义:用化学式来表示化学反应的式子。
2.意义
(1)宏观:表示反应物、生成物以及反应条件
(2)微观:表示反应物、生成物之间的粒子个数比
(3)质量:表示反应物、生成物之间的质量比
【注意】①反应中的“粒子个数”,即化学方程式中化学式前面的化学计量数;②计算反应中的“质量关系”时,要乘以化学式前面的化学计量数。
3.书写原则:以客观事实为依据,遵守质量守恒定律。
4.书写步骤
①写:写出反应物和生成物的化学式
②配:配平化学方程式,使等号两边各元素原子个数相等
③注:注明反应条件,注明生成物状态,将短线改为等号
④查:化学式是否正确;是否配平,反应条件、生成物状态是否标注,是否恰当。
【注意】①若反应物中无气体,生成物中有气体时,需用“↑”标出;
②在溶液中进行的反应,若反应物中没有不溶性固体,生成物中有不溶性固体则用“↓”符号标明。
三、化学反应类型
1.四大基本反应类型
反应类型 概念 形式 特征
化合反应 由两种或两种以上的物质生成另外一种物质的反应 A+B+······→AB 多变一
分解反应 由一种物质生成两种或两种以上物质的反应 C→A+B+······ 一变多
置换反应 一种的单质与一种化合物反应,生成另一种单质和另一种化合物的反应 A+BC→AC+B 一换一
复分解反应 两种化合物相互交换成分生成另外两种化合物的反应 AB+CD→ AD+CB 双交换、 价不变
发生复分解反应要满足的条件:生成物中必须有沉淀或气体或水
2.其他反应类型
类型 定义
氧化反应 物质与氧发生的反应,根据反应的剧烈程度不同,分为缓慢氧化和剧烈氧化(其中提供氧的物质具有氧化性)
还原反应 含氧化合物里的氧被夺走的反应(其中能夺取氧的物质具有还原性,如CO、C和H2
中和反应 酸与碱作用生成盐和水的反应称为中和反应。中和反应属于复分解反应
考向一、质量守恒定律
典例1.(2021·天津)将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
A.R只含碳、氢元素 B.消耗氧气32g
C.R含碳、氢、氧三种元素 D.R中碳元素的质量分数为70%
【答案】A
【分析】化学反应前后元素种类质量不变;R中碳、氢元素质量等于二氧化碳、水中碳、氢元素质量,分别为、,12+4=16g,故R只含碳、氢元素。
【详解】
A. R只含碳、氢元素,正确;
B. 根据质量守恒定律,消耗氧气为44+36-16=64g,错误;
C. R含碳、氢、氧三种元素,错误;
D. R中碳元素的质量分数为,错误。
考向二、化学方程式
典例2.(2021·湖北黄石)下列反应的化学方程式书写正确的是( )
A.高炉炼铁:
B.盐酸除铁锈:
C.小苏打治疗胃酸过多:
D.铝制品耐腐蚀:
【答案】A
【详解】
A、高炉炼铁:,A正确。
B、铁锈主要成分是氧化铁,化学方程式,B错误。
C、小苏打是碳酸氢钠,化学方程式,C错误。
D、铝和氧气反应生成氧化铝,,D错误。
考向三、化学反应类型
典例3.(2021·山东济宁)下列化学方程式的书写和对反应类型的判断,都正确的是( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
【答案】A
【详解】
A、该化学方程式中化学式书写、配平等都正确,该反应反应物是两种,生成物是一种,符合“多变一”的特征,属于化合反应,符合题意;
B、该化学方程式没有配平,化学方程式书写不正确,但反应物是一种,生成物是两种,符合“一变多”的特征,属于分解反应,反应类型判断正确,不符合题意;
C、该化学方程式书写正确,但反应物是两种化合物,不属于置换反应,反应类型判断错误,不符合题意;
D、假设氯化钾和硝酸“互相交换成分”,得到的是硝酸钾和盐酸,因为没有沉淀、气体或水生成,不符合复分解反应发生的条件,所以不能发生反应,该化学方程式是错误的。不能发生的反应也无反应类型可言,不符合题意。故选A。
1.(2021·湖北随州)化学学习常用化学思维去认识和理解世界,下列说法错误的个数有( )
物质 甲 乙 丙 丁
反应前质量/g 10 5 12 20
反应后质量/g 8 5 30 x
(1)反应中甲和丙的质量比为1:8
(2)x=4
(3)该反应为化合反应
(4)乙可能是催化剂
(5)若甲与丁的化学计量数之比为2:3;则其相对分子质量之比为3:16。
A.1个 B.2个 C.3个 D.4个
2.(2021·湖南湘潭)将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 1 10 27 4
反应后质量/g 1 a 0 23
A.a的值是8 B.甲物质一定是该反应的催化剂
C.该反应属于分解反应 D.反应过程中乙、丁的质量比是5:2
3.(2021·湖南湘潭)根据如下微观示意图分析,下列结论正确的是( )
A.反应前后原子种类不变 B.丙物质的相对分子质量是18g
C.参加反应的甲与乙分子个数比为1:1 D.反应前后各元素的化合价均不变
4.(2021·湖北荆州)物质X和Ba(OH)2在溶液中反应的化学方程式为:,下列说法正确的是( )
A.X可能为氯化铁 B.X只能为硫酸
C.Y可以为氢氧化铜 D.Y不一定是水
5.(2021·湖南株洲)下图是某反应前后的微观示意图,“”和“”表示两种不同元素的原子。下列有关说法正确的是( )
A.该反应没有单质生成 B.该反应属于复分解反应
C.该反应中,原子个数发生了改变 D.参加反应的两种分子(和)的个数比为1:1
6.(2021·湖南怀化)已知某纯净物2.3g在足量的氧气中充分燃烧后,生成4.4g二氧化碳和2.7g水。下列关于该纯净物组成的说法正确的是( )
A.只含有碳、氢元素
B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢元素,可能含有氧元素
D.一定含有碳元素,可能含有氢、氧元素
7.(2021·江苏盐城)铜制品长期暴露在空气中表面生成铜锈(主要成分Cu2(OH)2CO3),下列物质与铜制品生锈无关的是( )
A.N2 B.O2 C.H2O D.CO2
8.(2021·四川成都)工业上用CH4和CO2制取合成气会产生积碳,如图是抗积碳示意图。有关说法错误的是( )
A.Ni基双金属催化剂可重复使用
B.反应前后元素的化合价均改变
C.反应前后原子种类和数目不变
D.合成气可合成多种化工产品,价值大
9.(2021·山东潍坊)在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:丙的质量为5g,丁的质量为3g),充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应 B.丙一定是催化剂
C.反应后丁的质量为8g D.反应生成的乙和丁的质量比为1∶1
10.(2021·重庆)2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是( )
A.属于置换反应 B.反应前后原子种类改变
C.反应中涉及2种氧化物 D.参加反应的反应物分子个数比为1:1
11.(2021·湖南湘潭)石笋和钟乳石的形成蕴含许多化学原理,其反应之一为: 则X的化学式为( )
A.CaCO3 B.Ca(OH)2 C.CaO D.CaH2
12.(2021·四川广安)下列化学方程式书写完全正确的是( )
A. B.
C. D.
13.(2021·河北)利用催化剂将废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+3H2X+H2O,X的化学式为( )
A.CO B.CH4 C.CH3OH D.C2H5OH
14.(2021·湖南永州)工业法生产硝酸的一个中间反应可用微观模型表示如下,下列说法正确的是( )
A.该反应前后分子的数目无变化
B.该反应前后元素种类没有变化
C.该反应过程中氧气分子全部参与了反应
D.该反应的化学方程式可表示为:
15.如图表示两种物质发生的化学反应,其中相同的球代表同种原子,根据图示判断,反应类型是( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
16.(2021·四川遂宁)在宏观、微观与符号之间建立联系是化学学科的特点。天然气是广泛使用的燃料,其主要成分还可能发生的化学反应微观示意图如下:
(1)写出乙物质的化学式___________。
(2)请写出工业上用丙物质从赤铁矿中冶炼铁的反应化学方程式___________。
17.(2021·湖北恩施土家族苗族自治州·)“宏微结合”是化学学科核心素养之一。某物质在点燃的条件下发生反应,生成物和反应物共四种,它们的微观示意图和反应前后的质量如下表所示。
物质序号 微观示意图 反应前质量/g 反应后质量/g
甲 16 0
乙 100 x
丙 1 45
丁 0 y
(1)由构成的物质中,所代表的元素的化合价为______。
(2)表中的四种物质,属于有机物的是______(填化学式)。
(3)上述反应的化学方程式为_____________________________________。
(4)某同学在计算反应物和生成物之间的质量关系时,可得出x+y=______。
18.(2021·四川南充)碱性甲烷燃料电池具有低污染、高效率等特点,是一种很有前途的能源利用方式。电池总反应方程式为 ,则X的化学式为______。
19.(2021·四川南充)在农业生产中,改良酸性土壤(硫酸型酸雨所致),通常加入______,以中和其酸性,反应的化学方程式为_________________,该反应属于______________(填基本反应类型)。
20.(2021·湖北荆州)我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:,则X的化学式为__________,B(OH)3中B的化合价为_________。
(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,该反应的化学方程式为________________________________。
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如图所示:该反应的化学方程式为___________________________________________________。
答案解析部分
1.D
【解析】(1)反应中甲和丙的质量比为(10-8):(30-12)=1:9,错误;
(2)根据质量守恒定律,10+5+12+20=8+5+30+x,x=4,正确;
(3)该反应中甲、丁质量减少为反应物,丙质量增加为生成物,反应符合多变一特点,为化合反应,正确;
(4)乙质量反应前后不变,可能不参与反应、可能是催化剂,正确;
(5)反应的甲与丁质量比为(10-8):(20-4)=1:8;若甲与丁的化学计量数之比为2:3;设甲、丁相对分子质量分别为a、b,则有=,解得=,正确。
2.C
【解析】根据表格信息可知,丙从27g变成0g,是反应物,丁从4g增加到23g,是生成物,由于反应前后物质的质量是守恒的,所以推算出乙的质量应该是27g-19g=8g,写出该反应的方程式为:丙→丁+乙。
A、因为生成乙的质量为8g,所以a应该是8+10=18,故A不符合题意;
B、甲反应前后质量不变,可能是催化剂,也可能是不参与反应的杂质,故B不符合题意;
C、该反应由一种物质生成两种物质,是分解反应,故C符合题意;
D、反应中乙生成了8g,丁生成了19g,所以质量比为8:19,故D不符合题意。
3.A
【解析】A、由图可知,反应前后原子种类数目不变,A正确。
B、相对分子质量单位是“1”不是“g”,B错误。
C、由微观示意图可知,反应化学方程式2C2H6+7O24CO2+6H2O,故参加反应的甲与乙分子个数比为2:7,C错误。
D、反应前氧气为单质,氧元素0价,反应后氧元素-2价,化合价改变,D错误。
4.D
【解析】A、根据生成物中有硫酸钡生成,故X中一定含有硫酸根,该说法错误;
B、反应生成硫酸钡,X可以为硫酸也可以是可硫酸钠、硫酸钾等化合物,故该说法错误;
C、因为生成的Y为可溶性物质,而氢氧化铜在水中不溶解,则不可能为氢氧化铜,故说法错误;
D、若X是硫酸,则生成的Y为水,若X是硫酸钠、硫酸钾等化合物,则生成的Y是碱,故Y不一定是水,说法正确
5.A
【解析】A、反应后增加的是生成物,减少的是反应物,由图可知,反应后没有单质生成,A正确。
B、反应后增加的是生成物,减少的是反应物,由图可知,生成物只有一种,不属于复分解反应,B错误。
C、由图可知,该反应中,原子个数没有发生改变,C错误。
D、反应后增加的是生成物,减少的是反应物,参加反应的两种分子(和 )的个数比为2:1,D错误。
6.B
【解析】已知某纯净物2.3g在足量的氧气中充分燃烧后,生成4.4g二氧化碳和2.7g水。根据质量守恒定律,化学反应前后,元素的种类和质量不变,故该纯净物中一定含C、H元素,碳元素的质量为:,氢元素的质量为: ,1.2g+0.3g=1.5g<2.3g,故该纯净物中一定含氧元素。
7.A
【解析】表面生成铜锈主要成分Cu2(OH)2CO3,由Cu、O、H、C元素组成,不含氮元素,故与铜制品生锈无关的是氮气
8.B
【解析】A、Ni基双金属在反应中作为催化剂,催化剂在反应前后质量和化学性质不发生变化,可重复使用,正确;
B、该反应为,反应后碳元素的化合价有+4价变为+2价,氧元素的化合价在反应前后都是-2价,未发生变化,氢元素的化合价由+1价变为0价,因此错误;
C、根据质量守恒定律反应前后原子种类和数目不变,正确;
D、合成气为一氧化碳和氢气混合气体,可合成多种化工产品,价值大,正确。
9.D
【解析】A、根据分析,反应中甲物质的质量减少16g,乙物质的质量增加8g,丙物质的质量没有发生变化,丁物质的质量增加8g。化学反应中反应物的质量减少,生成物的质量增加,因此该反应的反应物是甲,生成物是乙和丁,符合“一变多”的特点,属于分解反应,选项A不正确;B、该反应中丙物质的质量没有发生变化,化学反应中,质量不变的物质可能是催化剂,也可能是不参加反应的其他物质,因此丙不一定是催化剂,选项B不正确;
C、反应中生成丁的质量为8g,反应前丁的质量为3g,因此反应后丁的质量为11g,选项C不正确;
D、该反应中生成的乙和丁质量都是8g,因此反应生成的乙和丁的质量比为:8g∶8g=1∶1,选项D正确。
10.B
【解析】由图可知,该反应为二氧化碳和水在催化剂和光照的作用下反应生成甲烷和氧气,该反应的化学方程式为:
A、该反应的反应物都是化合物,不属于置换反应,不符合题意;
B、根据质量守恒定律,化学反应前后,原子的种类和数目不变,不符合题意;
C、二氧化碳是由C、O元素组成的化合物,属于氧化物,水是由H、O元素组成的化合物,属于氧化物,甲烷是由C、H元素组成的化合物,不属于氧化物,氧气是由氧元素组成的纯净物,属于单质,共涉及2种氧化物,符合题意;
D、由化学方程式可知,参加反应的反应物的分子个数比为:1:2,不符合题意。
11.A
【解析】根据质量守恒,反应前后原子个数不变,反应前碳原子为1个,氢原子为2个,氧原子为3个,反应后钙原子为1个,氢原子为2个,碳原子为2个,氧原子为6个,所以左侧少了1个钙原子,1个碳原子,3个氧原子,所以化学式为CaCO3。
12.C
【解析】A、铁在氧气中燃烧生成四氧化三铁,该反应的化学方程式为:,不符合题意;
B、铁和稀盐酸反应生成氯化亚铁和氢气,该反应的化学方程式为:,不符合题意;
C、氧化铁和稀盐酸反应生成氯化铁和水,该反应的化学方程式为:,符合题意;
D、铝和硫酸铜反应生成硫酸铝和铜,该反应的化学方程式为:,不符合题意。
13.C
【解析】根据质量守恒定律,反应前后原子的种类、数目不变,反应前C、H、O的原子个数分别为1、6、2,反应后C、H、O的原子个数分别为0、2、1,所以1个X分子中含有1个碳原子、4个氢原子和1个氧原子,X的化学式为CH3OH。
14.B
【解析】由图示可知,一氧化氮和氧气反应生成二氧化氮,反应为;
A. 该反应前后分子的数目发生改变,错误;
B. 该反应前后元素种类没有变化,正确;
C. 该反应过程中氧气分子没有全部参与反应,错误
D. 该反应的化学方程式可表示为:,错误。
15.D
【解析】由分子结构模型可知,反应前有两种分子,其中一种分子是由同种原子构成的,该物质属于单质,另一种是由不同种原子构成的,该物质属于化合物;反应后生成两种新分子,其中一种是单质,另一种属于化合物,因此该反应属于置换反应。
16.H2O
【解析】(1)化学反应前后原子中了数目不变,反应后碳、氧、氢原子数目分别为1、1、6,反应前碳、氧、氢原子数目分别为1、0、4,故乙物质的化学式为H2O。
(2)丙物质是一氧化碳,赤铁矿的主要成分是氧化铁, 一氧化碳在高温下和氧化铁反应生成二氧化碳和铁。
17.0价 CH4 CH4+2O2CO2+2H2O 72
【解析】(1)构成的物质属于单质,单质中元素化合价为0价,故填:0价。
(2)含碳元素的化合物,属于有机物,CH4、CO2含碳元素,但是CO2化学性质和无机物非常接近,我们称之为无机物,故填:CH4。
(3)甲质量减少是反应物,丙质量增加是生成物,根据质量守恒反应前后元素种类不变,为了维持反应前后都有氧元素,反应物中一定有氧气,为了维持反应前后都有氢元素,生成物中一定有水,甲烷和氧气生成二氧化碳和水,化学方程式CH4+2O2CO2+2H2O,故填:CH4+2O2CO2+2H2O。
(4)根据质量守恒,反应前后物质总质量不变,故16+100+1=x+45+y,x+y=72,故填:72。
18.H2O
【解析】化学反应前后原子种类数目不变;反应前碳、氢、氧、钾原子数目分别为1、6、6、2,反应后碳、氢、氧、钾原子数目分别为1、0、3、2,3个X分子中含6个氢原子和3氧原子,则X的化学式为H2O。
19.熟石灰 复分解反应
【解析】氢氧化钙显弱碱性,能和酸反应,在农业生产中,改良酸性土壤(硫酸型酸雨所致),通常加入熟石灰氢氧化钙,以中和其酸性;硫酸和氢氧化钙反应生成硫酸钙和水,反应的化学方程式为,该反应是两种化合物交换成分生成另外两种化合物的反应,属于复分解反应。
20.H2O +3
【解析】(1)化学反应前后原子种类数目 不变;反应后硼、氧、氢原子数目分别为2、6、12,反应前硼、氧、氢原子数目分别为2、0、0,故X的化学式为H2O;B(OH)3中氢氧根化合价为负一价,设硼元素化合价为x,化合物中正负化合价代数和为零;则x +(-1)×3=0,x=+3。
(2)氢氧化钠和二氧化碳反应生成碳酸钠和水:。
(3)由图示可知,氢气和二氧化碳在催化剂作用下生成水和CH4O,方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
