第九单元 溶液 练习题—2021-2022学年九年级化学人教版下册(有答案)
文档属性
| 名称 | 第九单元 溶液 练习题—2021-2022学年九年级化学人教版下册(有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 68.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-23 23:14:48 | ||
图片预览


文档简介
人教版九年级化学下册 第九单元 溶液
一、单选题
1.下列说法正确的是( )
A. 凡是均一的、稳定的液体一定是溶液
B. 洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C. 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D. 5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
2.下列有关饱和溶液和不饱和溶液的说法中,正确的是( )
A. 溶液析出晶体后,在当时条件下应该成为不饱和溶液
B. 溶质质量分数大的溶液,一定是饱和溶液
C. 升温或蒸发溶剂都能使不饱和氯化钠溶液达到饱和
D. 在一定条件下,不能继续溶解溶质的溶液即为该溶质的饱和溶液
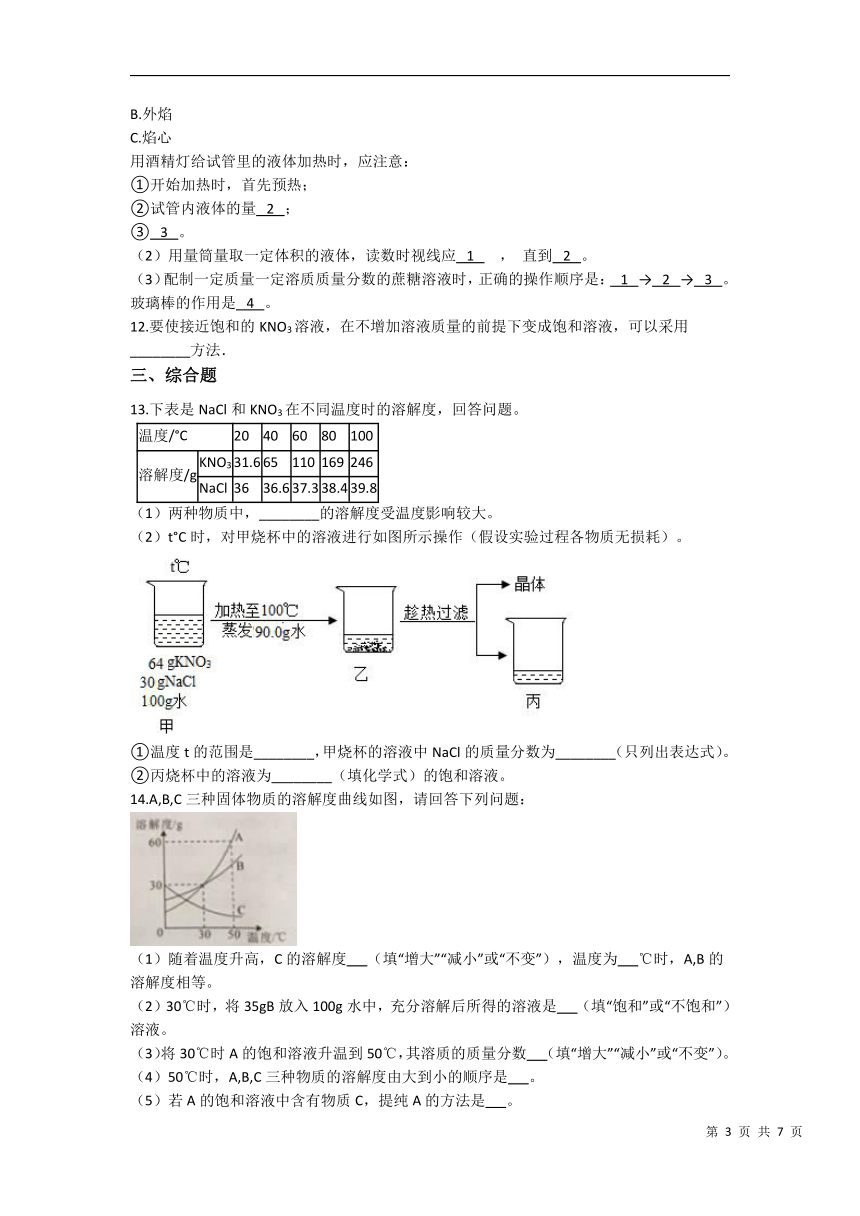
3.图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示),下列说法正确的是( )
A. 上述图象表示碳酸钠的溶解度曲线
B. 2℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将50gNaOH分别投入到100g水和l00g酒精中,都能形成饱和溶液
D. 40℃时,将适量CO2通入饱和的NaOH酒精溶液中,观察不到明显的现象
4.如图是A、B两种固体物质的溶解度曲线下列说法中错误的是( )
A. t1℃时A、B的溶解度相等 B. t2℃时,A的饱和溶液中溶质的质量分数为 a 100 ×100%
C. A、B的溶解度都随温度升高而增大 D. 将t2℃时B的饱和溶液降温到t1℃时,溶液变稀了
5.在配制100g质量分数为10%的氢氧化钠溶液的过程中,下列操作正确的是()
A. 用量筒量取90mL水时俯视读数 B. 氢氧化钠易潮解,应放在玻璃器皿中称量
C. 用蒸馏水洗涤烧杯后,立即溶解氢氧化钠 D. 实验过程中,用到的玻璃仪器只有烧杯和量筒
6.某溶液恒温蒸发掉部分溶剂后,无晶体析出,下列说法正确的是( )
A. 原溶液可能是饱和溶液 B. 剩余的溶液一定是不饱和溶液
C. 剩余的溶液可能是饱和溶液 D. 剩余的溶液与原溶液中的溶质的质量分数可能相等
7.实验室配制50g质量分数为15%的氯化钠溶液时,下列某操作对溶质质量分数没有影响的是( )
A. 称量氯化钠时,将砝码放在左盘(1g以下用游码)
B. 用仰视的方法量取42.5mL的蒸馏水
C. 把配制好的溶液转移至试剂瓶时有少量溅出
D. 把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶
8.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A. t℃在60℃到80℃之间,且甲表示KNO3的溶解度曲线
B. t℃时,甲、乙两种溶液的溶质质量分数不一定相等
C. 把60℃时的105g KNO3饱和溶液降温至20℃,能析出晶体78.4g
D. 两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
二、填空题
9.冬天,人们常用甘油 (C3H8O3) 溶液护肤,使皮肤保持湿润.溶质质量分数为80%的甘油溶液护肤效果最佳。甘油溶液中的溶剂是 。若想配500g80%的甘油溶液,则需甘油 g 。
10.实验室配制溶液时,有以下操作:
①溶解 ②称量 ③计算 ④装瓶存放,贴上标签.
回答下列问题:
(1)现欲配制50g 5%氯化钠溶液,操作步骤为 (填序号).
(2)溶解操作中需要的仪器有 、 .
(3)量取蒸馏水时,若仰视读数,则会导致氯化钠溶液的溶质质量分数 (填“<”或“>”)5%.
11.请回答下列问题:
(1)使用酒精灯加热时,应用酒精灯的 1 。(填写字母序号)
A.内焰
B.外焰
C.焰心
用酒精灯给试管里的液体加热时,应注意:
①开始加热时,首先预热;
②试管内液体的量 2 ;
③ 3 。
(2)用量筒量取一定体积的液体,读数时视线应 1 , 直到 2 。
(3)配制一定质量一定溶质质量分数的蔗糖溶液时,正确的操作顺序是: 1 → 2 → 3 。玻璃棒的作用是 4 。
12.要使接近饱和的KNO3溶液,在不增加溶液质量的前提下变成饱和溶液,可以采用________方法.
三、综合题
13.下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/°C 20 40 60 80 100
溶解度/g KNO3 31.6 65 110 169 246
NaCl 36 36.6 37.3 38.4 39.8
(1)两种物质中,________的溶解度受温度影响较大。
(2)t°C时,对甲烧杯中的溶液进行如图所示操作(假设实验过程各物质无损耗)。
①温度t的范围是________,甲烧杯的溶液中NaCl的质量分数为________(只列出表达式)。
②丙烧杯中的溶液为________(填化学式)的饱和溶液。
14.A,B,C三种固体物质的溶解度曲线如图,请回答下列问题:
(1)随着温度升高,C的溶解度 (填“增大”“减小”或“不变”),温度为 ℃时,A,B的溶解度相等。
(2)30℃时,将35gB放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。
(3)将30℃时A的饱和溶液升温到50℃,其溶质的质量分数 (填“增大”“减小”或“不变”)。
(4)50℃时,A,B,C三种物质的溶解度由大到小的顺序是 。
(5)若A的饱和溶液中含有物质C,提纯A的方法是 。
15.由 128 克硝酸钾、60 克氯化钠组成的混合物投入 200g 热水溶解,对该溶液进行如图实验(假设实验过程中无损耗):
(1)两种物质溶解在水中,用玻璃棒搅拌的目的是 。
(2)实验时温度 t 的范围为 。
(3)操作 1 用到的实验仪器有_____。
A. 酒精灯 B. 铁架台 C. 漏斗 D. 玻璃棒 E. 蒸发皿
(4)定量描述晶体 1 的组成 。
(5)溶液 2 为 (填物质名称)的饱和溶液。
(6)关于溶液中 NaCl 的质量分数:溶液 1 溶液 2(选填“>”、“<”或“=”)。
(7)关于上述实验说法错误的是_____。
A. 晶体1与晶体2比较,晶体1中KNO3的纯度更高 B. 溶液1中KNO3为饱和溶液,NaCl为不饱和溶液
C. 溶液1恒温蒸发90g水后,与溶液2的成分相同 D. 溶液2将水蒸干就可得到纯净的KNO3固体
16.根据表中的数据,回答下列问题.
温度/℃ 0 20 40 60 80 100
溶解度/ NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)40℃时,NaCl的溶解度是________.
(2)20℃时,称取31.6g KNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是________(填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是________.
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为________.
(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号)________.
A 都是饱和溶液 B 溶剂质量:KNO3>NaCl C 溶液质量:KNO3<NaCl.
17.根据固体物质M在水中的溶解度曲线图,回答下列问题:
(1)B点所表示的溶液为M在t2℃的 (选填“饱和”或“不饱和”)溶液.
(2)将A点对应的溶液从t1℃升温到t2℃(忽略水的蒸发),在此过程中M的质量分数 (选填“增大”、“减小”或“不变”);
(3)将A点对应的100g溶液恒温蒸发10g水,可析出M的质量为 g,剩下的溶液中M的质量分数为
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 B
4.【答案】 B
5.【答案】 B
6.【答案】 C
7.【答案】 C
8.【答案】 C
二、填空题
9.【答案】 水;400
10.【答案】 ③②①④;玻璃棒;烧杯;<
11.【答案】 (1)B;不能超过试管容积的 ;试管口不可对着自己或他人
(2)平视凹液面(或平视刻度线);凹液面的最低点与刻度线相切
(3)计算;称量;溶解;搅拌,加快蔗糖的溶解
12.【答案】降低温度至恰好饱和
三、综合题
13.【答案】 (1)KNO3或硝酸钾
(2)40° C≤t<100 °C;;NaCl和KNO3
14.【答案】 (1)减小;30
(2)饱和
(3)不变
(4)A>B>C
(5)降温结晶
15.【答案】 (1)加速溶解
(2)40℃≤t<100℃
(3)B,C,D
(4)32.4gKNO3
(5)硝酸钾、氯化钠
(6)<
(7)C,D
16.【答案】 (1)36.6g
(2)饱和;继续加KNO3固体至天平平衡
(3)降温结晶(或冷却热饱和溶液)
(4)AC
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
17.【答案】 (1)不饱和
(2)不变
(3)0.1ag; . (
第
2
页
共
2
页
)
一、单选题
1.下列说法正确的是( )
A. 凡是均一的、稳定的液体一定是溶液
B. 洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C. 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D. 5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
2.下列有关饱和溶液和不饱和溶液的说法中,正确的是( )
A. 溶液析出晶体后,在当时条件下应该成为不饱和溶液
B. 溶质质量分数大的溶液,一定是饱和溶液
C. 升温或蒸发溶剂都能使不饱和氯化钠溶液达到饱和
D. 在一定条件下,不能继续溶解溶质的溶液即为该溶质的饱和溶液
3.图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如下表所示),下列说法正确的是( )
A. 上述图象表示碳酸钠的溶解度曲线
B. 2℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将50gNaOH分别投入到100g水和l00g酒精中,都能形成饱和溶液
D. 40℃时,将适量CO2通入饱和的NaOH酒精溶液中,观察不到明显的现象
4.如图是A、B两种固体物质的溶解度曲线下列说法中错误的是( )
A. t1℃时A、B的溶解度相等 B. t2℃时,A的饱和溶液中溶质的质量分数为 a 100 ×100%
C. A、B的溶解度都随温度升高而增大 D. 将t2℃时B的饱和溶液降温到t1℃时,溶液变稀了
5.在配制100g质量分数为10%的氢氧化钠溶液的过程中,下列操作正确的是()
A. 用量筒量取90mL水时俯视读数 B. 氢氧化钠易潮解,应放在玻璃器皿中称量
C. 用蒸馏水洗涤烧杯后,立即溶解氢氧化钠 D. 实验过程中,用到的玻璃仪器只有烧杯和量筒
6.某溶液恒温蒸发掉部分溶剂后,无晶体析出,下列说法正确的是( )
A. 原溶液可能是饱和溶液 B. 剩余的溶液一定是不饱和溶液
C. 剩余的溶液可能是饱和溶液 D. 剩余的溶液与原溶液中的溶质的质量分数可能相等
7.实验室配制50g质量分数为15%的氯化钠溶液时,下列某操作对溶质质量分数没有影响的是( )
A. 称量氯化钠时,将砝码放在左盘(1g以下用游码)
B. 用仰视的方法量取42.5mL的蒸馏水
C. 把配制好的溶液转移至试剂瓶时有少量溅出
D. 把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶
8.K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下。下列说法错误的是( )
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A. t℃在60℃到80℃之间,且甲表示KNO3的溶解度曲线
B. t℃时,甲、乙两种溶液的溶质质量分数不一定相等
C. 把60℃时的105g KNO3饱和溶液降温至20℃,能析出晶体78.4g
D. 两种饱和液从80℃降温到20℃,析出晶体的质量(不含结晶水)无法比较
二、填空题
9.冬天,人们常用甘油 (C3H8O3) 溶液护肤,使皮肤保持湿润.溶质质量分数为80%的甘油溶液护肤效果最佳。甘油溶液中的溶剂是 。若想配500g80%的甘油溶液,则需甘油 g 。
10.实验室配制溶液时,有以下操作:
①溶解 ②称量 ③计算 ④装瓶存放,贴上标签.
回答下列问题:
(1)现欲配制50g 5%氯化钠溶液,操作步骤为 (填序号).
(2)溶解操作中需要的仪器有 、 .
(3)量取蒸馏水时,若仰视读数,则会导致氯化钠溶液的溶质质量分数 (填“<”或“>”)5%.
11.请回答下列问题:
(1)使用酒精灯加热时,应用酒精灯的 1 。(填写字母序号)
A.内焰
B.外焰
C.焰心
用酒精灯给试管里的液体加热时,应注意:
①开始加热时,首先预热;
②试管内液体的量 2 ;
③ 3 。
(2)用量筒量取一定体积的液体,读数时视线应 1 , 直到 2 。
(3)配制一定质量一定溶质质量分数的蔗糖溶液时,正确的操作顺序是: 1 → 2 → 3 。玻璃棒的作用是 4 。
12.要使接近饱和的KNO3溶液,在不增加溶液质量的前提下变成饱和溶液,可以采用________方法.
三、综合题
13.下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/°C 20 40 60 80 100
溶解度/g KNO3 31.6 65 110 169 246
NaCl 36 36.6 37.3 38.4 39.8
(1)两种物质中,________的溶解度受温度影响较大。
(2)t°C时,对甲烧杯中的溶液进行如图所示操作(假设实验过程各物质无损耗)。
①温度t的范围是________,甲烧杯的溶液中NaCl的质量分数为________(只列出表达式)。
②丙烧杯中的溶液为________(填化学式)的饱和溶液。
14.A,B,C三种固体物质的溶解度曲线如图,请回答下列问题:
(1)随着温度升高,C的溶解度 (填“增大”“减小”或“不变”),温度为 ℃时,A,B的溶解度相等。
(2)30℃时,将35gB放入100g水中,充分溶解后所得的溶液是 (填“饱和”或“不饱和”)溶液。
(3)将30℃时A的饱和溶液升温到50℃,其溶质的质量分数 (填“增大”“减小”或“不变”)。
(4)50℃时,A,B,C三种物质的溶解度由大到小的顺序是 。
(5)若A的饱和溶液中含有物质C,提纯A的方法是 。
15.由 128 克硝酸钾、60 克氯化钠组成的混合物投入 200g 热水溶解,对该溶液进行如图实验(假设实验过程中无损耗):
(1)两种物质溶解在水中,用玻璃棒搅拌的目的是 。
(2)实验时温度 t 的范围为 。
(3)操作 1 用到的实验仪器有_____。
A. 酒精灯 B. 铁架台 C. 漏斗 D. 玻璃棒 E. 蒸发皿
(4)定量描述晶体 1 的组成 。
(5)溶液 2 为 (填物质名称)的饱和溶液。
(6)关于溶液中 NaCl 的质量分数:溶液 1 溶液 2(选填“>”、“<”或“=”)。
(7)关于上述实验说法错误的是_____。
A. 晶体1与晶体2比较,晶体1中KNO3的纯度更高 B. 溶液1中KNO3为饱和溶液,NaCl为不饱和溶液
C. 溶液1恒温蒸发90g水后,与溶液2的成分相同 D. 溶液2将水蒸干就可得到纯净的KNO3固体
16.根据表中的数据,回答下列问题.
温度/℃ 0 20 40 60 80 100
溶解度/ NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)40℃时,NaCl的溶解度是________.
(2)20℃时,称取31.6g KNO3固体加入盛有100g水的烧杯中,充分溶解形成的溶液是________(填“饱和”或“不饱和”)溶液;称取31.6g KNO3固体时,发现托盘天平指针偏右,接下来的操作是________.
(3)当KNO3中混有少量NaCl时,提纯KNO3所采用的方法为________.
(4)将等质量KNO3的饱和溶液和NaC1的饱和溶液从60℃降温到20℃,对所得溶液的叙述正确的是(填序号)________.
A 都是饱和溶液 B 溶剂质量:KNO3>NaCl C 溶液质量:KNO3<NaCl.
17.根据固体物质M在水中的溶解度曲线图,回答下列问题:
(1)B点所表示的溶液为M在t2℃的 (选填“饱和”或“不饱和”)溶液.
(2)将A点对应的溶液从t1℃升温到t2℃(忽略水的蒸发),在此过程中M的质量分数 (选填“增大”、“减小”或“不变”);
(3)将A点对应的100g溶液恒温蒸发10g水,可析出M的质量为 g,剩下的溶液中M的质量分数为
答案部分
一、单选题
1.【答案】 C
2.【答案】 D
3.【答案】 B
4.【答案】 B
5.【答案】 B
6.【答案】 C
7.【答案】 C
8.【答案】 C
二、填空题
9.【答案】 水;400
10.【答案】 ③②①④;玻璃棒;烧杯;<
11.【答案】 (1)B;不能超过试管容积的 ;试管口不可对着自己或他人
(2)平视凹液面(或平视刻度线);凹液面的最低点与刻度线相切
(3)计算;称量;溶解;搅拌,加快蔗糖的溶解
12.【答案】降低温度至恰好饱和
三、综合题
13.【答案】 (1)KNO3或硝酸钾
(2)40° C≤t<100 °C;;NaCl和KNO3
14.【答案】 (1)减小;30
(2)饱和
(3)不变
(4)A>B>C
(5)降温结晶
15.【答案】 (1)加速溶解
(2)40℃≤t<100℃
(3)B,C,D
(4)32.4gKNO3
(5)硝酸钾、氯化钠
(6)<
(7)C,D
16.【答案】 (1)36.6g
(2)饱和;继续加KNO3固体至天平平衡
(3)降温结晶(或冷却热饱和溶液)
(4)AC
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
17.【答案】 (1)不饱和
(2)不变
(3)0.1ag; . (
第
2
页
共
2
页
)
同课章节目录
