人教版九年级化学下册 9.2 溶解度 课件(24张PPT)
文档属性
| 名称 | 人教版九年级化学下册 9.2 溶解度 课件(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 36.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 00:00:00 | ||
图片预览




文档简介
(共24张PPT)
第九单元 课题2 溶解度
汤太淡了,怎么办?
一锅汤里面能不能无限制地溶解食盐呢?
情境引入
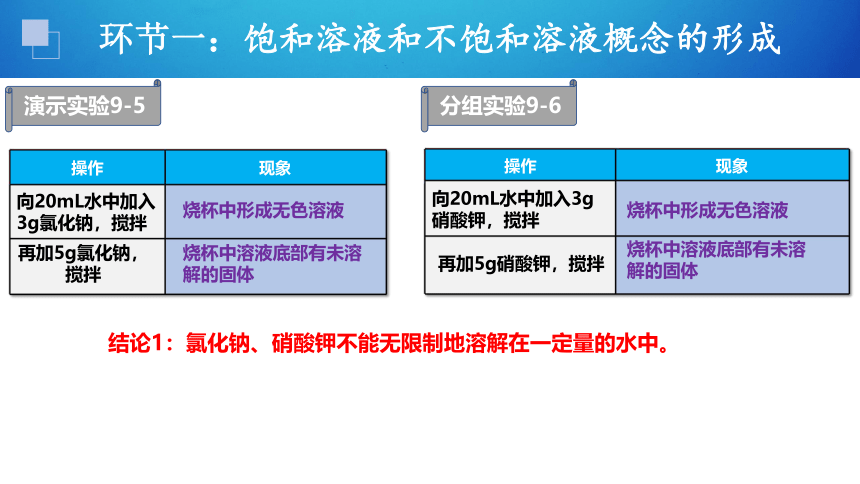
操作 现象
向20mL水中加入3g氯化钠,搅拌
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
结论1:氯化钠、硝酸钾不能无限制地溶解在一定量的水中。
环节一:饱和溶液和不饱和溶液概念的形成
演示实验9-5
操作 现象
向20mL水中加入3g硝酸钾,搅拌
分组实验9-6
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
再加5g氯化钠,
搅拌
再加5g硝酸钾,搅拌
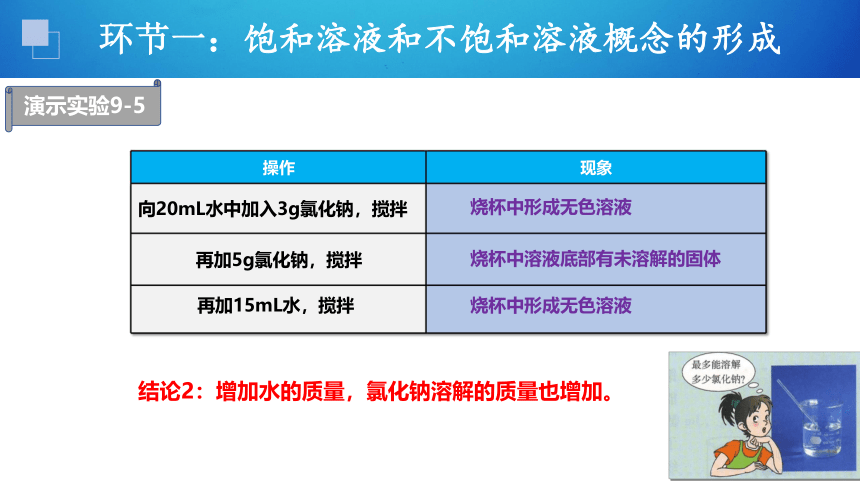
操作 现象
向20mL水中加入3g氯化钠,搅拌
再加5g氯化钠,搅拌
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
烧杯中形成无色溶液
结论2:增加水的质量,氯化钠溶解的质量也增加。
环节一:饱和溶液和不饱和溶液概念的形成
演示实验9-5
再加15mL水,搅拌
环节一:饱和溶液和不饱和溶液概念的形成
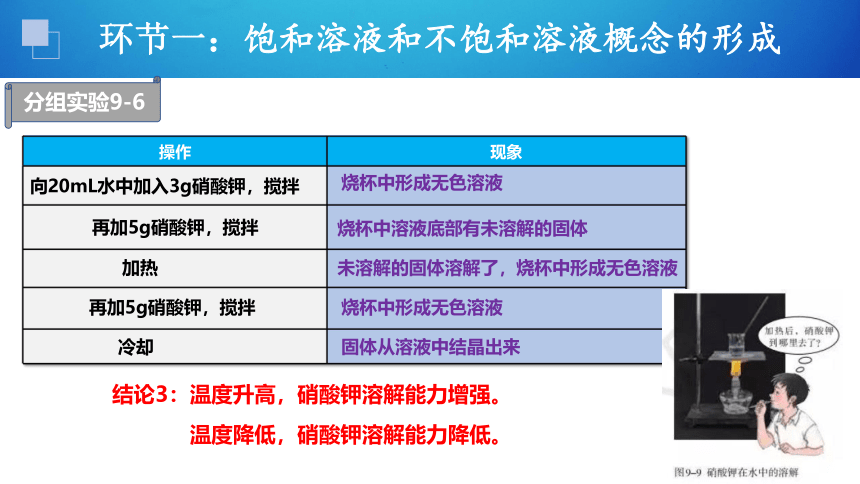
操作 现象
向20mL水中加入3g硝酸钾,搅拌
再加5g硝酸钾,搅拌
结论3:温度升高,硝酸钾溶解能力增强。
分组实验9-6
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
未溶解的固体溶解了,烧杯中形成无色溶液
烧杯中形成无色溶液
固体从溶液中结晶出来
温度降低,硝酸钾溶解能力降低。
加热
再加5g硝酸钾,搅拌
冷却
饱和溶液和不饱和溶液
【饱和溶液】在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。
【不饱和溶液】在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时,所得到的溶液叫做这种溶质的不饱和溶液。
环节一:饱和溶液和不饱和溶液概念的形成
注意:只有指明“在一定量溶剂里”和“在一定温度下”,
溶液的“饱和”和“不饱和”才有确定的意义。
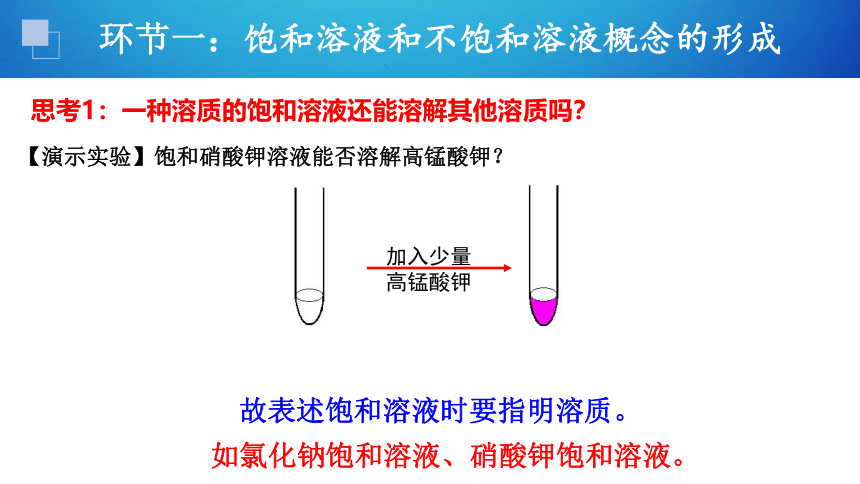
故表述饱和溶液时要指明溶质。
如氯化钠饱和溶液、硝酸钾饱和溶液。
加入少量
高锰酸钾
【演示实验】饱和硝酸钾溶液能否溶解高锰酸钾?
环节一:饱和溶液和不饱和溶液概念的形成
思考1:一种溶质的饱和溶液还能溶解其他溶质吗?
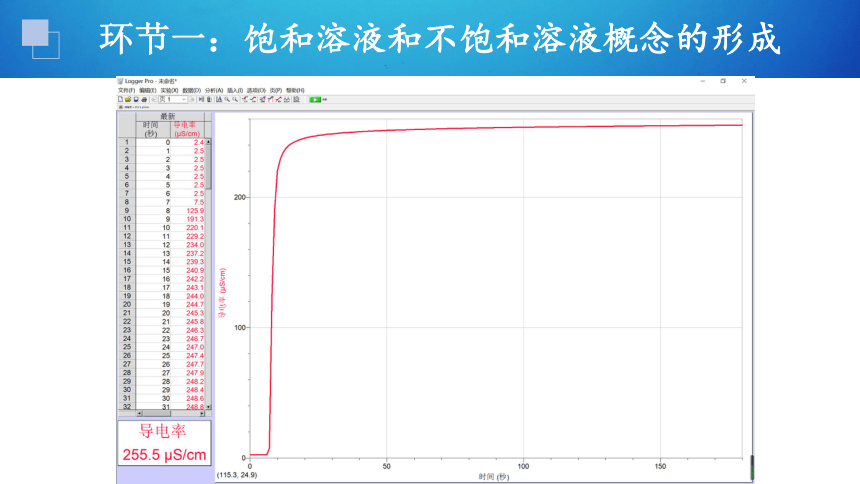
通过氢氧化钙溶解过程中电导率的测定,认识饱和溶液形成的微观过程。
第一步:室温下,取 一定量蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用电导率传感器采集数据,将氢氧化钙加入烧杯中。
实验步骤
①氢氧化钙溶于水是以钙离子和氢氧根离子的形式均匀地分散到水分子之间。
②电导率传感器用于测量溶液的导电性强弱;
一定条件下,电导率的大小能反映离子浓度的大小。
环节一:饱和溶液和不饱和溶液概念的形成
查阅资料
实验目的
思考2:从微观角度认识饱和溶液的形成。
环节一:饱和溶液和不饱和溶液概念的形成
操作 溶液状态
向20mL水中加入5g氯化钠,搅拌
再加5g氯化钠,搅拌
再加15mL水,搅拌
操作 溶液状态
向20mL水中加入2g硝酸钾,搅拌
再加5g硝酸钾,搅拌
加热
再加5g硝酸钾,搅拌
冷却
讨论:通过哪些方法可以实现饱和溶液和不饱和溶液的转化?
环节二:饱和溶液和不饱和溶液的相互转化
溶液1——不饱和溶液
溶液2——饱和溶液
溶液3——
溶液4——不饱和溶液
溶液5——饱和溶液
溶液6——不饱和溶液
溶液7——
溶液8——饱和溶液
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
升温和降温针对的是大多数物质,特殊物质如熟石灰Ca(OH)2的饱和与不饱和溶液转化,温度变化和一般物质相反。
环节二:饱和溶液和不饱和溶液的相互转化
【例1】20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
D
饱和溶液
不包括未溶解的固体!
课堂练习
【例2】现有一瓶接近饱和的硝酸钾溶液,使它变成饱和溶液的方法中,不正确的是( )
A.加入硝酸钾固体
B.降低溶液的温度
C.蒸发一部分溶剂后再恢复到原温度
D.用滴管吸出一部分溶液
D
课堂练习
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
环节二:饱和溶液和不饱和溶液的相互转化
结晶
?
【结晶】已溶解在溶液里的溶质从溶液中以晶体的形式析出,叫做结晶。(分离混合物的方法)
硝酸钾晶体
雪花晶体
冷却热饱和溶液
结晶后所得到的溶液是饱和溶液。
环节三:结晶及其应用
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
结晶
冷却
环节三:结晶及其应用
?
不饱和溶液
环节三:结晶及其应用
写出每个流程中分别是氯化钠的饱和溶液还是不饱和溶液?
不饱和溶液
不饱和溶液
饱和溶液
饱和溶液
海
水
晒
盐
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
归纳小结
结晶
蒸发溶剂
冷却
如何判断实验9-5最后得到的溶液是饱和溶液还是不饱和溶液?
环节四:判断溶液是否饱和的一般思路和方法
某溶液
总结:判断溶液是否饱和的一般思路和方法
有未溶解的溶质时为饱和溶液。
没有未溶解的溶质
加少量该溶质,观察是否继续溶解。
蒸发该溶液,观察是否立即结晶。
给该溶液降温,观察是否立即结晶。
环节四:判断溶液是否饱和的一般思路和方法
(温度升高,该溶质溶解能力增强)
课堂练习
1、t℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是( )
A.恒温蒸发溶剂
B.降低溶液的温度
C.向溶液中加入硝酸钾
D.向溶液中加入t℃时硝酸钾的饱和溶液
2、现将40℃时的一杯硝酸钾溶液降温至20℃,结果有少量晶体析出,下列说法错误的是( )
A.40℃时的溶液一定为饱和溶液
B.溶剂的质量没有改变
C.20℃时的溶液一定为饱和溶液
D.溶液的质量减少
D
A
3、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A B C D
A
B
C
D
课堂练习
课堂练习
4、下图是利用海水提取粗盐的过程:
(1)图中①是 池。
(2)根据海水晒盐的原理,下列说法中正确的是( )
A.海水进入贮水池,海水的成分基本不变
B.在①中,海水中氯化钠的质量逐渐增加
C.在①中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
蒸发
AC
重要的不是知识的数量,而是知识的质量,有些人知道很多很多,但却不知道最有用的东西。
---托尔斯泰
第九单元 课题2 溶解度
汤太淡了,怎么办?
一锅汤里面能不能无限制地溶解食盐呢?
情境引入
操作 现象
向20mL水中加入3g氯化钠,搅拌
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
结论1:氯化钠、硝酸钾不能无限制地溶解在一定量的水中。
环节一:饱和溶液和不饱和溶液概念的形成
演示实验9-5
操作 现象
向20mL水中加入3g硝酸钾,搅拌
分组实验9-6
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
再加5g氯化钠,
搅拌
再加5g硝酸钾,搅拌
操作 现象
向20mL水中加入3g氯化钠,搅拌
再加5g氯化钠,搅拌
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
烧杯中形成无色溶液
结论2:增加水的质量,氯化钠溶解的质量也增加。
环节一:饱和溶液和不饱和溶液概念的形成
演示实验9-5
再加15mL水,搅拌
环节一:饱和溶液和不饱和溶液概念的形成
操作 现象
向20mL水中加入3g硝酸钾,搅拌
再加5g硝酸钾,搅拌
结论3:温度升高,硝酸钾溶解能力增强。
分组实验9-6
烧杯中形成无色溶液
烧杯中溶液底部有未溶解的固体
未溶解的固体溶解了,烧杯中形成无色溶液
烧杯中形成无色溶液
固体从溶液中结晶出来
温度降低,硝酸钾溶解能力降低。
加热
再加5g硝酸钾,搅拌
冷却
饱和溶液和不饱和溶液
【饱和溶液】在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。
【不饱和溶液】在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时,所得到的溶液叫做这种溶质的不饱和溶液。
环节一:饱和溶液和不饱和溶液概念的形成
注意:只有指明“在一定量溶剂里”和“在一定温度下”,
溶液的“饱和”和“不饱和”才有确定的意义。
故表述饱和溶液时要指明溶质。
如氯化钠饱和溶液、硝酸钾饱和溶液。
加入少量
高锰酸钾
【演示实验】饱和硝酸钾溶液能否溶解高锰酸钾?
环节一:饱和溶液和不饱和溶液概念的形成
思考1:一种溶质的饱和溶液还能溶解其他溶质吗?
通过氢氧化钙溶解过程中电导率的测定,认识饱和溶液形成的微观过程。
第一步:室温下,取 一定量蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用电导率传感器采集数据,将氢氧化钙加入烧杯中。
实验步骤
①氢氧化钙溶于水是以钙离子和氢氧根离子的形式均匀地分散到水分子之间。
②电导率传感器用于测量溶液的导电性强弱;
一定条件下,电导率的大小能反映离子浓度的大小。
环节一:饱和溶液和不饱和溶液概念的形成
查阅资料
实验目的
思考2:从微观角度认识饱和溶液的形成。
环节一:饱和溶液和不饱和溶液概念的形成
操作 溶液状态
向20mL水中加入5g氯化钠,搅拌
再加5g氯化钠,搅拌
再加15mL水,搅拌
操作 溶液状态
向20mL水中加入2g硝酸钾,搅拌
再加5g硝酸钾,搅拌
加热
再加5g硝酸钾,搅拌
冷却
讨论:通过哪些方法可以实现饱和溶液和不饱和溶液的转化?
环节二:饱和溶液和不饱和溶液的相互转化
溶液1——不饱和溶液
溶液2——饱和溶液
溶液3——
溶液4——不饱和溶液
溶液5——饱和溶液
溶液6——不饱和溶液
溶液7——
溶液8——饱和溶液
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
升温和降温针对的是大多数物质,特殊物质如熟石灰Ca(OH)2的饱和与不饱和溶液转化,温度变化和一般物质相反。
环节二:饱和溶液和不饱和溶液的相互转化
【例1】20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
D
饱和溶液
不包括未溶解的固体!
课堂练习
【例2】现有一瓶接近饱和的硝酸钾溶液,使它变成饱和溶液的方法中,不正确的是( )
A.加入硝酸钾固体
B.降低溶液的温度
C.蒸发一部分溶剂后再恢复到原温度
D.用滴管吸出一部分溶液
D
课堂练习
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
环节二:饱和溶液和不饱和溶液的相互转化
结晶
?
【结晶】已溶解在溶液里的溶质从溶液中以晶体的形式析出,叫做结晶。(分离混合物的方法)
硝酸钾晶体
雪花晶体
冷却热饱和溶液
结晶后所得到的溶液是饱和溶液。
环节三:结晶及其应用
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
结晶
冷却
环节三:结晶及其应用
?
不饱和溶液
环节三:结晶及其应用
写出每个流程中分别是氯化钠的饱和溶液还是不饱和溶液?
不饱和溶液
不饱和溶液
饱和溶液
饱和溶液
海
水
晒
盐
饱和
溶液
不饱和
溶液
1.增加溶剂
2.升高温度
3.降低温度
1.增加溶质
2.蒸发溶剂
归纳小结
结晶
蒸发溶剂
冷却
如何判断实验9-5最后得到的溶液是饱和溶液还是不饱和溶液?
环节四:判断溶液是否饱和的一般思路和方法
某溶液
总结:判断溶液是否饱和的一般思路和方法
有未溶解的溶质时为饱和溶液。
没有未溶解的溶质
加少量该溶质,观察是否继续溶解。
蒸发该溶液,观察是否立即结晶。
给该溶液降温,观察是否立即结晶。
环节四:判断溶液是否饱和的一般思路和方法
(温度升高,该溶质溶解能力增强)
课堂练习
1、t℃时,有一杯接近饱和的硝酸钾溶液,下列做法一定不能使其变为饱和溶液的是( )
A.恒温蒸发溶剂
B.降低溶液的温度
C.向溶液中加入硝酸钾
D.向溶液中加入t℃时硝酸钾的饱和溶液
2、现将40℃时的一杯硝酸钾溶液降温至20℃,结果有少量晶体析出,下列说法错误的是( )
A.40℃时的溶液一定为饱和溶液
B.溶剂的质量没有改变
C.20℃时的溶液一定为饱和溶液
D.溶液的质量减少
D
A
3、A、B、C、D四个烧杯里分别盛有质量相等的同种溶剂,向四个烧杯加入某溶质,且固体溶质质量依次减少(温度相同),充分溶解,(如下图所示)回答下列各问(填序号)
(1)_____________中盛的一定是饱和溶液;
(2)_____________中盛的可能是饱和溶液;
(3)_____________中盛的一定是不饱和溶液;
A B C D
A
B
C
D
课堂练习
课堂练习
4、下图是利用海水提取粗盐的过程:
(1)图中①是 池。
(2)根据海水晒盐的原理,下列说法中正确的是( )
A.海水进入贮水池,海水的成分基本不变
B.在①中,海水中氯化钠的质量逐渐增加
C.在①中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
蒸发
AC
重要的不是知识的数量,而是知识的质量,有些人知道很多很多,但却不知道最有用的东西。
---托尔斯泰
同课章节目录
