9.3溶解度同步练习—2021_2022学年九年级化学京改版(2013)版下册(word版含解析)
文档属性
| 名称 | 9.3溶解度同步练习—2021_2022学年九年级化学京改版(2013)版下册(word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 207.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 22:47:35 | ||
图片预览




文档简介
9.3溶解度
一、选择题(共16题)
1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A.蒸馏 B.蒸发 C.过滤 D.溶解
2.已知20 ℃时100 g 水中最多能溶解36 g 氯化钠,20 ℃时向100 g 水中加50 g 氯化钠,充分溶解后,所得溶液中溶质的质量分数为
A.36% B.50% C.33.3% D.26. 5%
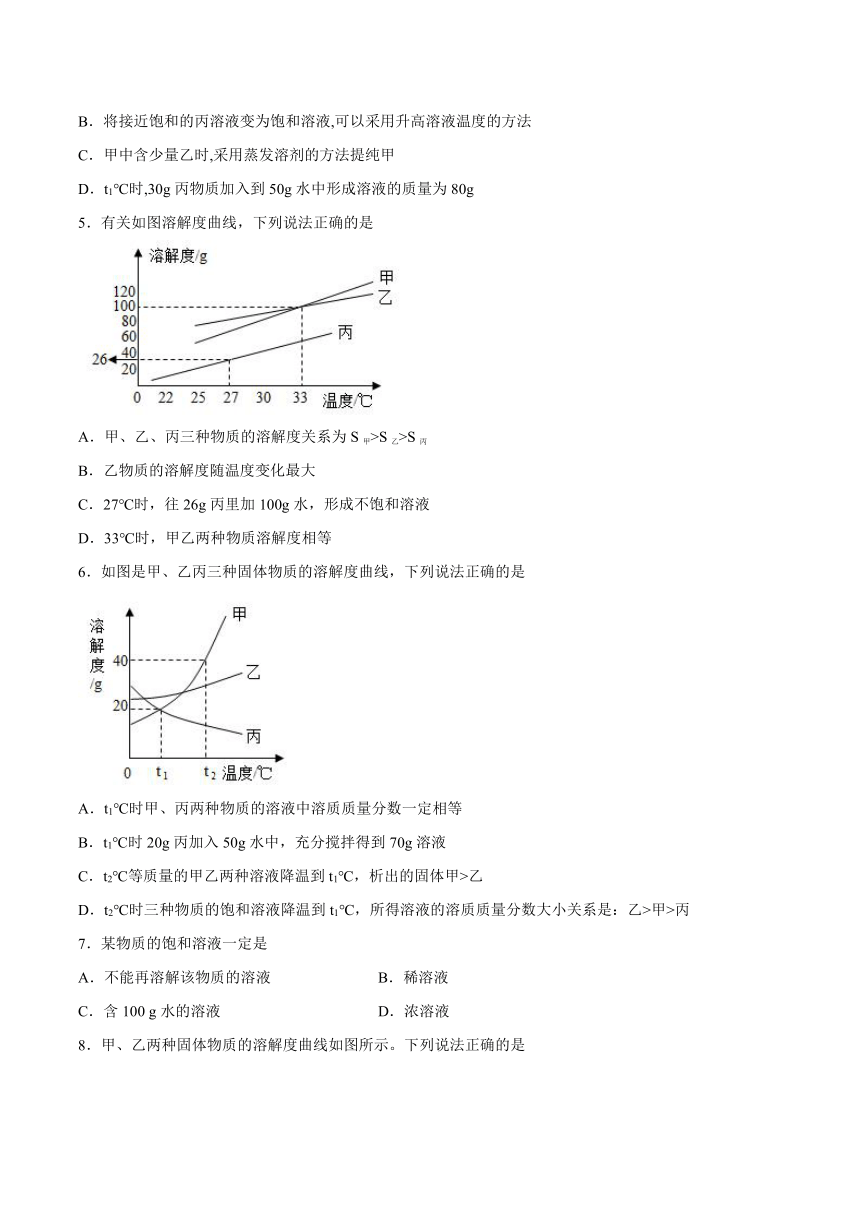
3.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后两者的溶解情况如图-1所其溶解度曲线如图-2所示,下列说法正确的是( )
A.甲对应的溶解度曲线为b
B.10℃时,甲、乙的两种溶液都是饱和溶液
C.10℃时,乙溶液中溶质与溶剂质量比为3:10
D.当温度升高至25℃时,甲、乙两物质的溶质质量分数均不变
4.如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是
A.甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D.t1℃时,30g丙物质加入到50g水中形成溶液的质量为80g
5.有关如图溶解度曲线,下列说法正确的是
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲乙两种物质溶解度相等
6.如图是甲、乙丙三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时甲、丙两种物质的溶液中溶质质量分数一定相等
B.t1℃时20g丙加入50g水中,充分搅拌得到70g溶液
C.t2℃等质量的甲乙两种溶液降温到t1℃,析出的固体甲>乙
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数大小关系是:乙>甲>丙
7.某物质的饱和溶液一定是
A.不能再溶解该物质的溶液 B.稀溶液
C.含100 g水的溶液 D.浓溶液
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.乙的溶解度随温度的升高而增大
B.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液中溶质的质量分数相等
C.将 t1℃时甲的饱和溶液升温至t2℃,仍是饱和溶液
D.分别将t1℃时甲、乙的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲大于乙
9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法不合理的是
A.t1℃时,乙物质的溶解度是20g
B.若将t2℃甲、乙、丙三种物质的饱和溶液分别降温到t1℃,溶质质量分数最小的是丙
C.t1℃时,将15g甲加入到150g水中,充分溶解,继续加入甲物质,可提高该溶液在t1℃时的溶质质量分数
D.取甲、乙的混合物50g溶于100g热水中,待冷却到t1℃,若甲析出晶体而乙不析出晶体,则混合物中甲的质量分数ω的取值范围是60%≤ω<100%
10.如图是硝酸钾和氯化钠的溶解度曲线,据图判断下列说法正确的是
A.硝酸钾的溶解度大于氯化钠的溶解度
B.60℃时,硝酸钾和氯化钠的饱和溶液各100g,分别降温到t℃时,两种溶液析出的晶体质量相等
C.使氯化钠从其溶液中结晶的最好方法是蒸发溶剂
D.60℃时,饱和硝酸钾溶液的溶质质量分数是110%
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是
A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液
B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少
C.分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲=丙
D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多,丙溶液中无晶体析出
12.如图是三种物质的溶解度曲线,下列说法不正确的是
A.70℃时硝酸钠与硝酸钾的溶解度相等
B.硫酸铈的溶解度随温度升高而降低
C.将70℃时三种物质的饱和溶液降温至30℃,均可得到饱和溶液
D.将80℃时三种物质的饱和溶液降温至10℃,溶质质量分数由大到小的顺序是硝酸钠、硝酸钾、硫酸铈
13.下列有关溶液的说法正确的是
A.盐水的沸点一定比水低 B.溶液一定是无色透明的
C.饱和溶液一定是浓溶液 D.溶液的各部分性质一定相同
14.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
15.列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.表格与图象均能反映温度对固体物质溶解度的影响,表格比图像更直观体现变化规律
B.由表格数据可知,物质的溶解度只受温度影响
C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液
D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成
16.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙两种物质的溶解度相等
B.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>丙>甲
C.甲的溶解度随温度的升高而增大
D.t1℃时,丙的饱和溶液中溶质的质量分数为28.6%
二、综合题(共6题)
17.如图为A、B、C三种固体物质的溶解度曲线。据图回答下列问题。
(1)在______ ℃时,A.C两种物质的溶解度相等。
(2)A、B、C三种物质中,溶解度受温度影响最小的是______。
(3)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是______(填“升高”或“降低”)温度。
(4)温度为t3℃时,三种物质的溶解度由小到大的顺序是______。
18.溶液与人们的生产生活密切相关。
(1)下列物质不属于溶液的是_____(填字母)。
A 冰水混合物 B 石灰水 C 碘酒 D 可乐饮料
(2)下列有关溶液的说法中,正确的是_____(填字母)。
A 溶液都是无色、透明、均一、稳定的液体
B 溶质都以分子的形式分散在溶剂中
C 饱和溶液的浓度不一定大于不饱和溶液的浓度
(3)喝了汽水后,常常会打嗝。这说明气体的溶解度与_____有关。
(4)室温时分别向三份等质量的水中加入硝酸铵、氯化钠和氢氧化钠固体,充分搅拌至不再溶解时,烧杯底部均有固体剩余。静置至室温后,观察到溶解____(填溶质的化学式)的烧杯底部固体明显减少。
温度(℃) 0 10 20 30 40 50 60
溶 解 度 /g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氢氧化钠 42.0 51.0 109.0 119.0 129.0 145.0 174.0
硝酸铵 119.0 140.0 190.0 236.0 286.0 303.0 421.0
(5)配制2500 mL浓度为0.9 g/100 mL的生理盐水需要溶质质量分数为3%的氯化钠溶液_____ g。
19.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
20.水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任
(1)下列物质溶于水,能形成溶液的是 _____ (填序号).
A 淀粉 B 蔗糖 C 面粉 D 高锰酸钾
(2)用如图甲装置进行电解水的实验,中收集到的气体是 _____ ,该实验说明水是由 _____ 组成的.
(3)电解水实验中往往要在水中滴入氢氧化钠溶液,其目的是 _____ 若将质量分数为的溶液进行电解,当溶液中 的质量分数升高到时停止电解,则生成的的质量为 _____。
(4)我国水资源丰富,但分布不均,有些村民地下水作为生活用水,人们常用 _____ 检验地下水是硬水还是软水,生活中可用 _____ 的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是 _____
(5)如图是A、B、C三种固体物质的溶解度曲线,据图回答:
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ (填写字母序号).
②时,将物质加入到水中不断搅拌,形成的溶液质量为 _____.
③将时,A、B、C三种物质饱和溶液的温度升高到,此时这三种溶液的溶质质量分数由小到大的关系是 _____ .
21.硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。
(1)图1中P点含义是________
(2)图2中烧杯甲中溶液的溶质是________(填化学式)。
(3)下列说法正确的是________(填标号)。
A图2烧杯甲中的溶液是饱和溶液
B图2烧杯乙中的溶液为饱和溶液
C.图3烧杯甲中溶液质量比烧杯乙中溶液质量大
(4)图3烧杯乙溶液中溶质的质量分数是________(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行_____(填“是”或“否”)。
22.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
(查阅资料)
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
参考答案
1.A
【详解】
粗盐提纯的步骤有溶解、过滤、蒸发,不需要的操作是蒸馏,故选A。
2.D
【详解】
在20 ℃时100 g 水中最多能溶解36 g 氯化钠,20 ℃时向100 g 水中加50 g 氯化钠,充分溶解后,只能溶解36g,所得溶液的质量为136g,溶质的质量分数为 ×100%=26. 5%.
故选D
3.C
【详解】
A.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后甲未完全溶解,乙溶解完,根据图-2知:10℃时,b的溶解度大于物质a,所以甲对应的溶解度曲线是a,选项A错;
B.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后甲未完全溶解,乙溶解完,甲是饱和溶液,乙的溶解度大于30g,所以乙是不饱和溶液,选项B错;
C.10℃时,乙完全溶解,故溶质的质量为3g,溶剂的质量为10g,乙溶液中溶质与溶剂质量比为3:10,选项C正确;
D.当温度升高至25℃时,甲、乙的溶解度增大,甲中未溶解的物质继续溶解,溶质的质量分数会变大,选项D错;
故选C
4.B
【详解】
A、没有说明甲乙饱和溶液的质量是否相等,所以无法判断析出晶体的质量,故选项错误;
B、由曲线图可知,丙的溶解度随温度的升高而减小,所以将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法,故选项正确;
C、甲的溶解度随温度变化明显,故当甲溶液中混有少量乙时,可采用降温结晶提纯甲,故选项错误;
D、t1℃时丙的溶解度为40g,50g水最多溶解20g丙物质,所以30g丙物质加人到50g水中形成溶液的质量为70g,故选项错误;
故选B。
5.D
【详解】
A、在一定温度条件下,100g水中达到饱和状态时,溶解固体物质的质量,单位是g,叫做该温度下固体物质的溶解度,选项中没有给出温度条件,无法进行比较,说法错误;
B、由溶解度曲线可知:溶解度曲线越陡,这种物质的溶解度随温度变化最大,溶解度曲线越平缓,这种物质的溶解度随温度变化最小,乙物质的溶解度随温度变化最小,说法错误;
C、由溶解度曲线可知,27℃时,丙物质的溶解度为26g,即27℃时,往26g丙里加100g水,形成饱和溶液,说法错误;
D、两条溶解度曲线的交点,表示该温度下两种物质的溶解度相等,33℃时,甲乙两种物质溶解度相等,说法正确;
故选:D。
6.D
【详解】
A、t1℃时甲和丙的溶解度相等,所以t1℃时甲、丙饱和溶液中所含溶质质量分数才相等,说法错误;
B、t1℃时,丙的溶解度是20g,即在该温度下,100g水中最多溶解20g,所以50g水中最多溶解10g,t1℃时20g丙加入50g水中,充分搅拌得到10g+50g=60g溶液,说法错误;
C、t2℃等质量的甲乙两种溶液降温到t1℃,因不明确溶液的状态,不能比较析出的固体质量,说法错误;
D、t2℃时三种物质的饱和溶液降温到t1℃,甲和乙的溶解度都变小,都会析出晶体,因为降温后乙的溶解度大于甲的溶解度,所以降温后乙的溶质质量分数大于甲的溶质质量分数,降温后丙的溶解度变大,变为不饱和溶液,溶质质量分数不变,因为t1℃甲的溶解度大于t2℃时丙的溶解度,所以t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数乙>甲>丙,说法正确。
故选:D。
7.A
【详解】
A、在一定温度下,不能继续溶解该物质的溶液,为该溶质的饱和溶液,正确;
B、稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,在一定温度下,某物质的饱和溶液不一定是很稀的溶液,错误; C、不能利用100克水的溶液来判断饱和溶液,主要看某温度下,一定量溶剂中溶解的溶质,错误;D、在一定温度下,某物质的饱和溶液不一定是浓溶液,也可能为稀溶液,如氢氧化钙的饱和溶液为稀溶液,错误。故选A。
8.B
【详解】
A、根据溶解度曲线图,乙的溶解度随温度升高先增大,后减小,错误;
B、t2℃和t1℃时甲、乙的溶解度相同,分别将t2℃时甲、乙的饱和溶液降温至t1℃,两者均析出晶体,还是饱和溶液,故所得溶液中溶质的质量分数相等,正确;
C、根据溶解度曲线图,甲的溶解度随温度升高而增大,将 t1℃时甲的饱和溶液升温至t2℃,溶解度增大,变为不饱和溶液,错误;
D、t2℃和t1℃时甲、乙的溶解度相同,分别将t1℃时甲、乙的饱和溶液升温至t2℃,两者变为不饱和溶液,所得溶液中溶质的质量分数相等,错误;
故选B。
9.C
【详解】
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液溶质质量分数的变化。
A、通过分析溶解度曲线可知,t1℃时,乙物质的溶解度是20g,故A正确;
B、若将t2℃甲、乙、丙三种物质的饱和溶液分别降温到t1℃,甲、乙物质的溶解度减小,应该按照t1℃时的溶解度计算,丙物质的溶解度增大,应该按照t2℃时的溶解度计算,所以溶质质量分数最小的是丙,故B正确;
C、t1℃时,甲物质的溶解度是10g,将15g甲加入到150g水中,充分溶解,刚好达到饱和状态,继续加入甲物质,不能提高该溶液在t1℃时的溶质质量分数,故C错误;
D、甲物质的溶解度受温度的影响较大,而乙物质溶解度受温度影响较小,t1℃时,乙物质的溶解度是20g,所以混合物中甲的质量大于或等于30g,混合物中甲的质量分数ω的取值范围是≥×100%=60%,故D正确。
故选:C。
10.C
【解析】
A、溶解度受温度影响,不指名温度,不能比较溶解度的大小;B、60℃时,硝酸钾和氯化钠的饱和溶液各100g,分别降温到t℃时,硝酸钾的溶解度减小的比氯化钠更多,降温时析出晶体更多;C. 氯化钠的溶解度受温度很小,降低温度时析出的晶体很少,使氯化钠从其溶液中结晶的最好方法是蒸发溶剂;D. 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% 。60℃时,饱和硝酸钾溶液的溶质质量分数=110g÷(110g+100g)×100% ≈52.4%
11.B
【详解】
由题中信息知,A. t2℃时,甲物质溶解度是50g,将50g甲物质放入50g水中,充分搅拌后得到50g+25g=75g甲溶液.故A错误。B. t2℃时,溶解度甲>乙>丙,配制等质量的三种物质的饱和溶液,甲所需要的水最少。故B正确。C. 分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲>丙。故C错误。D. 分别将t2℃时三种物质的饱和溶液,由于没有质量限制,降温到t1℃,不能说甲溶液中析出的晶体最多,丙溶液中肯定无晶体析出。故D错误。
12.C
【详解】
A、根据溶解度曲线,通过分析溶解度曲线可知,70℃时。硝酸钠与硝酸钾的溶解度曲线相交,所以二者的溶解度相等,此选项正确;
B、根据溶解度曲线,硫酸铈的溶解度随温度升高而降低,此选项正确;
C、将70℃时三种物质的饱和溶液降温至30℃,硝酸钠、硝酸钾的溶解度减小,可得到饱和溶液,硫酸铈的溶解度增大,变成不饱和溶液,此选项错误;
D、10℃时,硝酸钠的溶解度最大,硝酸钾、硫酸铈的溶解度相等。降低温度,硝酸钠、硝酸钾的溶解度减小,析出晶体。硫酸铈的溶解度增大,不会析出晶体,应该按照80℃时的溶解度计算。所以将80℃时三种物质的饱和溶液降温至10℃,溶质质量分数由大到小的顺序是:硝酸钠、硝酸钾、硫酸铈,此选项正确。
故选C。
13.D
【详解】
试题分析:A、沸点还与气压有关,因此不一定,是否错误;B、如硫酸铜溶液为蓝色,说法错误;C、如氢氧化钙微溶于水,它的饱和溶液浓度依然很低,说法错误;D、溶液是均一稳定的混合物,因此各部分性质一定相同,说法正确。
14.D
【详解】
A项,溶液具有均一性,在溶液中各部分的浓度相同,不会因为溶液倒出一半,而使溶液的质量分数减少,错误;
B项,溶液中有晶体析出说明该温度下得到的是饱和溶液,错误;
C项,溶液处于饱和状态,温度不变,溶质的溶解度不变,所以溶质的质量分数不会改变,错误;
D项,稀溶液、浓溶液与溶液是否饱和没有必然的联系,正确。
15.D
【详解】
A.通过分析溶解度表和溶解度曲线可知,图象与表格均能反映温度对固体物质溶解度的影响,其中图象的优点是变化规律更直观,故A错误;B.由表格数据可知,物质的溶解度受温度和溶剂影响,故B错误;C.40℃时,氢氧化钠在水中的溶解度是129g,氢氧化钠在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和酒精中,在水中不能形成饱和溶液,故C错误;D.40℃时,碳酸钠在酒精中难溶,所以将CO2通入饱和的NaOH酒精溶液中有沉淀生成,故D正确;故选D。
16.B
【解析】A、根据溶解度曲线的交点解答;
B、据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答;
C、根据溶解度曲线解答;
D、根据饱和溶液溶质质量分数解答。
解:A、根据题中溶解度曲线图可知t2℃时,甲乙两种物质的溶解度相等,故正确;
B、根据曲线图,甲、乙的溶解度都随温度的升高而增大,故将t3℃时甲、乙的饱和溶液降温至t1℃,都有晶体析出,都成为t1℃时的饱和溶液,但由于在t1℃,乙的溶解度大于甲,故此时甲、乙的饱和溶液溶质的质量分数大小关系是乙>甲,而丙的溶解度都随温度的升高而减少,故将t3℃时丙的饱和溶液降温至t1℃,变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,而通过观察,丙在t3℃时的溶解度要小于甲在t1℃时的溶解度,故丙的溶质的质量分数最小,故所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙,错误;
C、根据题中溶解度曲线图可知, 甲的溶解度随温度的升高而增大,故正确;
D、t1℃时,丙的饱和溶液中溶质的质量分数为100%=28.6%,故正确。
故选B。
17.t1 B 降低 C【详解】
(1)由溶解曲线图可知:在t1时,A、C两种物质的溶解度曲线相交于一点故在此温度下它们溶解度相等,故填:t1;
(2)根据溶解度曲线图可知A、B、C三种物质中,溶解度受温度影响最小的是B,它的曲线变化最平缓。故填:B;
(3)A物质的溶解度随着温度的升高而升高,故要使A物质的不饱和溶液变为饱和溶液,可采用的方法是:降低温度。故填:降低;
(4)又溶解度曲线可知温度为t3℃时,三种物质的溶解度由小到大的顺序是C18.A C 温度 NH4NO3 750
【详解】
(1)冰水混合物只含一种物质水,所以不是溶液,石灰水是氢氧化钙的水溶液,碘酒是碘的酒精溶液,可乐饮料是溶液,所以选A。
(2)溶液不都是无色的,如硫酸铜溶液;
溶质也不一定是分子,如硫酸铜溶液中溶质是离子;
同一温度下,饱和溶液不一定比不饱和溶液的浓度大,例如氢氧化钙和硝酸钾两种物质,所以选C。
(3)喝了汽水后,常常会打嗝。这是因为喝下去后体温将汽水加热,二氧化碳的溶解度因温度的升高而减小,说明气体的溶解度与温度有关,故填:温度;
(4)室温时,即20℃时,等质量的水中加入硝酸铵、氯化钠、氢氧化钠固体时,都有剩余,但硝酸铵溶解时吸热,溶液的温度要低于室温,氢氧化钠溶解时放热,溶液的温度要高于室温,所以恢复到室温时,硝酸铵溶液中的晶体因溶液的温度升高而多溶解一些,所以溶解硝酸铵的烧杯底部固体明显减少,硝酸铵的化学式为NH4NO3;
(5)设需要溶质质量分数为3%的氯化钠溶液质量为x,
2500mL×0.9 g/100 mL=3%x,x=750g,故填:750。
19.酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
【详解】
(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
20.BD 氢气 氢元素和氧元素 增强水的导电性 5 肥皂水 煮沸 吸附色素和异味 B>C>A 65 B>C>A
【详解】
(1)淀粉溶于水形成悬浊液,蔗糖溶于水形成均一稳定的混合物,属于溶液;面粉溶于水形成悬浊液;高锰酸钾溶于水形成均一稳定的混合物,属于溶液,故选BD。
(2)水在通电的条件下生成氢气和氧气,氢气与氧气的体积之比为2:1,故b中收集到的是氢气;该实验说明水是由氢元素和氧元素组成的;
(3)电解水试验中加入氢氧化钠的目的是增强水的导电性,应为氢氧化钠再水中以离子形态存在;
氢氧化钠在水电解前后质量不变,90g质量分数为的溶液中含有氢氧化钠的质量为0.9g,进行电解,当溶液中的质量分数升高到时,溶液的质量为,则电解的水的质量为45g,设生成的氢气的质量为x
x=5g
(4)常用肥皂水检验软水和硬水,加入肥皂水,产生泡沫较多的是软水,产生浮渣较多的是软水;生活中常用煮沸的方法使水中的钙镁离子转化为沉淀从而降低水的硬度;净水器中活性炭的作用是吸附色素和异味;
(5)①由溶解度曲线可知,时,A、B、C三种物质的溶解度由大到小的顺序是B>C>A;
②时,A的溶解度为30g,即100g水中溶解30gA刚好达到饱和状态,故将物质加入到水中不断搅拌,只能溶解15gA,形成的溶液质量为65g;
③时,A、B、C三种物质饱和溶液的溶质质量分数大小为B>C>A,温度升高到,A、B的溶质质量分数不变,C的溶质质量分数减小,但C的溶质质量分数大于A,此时这三种溶液的溶质质量分数由小到大的关系是B>C>A。
21.在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g KNO3 B 25.9% 否
【详解】
(1)P点为硝酸钾和氯化钠溶解度曲线的交点,因此P点的含义是在t℃时,氯化钠和硝酸钾的溶解度都是36.2g或者在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g;
故填:在t1℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g。
(2)20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,乙烧杯中固体全部溶解,甲烧杯固体还有部分未溶解,根据溶解度曲线可知20℃时,氯化钠的溶解度大于硝酸钾,因此烧杯甲中溶液的溶质是KNO3;
故填:KNO3。
(3)20℃时,氯化钠的溶解度为36g,而甲烧杯中是100g的水放了35g的氯化钠,因此没有达到饱和状态,故A错;图2中乙烧杯中还有部分固体未溶解,因此肯定是饱和溶液,故B对;图3中甲、乙烧杯中溶剂的质量都是100g,溶质的质量都是35g,因此溶质的质量分数都是一样的,故C错;
故填:B。
(4)图3中乙烧杯中溶剂的质量是100g,溶质的质量是35g,根据溶质的质量分数公式可知,w(KNO3)=×100%=25.9%;50℃时硝酸钾的溶解度是85.5g,则50g水中最多可以溶解42.75g,将烧杯乙蒸发掉50g水,则水有50g,硝酸钾有35g,因此还是不饱和状态。
故填:25.9% 否。
22.增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
【详解】
(1)反应物的接触面积越多,反应速率越快,则菱锶矿、焦炭混合粉碎的目的是增大反应物之间的接触面积,使反应更充分,加快反应反应速率。在化合物中正负化合价的代数和为零,碳酸根离子显-2价,设Sr的化合价为x,则x+(﹣2)=0,解得x=+2,所以碳酸锶(SrCO3)中锶的化合价为+2,即。
(2)分析流程图信息可知,立窑煅烧中反应物是焦炭和碳酸锶,生成物为锶和一氧化碳,故得到单质锶的化学方程式写为。
(3)氢氧化锶溶解度随温度升高而增大、氢氧化钙溶解度随温度升高而减小、氢氧化镁是不溶物,则“浸取”中用热水浸取而不用冷水的原因是增大氢氧化锶的溶解度,使氢氧化钙析出;由图可知,滤渣1含有Ca(OH)2和氢氧化镁[Mg(OH)2]。
(4)“除钡”环节生成硫酸钡沉淀,故滤渣2的化学式是BaSO4。
(5)氢氧化锶的溶解度随温度升高而增大,则结晶采用的是降温结晶法;得到的“母液”一定是氢氧化锶的饱和溶液。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,是因为NH4HCO3受热易分解,故为加速化学反应变率且防止NH4HCO3受热分解,应反应需的温度应控制在在65-80℃。
(7)详见答案。
一、选择题(共16题)
1.食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A.蒸馏 B.蒸发 C.过滤 D.溶解
2.已知20 ℃时100 g 水中最多能溶解36 g 氯化钠,20 ℃时向100 g 水中加50 g 氯化钠,充分溶解后,所得溶液中溶质的质量分数为
A.36% B.50% C.33.3% D.26. 5%
3.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后两者的溶解情况如图-1所其溶解度曲线如图-2所示,下列说法正确的是( )
A.甲对应的溶解度曲线为b
B.10℃时,甲、乙的两种溶液都是饱和溶液
C.10℃时,乙溶液中溶质与溶剂质量比为3:10
D.当温度升高至25℃时,甲、乙两物质的溶质质量分数均不变
4.如图为甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线。下列相关说法中正确的是
A.甲和乙两物质的饱和溶液温度从t3℃降至t2℃时,析出晶体质量甲>乙
B.将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法
C.甲中含少量乙时,采用蒸发溶剂的方法提纯甲
D.t1℃时,30g丙物质加入到50g水中形成溶液的质量为80g
5.有关如图溶解度曲线,下列说法正确的是
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加100g水,形成不饱和溶液
D.33℃时,甲乙两种物质溶解度相等
6.如图是甲、乙丙三种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时甲、丙两种物质的溶液中溶质质量分数一定相等
B.t1℃时20g丙加入50g水中,充分搅拌得到70g溶液
C.t2℃等质量的甲乙两种溶液降温到t1℃,析出的固体甲>乙
D.t2℃时三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数大小关系是:乙>甲>丙
7.某物质的饱和溶液一定是
A.不能再溶解该物质的溶液 B.稀溶液
C.含100 g水的溶液 D.浓溶液
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.乙的溶解度随温度的升高而增大
B.分别将t2℃时甲、乙的饱和溶液降温至t1℃,所得溶液中溶质的质量分数相等
C.将 t1℃时甲的饱和溶液升温至t2℃,仍是饱和溶液
D.分别将t1℃时甲、乙的饱和溶液升温至t2℃,所得溶液中溶质的质量分数甲大于乙
9.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法不合理的是
A.t1℃时,乙物质的溶解度是20g
B.若将t2℃甲、乙、丙三种物质的饱和溶液分别降温到t1℃,溶质质量分数最小的是丙
C.t1℃时,将15g甲加入到150g水中,充分溶解,继续加入甲物质,可提高该溶液在t1℃时的溶质质量分数
D.取甲、乙的混合物50g溶于100g热水中,待冷却到t1℃,若甲析出晶体而乙不析出晶体,则混合物中甲的质量分数ω的取值范围是60%≤ω<100%
10.如图是硝酸钾和氯化钠的溶解度曲线,据图判断下列说法正确的是
A.硝酸钾的溶解度大于氯化钠的溶解度
B.60℃时,硝酸钾和氯化钠的饱和溶液各100g,分别降温到t℃时,两种溶液析出的晶体质量相等
C.使氯化钠从其溶液中结晶的最好方法是蒸发溶剂
D.60℃时,饱和硝酸钾溶液的溶质质量分数是110%
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是
A.t2℃时将50g甲物质放入50g水中,充分搅拌后得到100g甲溶液
B.t2℃时配制等质量的三种物质的饱和溶液,甲所需要的水最少
C.分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲=丙
D.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体最多,丙溶液中无晶体析出
12.如图是三种物质的溶解度曲线,下列说法不正确的是
A.70℃时硝酸钠与硝酸钾的溶解度相等
B.硫酸铈的溶解度随温度升高而降低
C.将70℃时三种物质的饱和溶液降温至30℃,均可得到饱和溶液
D.将80℃时三种物质的饱和溶液降温至10℃,溶质质量分数由大到小的顺序是硝酸钠、硝酸钾、硫酸铈
13.下列有关溶液的说法正确的是
A.盐水的沸点一定比水低 B.溶液一定是无色透明的
C.饱和溶液一定是浓溶液 D.溶液的各部分性质一定相同
14.下列关于溶液的说法正确的是( )
A.从一杯质量分数为10%的食盐溶液中倒出一半,余下的溶液质量分数为5%
B.某饱和溶液降温后析出晶体,此时它就变成不饱和溶液
C.向某物质的饱和溶液中加少量该物质,恒温下放置一定时间后,溶液中的溶质质量分数变大
D.稀溶液可能是饱和溶液,浓溶液也可能是不饱和溶液
15.列表和作图是常用的数据处理方法.结合材料所绘图表判断下列说法正确的是( )
氢氧化钠 碳酸钠
20℃ 40℃ 20℃ 40℃
水 109g 129g 21.8g 49g
酒精 17.3g 40g 不溶 不溶
A.表格与图象均能反映温度对固体物质溶解度的影响,表格比图像更直观体现变化规律
B.由表格数据可知,物质的溶解度只受温度影响
C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液
D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成
16.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲、乙两种物质的溶解度相等
B.分别将t3℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>丙>甲
C.甲的溶解度随温度的升高而增大
D.t1℃时,丙的饱和溶液中溶质的质量分数为28.6%
二、综合题(共6题)
17.如图为A、B、C三种固体物质的溶解度曲线。据图回答下列问题。
(1)在______ ℃时,A.C两种物质的溶解度相等。
(2)A、B、C三种物质中,溶解度受温度影响最小的是______。
(3)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是______(填“升高”或“降低”)温度。
(4)温度为t3℃时,三种物质的溶解度由小到大的顺序是______。
18.溶液与人们的生产生活密切相关。
(1)下列物质不属于溶液的是_____(填字母)。
A 冰水混合物 B 石灰水 C 碘酒 D 可乐饮料
(2)下列有关溶液的说法中,正确的是_____(填字母)。
A 溶液都是无色、透明、均一、稳定的液体
B 溶质都以分子的形式分散在溶剂中
C 饱和溶液的浓度不一定大于不饱和溶液的浓度
(3)喝了汽水后,常常会打嗝。这说明气体的溶解度与_____有关。
(4)室温时分别向三份等质量的水中加入硝酸铵、氯化钠和氢氧化钠固体,充分搅拌至不再溶解时,烧杯底部均有固体剩余。静置至室温后,观察到溶解____(填溶质的化学式)的烧杯底部固体明显减少。
温度(℃) 0 10 20 30 40 50 60
溶 解 度 /g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氢氧化钠 42.0 51.0 109.0 119.0 129.0 145.0 174.0
硝酸铵 119.0 140.0 190.0 236.0 286.0 303.0 421.0
(5)配制2500 mL浓度为0.9 g/100 mL的生理盐水需要溶质质量分数为3%的氯化钠溶液_____ g。
19.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)消毒酒精是医疗上常用的一种溶液,其溶质是________。
(2)现有100g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增大一倍,应蒸发掉水______g。
(3)为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
①实验一的目的是_________。实验一的现象是:氯化钠溶于水溶液,氯化钠几乎不溶于酒精。对比得出的实验结论是_________。
②实验二的目的是________。
思路分析:在实验中需要改变的因素是________,需要保持不变的因素是________。
实验步骤及现象:取一定量的硝酸钾加入5mL水中,充分振荡,有部分硝酸钾未溶解;加热后硝酸钾完全溶解,冷至室温又有部分硝酸钾析出。
实验结论:在________保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会________;降低温度时,其最大溶解量会_______。
20.水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任
(1)下列物质溶于水,能形成溶液的是 _____ (填序号).
A 淀粉 B 蔗糖 C 面粉 D 高锰酸钾
(2)用如图甲装置进行电解水的实验,中收集到的气体是 _____ ,该实验说明水是由 _____ 组成的.
(3)电解水实验中往往要在水中滴入氢氧化钠溶液,其目的是 _____ 若将质量分数为的溶液进行电解,当溶液中 的质量分数升高到时停止电解,则生成的的质量为 _____。
(4)我国水资源丰富,但分布不均,有些村民地下水作为生活用水,人们常用 _____ 检验地下水是硬水还是软水,生活中可用 _____ 的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是 _____
(5)如图是A、B、C三种固体物质的溶解度曲线,据图回答:
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ (填写字母序号).
②时,将物质加入到水中不断搅拌,形成的溶液质量为 _____.
③将时,A、B、C三种物质饱和溶液的温度升高到,此时这三种溶液的溶质质量分数由小到大的关系是 _____ .
21.硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。
(1)图1中P点含义是________
(2)图2中烧杯甲中溶液的溶质是________(填化学式)。
(3)下列说法正确的是________(填标号)。
A图2烧杯甲中的溶液是饱和溶液
B图2烧杯乙中的溶液为饱和溶液
C.图3烧杯甲中溶液质量比烧杯乙中溶液质量大
(4)图3烧杯乙溶液中溶质的质量分数是________(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行_____(填“是”或“否”)。
22.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
(查阅资料)
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
参考答案
1.A
【详解】
粗盐提纯的步骤有溶解、过滤、蒸发,不需要的操作是蒸馏,故选A。
2.D
【详解】
在20 ℃时100 g 水中最多能溶解36 g 氯化钠,20 ℃时向100 g 水中加50 g 氯化钠,充分溶解后,只能溶解36g,所得溶液的质量为136g,溶质的质量分数为 ×100%=26. 5%.
故选D
3.C
【详解】
A.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后甲未完全溶解,乙溶解完,根据图-2知:10℃时,b的溶解度大于物质a,所以甲对应的溶解度曲线是a,选项A错;
B.10℃时,将甲、乙两种固体各3g分别放入盛有10mL水的试管中、一段时间后甲未完全溶解,乙溶解完,甲是饱和溶液,乙的溶解度大于30g,所以乙是不饱和溶液,选项B错;
C.10℃时,乙完全溶解,故溶质的质量为3g,溶剂的质量为10g,乙溶液中溶质与溶剂质量比为3:10,选项C正确;
D.当温度升高至25℃时,甲、乙的溶解度增大,甲中未溶解的物质继续溶解,溶质的质量分数会变大,选项D错;
故选C
4.B
【详解】
A、没有说明甲乙饱和溶液的质量是否相等,所以无法判断析出晶体的质量,故选项错误;
B、由曲线图可知,丙的溶解度随温度的升高而减小,所以将接近饱和的丙溶液变为饱和溶液,可以采用升高溶液温度的方法,故选项正确;
C、甲的溶解度随温度变化明显,故当甲溶液中混有少量乙时,可采用降温结晶提纯甲,故选项错误;
D、t1℃时丙的溶解度为40g,50g水最多溶解20g丙物质,所以30g丙物质加人到50g水中形成溶液的质量为70g,故选项错误;
故选B。
5.D
【详解】
A、在一定温度条件下,100g水中达到饱和状态时,溶解固体物质的质量,单位是g,叫做该温度下固体物质的溶解度,选项中没有给出温度条件,无法进行比较,说法错误;
B、由溶解度曲线可知:溶解度曲线越陡,这种物质的溶解度随温度变化最大,溶解度曲线越平缓,这种物质的溶解度随温度变化最小,乙物质的溶解度随温度变化最小,说法错误;
C、由溶解度曲线可知,27℃时,丙物质的溶解度为26g,即27℃时,往26g丙里加100g水,形成饱和溶液,说法错误;
D、两条溶解度曲线的交点,表示该温度下两种物质的溶解度相等,33℃时,甲乙两种物质溶解度相等,说法正确;
故选:D。
6.D
【详解】
A、t1℃时甲和丙的溶解度相等,所以t1℃时甲、丙饱和溶液中所含溶质质量分数才相等,说法错误;
B、t1℃时,丙的溶解度是20g,即在该温度下,100g水中最多溶解20g,所以50g水中最多溶解10g,t1℃时20g丙加入50g水中,充分搅拌得到10g+50g=60g溶液,说法错误;
C、t2℃等质量的甲乙两种溶液降温到t1℃,因不明确溶液的状态,不能比较析出的固体质量,说法错误;
D、t2℃时三种物质的饱和溶液降温到t1℃,甲和乙的溶解度都变小,都会析出晶体,因为降温后乙的溶解度大于甲的溶解度,所以降温后乙的溶质质量分数大于甲的溶质质量分数,降温后丙的溶解度变大,变为不饱和溶液,溶质质量分数不变,因为t1℃甲的溶解度大于t2℃时丙的溶解度,所以t2℃时三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数乙>甲>丙,说法正确。
故选:D。
7.A
【详解】
A、在一定温度下,不能继续溶解该物质的溶液,为该溶质的饱和溶液,正确;
B、稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,在一定温度下,某物质的饱和溶液不一定是很稀的溶液,错误; C、不能利用100克水的溶液来判断饱和溶液,主要看某温度下,一定量溶剂中溶解的溶质,错误;D、在一定温度下,某物质的饱和溶液不一定是浓溶液,也可能为稀溶液,如氢氧化钙的饱和溶液为稀溶液,错误。故选A。
8.B
【详解】
A、根据溶解度曲线图,乙的溶解度随温度升高先增大,后减小,错误;
B、t2℃和t1℃时甲、乙的溶解度相同,分别将t2℃时甲、乙的饱和溶液降温至t1℃,两者均析出晶体,还是饱和溶液,故所得溶液中溶质的质量分数相等,正确;
C、根据溶解度曲线图,甲的溶解度随温度升高而增大,将 t1℃时甲的饱和溶液升温至t2℃,溶解度增大,变为不饱和溶液,错误;
D、t2℃和t1℃时甲、乙的溶解度相同,分别将t1℃时甲、乙的饱和溶液升温至t2℃,两者变为不饱和溶液,所得溶液中溶质的质量分数相等,错误;
故选B。
9.C
【详解】
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液溶质质量分数的变化。
A、通过分析溶解度曲线可知,t1℃时,乙物质的溶解度是20g,故A正确;
B、若将t2℃甲、乙、丙三种物质的饱和溶液分别降温到t1℃,甲、乙物质的溶解度减小,应该按照t1℃时的溶解度计算,丙物质的溶解度增大,应该按照t2℃时的溶解度计算,所以溶质质量分数最小的是丙,故B正确;
C、t1℃时,甲物质的溶解度是10g,将15g甲加入到150g水中,充分溶解,刚好达到饱和状态,继续加入甲物质,不能提高该溶液在t1℃时的溶质质量分数,故C错误;
D、甲物质的溶解度受温度的影响较大,而乙物质溶解度受温度影响较小,t1℃时,乙物质的溶解度是20g,所以混合物中甲的质量大于或等于30g,混合物中甲的质量分数ω的取值范围是≥×100%=60%,故D正确。
故选:C。
10.C
【解析】
A、溶解度受温度影响,不指名温度,不能比较溶解度的大小;B、60℃时,硝酸钾和氯化钠的饱和溶液各100g,分别降温到t℃时,硝酸钾的溶解度减小的比氯化钠更多,降温时析出晶体更多;C. 氯化钠的溶解度受温度很小,降低温度时析出的晶体很少,使氯化钠从其溶液中结晶的最好方法是蒸发溶剂;D. 饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% 。60℃时,饱和硝酸钾溶液的溶质质量分数=110g÷(110g+100g)×100% ≈52.4%
11.B
【详解】
由题中信息知,A. t2℃时,甲物质溶解度是50g,将50g甲物质放入50g水中,充分搅拌后得到50g+25g=75g甲溶液.故A错误。B. t2℃时,溶解度甲>乙>丙,配制等质量的三种物质的饱和溶液,甲所需要的水最少。故B正确。C. 分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为乙>甲>丙。故C错误。D. 分别将t2℃时三种物质的饱和溶液,由于没有质量限制,降温到t1℃,不能说甲溶液中析出的晶体最多,丙溶液中肯定无晶体析出。故D错误。
12.C
【详解】
A、根据溶解度曲线,通过分析溶解度曲线可知,70℃时。硝酸钠与硝酸钾的溶解度曲线相交,所以二者的溶解度相等,此选项正确;
B、根据溶解度曲线,硫酸铈的溶解度随温度升高而降低,此选项正确;
C、将70℃时三种物质的饱和溶液降温至30℃,硝酸钠、硝酸钾的溶解度减小,可得到饱和溶液,硫酸铈的溶解度增大,变成不饱和溶液,此选项错误;
D、10℃时,硝酸钠的溶解度最大,硝酸钾、硫酸铈的溶解度相等。降低温度,硝酸钠、硝酸钾的溶解度减小,析出晶体。硫酸铈的溶解度增大,不会析出晶体,应该按照80℃时的溶解度计算。所以将80℃时三种物质的饱和溶液降温至10℃,溶质质量分数由大到小的顺序是:硝酸钠、硝酸钾、硫酸铈,此选项正确。
故选C。
13.D
【详解】
试题分析:A、沸点还与气压有关,因此不一定,是否错误;B、如硫酸铜溶液为蓝色,说法错误;C、如氢氧化钙微溶于水,它的饱和溶液浓度依然很低,说法错误;D、溶液是均一稳定的混合物,因此各部分性质一定相同,说法正确。
14.D
【详解】
A项,溶液具有均一性,在溶液中各部分的浓度相同,不会因为溶液倒出一半,而使溶液的质量分数减少,错误;
B项,溶液中有晶体析出说明该温度下得到的是饱和溶液,错误;
C项,溶液处于饱和状态,温度不变,溶质的溶解度不变,所以溶质的质量分数不会改变,错误;
D项,稀溶液、浓溶液与溶液是否饱和没有必然的联系,正确。
15.D
【详解】
A.通过分析溶解度表和溶解度曲线可知,图象与表格均能反映温度对固体物质溶解度的影响,其中图象的优点是变化规律更直观,故A错误;B.由表格数据可知,物质的溶解度受温度和溶剂影响,故B错误;C.40℃时,氢氧化钠在水中的溶解度是129g,氢氧化钠在酒精中的溶解度是40g,所以将50gNaOH分别投入到100g水和酒精中,在水中不能形成饱和溶液,故C错误;D.40℃时,碳酸钠在酒精中难溶,所以将CO2通入饱和的NaOH酒精溶液中有沉淀生成,故D正确;故选D。
16.B
【解析】A、根据溶解度曲线的交点解答;
B、据三种物质的溶解度随温度变化情况及饱和溶液中溶质质量分数的计算式分析解答;
C、根据溶解度曲线解答;
D、根据饱和溶液溶质质量分数解答。
解:A、根据题中溶解度曲线图可知t2℃时,甲乙两种物质的溶解度相等,故正确;
B、根据曲线图,甲、乙的溶解度都随温度的升高而增大,故将t3℃时甲、乙的饱和溶液降温至t1℃,都有晶体析出,都成为t1℃时的饱和溶液,但由于在t1℃,乙的溶解度大于甲,故此时甲、乙的饱和溶液溶质的质量分数大小关系是乙>甲,而丙的溶解度都随温度的升高而减少,故将t3℃时丙的饱和溶液降温至t1℃,变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,而通过观察,丙在t3℃时的溶解度要小于甲在t1℃时的溶解度,故丙的溶质的质量分数最小,故所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙,错误;
C、根据题中溶解度曲线图可知, 甲的溶解度随温度的升高而增大,故正确;
D、t1℃时,丙的饱和溶液中溶质的质量分数为100%=28.6%,故正确。
故选B。
17.t1 B 降低 C
(1)由溶解曲线图可知:在t1时,A、C两种物质的溶解度曲线相交于一点故在此温度下它们溶解度相等,故填:t1;
(2)根据溶解度曲线图可知A、B、C三种物质中,溶解度受温度影响最小的是B,它的曲线变化最平缓。故填:B;
(3)A物质的溶解度随着温度的升高而升高,故要使A物质的不饱和溶液变为饱和溶液,可采用的方法是:降低温度。故填:降低;
(4)又溶解度曲线可知温度为t3℃时,三种物质的溶解度由小到大的顺序是C
【详解】
(1)冰水混合物只含一种物质水,所以不是溶液,石灰水是氢氧化钙的水溶液,碘酒是碘的酒精溶液,可乐饮料是溶液,所以选A。
(2)溶液不都是无色的,如硫酸铜溶液;
溶质也不一定是分子,如硫酸铜溶液中溶质是离子;
同一温度下,饱和溶液不一定比不饱和溶液的浓度大,例如氢氧化钙和硝酸钾两种物质,所以选C。
(3)喝了汽水后,常常会打嗝。这是因为喝下去后体温将汽水加热,二氧化碳的溶解度因温度的升高而减小,说明气体的溶解度与温度有关,故填:温度;
(4)室温时,即20℃时,等质量的水中加入硝酸铵、氯化钠、氢氧化钠固体时,都有剩余,但硝酸铵溶解时吸热,溶液的温度要低于室温,氢氧化钠溶解时放热,溶液的温度要高于室温,所以恢复到室温时,硝酸铵溶液中的晶体因溶液的温度升高而多溶解一些,所以溶解硝酸铵的烧杯底部固体明显减少,硝酸铵的化学式为NH4NO3;
(5)设需要溶质质量分数为3%的氯化钠溶液质量为x,
2500mL×0.9 g/100 mL=3%x,x=750g,故填:750。
19.酒精 50 比较氯化钠在水和酒精中的溶解情况 同种溶质在不同的溶剂中溶解性不同 比较温度对硝酸钾在水中的溶解性的影响 温度 一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量) 溶质和溶剂的种类和质量 增加 减少
【详解】
(1)消毒酒精是医疗上常用的一种溶液,其溶质是酒精,溶剂是水;
(2)若使溶液的溶质质量分数增大一倍,设应蒸发掉水的质量为x,则有100g×10%=(100g-x)×20%,x=50g;
(3)
①根据图示可知实验一的目的是比较氯化钠在水和酒精中的溶解情况;
氯化钠溶于水,几乎不溶于酒精,对比得出的实验结论是同种溶质在不同的溶剂中溶解性不同。
②根据图示可知,硝酸钾和水定量条件下,温度从20℃硝酸钾固体未完全溶解到加热完全溶解再到降温20℃硝酸钾固体未完全溶解,可知实验二的目的是比较温度对硝酸钾在水中的溶解性的影响;
由上分析可知在实验中需要改变的因素是温度,需要保持不变的因素是一定质量的硝酸钾和一定质量的水(或溶质、溶剂的种类及质量);
根据实验现象可知在溶质和溶剂的种类和质量保持不变的情况下,当温度升高时,硝酸钾晶体在水中的最大溶解量会增加,降低温度时,其最大溶解量会减少。
20.BD 氢气 氢元素和氧元素 增强水的导电性 5 肥皂水 煮沸 吸附色素和异味 B>C>A 65 B>C>A
【详解】
(1)淀粉溶于水形成悬浊液,蔗糖溶于水形成均一稳定的混合物,属于溶液;面粉溶于水形成悬浊液;高锰酸钾溶于水形成均一稳定的混合物,属于溶液,故选BD。
(2)水在通电的条件下生成氢气和氧气,氢气与氧气的体积之比为2:1,故b中收集到的是氢气;该实验说明水是由氢元素和氧元素组成的;
(3)电解水试验中加入氢氧化钠的目的是增强水的导电性,应为氢氧化钠再水中以离子形态存在;
氢氧化钠在水电解前后质量不变,90g质量分数为的溶液中含有氢氧化钠的质量为0.9g,进行电解,当溶液中的质量分数升高到时,溶液的质量为,则电解的水的质量为45g,设生成的氢气的质量为x
x=5g
(4)常用肥皂水检验软水和硬水,加入肥皂水,产生泡沫较多的是软水,产生浮渣较多的是软水;生活中常用煮沸的方法使水中的钙镁离子转化为沉淀从而降低水的硬度;净水器中活性炭的作用是吸附色素和异味;
(5)①由溶解度曲线可知,时,A、B、C三种物质的溶解度由大到小的顺序是B>C>A;
②时,A的溶解度为30g,即100g水中溶解30gA刚好达到饱和状态,故将物质加入到水中不断搅拌,只能溶解15gA,形成的溶液质量为65g;
③时,A、B、C三种物质饱和溶液的溶质质量分数大小为B>C>A,温度升高到,A、B的溶质质量分数不变,C的溶质质量分数减小,但C的溶质质量分数大于A,此时这三种溶液的溶质质量分数由小到大的关系是B>C>A。
21.在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g KNO3 B 25.9% 否
【详解】
(1)P点为硝酸钾和氯化钠溶解度曲线的交点,因此P点的含义是在t℃时,氯化钠和硝酸钾的溶解度都是36.2g或者在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g;
故填:在t1℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g。
(2)20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,乙烧杯中固体全部溶解,甲烧杯固体还有部分未溶解,根据溶解度曲线可知20℃时,氯化钠的溶解度大于硝酸钾,因此烧杯甲中溶液的溶质是KNO3;
故填:KNO3。
(3)20℃时,氯化钠的溶解度为36g,而甲烧杯中是100g的水放了35g的氯化钠,因此没有达到饱和状态,故A错;图2中乙烧杯中还有部分固体未溶解,因此肯定是饱和溶液,故B对;图3中甲、乙烧杯中溶剂的质量都是100g,溶质的质量都是35g,因此溶质的质量分数都是一样的,故C错;
故填:B。
(4)图3中乙烧杯中溶剂的质量是100g,溶质的质量是35g,根据溶质的质量分数公式可知,w(KNO3)=×100%=25.9%;50℃时硝酸钾的溶解度是85.5g,则50g水中最多可以溶解42.75g,将烧杯乙蒸发掉50g水,则水有50g,硝酸钾有35g,因此还是不饱和状态。
故填:25.9% 否。
22.增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
【详解】
(1)反应物的接触面积越多,反应速率越快,则菱锶矿、焦炭混合粉碎的目的是增大反应物之间的接触面积,使反应更充分,加快反应反应速率。在化合物中正负化合价的代数和为零,碳酸根离子显-2价,设Sr的化合价为x,则x+(﹣2)=0,解得x=+2,所以碳酸锶(SrCO3)中锶的化合价为+2,即。
(2)分析流程图信息可知,立窑煅烧中反应物是焦炭和碳酸锶,生成物为锶和一氧化碳,故得到单质锶的化学方程式写为。
(3)氢氧化锶溶解度随温度升高而增大、氢氧化钙溶解度随温度升高而减小、氢氧化镁是不溶物,则“浸取”中用热水浸取而不用冷水的原因是增大氢氧化锶的溶解度,使氢氧化钙析出;由图可知,滤渣1含有Ca(OH)2和氢氧化镁[Mg(OH)2]。
(4)“除钡”环节生成硫酸钡沉淀,故滤渣2的化学式是BaSO4。
(5)氢氧化锶的溶解度随温度升高而增大,则结晶采用的是降温结晶法;得到的“母液”一定是氢氧化锶的饱和溶液。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,是因为NH4HCO3受热易分解,故为加速化学反应变率且防止NH4HCO3受热分解,应反应需的温度应控制在在65-80℃。
(7)详见答案。
