黑龙江省绥化市安达市第七高级中学2021-2022学年高二上学期11月月考化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省绥化市安达市第七高级中学2021-2022学年高二上学期11月月考化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1007.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-26 00:00:00 | ||
图片预览



文档简介
安达市第七中学2021-2022学年高二年级11月份月考
化学
一、单选题
1.化学与生产、生活密切相关,下列叙述错误的是( )
A. 纯碱属于盐,热的纯碱溶液可以用于除去餐具上的油污
B. 合成氨工业中使用的氮气来自于空气
C. 明矾和漂白粉常用于自来水的净化和杀菌消毒,其作用原理相同
D. 用作沉淀剂,除去废水中的和
2.下列反应中生成的速率最快的是( )
金属 酸溶液 温度
A Mg 20 ℃
B Mg 30 ℃
C Zn 20 ℃
D Fe 20 ℃
A. A B. B C. C D. D
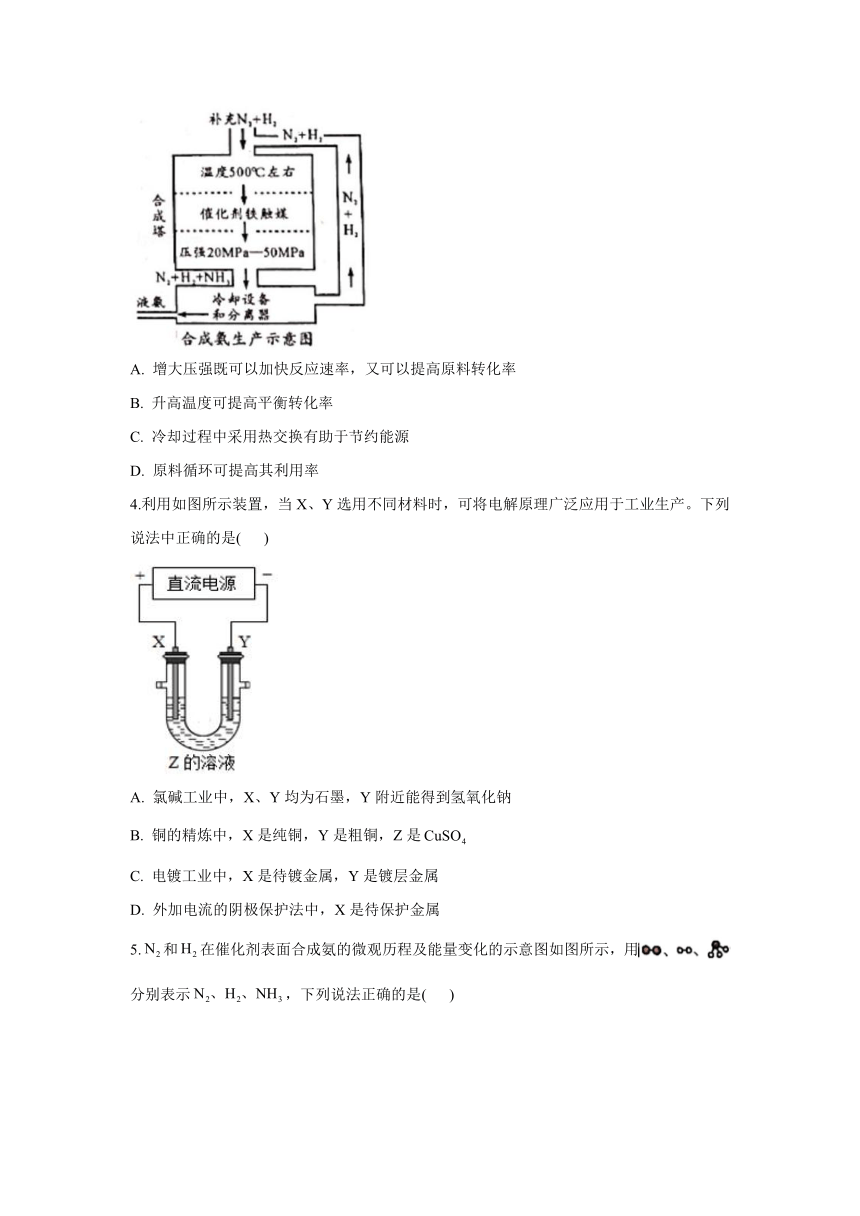
3.德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是( )
A. 增大压强既可以加快反应速率,又可以提高原料转化率
B. 升高温度可提高平衡转化率
C. 冷却过程中采用热交换有助于节约能源
D. 原料循环可提高其利用率
4.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( )
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
5.和在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用分别表示,下列说法正确的是( )
A. 使用催化剂时,合成氨的反应放出的热量减少
B. 使用催化剂能增大反应速率的原因是降低了反应的活化能
C. 在该过程中,N原子和H原子形成了含有非极性键的
D. 合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
6.下列有关说法正确的是( )
A. 将溶液蒸干得到固体
B. 在化学反应中,发生物质变化的同时不一定发生能量变化
C. 向纯水通入少量HCl气体,水的电离程度减小,减小
D. 常温下,放热反应一般能自发进行,吸热反应都不能自发进行
7.化学用语是学习化学重要工具,下列表示物质变化的化学用语中,正确的是( )
A. 碱性可充电镍镉电池的两极材料分别为Cd和NiOOH,其电池总反应可以表示为:
B. 溶液显酸性的主要原因:
C. 钢铁在海水中发生电化学腐蚀的正极反应式为:
D. 水解的离子方程式:
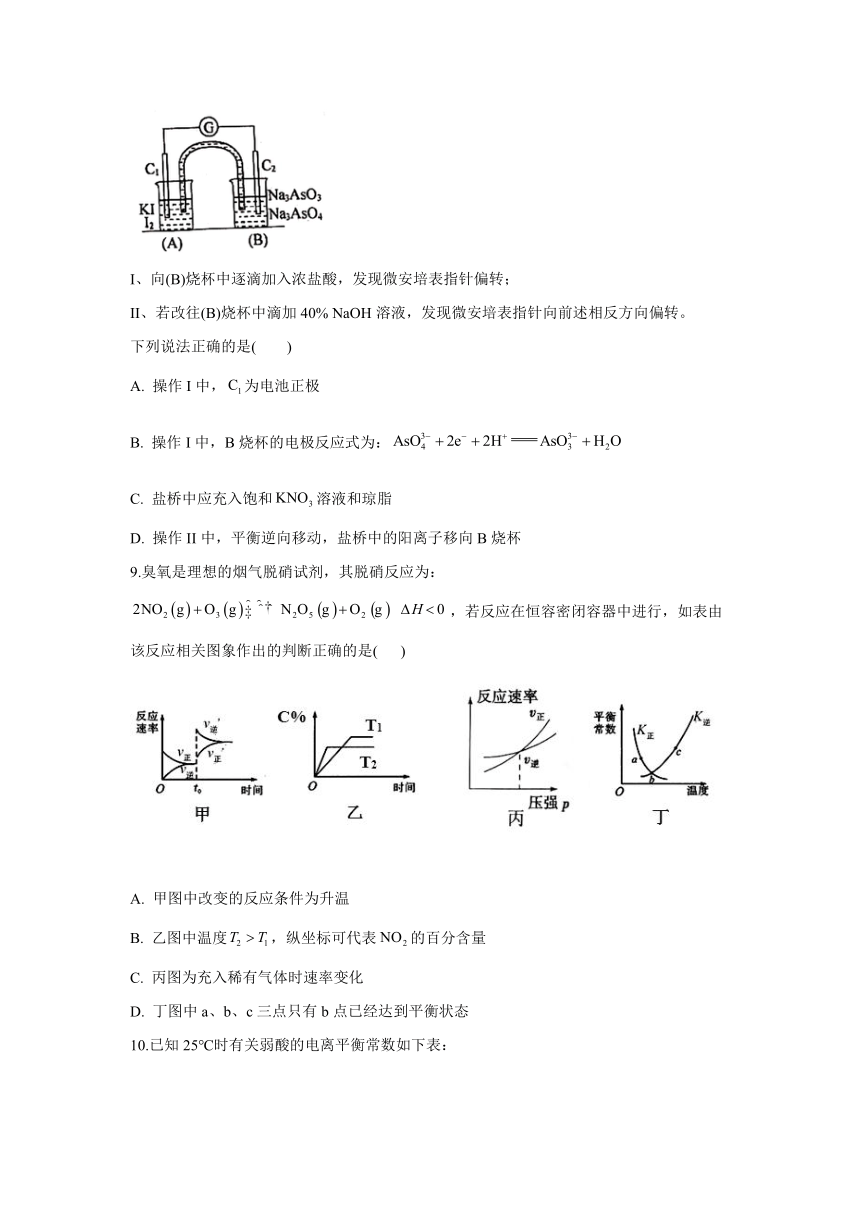
8.已知反应是可逆反应。设计如图装置进行下述操作:
I、向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
II、若改往(B)烧杯中滴加40% NaOH溶液,发现微安培表指针向前述相反方向偏转。
下列说法正确的是( )
A. 操作I中,为电池正极
B. 操作I中,B烧杯的电极反应式为:
C. 盐桥中应充入饱和溶液和琼脂
D. 操作II中,平衡逆向移动,盐桥中的阳离子移向B烧杯
9.臭氧是理想的烟气脱硝试剂,其脱硝反应为:,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
A. 甲图中改变的反应条件为升温
B. 乙图中温度,纵坐标可代表的百分含量
C. 丙图为充入稀有气体时速率变化
D. 丁图中a、b、c三点只有b点已经达到平衡状态
10.已知25℃时有关弱酸的电离平衡常数如下表:
弱酸化学式 HX HY
电离平衡常数
下列推断正确的是( )
A. 等pH的HX和HY浓度大小为:
B. 相同条件下溶液的碱性:
C. 溶液中加入过量HX,离子方程式为:
D. NaY溶液中通入过量,离子方程式为:
11.已知下列四组实验,现象和结论均正确的是( )
操作 现象 结论
A 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 试纸不变蓝 原溶液中
B 将通入溶液中 出现白色沉淀 沉淀
C 滴加溶液,再滴加溶液 先无白色沉淀,后有不溶于稀硝酸的白色沉淀生成 原溶液中有
D 滴加盐酸 有能使澄清石灰水变浑浊的气体产生 原溶液中有
A. A B. B C. C D. D
12.往10 L恒容密闭容器中充入气体X和Y,发生反应,测得实验数据如下表:
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
① 700 2 1 0.9
② 800 2 1 0.8
③ 800 1 0.5 a
下列说法不正确的是( )
A.
B.
C. 800 ℃时,该反应的平衡常数
D. 实验③中,达到平衡时,Y的转化率为20%
13.常温下,用 溶液滴定 溶液所得滴定曲线如图。下列说法正确的是( )
A. 点①所示溶液中:
B. 点②所示溶液中:
C. 点③所示溶液中:
D. 滴定过程中可能出现:
14.室温下有下列四种溶液,下列叙述正确的是( )
编号 ① ② ③ ④
pH 3 3 11 11
溶液 盐酸 醋酸溶液 氢氧化钠溶液 氨水
A. ①、②、③三种溶液的物质的量浓度大小为:①=③>②
B. 相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①>②
C. ②、③两溶液等体积混合,所得溶液中
D. ①、③溶液以体积比为9:11混合,则混合溶液的pH=4
15.已知。向盛有0.1 mol/L 溶液的试管中滴加等体积0.1 mol/L NaCl溶液,静置沉降,取上层清液和下层悬浊液分别进行实验。已知,,下列判断正确的是( )
A. 将浓度为0.1mol/L的溶液逐滴加入浓度均为0.01 mol/L的KCl和的混合溶液中,将先看到沉淀
B. 向清液中滴加0.1 mol/L 溶液,不变
C. 向悬浊液中滴加0.1 mol/L KI溶液,不会有明显变化
D. 上层清液为AgCl的饱和溶液
16.一定温度下,水溶液中和 的浓度变化曲线如图,下列说法正确的是( )
A. 该温度下,a点溶液呈碱性
B. 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性
C. 该温度下,加入NaOH可能引起由b向c的变化
D. b点时,升高温度,可能引起由b向d的变化
二、填空题
17.计算以下数值(以下均为25 ℃时)。
(1)某浓度的溶液中,由水电离的,该溶液的pH=______。
(2)将pH=3的溶液和pH=12的NaOH溶液混合,混合后所得溶液的pH=10,则溶液与NaOH溶液的体积比为______。
(3)与的混合溶液,若测得pH =6,则溶液中______(填精确值)。
(4)将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为______(用含代数a、b等表示)。
(5)pH=5的溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中______。
(6)盐碱地因含较多的,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式______。
18.加热的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ 10 20 30 加热煮沸后冷却到50℃
pH 8.3 8.4 8.5 8.8
(1)写出水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是受热分解,生成了,并推断的水解程度_______(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A.溶液 B.溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10 ℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现的分解温度为150 ℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。
19.高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
已知。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入溶液是为了除去浸出液中的和(溶液中Mn全部转化为),请配平下列除去的离子方程式: ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知浸出液中,、,加入溶液反应一段时间后,溶液中,若溶液pH=3,则此时__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①,;②及其钠盐的溶液中,分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。
①比较三者的酸性强弱_________________________________
②NaHR溶液中存在 _______________________
20.甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,加氢合成甲醇是合理利用 的有效途径。由制备甲醇过程可能涉及反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅲ的 _____(填“<”、“=”或“>”)0;反应Ⅱ的 _____。
(2)在恒压密闭容器中,充入一定量的 和 (假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 的平衡转化率与压强的关系曲线如图所示。
①比较与的大小关系:____ (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 和的条件下,往密闭容器中充入 3 mol 和 1 mol ,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 的浓度变化计算从4 min 开始到A点的反应速率_____(保留两位小数)。
b.若温度不变,压强恒定在 的条件下重新达到平衡时,容器的体积变为_____L。
三、实验题
21.某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:相对分子质量:98,质量分数:98% 密度:。甲同学认为,可以用一种精密仪器测量该溶液的,若,则该溶液的质量分数为98%。乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:
(1)乙同学推测甲同学的方案不可行的理由是_____________________________________
(2)乙同学的方案的关键操作有两点:①确保-完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,请设计简单实验检验是否完全沉淀:____________________________
检验沉淀是否洗净的操作方法是__________________________________________________;
(3)在丙同学的方案中步骤②用到的指示剂是____________;达到滴定终点的标志是______________________________________________________________________________。
(4)丙同学的方案中,下列操作使测定结果偏小的是_____________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后,俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:
实验序号 硫酸体积 NaOH溶液体积 NaOH溶液浓度
① 5.00 mL 35.65 mL
② 5.00 mL 39.65 mL
③ 5.00 mL 35.55 mL
通过计算,该浓硫酸物质的量浓度为____________________________________________。是否与标签上表示的溶质质量分数相同___________(填“是”或“否”)
参考答案
1.答案:C
2.答案:B
3.答案:B
4.答案:D
5.答案:B
6.答案:A
7.答案:C
8.答案:B
9.答案:A
10.答案:D
11.答案:C
12.答案:D
13.答案:D
14.答案:C
15.答案:D
16.答案:C
17.答案: (1)12
(2)9:1
(3)
(4)或
(5)20:1
(6)
18.答案: (1)
(2)>
(3)①乙;B;②= ;甲;③乙 ;常压下加热的水溶液,溶液的温度达不到150 ℃
19.答案: (1)将工业级氧化锌粉碎、搅拌;增大硫酸浓度,提高浸出温度等
(2) 1;3;7;;1;3;5
(3)调节溶液pH,除去溶液中的等
(4)不能
(5) ;
20.答案: (1)<;
(2) <;反应Ⅲ放热反应,温度降低,反应正向移动,所以 ;4/27 或 0.148;降低压强;;8/15 或 0.533
21.答案: (1)浓硫酸主要以分子形式存在
(2)静置,取少量上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明没有完全沉淀;若不产生白色沉淀,则说明已完全沉淀;取最后一次洗涤液少许于试管,向其中滴入硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明沉淀已经洗净,否则则没有洗净 (3)酚酞试液;无色变成粉红色,且半分钟内不褪色
(4)⑤
(5);否
化学
一、单选题
1.化学与生产、生活密切相关,下列叙述错误的是( )
A. 纯碱属于盐,热的纯碱溶液可以用于除去餐具上的油污
B. 合成氨工业中使用的氮气来自于空气
C. 明矾和漂白粉常用于自来水的净化和杀菌消毒,其作用原理相同
D. 用作沉淀剂,除去废水中的和
2.下列反应中生成的速率最快的是( )
金属 酸溶液 温度
A Mg 20 ℃
B Mg 30 ℃
C Zn 20 ℃
D Fe 20 ℃
A. A B. B C. C D. D
3.德国化学家哈伯在合成氨方面的研究促进了人类的发展。合成氨的工业流程如图,下列说法错误的是( )
A. 增大压强既可以加快反应速率,又可以提高原料转化率
B. 升高温度可提高平衡转化率
C. 冷却过程中采用热交换有助于节约能源
D. 原料循环可提高其利用率
4.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( )
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
5.和在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用分别表示,下列说法正确的是( )
A. 使用催化剂时,合成氨的反应放出的热量减少
B. 使用催化剂能增大反应速率的原因是降低了反应的活化能
C. 在该过程中,N原子和H原子形成了含有非极性键的
D. 合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
6.下列有关说法正确的是( )
A. 将溶液蒸干得到固体
B. 在化学反应中,发生物质变化的同时不一定发生能量变化
C. 向纯水通入少量HCl气体,水的电离程度减小,减小
D. 常温下,放热反应一般能自发进行,吸热反应都不能自发进行
7.化学用语是学习化学重要工具,下列表示物质变化的化学用语中,正确的是( )
A. 碱性可充电镍镉电池的两极材料分别为Cd和NiOOH,其电池总反应可以表示为:
B. 溶液显酸性的主要原因:
C. 钢铁在海水中发生电化学腐蚀的正极反应式为:
D. 水解的离子方程式:
8.已知反应是可逆反应。设计如图装置进行下述操作:
I、向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
II、若改往(B)烧杯中滴加40% NaOH溶液,发现微安培表指针向前述相反方向偏转。
下列说法正确的是( )
A. 操作I中,为电池正极
B. 操作I中,B烧杯的电极反应式为:
C. 盐桥中应充入饱和溶液和琼脂
D. 操作II中,平衡逆向移动,盐桥中的阳离子移向B烧杯
9.臭氧是理想的烟气脱硝试剂,其脱硝反应为:,若反应在恒容密闭容器中进行,如表由该反应相关图象作出的判断正确的是( )
A. 甲图中改变的反应条件为升温
B. 乙图中温度,纵坐标可代表的百分含量
C. 丙图为充入稀有气体时速率变化
D. 丁图中a、b、c三点只有b点已经达到平衡状态
10.已知25℃时有关弱酸的电离平衡常数如下表:
弱酸化学式 HX HY
电离平衡常数
下列推断正确的是( )
A. 等pH的HX和HY浓度大小为:
B. 相同条件下溶液的碱性:
C. 溶液中加入过量HX,离子方程式为:
D. NaY溶液中通入过量,离子方程式为:
11.已知下列四组实验,现象和结论均正确的是( )
操作 现象 结论
A 滴加稀NaOH溶液,将红色石蕊试纸置于试管口 试纸不变蓝 原溶液中
B 将通入溶液中 出现白色沉淀 沉淀
C 滴加溶液,再滴加溶液 先无白色沉淀,后有不溶于稀硝酸的白色沉淀生成 原溶液中有
D 滴加盐酸 有能使澄清石灰水变浑浊的气体产生 原溶液中有
A. A B. B C. C D. D
12.往10 L恒容密闭容器中充入气体X和Y,发生反应,测得实验数据如下表:
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
① 700 2 1 0.9
② 800 2 1 0.8
③ 800 1 0.5 a
下列说法不正确的是( )
A.
B.
C. 800 ℃时,该反应的平衡常数
D. 实验③中,达到平衡时,Y的转化率为20%
13.常温下,用 溶液滴定 溶液所得滴定曲线如图。下列说法正确的是( )
A. 点①所示溶液中:
B. 点②所示溶液中:
C. 点③所示溶液中:
D. 滴定过程中可能出现:
14.室温下有下列四种溶液,下列叙述正确的是( )
编号 ① ② ③ ④
pH 3 3 11 11
溶液 盐酸 醋酸溶液 氢氧化钠溶液 氨水
A. ①、②、③三种溶液的物质的量浓度大小为:①=③>②
B. 相同体积的①、②溶液分别与③溶液完全中和,消耗③溶液的体积:①>②
C. ②、③两溶液等体积混合,所得溶液中
D. ①、③溶液以体积比为9:11混合,则混合溶液的pH=4
15.已知。向盛有0.1 mol/L 溶液的试管中滴加等体积0.1 mol/L NaCl溶液,静置沉降,取上层清液和下层悬浊液分别进行实验。已知,,下列判断正确的是( )
A. 将浓度为0.1mol/L的溶液逐滴加入浓度均为0.01 mol/L的KCl和的混合溶液中,将先看到沉淀
B. 向清液中滴加0.1 mol/L 溶液,不变
C. 向悬浊液中滴加0.1 mol/L KI溶液,不会有明显变化
D. 上层清液为AgCl的饱和溶液
16.一定温度下,水溶液中和 的浓度变化曲线如图,下列说法正确的是( )
A. 该温度下,a点溶液呈碱性
B. 该温度下,pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,所得溶液显中性
C. 该温度下,加入NaOH可能引起由b向c的变化
D. b点时,升高温度,可能引起由b向d的变化
二、填空题
17.计算以下数值(以下均为25 ℃时)。
(1)某浓度的溶液中,由水电离的,该溶液的pH=______。
(2)将pH=3的溶液和pH=12的NaOH溶液混合,混合后所得溶液的pH=10,则溶液与NaOH溶液的体积比为______。
(3)与的混合溶液,若测得pH =6,则溶液中______(填精确值)。
(4)将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为______(用含代数a、b等表示)。
(5)pH=5的溶液加水稀释至原溶液体积的1000倍,求稀释后溶液中______。
(6)盐碱地因含较多的,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式______。
18.加热的饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ 10 20 30 加热煮沸后冷却到50℃
pH 8.3 8.4 8.5 8.8
(1)写出水解的离子方程式__________,甲同学认为,该溶液的pH升高的原因是的水解程度增大,故碱性增强。
(2)乙同学认为溶液的pH升高的原因是受热分解,生成了,并推断的水解程度_______(选填“>”、“<”或“=”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_______(选填“甲”或“乙”)判断正确。试剂X是_________。
A.溶液 B.溶液 C.NaOH溶液 D.澄清石灰水
②将加热后的溶液冷却到10 ℃,若溶液的pH____8.3(选填“>”、“<”或“=”),则__________(选填“甲”或“乙”)判断正确。
③查阅资料,发现的分解温度为150 ℃,丙断言_____(选填“甲”或“乙”)的判断是错误的,理由是______________________。
19.高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
已知。
回答下列问题:
(1)浸出时,为了提高浸出效率可采用的措施有(写两种):___________;___________。
(2)氧化时,加入溶液是为了除去浸出液中的和(溶液中Mn全部转化为),请配平下列除去的离子方程式: ____________
(3)加入锌粉的目的是_______________________________________________________。
(4)已知浸出液中,、,加入溶液反应一段时间后,溶液中,若溶液pH=3,则此时__________(填“能”或“不能”)生成沉淀。
(5) 已知:常温下,①,;②及其钠盐的溶液中,分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。
①比较三者的酸性强弱_________________________________
②NaHR溶液中存在 _______________________
20.甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,加氢合成甲醇是合理利用 的有效途径。由制备甲醇过程可能涉及反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅲ的 _____(填“<”、“=”或“>”)0;反应Ⅱ的 _____。
(2)在恒压密闭容器中,充入一定量的 和 (假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 的平衡转化率与压强的关系曲线如图所示。
①比较与的大小关系:____ (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 和的条件下,往密闭容器中充入 3 mol 和 1 mol ,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 的浓度变化计算从4 min 开始到A点的反应速率_____(保留两位小数)。
b.若温度不变,压强恒定在 的条件下重新达到平衡时,容器的体积变为_____L。
三、实验题
21.某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:相对分子质量:98,质量分数:98% 密度:。甲同学认为,可以用一种精密仪器测量该溶液的,若,则该溶液的质量分数为98%。乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:
(1)乙同学推测甲同学的方案不可行的理由是_____________________________________
(2)乙同学的方案的关键操作有两点:①确保-完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,请设计简单实验检验是否完全沉淀:____________________________
检验沉淀是否洗净的操作方法是__________________________________________________;
(3)在丙同学的方案中步骤②用到的指示剂是____________;达到滴定终点的标志是______________________________________________________________________________。
(4)丙同学的方案中,下列操作使测定结果偏小的是_____________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后,俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:
实验序号 硫酸体积 NaOH溶液体积 NaOH溶液浓度
① 5.00 mL 35.65 mL
② 5.00 mL 39.65 mL
③ 5.00 mL 35.55 mL
通过计算,该浓硫酸物质的量浓度为____________________________________________。是否与标签上表示的溶质质量分数相同___________(填“是”或“否”)
参考答案
1.答案:C
2.答案:B
3.答案:B
4.答案:D
5.答案:B
6.答案:A
7.答案:C
8.答案:B
9.答案:A
10.答案:D
11.答案:C
12.答案:D
13.答案:D
14.答案:C
15.答案:D
16.答案:C
17.答案: (1)12
(2)9:1
(3)
(4)或
(5)20:1
(6)
18.答案: (1)
(2)>
(3)①乙;B;②= ;甲;③乙 ;常压下加热的水溶液,溶液的温度达不到150 ℃
19.答案: (1)将工业级氧化锌粉碎、搅拌;增大硫酸浓度,提高浸出温度等
(2) 1;3;7;;1;3;5
(3)调节溶液pH,除去溶液中的等
(4)不能
(5) ;
20.答案: (1)<;
(2) <;反应Ⅲ放热反应,温度降低,反应正向移动,所以 ;4/27 或 0.148;降低压强;;8/15 或 0.533
21.答案: (1)浓硫酸主要以分子形式存在
(2)静置,取少量上层清液,滴加氯化钡(或硝酸钡等)溶液,若产生白色沉淀,则说明没有完全沉淀;若不产生白色沉淀,则说明已完全沉淀;取最后一次洗涤液少许于试管,向其中滴入硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明沉淀已经洗净,否则则没有洗净 (3)酚酞试液;无色变成粉红色,且半分钟内不褪色
(4)⑤
(5);否
同课章节目录
