第三章 第三节 第3课时 盐类水解在溶液中离子浓度大小比较中的应用 课件(36张PPT)
文档属性
| 名称 | 第三章 第三节 第3课时 盐类水解在溶液中离子浓度大小比较中的应用 课件(36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-24 17:26:35 | ||
图片预览











文档简介
(共36张PPT)
第3课时 盐类水解在溶液中离子浓度大小比较中的应用
第三章 第三节 盐类的水解
[学习目标定位]
1.根据电解质的电离、弱离子的水解,会判断溶液中微粒种类。
2.会比较离子浓度大小。
3.根据盐的水解会判断相应酸(或碱)的强弱。
新知导学
达标检测
内容索引
新知导学
一、溶液中离子浓度的大小比较
抑制
促进
c>a>b
2.弱酸溶液中离子浓度大小比较
(1)HClO溶液中存在的平衡有: ,溶液中微粒有 ,由于HClO电离程度小,且H2O的电离程度更小,所以溶液中微粒浓度由大到小的顺序(H2O除外)是 。
(2)碳酸的电离方程式是 。碳酸溶液中存在的微粒有 。
碳酸是弱酸,第一步电离很微弱,第二步电离更微弱。推测其溶液中粒子浓度由大到小的顺序(水分子除外)是 。
H2O、HClO、H+、OH-、ClO-
c(HClO)>c(H+)>c(ClO-)>c(OH-)
3.单一溶液中离子浓度大小的比较
(1)氯化铵溶液
①先分析NH4Cl溶液中的电离、水解过程。
电离: 。
水解: 。
判断溶液中存在的离子有 。
②再根据其电离和水解程度的相对大小,比较确定氯化铵溶液中离子浓度由大到小的顺序是 。
(2)碳酸钠溶液
①分析Na2CO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
②溶液中离子浓度由大到小的顺序是 。
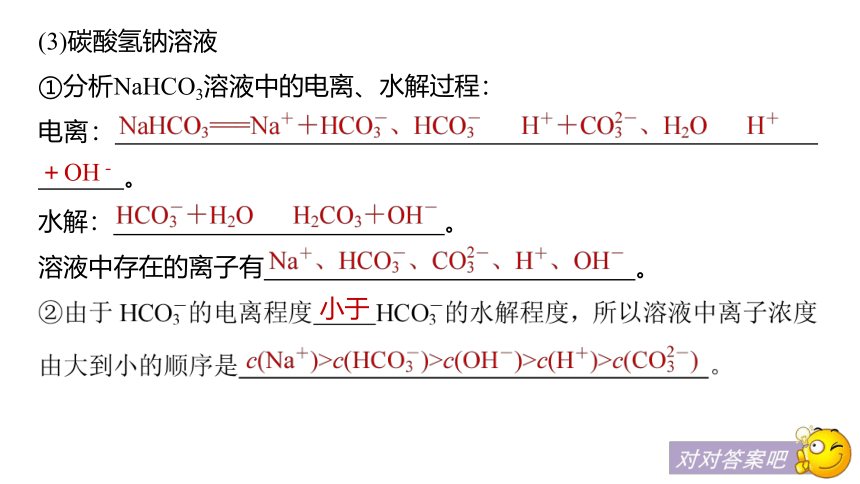
(3)碳酸氢钠溶液
①分析NaHCO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
+OH-
小于
4.混合溶液中离子浓度大小的比较
(1)物质的量浓度相同的NaOH溶液、NH4Cl溶液等体积混合
反应的化学方程式: ;溶液中存在的离子有 ;其浓度由大到小的顺序是
。
(2)物质的量浓度相同的NH4Cl溶液、氨水等体积混合
混合后不发生反应,溶液中的溶质为 ,由于NH3·H2O
的电离程度 NH 的水解程度,所以溶液呈 性;溶液中存在的离子有 ;其浓度由大到小的顺序是 。
NH4Cl+NaOH===NH3·H2O+NaCl
NH4Cl、NH3·H2O
大于
碱
c(OH-)>c(H+)
(3)物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中的溶质为 ,溶液中存在的离子有 ,由于ClO-的水解程度 CH3COO-的水解程度,所以溶液中离子浓度由大到小的顺序为 。
CH3COONa、NaClO
Na+、ClO-、
CH3COO-、H+、OH-
大于
c(Na+)>c(CH3COO-)>
c(ClO-)>c(OH-)>c(H+)
Na2CO3和NaHCO3
大于
1.溶液中离子浓度大小比较的方法思路
(1)先确定溶液中的溶质成分及各自物质的量浓度大小。
(2)写出电离方程式、水解方程式,找出溶液中存在的离子。
(3)依据电离和水解程度的相对大小,比较离子浓度大小。
2.特别注意的问题
(1)多元弱酸的正盐溶液(如Na2CO3溶液),要分清主次关系。即盐完全电离,多元弱酸根的第一步水解大于第二步水解。
归纳总结
(2)多元弱酸的酸式盐溶液,要注意考虑酸式酸根水解程度和电离程度的相对大小。若酸式酸根的电离程度大于水解程度,溶液呈酸性;若水解程度大于电离程度,溶液呈碱性。
(3)当两种溶液混合或两种物质发生反应时,要根据反应原理准确地判断溶质的成分,然后判断离子种类,再根据规律比较其大小。
(4)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。
答案
√
解析
例2 室温下将pH=10的NaOH溶液与pH=4的CH3COOH溶液等体积混合:
(1)混合后溶液中的溶质是______________________,呈___性。
(2)溶液中离子浓度由大到小的顺序是__________________________________。
CH3COONa、CH3COOH
酸
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
答案
1.醋酸钠溶液中存在的平衡有 、 ,存在的离子有 。
(1)电荷守恒:溶液呈电中性,所以溶液中n(正电荷)=n(负电荷)
即:n(Na+)+n(H+) n(CH3COO-)+n(OH-)(两边同时除以体积)
即: 。
二、水解平衡中的三个守恒关系
Na+、H+、CH3COO-、OH-
=
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
(2)物料守恒:CH3COONa固体中,n(Na+) n(CH3COO-),但在CH3COONa
溶液中,因为CH3COO-水解,所以n(Na+) n(CH3COO-),即c(Na+)___
c(CH3COO-);根据CH3COONa固体中,n(Na+) n(CH3COO-),所以该溶液中n(Na+) n(CH3COO-)+n(CH3COOH),(两边同时除以体积)即:
。
(3)质子守恒:将上述两式相加得到以下关系:c(OH-)= 。根据水电离出的c(OH-)=c(H+),溶液中的H+或OH-虽与其他离子结合而以不同的形式存在,但其总量相同。
=
>
>
=
=
c(CH3COOH)+c(CH3COO-)=c(Na+)
c (H+)+c (CH3COOH)
2.NH4Cl溶液中存在:
(1)电荷守恒: 。
(2)物料守恒: 。
(3)质子守恒: 。
归纳总结
解溶液中粒子浓度三守恒关系式策略
(1)分析电解质的电离和水解情况,找全溶液中的离子和分子。
(2)分清题目考查的守恒关系,可以是单一守恒关系式,也可以是它们的变形关系式,也可以是两种守恒关系式导出的新的守恒式。
(3)注意选择题常涉及的易错点:
①守恒关系式中多写或漏写离子或分子;
②守恒关系式浓度前的化学计量数设错;
③在混合后忽视溶液体积变化上设错。
答案
解析
答案 正确的有(2)(4)(6),其余不正确。
(2)符合质子守恒,c(OH-)=c(H+)+2c(H2S)+c(HS-)移项即可。
(7)不符合质子守恒,正确的关系式为c(OH-)=c(H+)+c(CH3COOH)。
达标检测
1.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+c(H+)=c(A-)+c(OH-)
√
答案
1
2
3
4
5
解析
解析 因A-+H2O??HA+OH-,所以c(Na+)>c(A-)>c(OH-);
水解后溶液呈碱性,则c(OH-)>c(H+);
根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-)。
1
2
3
4
5
2.t ℃时,某氯化铵溶液的pH=4,下列说法中一定正确的是
A.由水电离出的氢离子浓度为10-10 mol·L-1
B.溶液中c(H+)·c(OH-)=1.0×10-14
答案
解析
1
2
3
4
5
√
1
2
3
4
5
在25 ℃时,水的离子积为1.0×10-14,B错;
答案
1
2
3
4
5
3.在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
√
解析
1
2
3
4
5
解析 pH=11的NaOH溶液中c(NaOH)=c(OH-)=10-3 mol·L-1,而pH=3的CH3COOH溶液中c(H+)=10-3 mol·L-1,c(CH3COOH)远远大于10-3 mol·L-1。两者等体积混合后,形成CH3COOH与CH3COONa的混合液,且c(CH3COOH)远大于c(CH3COONa),溶液呈酸性,电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
4.(2017·南昌二中高二第二次考试)有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:
①CH3COONa与NaCl;②CH3COONa与NaOH;
③CH3COONa与NaHSO4;④CH3COONa与NaHCO3。
c(CH3COO-)由大到小排序正确的是
A.②>④>③>① B.②>④>①>③
C.③>①>②>④ D.①>④>③>②
答案
解析
1
2
3
4
5
√
1
2
3
4
5
解析 ①CH3COONa与NaCl,CH3COO-发生水解;
②CH3COONa与NaOH,NaOH为强碱,NaOH电离的OH-大大抑制了CH3COO-的水解,CH3COO-浓度最大;
③CH3COONa与NaHSO4,二者恰好反应生成CH3COOH,CH3COOH的电离程度较小,溶液中CH3COO-浓度最小;
1
2
3
4
5
答案
5.某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是 (用离子方程式表示)。
解析
碱性
B2-+
1
2
3
4
5
答案
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 (填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
解析
√
√
1
2
3
4
5
由物料守恒知,c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对;
在Na2B溶液中不存在H2B,A错;
由物料守恒和电荷守恒知,B错。
1
2
3
4
5
答案
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
解析
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
第3课时 盐类水解在溶液中离子浓度大小比较中的应用
第三章 第三节 盐类的水解
[学习目标定位]
1.根据电解质的电离、弱离子的水解,会判断溶液中微粒种类。
2.会比较离子浓度大小。
3.根据盐的水解会判断相应酸(或碱)的强弱。
新知导学
达标检测
内容索引
新知导学
一、溶液中离子浓度的大小比较
抑制
促进
c>a>b
2.弱酸溶液中离子浓度大小比较
(1)HClO溶液中存在的平衡有: ,溶液中微粒有 ,由于HClO电离程度小,且H2O的电离程度更小,所以溶液中微粒浓度由大到小的顺序(H2O除外)是 。
(2)碳酸的电离方程式是 。碳酸溶液中存在的微粒有 。
碳酸是弱酸,第一步电离很微弱,第二步电离更微弱。推测其溶液中粒子浓度由大到小的顺序(水分子除外)是 。
H2O、HClO、H+、OH-、ClO-
c(HClO)>c(H+)>c(ClO-)>c(OH-)
3.单一溶液中离子浓度大小的比较
(1)氯化铵溶液
①先分析NH4Cl溶液中的电离、水解过程。
电离: 。
水解: 。
判断溶液中存在的离子有 。
②再根据其电离和水解程度的相对大小,比较确定氯化铵溶液中离子浓度由大到小的顺序是 。
(2)碳酸钠溶液
①分析Na2CO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
②溶液中离子浓度由大到小的顺序是 。
(3)碳酸氢钠溶液
①分析NaHCO3溶液中的电离、水解过程:
电离: 。
水解: 。
溶液中存在的离子有 。
+OH-
小于
4.混合溶液中离子浓度大小的比较
(1)物质的量浓度相同的NaOH溶液、NH4Cl溶液等体积混合
反应的化学方程式: ;溶液中存在的离子有 ;其浓度由大到小的顺序是
。
(2)物质的量浓度相同的NH4Cl溶液、氨水等体积混合
混合后不发生反应,溶液中的溶质为 ,由于NH3·H2O
的电离程度 NH 的水解程度,所以溶液呈 性;溶液中存在的离子有 ;其浓度由大到小的顺序是 。
NH4Cl+NaOH===NH3·H2O+NaCl
NH4Cl、NH3·H2O
大于
碱
c(OH-)>c(H+)
(3)物质的量浓度相同的CH3COONa溶液和NaClO溶液等体积混合,溶液中的溶质为 ,溶液中存在的离子有 ,由于ClO-的水解程度 CH3COO-的水解程度,所以溶液中离子浓度由大到小的顺序为 。
CH3COONa、NaClO
Na+、ClO-、
CH3COO-、H+、OH-
大于
c(Na+)>c(CH3COO-)>
c(ClO-)>c(OH-)>c(H+)
Na2CO3和NaHCO3
大于
1.溶液中离子浓度大小比较的方法思路
(1)先确定溶液中的溶质成分及各自物质的量浓度大小。
(2)写出电离方程式、水解方程式,找出溶液中存在的离子。
(3)依据电离和水解程度的相对大小,比较离子浓度大小。
2.特别注意的问题
(1)多元弱酸的正盐溶液(如Na2CO3溶液),要分清主次关系。即盐完全电离,多元弱酸根的第一步水解大于第二步水解。
归纳总结
(2)多元弱酸的酸式盐溶液,要注意考虑酸式酸根水解程度和电离程度的相对大小。若酸式酸根的电离程度大于水解程度,溶液呈酸性;若水解程度大于电离程度,溶液呈碱性。
(3)当两种溶液混合或两种物质发生反应时,要根据反应原理准确地判断溶质的成分,然后判断离子种类,再根据规律比较其大小。
(4)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。
答案
√
解析
例2 室温下将pH=10的NaOH溶液与pH=4的CH3COOH溶液等体积混合:
(1)混合后溶液中的溶质是______________________,呈___性。
(2)溶液中离子浓度由大到小的顺序是__________________________________。
CH3COONa、CH3COOH
酸
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
答案
1.醋酸钠溶液中存在的平衡有 、 ,存在的离子有 。
(1)电荷守恒:溶液呈电中性,所以溶液中n(正电荷)=n(负电荷)
即:n(Na+)+n(H+) n(CH3COO-)+n(OH-)(两边同时除以体积)
即: 。
二、水解平衡中的三个守恒关系
Na+、H+、CH3COO-、OH-
=
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
(2)物料守恒:CH3COONa固体中,n(Na+) n(CH3COO-),但在CH3COONa
溶液中,因为CH3COO-水解,所以n(Na+) n(CH3COO-),即c(Na+)___
c(CH3COO-);根据CH3COONa固体中,n(Na+) n(CH3COO-),所以该溶液中n(Na+) n(CH3COO-)+n(CH3COOH),(两边同时除以体积)即:
。
(3)质子守恒:将上述两式相加得到以下关系:c(OH-)= 。根据水电离出的c(OH-)=c(H+),溶液中的H+或OH-虽与其他离子结合而以不同的形式存在,但其总量相同。
=
>
>
=
=
c(CH3COOH)+c(CH3COO-)=c(Na+)
c (H+)+c (CH3COOH)
2.NH4Cl溶液中存在:
(1)电荷守恒: 。
(2)物料守恒: 。
(3)质子守恒: 。
归纳总结
解溶液中粒子浓度三守恒关系式策略
(1)分析电解质的电离和水解情况,找全溶液中的离子和分子。
(2)分清题目考查的守恒关系,可以是单一守恒关系式,也可以是它们的变形关系式,也可以是两种守恒关系式导出的新的守恒式。
(3)注意选择题常涉及的易错点:
①守恒关系式中多写或漏写离子或分子;
②守恒关系式浓度前的化学计量数设错;
③在混合后忽视溶液体积变化上设错。
答案
解析
答案 正确的有(2)(4)(6),其余不正确。
(2)符合质子守恒,c(OH-)=c(H+)+2c(H2S)+c(HS-)移项即可。
(7)不符合质子守恒,正确的关系式为c(OH-)=c(H+)+c(CH3COOH)。
达标检测
1.HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)+c(H+)=c(A-)+c(OH-)
√
答案
1
2
3
4
5
解析
解析 因A-+H2O??HA+OH-,所以c(Na+)>c(A-)>c(OH-);
水解后溶液呈碱性,则c(OH-)>c(H+);
根据电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-)。
1
2
3
4
5
2.t ℃时,某氯化铵溶液的pH=4,下列说法中一定正确的是
A.由水电离出的氢离子浓度为10-10 mol·L-1
B.溶液中c(H+)·c(OH-)=1.0×10-14
答案
解析
1
2
3
4
5
√
1
2
3
4
5
在25 ℃时,水的离子积为1.0×10-14,B错;
答案
1
2
3
4
5
3.在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
√
解析
1
2
3
4
5
解析 pH=11的NaOH溶液中c(NaOH)=c(OH-)=10-3 mol·L-1,而pH=3的CH3COOH溶液中c(H+)=10-3 mol·L-1,c(CH3COOH)远远大于10-3 mol·L-1。两者等体积混合后,形成CH3COOH与CH3COONa的混合液,且c(CH3COOH)远大于c(CH3COONa),溶液呈酸性,电荷守恒关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
4.(2017·南昌二中高二第二次考试)有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:
①CH3COONa与NaCl;②CH3COONa与NaOH;
③CH3COONa与NaHSO4;④CH3COONa与NaHCO3。
c(CH3COO-)由大到小排序正确的是
A.②>④>③>① B.②>④>①>③
C.③>①>②>④ D.①>④>③>②
答案
解析
1
2
3
4
5
√
1
2
3
4
5
解析 ①CH3COONa与NaCl,CH3COO-发生水解;
②CH3COONa与NaOH,NaOH为强碱,NaOH电离的OH-大大抑制了CH3COO-的水解,CH3COO-浓度最大;
③CH3COONa与NaHSO4,二者恰好反应生成CH3COOH,CH3COOH的电离程度较小,溶液中CH3COO-浓度最小;
1
2
3
4
5
答案
5.某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-??H++B2-。回答下列问题。
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是 (用离子方程式表示)。
解析
碱性
B2-+
1
2
3
4
5
答案
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 (填字母)。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
解析
√
√
1
2
3
4
5
由物料守恒知,c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对;
在Na2B溶液中不存在H2B,A错;
由物料守恒和电荷守恒知,B错。
1
2
3
4
5
答案
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是 。
解析
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
