化学平衡全集
图片预览










文档简介
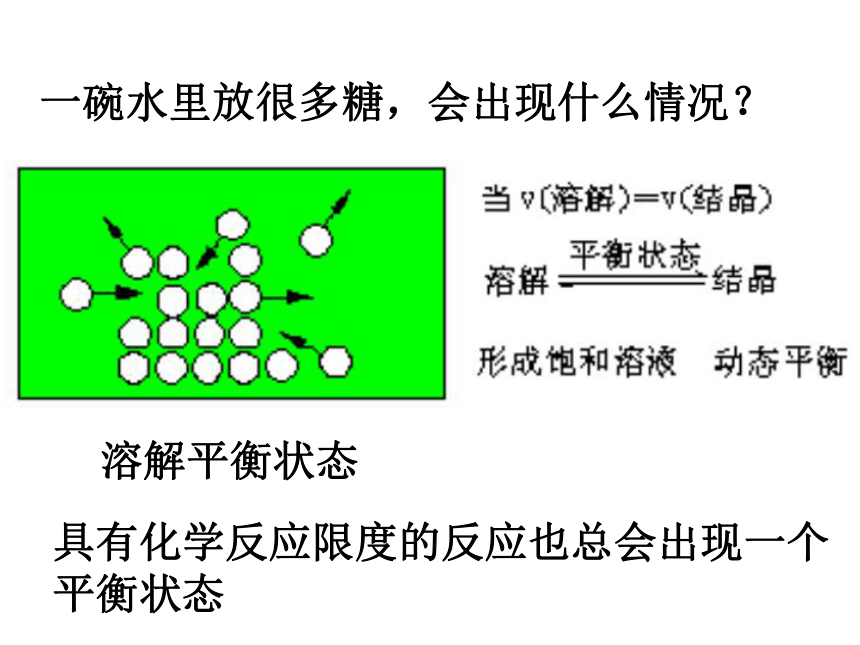
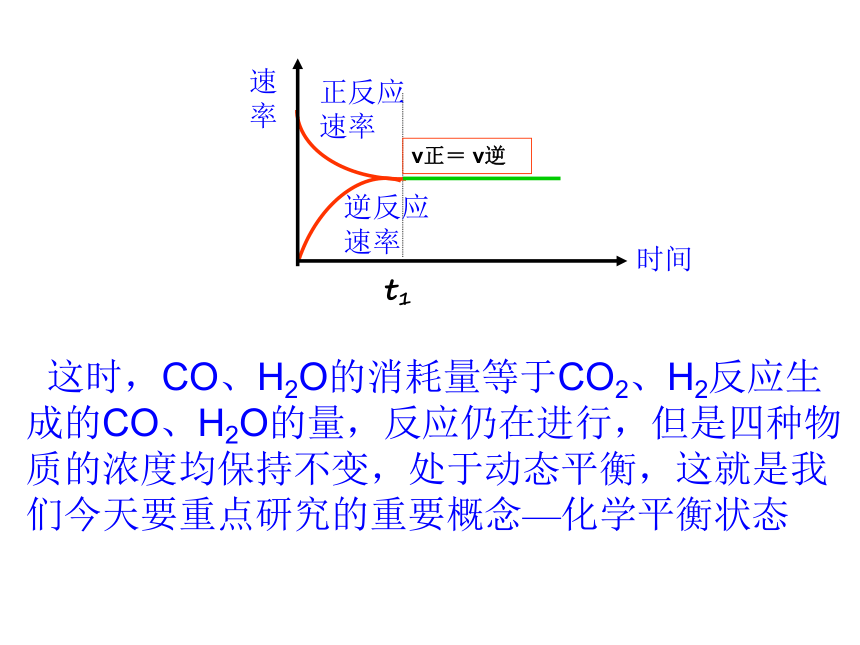
课件88张PPT。第三节 化学平衡恩施高中 2019年2月7日星期四一碗水里放很多糖,会出现什么情况?具有化学反应限度的反应也总会出现一个平衡状态溶解平衡状态一、可逆反应与不可逆反应1、可逆反应相同条件下,同时向正、逆两个反应方向进行的反应2、可逆反应的特征二、化学平衡状态1、化学平衡状态的建立具有反应限度1、反应刚开始时: 反应物浓度————,正反应速率———— 生成物浓度为————,逆反应速率为——最大最大002、反应过程中: 反应物浓度————,正反应速率 ,生成物浓度 ,逆反应速率 。 减小逐渐减小增大逐渐增大3、一定时间后,必然出现:正反应速率=逆反应速率t1正反应速率逆反应速率v正= v逆 这时,CO、H2O的消耗量等于CO2、H2反应生成的CO、H2O的量,反应仍在进行,但是四种物质的浓度均保持不变,处于动态平衡,这就是我们今天要重点研究的重要概念—化学平衡状态2、化学平衡状态:在一定条件下,可逆反应进行到一定的程度时,正反应速率与逆反应速率相等,化学反应进行到最大限度,反应物和生成物的浓度不再发生变化,反应混合物处于化学平衡状态,简称化学平衡
3、化学平衡状态的特征逆、动、等、定、变4、达到化学平衡的标志:正逆反应速率相等和反应混合物各组分浓度保持不变是判断平衡的两大主要标志⑴、直接标志:①、速率关系: v正= v逆应用:判断平衡时,要注意用“同”、“等”、“逆”的原则,即同:不同物质表示的反应速率必须转化为相同物质表示的反应速率等:转化后的反应速率必须相等逆:反应方向必须对立②、含量关系:反应混合物各组分的浓度、质量分数、物质的量、物质的量分数、体积分数、分子数之比保持不变⑵、间接标志:①、混合气体的总压强、总体积、总物质的量不随时间改变而—————,(适用于
—————————————)改变m+n≠p 的反应②、混合气体的平均相对分子质量、密度不随时间改变而—————,(适用于
—————————————)改变m+n≠p 的反应③、各气体体积、气体分压、各物质的物质的量不随时间改变⑶、特殊标志:①、对于有色物质参加反应,如果体系颜色不变,反应达到平衡②、对于吸热或放热反应,如果体系温度不变,反应达到平衡气体的总压、气体的总的物质的量、混合气体的平均相对分子质量、混合气体的密度、反应混合物平衡时物质的量之比⑷、在等系数的气体反应中不能作为平衡判据的是:例1、一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
A、单位时间内生成n mol A2同时生成n molAB
B、单位时间内生成2n mol AB 同时生成n mol B2
C、单位时间内生成n mol A2 同时生成n mol B2 D、单位时间内生成n mol A2 同时消耗n mol B2 √√在判断化学平衡时,要注意化学键数与反应物质的物质的量之间的联系,同时要注意成键、断键与反应方向之间的关系。例2、一定条件下,反应N2+3H2 2NH3达到平衡的标志是
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成 √√例3、在一定温度下,向aL密闭容器中加入1molX
气体和2molY气体发生如下反应:
X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
A、容器内压强不随时间变化
B、容器内各物质的浓度不随时间变化
C、容器内X、Y、Z的浓度之比为1:2:2
D、单位时间消耗0.1molX的同时生成0.2molZ√√练习: 【1】 在一定温度下,可逆反应
A(气)+3B(气) 2C(气)达到平衡的标志是( )
C的生成速率与C分解的速率相等 B. 单位时间内生成nmolA,同时生3nmolB C. A、B、C的浓度不再变化 D. A、B、C的分子数比为1:3:2AC【2】 下列说法中可以充分说明反应:
P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( ) A. 反应容器内压强不随时间变化 B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而变化B 【3】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A. 混合气体的压强
B. 混合气体的密度
C. B的物质的量浓度
D. 气体的总物质的量
BC【4】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2(② ⑧ ) 三、化学平衡的移动化学平衡的研究对象是——————,化学平衡是有条件限制的————平衡,只有在————————时才能保持平衡,当外界条件(浓度、温度、压强)改变时,化学平衡会被————,反应混合物里各组分的含量不断—————,由于条件变化对正逆反应速率的影响不同,致使v正—— v逆,然后在新条件下建立————可逆反应动态条件一定破坏变化新平衡≠ (一)、化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动(二)、化学平衡的移动方向的速率判断:①、若外界条件变化引起v正> v逆:平衡向正反应方向移动②、若外界条件变化引起v正< v逆:平衡向逆反应方向移动③、若外界条件变化引起v正= v逆:旧平衡未被破坏,平衡不移动化学平衡总往反应速率大的方向移动1、浓度对化学平衡的影响(三)、影响化学平衡移动的因素:影响因素:(1)浓度对平衡的影响实验2-5实验2-6结论:当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向————反应方向移动;增大生成物浓度或减小反应物浓度,化学平衡向————反应方向移动。正逆强调:气体或溶液浓度的改变会引起反应速
率的变化,纯固体或纯液体用量的变化不会
引起反应速率改变,化学平衡不移动思考:1、某温度下,反应C(s)+H2O(g) CO(g)+H2(g)达到平衡后,增加或移去一部分碳固体,化学平衡移动吗?为什么?
2、实验2—6中,向平衡体系中加入少量氯化钾固体,溶液颜色怎么变?为什么?2、压强对化学平衡的影响讨论:压强的变化对化学反应速率如何影响?v正和 v逆怎样变化?会同等程度的增大或减小吗?N2(g)+3H2(g) 2NH3(g)反应中,压强变化和NH3含量的关系结论:压强增大, NH3%增大,平衡向正反应方向移动。即压强增大, v正和 v逆同时增大,但改变倍数不同;压强减小,v正和 v逆同时减小,但改变倍数不同。压强对化学平衡的影响:aA(g)+bB(g) cC(g)规律:增大压强,化学平衡向————————————————移动;减小压强,化学平衡向——————————————————移动;体积相等的气体反应,压强改变,化学平衡—————。 气体体积缩小方向气体体积扩大方向不移动增大压强,气体总物质的量浓度增大,化学平衡向气体总物质的量浓度减小的方向移动;
减小压强,气体的总物质的量浓度减小,化学平衡向气体总物质的量增大的方向移动。结论:压强变化不影响体积相等的气体反应的化学平衡讨论:压强的变化不会影响固体或液体物质的反应速率,压强的变化会使固体或液体反应的化学平衡移动吗?aA(g)+bB(g) cC(g) 当a+b=c时结论:无气体参加的反应,压强的改变,不能使化学平衡移动强调:压强变化若没有浓度的变化,化学反应速率——————,化学平衡——————。不变不移动不变不变不移动减小逆反应3、温度对化学平衡的影响讨论:温度的变化对化学反应速率如何影响?v正和 v逆怎样变化?结论:温度升高, v正和 v逆同时增大,但改变倍数不同;温度降低,v正和 v逆同时减小,但改变倍数不同;问题:温度的变化如何改变 不同反应的v正和 v逆的倍数?【实验2-5】温度对平衡的影响:2NO2 N2O4(正反应放热)实验现象:温度升高,混合气体颜色加深,——————————,平衡向—————— 方向移动;温度降低,混合气体颜色变浅,
————————————,平衡向—————— 方向移动NO2浓度增大逆反应NO2浓度减小正反应V正= V逆V正V逆t1t(s)V(molL-1S-1)0T2升温V”正 = V”逆V’逆V‘正温度对化学平衡的影响:改变的条件平衡移动的方向平衡移动的结果增大反应物浓度减小反应物浓度增大生成物浓度减小生成物浓度增大体系压强减小体系压强升高体系温度降低体系温度小结:aA(g)+bB(g) cC(g)+dD(g) △H<0 a+b > c+d 正反应方向 使反应物浓度减小逆反应方向 使反应物浓度增大逆反应方向 使生成物浓度减小 正反应方向 使生成物浓度增大 正反应方向 体系压强减小逆反应方向 体系压强增大逆反应方向 体系温度减低 正反应方向 体系温度升高 如果改变影响平衡的一个条件(浓度、温度、压强等),
平衡就向能够使这种改变减弱的方向移动。4、化学平衡移动原理——勒夏特列原理原理:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动⑴、此原理只适用于已达平衡的体系⑵、平衡移动方向与条件改变方向相反,例如:增大浓度,平衡移向减小这种浓度的方向;增大压强,向减小压强方向移动。说明:⑶、“减弱”的含义:平衡移动后结果变化的方向不变,但程度减小。例如,增加反应物浓度平衡移动后该反应物浓度仍增加,只是增加的程度比没有平衡移动时要小。①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向 方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为 ;②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为 ;③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为 。正反应 a< c < b正反应P1 < P3< P2逆反应T1 < T3< T2讨论:反应N2(g)+3H2 (g) 2NH3 (g)△H<0达到化学平衡,改变下列条件,根据反应体系中的变化填空:即:平衡移动的结果是减弱改变而不是抵消改变。5、催化剂对化学平衡的影响讨论:催化剂怎样改变v正和 v逆?小结:同步、等倍数改变v正和 v逆结论:催化剂不能使化学平衡发生移动;不能改变反应混合物含量;但可以改变达到平衡的时间课堂练习1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A 在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也无论反应物起始浓度的大小,最后达到平衡时,尽管每种物质的浓度在各个体系中并不一致,但各种生成物浓度的系数次方的乘积除以各反应物浓度的系数次方的乘积所得的之比却是恒定值。请仔细阅读教材P29表格,从中你能获得什么信息?—— K四、化学平衡常数实验测得,同一反应(如:aA+bB cC+dD)在某温度下达到的化学平衡状态,平衡体系中各物质的浓度满足下面关系:其中c为各组分的平衡浓度,温度一定,K为定值。即化学平衡常数只与温度有关,而与反应物或生成物的浓度无关。(一)、化学平衡常数表达式一定温度下,可逆反应处于平衡状态时,生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比为一常数化学平衡常数值的大小是可逆反应进行程度的标志。 表示在一定温度下,可逆反应达到平衡时该反应进行的程度(反应的限度)。(1)K值越大,说明平衡时生成物的浓度越大,反应物的浓度越小,反应程度越大,反应物转化率也越大;反之则转化率越低。(2)K值与浓度无关,随温度变化而变化。 化学平衡常数是一定温度下一个反应本身固有的内在性质的定量体现。(二)、化学平衡常数意义(三)、使用平衡常数应注意的问题(1)必须指明温度,反应必须达到平衡状态(2)平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大(3)在进行K值的计算时,反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数“1”而不代入公式,表达式中不需表达一定温度下如:一定温度下(4)平衡常数的表达式与方程式的书写有关K1 = 1/K2 = K32某温度下化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。(5)利用K值可判断某状态是否处于平衡状态如某温度下,可逆反应mA(g) + nB(g) pC(g) + qD(g)
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下: Q<K ,V正>V逆,反应向正方向进行Q=K ,V正=V逆,反应处于平衡状态Q>K ,V正<V逆,反应向逆方向进行则:现有一定温度下的密闭容器中存在如下反应:2SO2+O2 2SO3知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断,
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?例2五、有关化学平衡的计算:起始量、变化量、平衡量的计算关系在反应aA(g)+bB (g) cC (g)+ dD (g)中,计算关系为:aA(g)+ bB (g) cC (g)+ dD (g)n1n200 ax bxcxdxn1-ax n2-bxcxdx单位
统一已知条件计量系数之比加、减计算⑴、物质浓度的变化关系:①、反应物:平衡浓度= ————————————————起始浓度-变化浓度②、生成物:平衡浓度= ————————————————起始浓度+变化浓度③、各物质的变化浓度之比= ————————————————化学计量系数之比⑵、反应物的转化率:反应物转化为生成物的百分率解:∵mol20.1×5×4133422①、 ∵2 : x = 2 : (0.1×5×4)∴ x = 2 解析:这是一个连续平衡的计算,计算思路为:第一个反应的平衡量作为第二个反应的起始量解:起变平
4 mol00 x x x4 mol - x x x x 0 xyyy x - yy x +y x – y = 1.62 x +y = 4.50解得: x = 3.06 mol y = 1.44 mol 故:c (N2O5) = (4 – 3.06) mol / 1L=0.94 mol/L c (N2O ) = 1.44 mol / 1L=1.44 mol/L 解: n n0 x 2x 2x n - x n - 2x 2x由题意可知: n - x + n - 2x = 2 x x = 0.4n解题的一般步骤:列出三栏数据根据题意列方程求解气体反应计算时经常使用的推论:例4 教材P29例1
(3)计算(1)、 (2)问条件下H2、I2的转化率,通过比较你有什么想法?
不同的起始条件能达到相同的平衡状态。
(4)在上述温度下,该容器中若通入0.1molH2、0.2molI2,试计算H2、I2的转化率,通过分别与(1)、 (2)
的转化率比较,你能得出什么结论?
增加反应物之一的浓度,可以提高其他反应物的转化率,而自身的转化率降低。六、化学平衡图像问题1、浓度 - 时间图: 可用于:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3CA的转化率=33.3%
B的转化率=66.7%1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%2、速度-时间图: 可用于:
1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
将向 方向移动。减小生成物浓度正2、速度-时间图:?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸2、速度-时间图:?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
(>、<、=)p+q。增大逆<3、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热?m+nmA (g) + nB (g) pC (g) 有如图所示的关系,则:
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ——— p ;
⑶、该反应正反应为———— 反应<>>放热P1 → P2 P增大C%增大平衡右移体积缩小 T1 → T2 T降低C%增大平衡右移正反应放热 4、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+np+q?正反应吸热m+n=p+q恒定温度讨论压强:压强增大,D%增大,→正反应气体体积缩小恒定压强讨论温度:温度升高, D%减小,←逆反应为吸热反应>放热5、其它:?正反应吸热?正反应吸热?正反应放热?m+n
①p1与 p2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④Q与 0 的关系是 。P2 > P 1T2 < T 1m + n > p0 < Q练习一:练习二?对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D(广东18).右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.减小体积练习三下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。C点练习四(年 江苏 )18.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高七、等效平衡问题浓度/mol·L-1时间/s0.001.002.001.580.21浓度/mol·L-1t2HIH2或I20.001.002.001.580.21t1时间/sHIH2或I2从正反应开始从逆反应开始1molH2+1mol I22mol HI相当于在425℃时,在1L密闭容器中进行反应: H2+I2 2HI,达到平衡,分别说明下列各图所示的涵义。由图中的事实可以说明化学平衡具有哪些特征? 在一定条件下,可逆反应只要起始浓度相当,无论经过何种途径,达到化学平衡时,只要同种物质的体积分数相同,这样的平衡称为等效平衡。(一)、等效平衡的概念等效平衡建成条件探究一 在一定温度下,一个容积固定的密闭容器中发生反应:2A(g)+B(g)? 3C(g)+D(g),根据下表有关数据分析恒温、恒容下等效平衡建成的条件。恒温恒容?1、恒温、恒容下对于气态物质反应前后分子数变化的可逆反应等效平衡的
判断方法是: 使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量是否对应相等。(二)、等效平衡的建成条件、判断方法及产生结果:归纳总结产生结果:各组分百分量、n、c均相同练习1:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
?
达到平衡时, C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的体积分数为a%是
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol BAB 练习2、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
2mol2.25mol0.5molX+Z/2=1 , Y+3Z/2=3恒温恒容?等效平衡建成条件的探究二在恒温恒容时下列能与下图达到等效平衡的是( )A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)ABCD极限转化等效平衡建成条件的探究二2、恒温、恒容下对于气态物质反应前后分子数相等的可逆反应等效平衡的 判断方法是: 使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。归纳总结产生结果:各组分百分量相同,n、c同比例变化 (二)、等效平衡的建成条件、判断方法及产生结果:练习3:对于H2+I2(g) 2HI,在恒温、恒容下,按下列不同量反应等效的有 。1、23、4、5或练习4、在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:
A(气)+B(气) 2C(气)达 到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A.2mol C
B.3mol C
C.4mol A、2mol B
D.1mol A、2mol CCD 练习5:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
?
达到平衡时, C的浓度为1.2mol/L 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍为1.2mol/L的是
A、0.3mol C+0.1mol D
B、1.6mol A+0.8mol B+0.6mol C+0.2mol D
C、3mol C+1mol D +1mol B
D、4mol A+2mol BB 在一定温度下,一个压强恒定的密闭容中发生反应2A(g)+B(g)?3C(g)+D(g),根据下表有关数据分析恒温、恒压下等效平衡建成的条件。?
等效平衡建成条件的探究三恒温恒压平衡状态 与可逆反应气态物质的化学计量数无关,使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。3、恒温、恒压下等效平衡的
判断方法是: 归纳总结产生结果:各组分百分量、c相同,n同比例变化 (二)、等效平衡的建成条件、判断方法及产生结果:练习6、在一个1L的密闭容器中,加2molA 1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol BAB练习7、在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:
3A(气)+2B(气) xC(气)+yD(气)
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则X,Y的值分别为( )
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2 C D﹏等效平衡小结投料换算成相同物质表示时量相同两次平衡时各组分百分量、n、c均相同 投料换算成相同物质表示时等比例两次平衡时各组分百分量相同,n、c同比例变化 投料换算成相同物质表示时等比例两次平衡时各组分百分量、c相同,n同比例变化练习8、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4BC﹏练习9恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。 3a(1-a)mol23-3a概念的理解:(1)一定条件下:通常可以是
① 同T同V,②同T同P(2)平衡状态(终态)只与始态有关,而与途径无关,
(如:①无论反应从什么方向开始②投料是一次还是分成几次,)只要起始浓度相当,就达到等效平衡状态。概念的理解:(3)体积分数相同:即平衡混合物各组分的百分含量对应相同,但各组分的物质的量、浓度可能不同。概念的理解:
3、化学平衡状态的特征逆、动、等、定、变4、达到化学平衡的标志:正逆反应速率相等和反应混合物各组分浓度保持不变是判断平衡的两大主要标志⑴、直接标志:①、速率关系: v正= v逆应用:判断平衡时,要注意用“同”、“等”、“逆”的原则,即同:不同物质表示的反应速率必须转化为相同物质表示的反应速率等:转化后的反应速率必须相等逆:反应方向必须对立②、含量关系:反应混合物各组分的浓度、质量分数、物质的量、物质的量分数、体积分数、分子数之比保持不变⑵、间接标志:①、混合气体的总压强、总体积、总物质的量不随时间改变而—————,(适用于
—————————————)改变m+n≠p 的反应②、混合气体的平均相对分子质量、密度不随时间改变而—————,(适用于
—————————————)改变m+n≠p 的反应③、各气体体积、气体分压、各物质的物质的量不随时间改变⑶、特殊标志:①、对于有色物质参加反应,如果体系颜色不变,反应达到平衡②、对于吸热或放热反应,如果体系温度不变,反应达到平衡气体的总压、气体的总的物质的量、混合气体的平均相对分子质量、混合气体的密度、反应混合物平衡时物质的量之比⑷、在等系数的气体反应中不能作为平衡判据的是:例1、一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
A、单位时间内生成n mol A2同时生成n molAB
B、单位时间内生成2n mol AB 同时生成n mol B2
C、单位时间内生成n mol A2 同时生成n mol B2 D、单位时间内生成n mol A2 同时消耗n mol B2 √√在判断化学平衡时,要注意化学键数与反应物质的物质的量之间的联系,同时要注意成键、断键与反应方向之间的关系。例2、一定条件下,反应N2+3H2 2NH3达到平衡的标志是
A、一个N≡N键断裂的同时,有三个H-H键形成
B、一个N≡N键断裂的同时,有三个H-H键断裂
C、一个N≡N键断裂的同时,有六个N-H键断裂
D、一个N≡N键断裂的同时,有六个N-H键形成 √√例3、在一定温度下,向aL密闭容器中加入1molX
气体和2molY气体发生如下反应:
X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
A、容器内压强不随时间变化
B、容器内各物质的浓度不随时间变化
C、容器内X、Y、Z的浓度之比为1:2:2
D、单位时间消耗0.1molX的同时生成0.2molZ√√练习: 【1】 在一定温度下,可逆反应
A(气)+3B(气) 2C(气)达到平衡的标志是( )
C的生成速率与C分解的速率相等 B. 单位时间内生成nmolA,同时生3nmolB C. A、B、C的浓度不再变化 D. A、B、C的分子数比为1:3:2AC【2】 下列说法中可以充分说明反应:
P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( ) A. 反应容器内压强不随时间变化 B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而变化B 【3】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A. 混合气体的压强
B. 混合气体的密度
C. B的物质的量浓度
D. 气体的总物质的量
BC【4】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2(② ⑧ ) 三、化学平衡的移动化学平衡的研究对象是——————,化学平衡是有条件限制的————平衡,只有在————————时才能保持平衡,当外界条件(浓度、温度、压强)改变时,化学平衡会被————,反应混合物里各组分的含量不断—————,由于条件变化对正逆反应速率的影响不同,致使v正—— v逆,然后在新条件下建立————可逆反应动态条件一定破坏变化新平衡≠ (一)、化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动(二)、化学平衡的移动方向的速率判断:①、若外界条件变化引起v正> v逆:平衡向正反应方向移动②、若外界条件变化引起v正< v逆:平衡向逆反应方向移动③、若外界条件变化引起v正= v逆:旧平衡未被破坏,平衡不移动化学平衡总往反应速率大的方向移动1、浓度对化学平衡的影响(三)、影响化学平衡移动的因素:影响因素:(1)浓度对平衡的影响实验2-5实验2-6结论:当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向————反应方向移动;增大生成物浓度或减小反应物浓度,化学平衡向————反应方向移动。正逆强调:气体或溶液浓度的改变会引起反应速
率的变化,纯固体或纯液体用量的变化不会
引起反应速率改变,化学平衡不移动思考:1、某温度下,反应C(s)+H2O(g) CO(g)+H2(g)达到平衡后,增加或移去一部分碳固体,化学平衡移动吗?为什么?
2、实验2—6中,向平衡体系中加入少量氯化钾固体,溶液颜色怎么变?为什么?2、压强对化学平衡的影响讨论:压强的变化对化学反应速率如何影响?v正和 v逆怎样变化?会同等程度的增大或减小吗?N2(g)+3H2(g) 2NH3(g)反应中,压强变化和NH3含量的关系结论:压强增大, NH3%增大,平衡向正反应方向移动。即压强增大, v正和 v逆同时增大,但改变倍数不同;压强减小,v正和 v逆同时减小,但改变倍数不同。压强对化学平衡的影响:aA(g)+bB(g) cC(g)规律:增大压强,化学平衡向————————————————移动;减小压强,化学平衡向——————————————————移动;体积相等的气体反应,压强改变,化学平衡—————。 气体体积缩小方向气体体积扩大方向不移动增大压强,气体总物质的量浓度增大,化学平衡向气体总物质的量浓度减小的方向移动;
减小压强,气体的总物质的量浓度减小,化学平衡向气体总物质的量增大的方向移动。结论:压强变化不影响体积相等的气体反应的化学平衡讨论:压强的变化不会影响固体或液体物质的反应速率,压强的变化会使固体或液体反应的化学平衡移动吗?aA(g)+bB(g) cC(g) 当a+b=c时结论:无气体参加的反应,压强的改变,不能使化学平衡移动强调:压强变化若没有浓度的变化,化学反应速率——————,化学平衡——————。不变不移动不变不变不移动减小逆反应3、温度对化学平衡的影响讨论:温度的变化对化学反应速率如何影响?v正和 v逆怎样变化?结论:温度升高, v正和 v逆同时增大,但改变倍数不同;温度降低,v正和 v逆同时减小,但改变倍数不同;问题:温度的变化如何改变 不同反应的v正和 v逆的倍数?【实验2-5】温度对平衡的影响:2NO2 N2O4(正反应放热)实验现象:温度升高,混合气体颜色加深,——————————,平衡向—————— 方向移动;温度降低,混合气体颜色变浅,
————————————,平衡向—————— 方向移动NO2浓度增大逆反应NO2浓度减小正反应V正= V逆V正V逆t1t(s)V(molL-1S-1)0T2升温V”正 = V”逆V’逆V‘正温度对化学平衡的影响:改变的条件平衡移动的方向平衡移动的结果增大反应物浓度减小反应物浓度增大生成物浓度减小生成物浓度增大体系压强减小体系压强升高体系温度降低体系温度小结:aA(g)+bB(g) cC(g)+dD(g) △H<0 a+b > c+d 正反应方向 使反应物浓度减小逆反应方向 使反应物浓度增大逆反应方向 使生成物浓度减小 正反应方向 使生成物浓度增大 正反应方向 体系压强减小逆反应方向 体系压强增大逆反应方向 体系温度减低 正反应方向 体系温度升高 如果改变影响平衡的一个条件(浓度、温度、压强等),
平衡就向能够使这种改变减弱的方向移动。4、化学平衡移动原理——勒夏特列原理原理:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向减弱这种改变的方向移动⑴、此原理只适用于已达平衡的体系⑵、平衡移动方向与条件改变方向相反,例如:增大浓度,平衡移向减小这种浓度的方向;增大压强,向减小压强方向移动。说明:⑶、“减弱”的含义:平衡移动后结果变化的方向不变,但程度减小。例如,增加反应物浓度平衡移动后该反应物浓度仍增加,只是增加的程度比没有平衡移动时要小。①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向 方向移动,达到新平衡后, N2的浓度为c mol/L,则a、b、c的大小为 ;②若平衡体系的压强为P1 ,之后缩小反应体系体积使压强增大到P2 ,此时平衡向——————方向移动,达到新平衡后 体系的压强为P3 ,则P1 、 P2、 P3 的大小为 ;③若平衡体系的温度为T1 ,之后将温度升高到 T2 ,此时平衡向——————方向移动,达到新平衡后 体系的温度为T3 ,则T1 、 T2、 T3 的大小为 。正反应 a< c < b正反应P1 < P3< P2逆反应T1 < T3< T2讨论:反应N2(g)+3H2 (g) 2NH3 (g)△H<0达到化学平衡,改变下列条件,根据反应体系中的变化填空:即:平衡移动的结果是减弱改变而不是抵消改变。5、催化剂对化学平衡的影响讨论:催化剂怎样改变v正和 v逆?小结:同步、等倍数改变v正和 v逆结论:催化剂不能使化学平衡发生移动;不能改变反应混合物含量;但可以改变达到平衡的时间课堂练习1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
① 生成物的百分含量一定增加② 生成物的产量一定增加③ 反应物的转化率一定增大④ 反应物浓度一定降低⑤ 正反应速率一定大于逆反应速率⑥ 使用了合适的催化剂
A ① ② (B) ② ⑤ (C) ③ ⑤ (D) ④ ⑥
B2.恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: A. a>b+c B. a<b+c C. a=b+c D. a=b=c A 在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也无论反应物起始浓度的大小,最后达到平衡时,尽管每种物质的浓度在各个体系中并不一致,但各种生成物浓度的系数次方的乘积除以各反应物浓度的系数次方的乘积所得的之比却是恒定值。请仔细阅读教材P29表格,从中你能获得什么信息?—— K四、化学平衡常数实验测得,同一反应(如:aA+bB cC+dD)在某温度下达到的化学平衡状态,平衡体系中各物质的浓度满足下面关系:其中c为各组分的平衡浓度,温度一定,K为定值。即化学平衡常数只与温度有关,而与反应物或生成物的浓度无关。(一)、化学平衡常数表达式一定温度下,可逆反应处于平衡状态时,生成物浓度的系数次方的乘积与反应物浓度系数次方的乘积之比为一常数化学平衡常数值的大小是可逆反应进行程度的标志。 表示在一定温度下,可逆反应达到平衡时该反应进行的程度(反应的限度)。(1)K值越大,说明平衡时生成物的浓度越大,反应物的浓度越小,反应程度越大,反应物转化率也越大;反之则转化率越低。(2)K值与浓度无关,随温度变化而变化。 化学平衡常数是一定温度下一个反应本身固有的内在性质的定量体现。(二)、化学平衡常数意义(三)、使用平衡常数应注意的问题(1)必须指明温度,反应必须达到平衡状态(2)平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大(3)在进行K值的计算时,反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数“1”而不代入公式,表达式中不需表达一定温度下如:一定温度下(4)平衡常数的表达式与方程式的书写有关K1 = 1/K2 = K32某温度下化学平衡常数是指某一具体反应的平衡常数。若反应方向改变,则平衡常数改变。若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。(5)利用K值可判断某状态是否处于平衡状态如某温度下,可逆反应mA(g) + nB(g) pC(g) + qD(g)
平衡常数为K,若某时刻时,反应物和生成物的浓度关系如下: Q<K ,V正>V逆,反应向正方向进行Q=K ,V正=V逆,反应处于平衡状态Q>K ,V正<V逆,反应向逆方向进行则:现有一定温度下的密闭容器中存在如下反应:2SO2+O2 2SO3知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断,
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?例2五、有关化学平衡的计算:起始量、变化量、平衡量的计算关系在反应aA(g)+bB (g) cC (g)+ dD (g)中,计算关系为:aA(g)+ bB (g) cC (g)+ dD (g)n1n200 ax bxcxdxn1-ax n2-bxcxdx单位
统一已知条件计量系数之比加、减计算⑴、物质浓度的变化关系:①、反应物:平衡浓度= ————————————————起始浓度-变化浓度②、生成物:平衡浓度= ————————————————起始浓度+变化浓度③、各物质的变化浓度之比= ————————————————化学计量系数之比⑵、反应物的转化率:反应物转化为生成物的百分率解:∵mol20.1×5×4133422①、 ∵2 : x = 2 : (0.1×5×4)∴ x = 2 解析:这是一个连续平衡的计算,计算思路为:第一个反应的平衡量作为第二个反应的起始量解:起变平
4 mol00 x x x4 mol - x x x x 0 xyyy x - yy x +y x – y = 1.62 x +y = 4.50解得: x = 3.06 mol y = 1.44 mol 故:c (N2O5) = (4 – 3.06) mol / 1L=0.94 mol/L c (N2O ) = 1.44 mol / 1L=1.44 mol/L 解: n n0 x 2x 2x n - x n - 2x 2x由题意可知: n - x + n - 2x = 2 x x = 0.4n解题的一般步骤:列出三栏数据根据题意列方程求解气体反应计算时经常使用的推论:例4 教材P29例1
(3)计算(1)、 (2)问条件下H2、I2的转化率,通过比较你有什么想法?
不同的起始条件能达到相同的平衡状态。
(4)在上述温度下,该容器中若通入0.1molH2、0.2molI2,试计算H2、I2的转化率,通过分别与(1)、 (2)
的转化率比较,你能得出什么结论?
增加反应物之一的浓度,可以提高其他反应物的转化率,而自身的转化率降低。六、化学平衡图像问题1、浓度 - 时间图: 可用于:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3CA的转化率=33.3%
B的转化率=66.7%1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%2、速度-时间图: 可用于:
1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。?引起平衡移动的因素是
,平衡
将向 方向移动。增大反应物浓度正?引起平衡移动的因素是
,平衡
将向 方向移动。减小生成物浓度正2、速度-时间图:?已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低),平衡向 反应方向移动,正反应是 热反应。升高正吸2、速度-时间图:?对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如下图变化,则压强变化是 (增大或减小),平衡向 反应方向移动,m+n
(>、<、=)p+q。增大逆<3、某物质的转化率(或百分含量)-时间-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应吸热?m+n
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ——— p ;
⑶、该反应正反应为———— 反应<>>放热P1 → P2 P增大C%增大平衡右移体积缩小 T1 → T2 T降低C%增大平衡右移正反应放热 4、某物质的转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+n
①p1与 p2 的关系是 ;
②m + n 与p的关系是 ;
③T1 与 T2的关系是 ;
④Q与 0 的关系是 。P2 > P 1T2 < T 1m + n > p0 < Q练习一:练习二?对于2A(g)+B(g) C(g)+3D(g)(正反应吸热)有如下图所示的变化,图中Y轴可能表示:
A、B物质的转化率
B、正反应的速率
C、平衡体系中的A%
D、平衡体系中的C%A、D(广东18).右图曲线a表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.减小体积练习三下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。C点练习四(年 江苏 )18.在容积固定的密闭容器中存在如下反应: A(g)+3B(g) 2C(g); △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高七、等效平衡问题浓度/mol·L-1时间/s0.001.002.001.580.21浓度/mol·L-1t2HIH2或I20.001.002.001.580.21t1时间/sHIH2或I2从正反应开始从逆反应开始1molH2+1mol I22mol HI相当于在425℃时,在1L密闭容器中进行反应: H2+I2 2HI,达到平衡,分别说明下列各图所示的涵义。由图中的事实可以说明化学平衡具有哪些特征? 在一定条件下,可逆反应只要起始浓度相当,无论经过何种途径,达到化学平衡时,只要同种物质的体积分数相同,这样的平衡称为等效平衡。(一)、等效平衡的概念等效平衡建成条件探究一 在一定温度下,一个容积固定的密闭容器中发生反应:2A(g)+B(g)? 3C(g)+D(g),根据下表有关数据分析恒温、恒容下等效平衡建成的条件。恒温恒容?1、恒温、恒容下对于气态物质反应前后分子数变化的可逆反应等效平衡的
判断方法是: 使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量是否对应相等。(二)、等效平衡的建成条件、判断方法及产生结果:归纳总结产生结果:各组分百分量、n、c均相同练习1:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
?
达到平衡时, C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的体积分数为a%是
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol BAB 练习2、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
2mol2.25mol0.5molX+Z/2=1 , Y+3Z/2=3恒温恒容?等效平衡建成条件的探究二在恒温恒容时下列能与下图达到等效平衡的是( )A. 2 mol HI
B. 2 mol H2+2 mol I2
C. 1 mol H2+1 mol I2+2 mol HI
D. 0.5 mol H2+0.5 mol I2+1 mol HI(1 1 0)(2 2 0)(2 2 0)(1 1 0)ABCD极限转化等效平衡建成条件的探究二2、恒温、恒容下对于气态物质反应前后分子数相等的可逆反应等效平衡的 判断方法是: 使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。归纳总结产生结果:各组分百分量相同,n、c同比例变化 (二)、等效平衡的建成条件、判断方法及产生结果:练习3:对于H2+I2(g) 2HI,在恒温、恒容下,按下列不同量反应等效的有 。1、23、4、5或练习4、在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:
A(气)+B(气) 2C(气)达 到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A.2mol C
B.3mol C
C.4mol A、2mol B
D.1mol A、2mol CCD 练习5:在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
?
达到平衡时, C的浓度为1.2mol/L 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍为1.2mol/L的是
A、0.3mol C+0.1mol D
B、1.6mol A+0.8mol B+0.6mol C+0.2mol D
C、3mol C+1mol D +1mol B
D、4mol A+2mol BB 在一定温度下,一个压强恒定的密闭容中发生反应2A(g)+B(g)?3C(g)+D(g),根据下表有关数据分析恒温、恒压下等效平衡建成的条件。?
等效平衡建成条件的探究三恒温恒压平衡状态 与可逆反应气态物质的化学计量数无关,使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的物质的量比是否相等。3、恒温、恒压下等效平衡的
判断方法是: 归纳总结产生结果:各组分百分量、c相同,n同比例变化 (二)、等效平衡的建成条件、判断方法及产生结果:练习6、在一个1L的密闭容器中,加2molA 1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol BAB练习7、在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:
3A(气)+2B(气) xC(气)+yD(气)
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 、0.4LB、4LC、0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则X,Y的值分别为( )
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2 C D﹏等效平衡小结投料换算成相同物质表示时量相同两次平衡时各组分百分量、n、c均相同 投料换算成相同物质表示时等比例两次平衡时各组分百分量相同,n、c同比例变化 投料换算成相同物质表示时等比例两次平衡时各组分百分量、c相同,n同比例变化练习8、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4BC﹏练习9恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为
(2)若开始时放入3molA和3molB,到达平衡后,生成C物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。 3a(1-a)mol23-3a概念的理解:(1)一定条件下:通常可以是
① 同T同V,②同T同P(2)平衡状态(终态)只与始态有关,而与途径无关,
(如:①无论反应从什么方向开始②投料是一次还是分成几次,)只要起始浓度相当,就达到等效平衡状态。概念的理解:(3)体积分数相同:即平衡混合物各组分的百分含量对应相同,但各组分的物质的量、浓度可能不同。概念的理解:
