化学平衡图像分析--高三复习课件
文档属性
| 名称 | 化学平衡图像分析--高三复习课件 |
|
|
| 格式 | zip | ||
| 文件大小 | 514.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-28 00:00:00 | ||
图片预览




文档简介
课件27张PPT。化学平衡图像分析 1.图像问题解题步骤
(1)看懂图像:
①看面(即弄清纵坐标与横坐标的意义);
②看线(即弄清线的走向和变化趋势);
③看点(即弄清起点、拐点、交点、终点的意义);
④看是否要作辅助线(如等温线、等压线);
⑤看定量图像中有关量的多少。
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。方法指导2.原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。方法指导1. 以速率—时间图像计算平衡浓度 例1:在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)
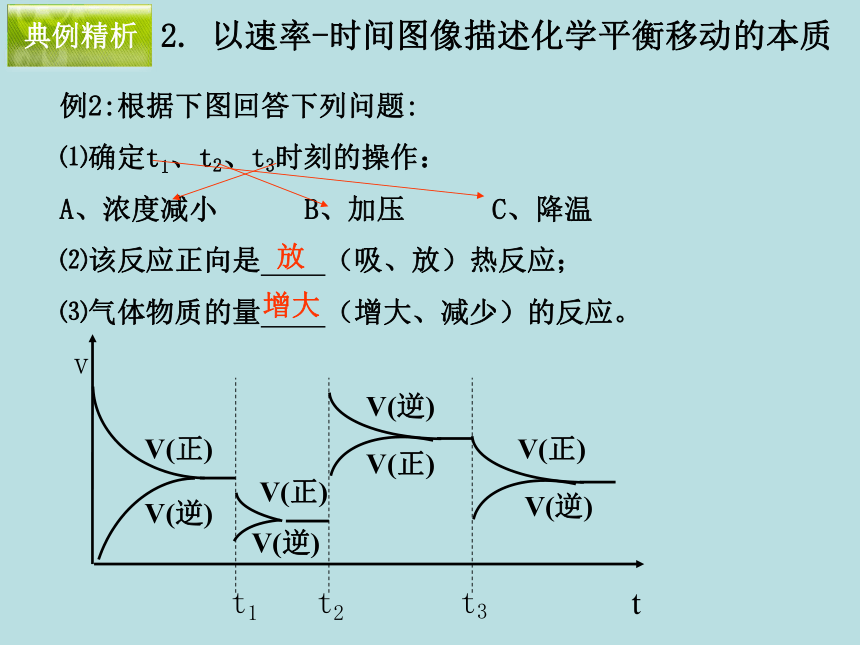
典例精析例2:根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、浓度减小 B、加压 C、降温
⑵该反应正向是 (吸、放)热反应;
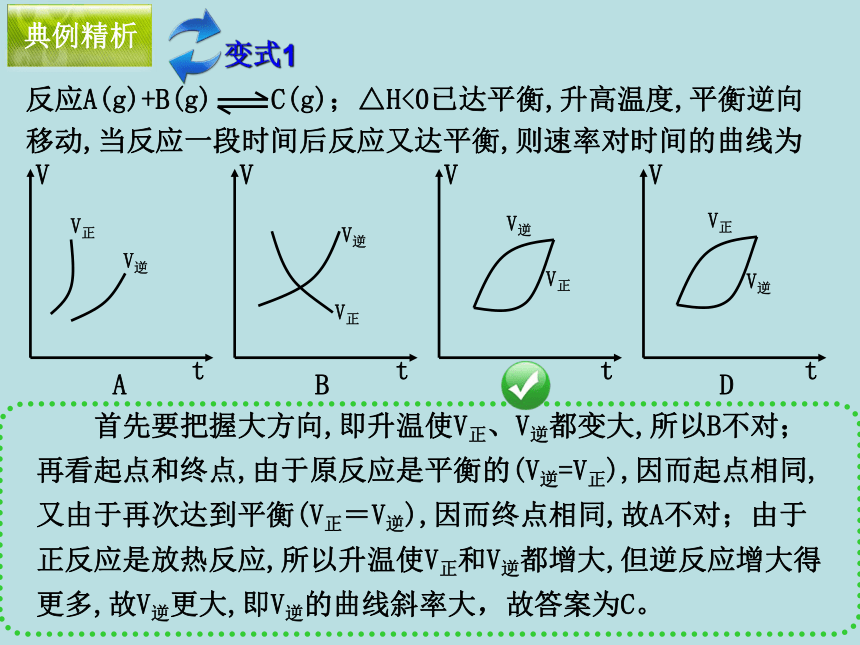
⑶气体物质的量 (增大、减少)的反应。放增大典例精析2. 以速率-时间图像描述化学平衡移动的本质 反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为 首先要把握大方向,即升温使V正、V逆都变大,所以B不对;再看起点和终点,由于原反应是平衡的(V逆=V正),因而起点相同,又由于再次达到平衡(V正=V逆),因而终点相同,故A不对;由于正反应是放热反应,所以升温使V正和V逆都增大,但逆反应增大得更多,故V逆更大,即V逆的曲线斜率大,故答案为C。典例精析变式1例3:下图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时的浓度随时间变化的曲线,下列有关该反应的描述正确的是
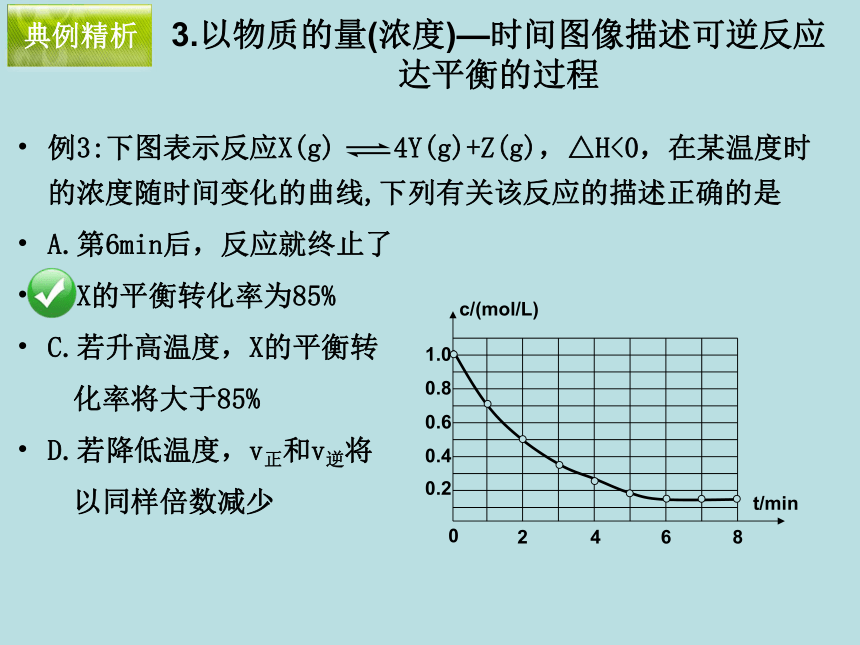
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转
化率将大于85%
D.若降低温度,v正和v逆将
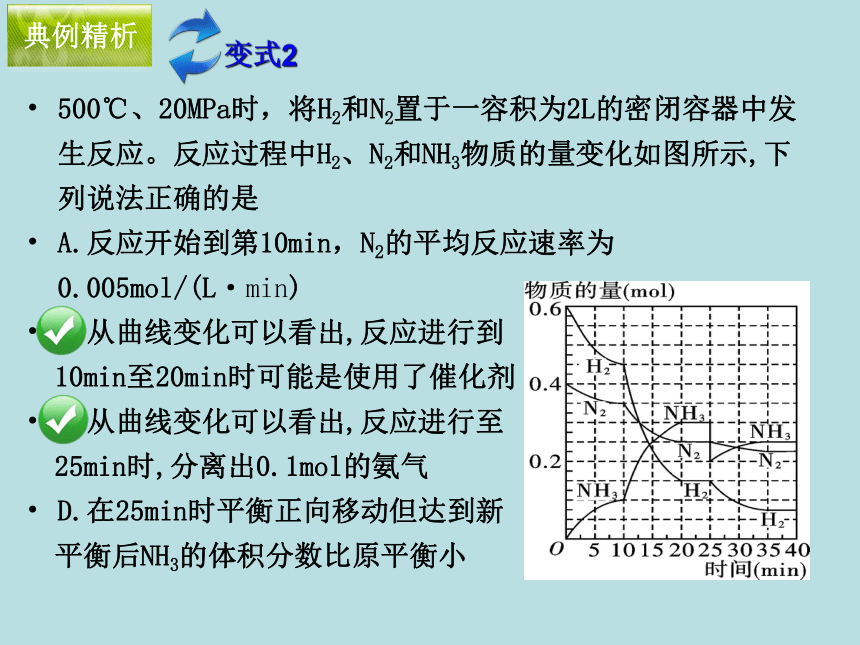
以同样倍数减少 典例精析3.以物质的量(浓度)—时间图像描述可逆反应达平衡的过程 典例精析500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第10min,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到
10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至
25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动但达到新
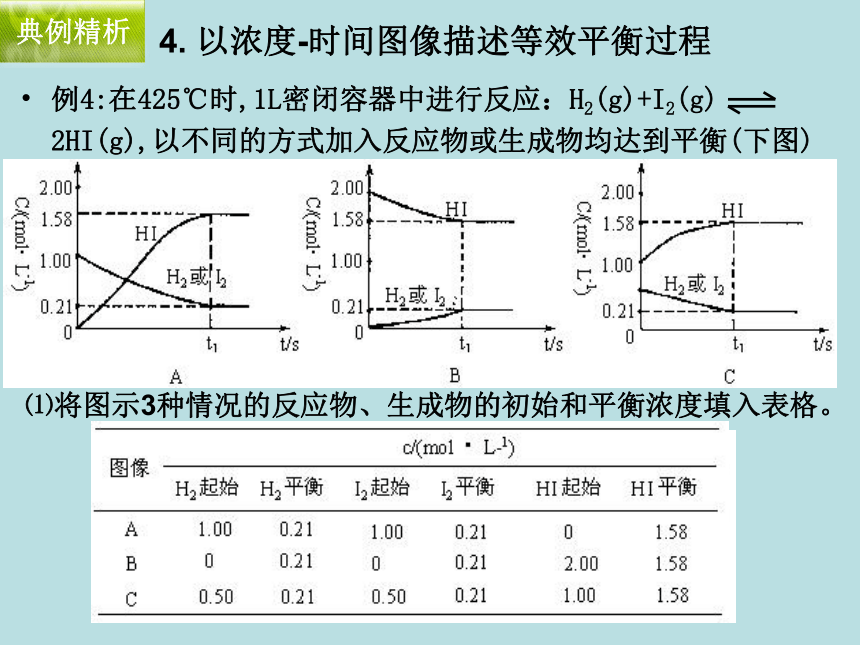
平衡后NH3的体积分数比原平衡小变式2例4:在425℃时,1L密闭容器中进行反应:H2(g)+I2(g) 2HI(g),以不同的方式加入反应物或生成物均达到平衡(下图)典例精析4. 以浓度-时间图像描述等效平衡过程 ⑴将图示3种情况的反应物、生成物的初始和平衡浓度填入表格。例4:在425℃时,1L密闭容器中进行反应:H2(g)+I2(g) 2HI(g),以不同的方式加入反应物或生成物均达到平衡(下图)典例精析4. 以浓度-时间图像描述等效平衡过程 ⑵以上3种情况达到化学平衡是否为同一平衡状态?由图中的事实可以说明化学平衡具有哪些特征? 达平衡时反应物和生成物浓度完全相同,故为同一平衡状态。
在一定条件下达到平衡后,正逆反应速率相等,平衡混合物中
各物质的浓度保持不变。 例5:对于可逆反应mA(g)+nB(s) C(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
A.降温,化学平衡向正反应方向移动?
B.使用催化剂可使D%有所增加?
C.化学方程式中气体的化学计量数m<p+q?
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 5. 以物质的量(转化率)—时间图像描述温度或压强对平衡移动的影响 典例精析A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
在密闭容器中进行下列反应:M(g)+ N(g) R(g)+2L此反应符合右图,下列叙述正确的是典例精析变式34.取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 典例精析6. 以转化率(体积分数)—压强(温度)图像判断平衡状态 mM(s)+ nN(g) pQ(g);正反应为放热反应。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是
A.A点时混合物的V正> V逆
B.A点比B点反应速率快
C.n>p
D.m+n>p
典例精析变式47. 根据质量分数(体积分数)—压强、温度图像判断反应特征 例7:已知反应 mA(g)+nB(g) xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是
A. 正反应吸热,
B. 正反应吸热,
C.正反应放热,
D. 正反应放热, 典例精析X(g)+Y(g) 2Z(g);△H<0,达平衡时,混合气体中Z的百分含量随温度变化的曲线为ABCD典例精析变式5例8 下列反应符合下图p-v变化曲线的是
A.H2(g)+I2(g) 2HI(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
D.CO(g)+C(s) 2CO(g) 8. 由速率-压强(温度)图像描述平衡移动时正逆反应速率的变化 典例精析下列反应符合下图T-v变化曲线的是
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0
B.N2O3(g) NO2(g)+NO(g);ΔH>0
C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g);ΔH<0
D.2CO(g) CO2(g)+C(s);ΔH<0典例精析变式69. 混合气体平均相对分子质量—温度(压强)图像 典例精析例9:可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E. A和B可能都是气体
10. 由体积分数—温度图像判断平衡进程 例10:在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g),在第7秒时分别测定其中的体积分数,并绘成下图曲线。 典例精析⑵此反应的正反应是______热反应。
⑶T1到T2变化时,V正 V逆,T3时,V正 V逆, T3到T4变化时,V正 V逆。A、B放⑴A、B、C、D、E中,尚未达到化学平衡状态的点是 。>=<10. 由体积分数—温度图像判断平衡进程 例10:在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g),在第7秒时分别测定其中的体积分数,并绘成下图曲线。 典例精析⑷AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为是 。AC段化学反应尚未平衡,受速率控制,T升高,反应速率加快, 增大为增函数;CE段达到平衡后受平衡因素控制,T升高,平衡向吸热的逆向移动,故 下降为减函数。 1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
⑴根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: 高考回放(4)平衡时反应物X的转化率.X(g)+2Y(g) 2Z(g)1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(2)体系中发生反应的化学方程式.
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率.
高考回放1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的
实验条件改变分别是:
① ___________
②____________
③____________
升高温度
加入催化剂
增大压强高考回放 3.(09年安徽理综)汽车尾气净化中的一个反应如下:NO(g)+CO(g) N2(g)+CO2(g) △H=-373.4kJ·mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
高考回放4.(09重庆卷)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是 高考回放再 见
(1)看懂图像:
①看面(即弄清纵坐标与横坐标的意义);
②看线(即弄清线的走向和变化趋势);
③看点(即弄清起点、拐点、交点、终点的意义);
④看是否要作辅助线(如等温线、等压线);
⑤看定量图像中有关量的多少。
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。方法指导2.原则
(1)“定一议二”原则
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。方法指导1. 以速率—时间图像计算平衡浓度 例1:在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)
典例精析例2:根据下图回答下列问题:
⑴确定t1、t2、t3时刻的操作:
A、浓度减小 B、加压 C、降温
⑵该反应正向是 (吸、放)热反应;
⑶气体物质的量 (增大、减少)的反应。放增大典例精析2. 以速率-时间图像描述化学平衡移动的本质 反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为 首先要把握大方向,即升温使V正、V逆都变大,所以B不对;再看起点和终点,由于原反应是平衡的(V逆=V正),因而起点相同,又由于再次达到平衡(V正=V逆),因而终点相同,故A不对;由于正反应是放热反应,所以升温使V正和V逆都增大,但逆反应增大得更多,故V逆更大,即V逆的曲线斜率大,故答案为C。典例精析变式1例3:下图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时的浓度随时间变化的曲线,下列有关该反应的描述正确的是
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转
化率将大于85%
D.若降低温度,v正和v逆将
以同样倍数减少 典例精析3.以物质的量(浓度)—时间图像描述可逆反应达平衡的过程 典例精析500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
A.反应开始到第10min,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到
10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至
25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动但达到新
平衡后NH3的体积分数比原平衡小变式2例4:在425℃时,1L密闭容器中进行反应:H2(g)+I2(g) 2HI(g),以不同的方式加入反应物或生成物均达到平衡(下图)典例精析4. 以浓度-时间图像描述等效平衡过程 ⑴将图示3种情况的反应物、生成物的初始和平衡浓度填入表格。例4:在425℃时,1L密闭容器中进行反应:H2(g)+I2(g) 2HI(g),以不同的方式加入反应物或生成物均达到平衡(下图)典例精析4. 以浓度-时间图像描述等效平衡过程 ⑵以上3种情况达到化学平衡是否为同一平衡状态?由图中的事实可以说明化学平衡具有哪些特征? 达平衡时反应物和生成物浓度完全相同,故为同一平衡状态。
在一定条件下达到平衡后,正逆反应速率相等,平衡混合物中
各物质的浓度保持不变。 例5:对于可逆反应mA(g)+nB(s) C(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是
A.降温,化学平衡向正反应方向移动?
B.使用催化剂可使D%有所增加?
C.化学方程式中气体的化学计量数m<p+q?
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 5. 以物质的量(转化率)—时间图像描述温度或压强对平衡移动的影响 典例精析A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
在密闭容器中进行下列反应:M(g)+ N(g) R(g)+2L此反应符合右图,下列叙述正确的是典例精析变式34.取5等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 典例精析6. 以转化率(体积分数)—压强(温度)图像判断平衡状态 mM(s)+ nN(g) pQ(g);正反应为放热反应。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是
A.A点时混合物的V正> V逆
B.A点比B点反应速率快
C.n>p
D.m+n>p
典例精析变式47. 根据质量分数(体积分数)—压强、温度图像判断反应特征 例7:已知反应 mA(g)+nB(g) xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是
A. 正反应吸热,
B. 正反应吸热,
C.正反应放热,
D. 正反应放热, 典例精析X(g)+Y(g) 2Z(g);△H<0,达平衡时,混合气体中Z的百分含量随温度变化的曲线为ABCD典例精析变式5例8 下列反应符合下图p-v变化曲线的是
A.H2(g)+I2(g) 2HI(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
D.CO(g)+C(s) 2CO(g) 8. 由速率-压强(温度)图像描述平衡移动时正逆反应速率的变化 典例精析下列反应符合下图T-v变化曲线的是
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0
B.N2O3(g) NO2(g)+NO(g);ΔH>0
C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g);ΔH<0
D.2CO(g) CO2(g)+C(s);ΔH<0典例精析变式69. 混合气体平均相对分子质量—温度(压强)图像 典例精析例9:可逆反应2A+B 2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B不可能都是气体
E. A和B可能都是气体
10. 由体积分数—温度图像判断平衡进程 例10:在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g),在第7秒时分别测定其中的体积分数,并绘成下图曲线。 典例精析⑵此反应的正反应是______热反应。
⑶T1到T2变化时,V正 V逆,T3时,V正 V逆, T3到T4变化时,V正 V逆。A、B放⑴A、B、C、D、E中,尚未达到化学平衡状态的点是 。>=<10. 由体积分数—温度图像判断平衡进程 例10:在容积相同的不同密闭容器内,分别充入同量的N2和H2,在不同温度,任其发生反应N2(g)+3H2(g) 2NH3(g),在第7秒时分别测定其中的体积分数,并绘成下图曲线。 典例精析⑷AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为是 。AC段化学反应尚未平衡,受速率控制,T升高,反应速率加快, 增大为增函数;CE段达到平衡后受平衡因素控制,T升高,平衡向吸热的逆向移动,故 下降为减函数。 1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
⑴根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: 高考回放(4)平衡时反应物X的转化率.X(g)+2Y(g) 2Z(g)1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(2)体系中发生反应的化学方程式.
(3)列式计算该反应在0-3min时间内产物Z的平均反应速率.
高考回放1.(09全国卷Ⅱ)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的
实验条件改变分别是:
① ___________
②____________
③____________
升高温度
加入催化剂
增大压强高考回放 3.(09年安徽理综)汽车尾气净化中的一个反应如下:NO(g)+CO(g) N2(g)+CO2(g) △H=-373.4kJ·mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
高考回放4.(09重庆卷)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是 高考回放再 见
