9.3.1溶质质量分数(课件29页)
图片预览






文档简介
(共29张PPT)
第九单元 课题3 溶液的浓度
课时1 溶质质量分数
生产生活中的常见溶液(标签)
酒类的酒精度
白醋的浓度
52%(V/V)
9%(V/V)
情景导入
1.掌握溶液中溶质的质量分数的概念;
2.会计算有关溶质的质量分数。
学习目标
一、溶液的浓度
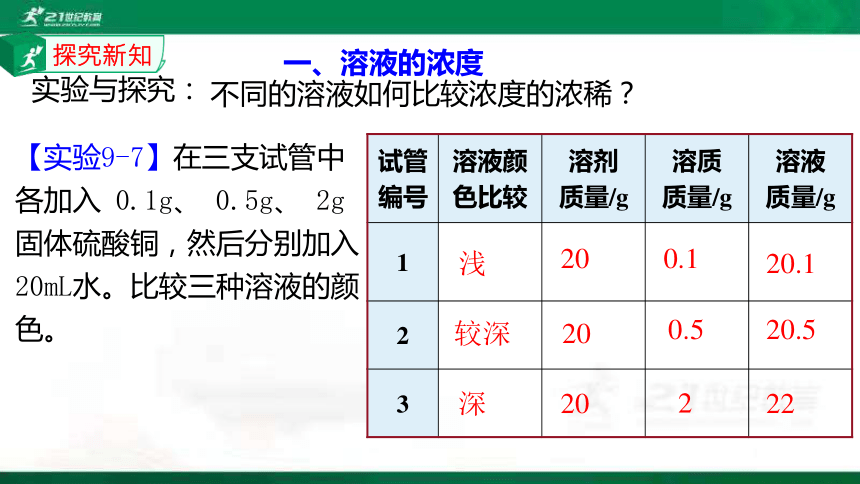
实验与探究:
不同的溶液如何比较浓度的浓稀?
【实验9-7】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
20
0.1
20.1
较深
20
0.5
20.5
深
20
2
22
探究新知
淡蓝 蓝色 深蓝
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
交流与讨论:
通过观察颜色来判断溶液的浓稀,仅仅是判断溶液浓稀粗略的方法。
我们应该学习商家向消费者介绍产品那样明确地表示出溶液的组成。其中表示溶液组成的方法有多种,这里主要认识溶质的质量分数。
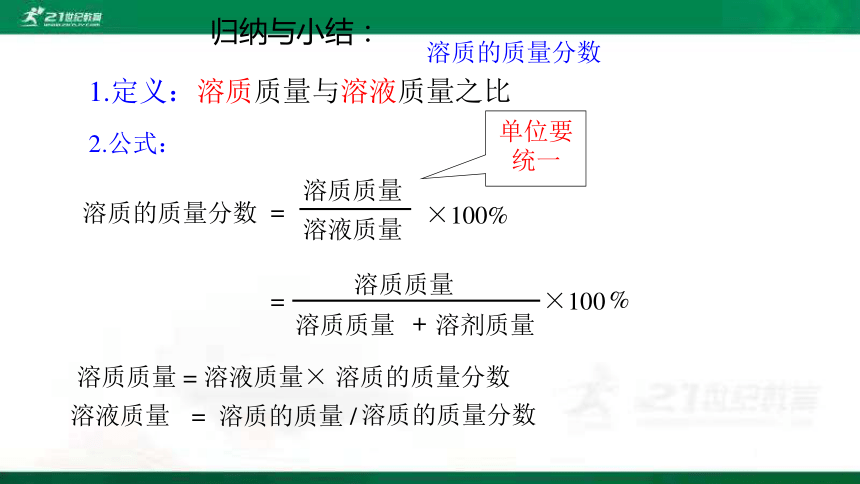
归纳与小结:
溶质的质量分数
1.定义:溶质质量与溶液质量之比
2.公式:
=
溶液质量
溶质质量
溶质的质量分数
×100%
%
×100
+
=
溶剂质量
溶质质量
溶质质量
溶质质量 = 溶液质量× 溶质的质量分数
溶质的质量分数
溶质的质量 /
溶液质量
=
单位要统一
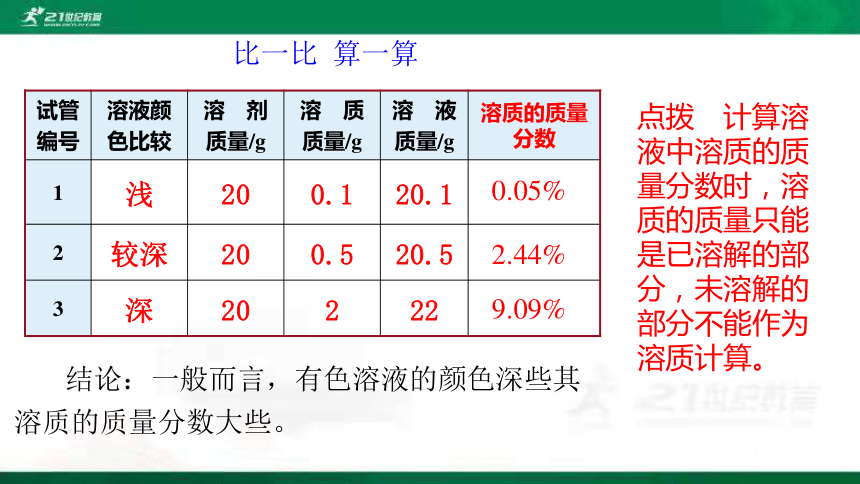
比一比 算一算
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质的质量分数
1 浅 20 0.1 20.1
2 较深 20 0.5 20.5
3 深 20 2 22
0.05%
2.44%
9.09%
结论:一般而言,有色溶液的颜色深些其溶质的质量分数大些。
点拨 计算溶液中溶质的质量分数时,溶质的质量只能是已溶解的部分,未溶解的部分不能作为溶质计算。
实验与探究:
【实验9-8】在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数。
溶质质量/g 溶剂(水)质量/g 现 象 溶液中溶质的质量分数
10 90 固体消失
20 80 固体消失
10%
20%
溶质的质量分数与溶解度的关系
已知20 ℃时,氯化钠的溶解度是36g。则20 ℃时氯化钠饱和溶液中溶质的质量分数为36%,对吗?(如果不对请列式改正)
不对,此时溶质的质量分数 =
36g
36g+100g
×
100% ≈ 26.5%
归纳:饱和溶液中溶质的质量分数与该温度下溶解度的关系为:
饱和溶液中溶质的质量分数
=_______________________________________________。
该温度下的溶解度
该温度下的溶解度+100g
×
100%
例2 甲、乙两种物质的溶解度曲线如图所示:
(1)20 ℃时,甲的饱和溶液中溶质的质量分数
(填“>”“=”或“<”)乙的饱和
溶液中溶质的质量分数。
(2)60 ℃时,甲的饱和溶液中溶质的质量分数为 。
(3)60 ℃时,将8 g甲加入20 g水中,充分溶解后,溶液中溶质的质量分数为 。
(4)将60 ℃时甲、乙的饱和溶液分别降温至t ℃,有晶体析出的是 ,溶质的质量分数减小的是 ,溶质的质量分数不变的是 ,此时甲、乙的溶液中溶质的质量分数大小关系为 。
<
20%
20%
甲
甲
乙
甲>乙
(1)溶解度曲线上溶液状态对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。
(2)饱和溶液溶质的溶解度变小,有晶体析出,溶质的质量分数减小;饱和溶液溶质的溶解度变大,溶液变为不饱和溶液,若不增加溶质,溶质的质量分数不变。
(3)饱和溶液变为不饱和溶液,溶质的质量分数不一定变小,如将KNO3饱和溶液升高温度,溶质的质量分数不变;不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,如将KNO3不饱和溶液降温到恰好饱和。
归纳与小结:
二、溶质的质量分数的简单计算
观察与思考:
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
=
溶液质量
溶质质量
溶质的质量分数
×100%
溶质质量 = 溶液质量× 溶质的质量分数
=150kg×16%
=126kg
溶剂质量 = 溶液质量- 溶质的质量
=150kg-24kg
=24kg
答:略。
探究新知
例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
溶液稀释前后溶质的质量不变
解:
设稀释后溶液的质量为x。
50g× 98%= x × 20%
x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
归纳与小结:
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前) (稀释后)
需要加入水的质量=_______质量-_______质量
稀溶液
浓溶液
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意:
溶质质量分数与溶解度的联系和区别
溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t 0C时溶解度36g是指: 在t 0C 时,100g水最多溶解该溶质36g。
饱和溶液的
溶质质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
1.溶质的质量分数
=
溶液质量
溶质质量
溶质的质量分数
×100%
2.溶质质量分数与溶解度的联系和区别:
一定温度下:某物质的饱和溶液的溶质质量分数
溶质的质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
课堂小结
1.下图是甲、乙两种物质的溶解度曲线。t3℃时,将取ag甲和ag乙分别放入100g水中,充分搅拌,然后降温,下列说法不正确的是( )
A.t1℃时,甲的溶解度小于乙的溶解度
B.降温至t2℃时,甲溶液和乙溶液均饱和
C.降温至t1℃时,两种溶液中溶质的质量分数相等
D.若甲中混有少量的乙,可用降温结晶的方法提纯甲
C
课堂练习
2.甲、乙两种固体的溶解度曲线如图所示,下列说法不正确的是( )
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙饱和溶液中溶质的质量分数相等
C.常采用冷却热饱和溶液的方法从溶液中获得甲物质晶体
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲等于乙
A
3.下列有关溶液的说法中,正确的是( )
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液都可以通过降低温度的方法变成饱和溶液
C.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
4.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaClB.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
D
C
5.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
D
1(2021·山东潍坊)如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )
A.t1℃时a、c两物质溶液中溶质的质量分数相等
B.t2℃时,物质a的100g饱和溶液中含有25g物质a
C.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g
D
中考练习
2.(2020·云南初三一模)如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是( )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
D
C
3.(2021·山东泰安)如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.t1℃时,a、c两种物质的溶液溶质质量分数一定相等
C.t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是:a>b>c
D.在t2℃时,将30ga物质加入50g水中充分溶解,所得溶液质量为80g
B
4.(2020·江苏初三二模).KCl和 KNO3的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶 解 度 /g KCl 31.0 34.0 37.0 40.0 42.6 45.5
KNO3 20.9 31.6 45.8 53.9 85.5 110
A.t2应介于 40℃~50℃
B.甲表示 KNO3溶解度曲线
C.55℃时,溶液的溶质质量分数:KNO3>KCl
D.甲、乙饱和溶液从 t1升温到 t2时,溶质的质量分数相等
5.(2020·广东初三二模)20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.②中所得溶液是饱和溶液
B.20℃时NaCl的溶液度为40g
C.①所得溶液的溶质质量分数为20%
D.③④溶液的溶质质量分数相等
D
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第九单元 课题3 溶液的浓度
课时1 溶质质量分数
生产生活中的常见溶液(标签)
酒类的酒精度
白醋的浓度
52%(V/V)
9%(V/V)
情景导入
1.掌握溶液中溶质的质量分数的概念;
2.会计算有关溶质的质量分数。
学习目标
一、溶液的浓度
实验与探究:
不同的溶液如何比较浓度的浓稀?
【实验9-7】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
20
0.1
20.1
较深
20
0.5
20.5
深
20
2
22
探究新知
淡蓝 蓝色 深蓝
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
交流与讨论:
通过观察颜色来判断溶液的浓稀,仅仅是判断溶液浓稀粗略的方法。
我们应该学习商家向消费者介绍产品那样明确地表示出溶液的组成。其中表示溶液组成的方法有多种,这里主要认识溶质的质量分数。
归纳与小结:
溶质的质量分数
1.定义:溶质质量与溶液质量之比
2.公式:
=
溶液质量
溶质质量
溶质的质量分数
×100%
%
×100
+
=
溶剂质量
溶质质量
溶质质量
溶质质量 = 溶液质量× 溶质的质量分数
溶质的质量分数
溶质的质量 /
溶液质量
=
单位要统一
比一比 算一算
试管 编号 溶液颜 色比较 溶 剂 质量/g 溶 质 质量/g 溶 液 质量/g 溶质的质量分数
1 浅 20 0.1 20.1
2 较深 20 0.5 20.5
3 深 20 2 22
0.05%
2.44%
9.09%
结论:一般而言,有色溶液的颜色深些其溶质的质量分数大些。
点拨 计算溶液中溶质的质量分数时,溶质的质量只能是已溶解的部分,未溶解的部分不能作为溶质计算。
实验与探究:
【实验9-8】在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数。
溶质质量/g 溶剂(水)质量/g 现 象 溶液中溶质的质量分数
10 90 固体消失
20 80 固体消失
10%
20%
溶质的质量分数与溶解度的关系
已知20 ℃时,氯化钠的溶解度是36g。则20 ℃时氯化钠饱和溶液中溶质的质量分数为36%,对吗?(如果不对请列式改正)
不对,此时溶质的质量分数 =
36g
36g+100g
×
100% ≈ 26.5%
归纳:饱和溶液中溶质的质量分数与该温度下溶解度的关系为:
饱和溶液中溶质的质量分数
=_______________________________________________。
该温度下的溶解度
该温度下的溶解度+100g
×
100%
例2 甲、乙两种物质的溶解度曲线如图所示:
(1)20 ℃时,甲的饱和溶液中溶质的质量分数
(填“>”“=”或“<”)乙的饱和
溶液中溶质的质量分数。
(2)60 ℃时,甲的饱和溶液中溶质的质量分数为 。
(3)60 ℃时,将8 g甲加入20 g水中,充分溶解后,溶液中溶质的质量分数为 。
(4)将60 ℃时甲、乙的饱和溶液分别降温至t ℃,有晶体析出的是 ,溶质的质量分数减小的是 ,溶质的质量分数不变的是 ,此时甲、乙的溶液中溶质的质量分数大小关系为 。
<
20%
20%
甲
甲
乙
甲>乙
(1)溶解度曲线上溶液状态对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。
(2)饱和溶液溶质的溶解度变小,有晶体析出,溶质的质量分数减小;饱和溶液溶质的溶解度变大,溶液变为不饱和溶液,若不增加溶质,溶质的质量分数不变。
(3)饱和溶液变为不饱和溶液,溶质的质量分数不一定变小,如将KNO3饱和溶液升高温度,溶质的质量分数不变;不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,如将KNO3不饱和溶液降温到恰好饱和。
归纳与小结:
二、溶质的质量分数的简单计算
观察与思考:
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
=
溶液质量
溶质质量
溶质的质量分数
×100%
溶质质量 = 溶液质量× 溶质的质量分数
=150kg×16%
=126kg
溶剂质量 = 溶液质量- 溶质的质量
=150kg-24kg
=24kg
答:略。
探究新知
例2: 化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:解决这道题的关键是什么?
溶液稀释前后溶质的质量不变
解:
设稀释后溶液的质量为x。
50g× 98%= x × 20%
x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
归纳与小结:
有关溶液稀释问题的计算
解题依据:溶液稀释前后,溶质的质量不变。
若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质量分数为b%的溶液Bg。则有:
Ag×a% = Bg×b%
(稀释前) (稀释后)
需要加入水的质量=_______质量-_______质量
稀溶液
浓溶液
① 溶质的质量分数表示溶质质量与溶液质量之比,并不是溶质质量与溶剂质量之比。
②溶质的质量分数一般用百分数表示。
③溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
④计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
注意:
溶质质量分数与溶解度的联系和区别
溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
溶质t 0C时溶解度36g是指: 在t 0C 时,100g水最多溶解该溶质36g。
饱和溶液的
溶质质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
1.溶质的质量分数
=
溶液质量
溶质质量
溶质的质量分数
×100%
2.溶质质量分数与溶解度的联系和区别:
一定温度下:某物质的饱和溶液的溶质质量分数
溶质的质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
课堂小结
1.下图是甲、乙两种物质的溶解度曲线。t3℃时,将取ag甲和ag乙分别放入100g水中,充分搅拌,然后降温,下列说法不正确的是( )
A.t1℃时,甲的溶解度小于乙的溶解度
B.降温至t2℃时,甲溶液和乙溶液均饱和
C.降温至t1℃时,两种溶液中溶质的质量分数相等
D.若甲中混有少量的乙,可用降温结晶的方法提纯甲
C
课堂练习
2.甲、乙两种固体的溶解度曲线如图所示,下列说法不正确的是( )
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙饱和溶液中溶质的质量分数相等
C.常采用冷却热饱和溶液的方法从溶液中获得甲物质晶体
D.将t1℃时相等质量的甲、乙的饱和溶液升温到t2℃,溶液中溶质的质量甲等于乙
A
3.下列有关溶液的说法中,正确的是( )
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液都可以通过降低温度的方法变成饱和溶液
C.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
4.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaClB.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
D
C
5.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
D
1(2021·山东潍坊)如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )
A.t1℃时a、c两物质溶液中溶质的质量分数相等
B.t2℃时,物质a的100g饱和溶液中含有25g物质a
C.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g
D
中考练习
2.(2020·云南初三一模)如图为a、b、c三种固体物质的溶解度曲线,下列说法中正确的是( )
A.将t2℃的a、b、c的饱和溶液降温到t1℃,溶液中溶质质量分数的关系是b>a=c
B.t1℃时,将20gc加入50g水中充分溶解,得到70g饱和溶液
C.t2℃时,a溶液的溶质质量分数一定大于b溶液的溶质质量分数
D.t1℃时,分别将11g的a、b、c溶于50g的水中,所得溶液的溶质质量分数最大的是b
D
C
3.(2021·山东泰安)如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以采用降温结晶的方法
B.t1℃时,a、c两种物质的溶液溶质质量分数一定相等
C.t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是:a>b>c
D.在t2℃时,将30ga物质加入50g水中充分溶解,所得溶液质量为80g
B
4.(2020·江苏初三二模).KCl和 KNO3的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 10 20 30 40 50 60
溶 解 度 /g KCl 31.0 34.0 37.0 40.0 42.6 45.5
KNO3 20.9 31.6 45.8 53.9 85.5 110
A.t2应介于 40℃~50℃
B.甲表示 KNO3溶解度曲线
C.55℃时,溶液的溶质质量分数:KNO3>KCl
D.甲、乙饱和溶液从 t1升温到 t2时,溶质的质量分数相等
5.(2020·广东初三二模)20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.②中所得溶液是饱和溶液
B.20℃时NaCl的溶液度为40g
C.①所得溶液的溶质质量分数为20%
D.③④溶液的溶质质量分数相等
D
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
