2021-2022学年高二上学期人教版(2019)化学选择性必修一4.2.1电解池课件(20张ppt)
文档属性
| 名称 | 2021-2022学年高二上学期人教版(2019)化学选择性必修一4.2.1电解池课件(20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-27 11:36:50 | ||
图片预览








文档简介
自学检测
预习检测
1.什么是电解?
2.电解过程中发生的能量转化是?
3.在电解池中,如何定义阴极、阳极?
电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程
电能转化为化学能
阳极:发生氧化反应(与直流电源正极相连)
阴极:发生还原反应(与直流电源负极相连)
第2节 电解池
第1课时 电解原理
第六章 化学反应与能量
学习目标
1.了解电解的概念。
2.了解电解池的构成,理解电解池的工作原理。(重点)
3.掌握电解池电极反应式和电解反应方程式的书写。
自1800年,伏特发明了伏打电池后,科学家们纷纷开始利用伏打电池研究电的化学效应,对水、盐溶液,熔融固体化合物进行通电实验,其中英国化学家戴维在点解释议案中发现了钠、钾、镁、钙、锶、钡等多种元素,成为发现最多新元素的科学家。
电解池的前世今生
1833年,英国科学家法拉第,经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气,这一发现为氯碱工业的发展有重要的促进作用
石墨
饱和食盐水
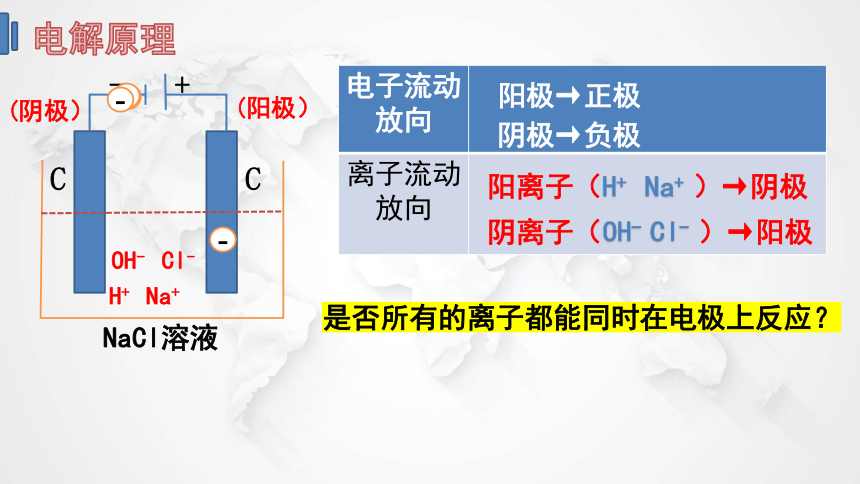
电解原理
(阴极)
- +
C C
(阳极)
NaCl溶液
OH- Cl-
H+ Na+
-
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子流动放向
离子流动放向
阳极→正极
阴极→负极
阳离子(H+ Na+ )→阴极
阴离子(OH- Cl- )→阳极
是否所有的离子都能同时在电极上反应?
-
-
-
学习任务一 电解CuCl2溶液实验探究
完成课本P101 【实验4-2】,思考讨论下列问题:
1、简述实验现象与结论
2、通电前,水中有哪些离子,如何运动?
3.通电后,导线和水中带电粒子如何运动?
4.电极上发生的是什么反应产生Cu和Cl2呢?
电解CuCl2溶液实验
电解原理
通电前后,水中有哪些离子,如何运动?
Ⅰ通电前
① 通电前:
氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前这些离子在溶液中作自由运动。
- +
阴极
阳极
Ⅱ通电后
② 通电后:
在电场的作用下,溶液中的离子作定向运动,
即Cl-、OH-向阳极(与直流电源正极相连的石墨棒)迁移,
Cu2+、H+向阴极(与直流电源负极相连的石墨棒)迁移。
2Cl- - 2e- = Cl2↑(氧化反应)
阳极:
Cu2+ + 2e- = Cu (还原反应)
阴极:
总反应式:CuCl2 ====== Cu + Cl2↑
电解
电解质离子放电顺序
② 阳极(与电极有关):发生氧化反应,溶液中的阴离子失电子。
① 阴极:发生还原反应,溶液中的阳离子得电子。
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
得到电子,由易到难
还原性
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
失去电子,由易到难
电解池模型
阴极
- +
C C
阳极
得到电子
发生还原反应
阴离子→
←阳离子
失去电子
发生氧化反应
结合上述内容,绘制反应电解池工作原理的示意图,包括以下内容
1.注明电解池的组成
2.注明氧化反应和还原反应发生的区域
3.表明电子的运动方向和阴阳离子的迁移方向
⑤能发生氧化还原反应:
可以是自发的反应,
也可以是非自发的反应
两极一液一电源一反应
①具有直流电源;
②两个电极(阴极、阳极);
③电解质溶液或熔融电解质;
④形成闭合回路。
思考
2NaCl+2H2O ====== 2NaOH + H2↑ + Cl2↑
电解
副反应:Cl2与NaOH反应
Cl2与H2反应
如何改进电解池装置,避免电解食盐水过程中副反应的发生?
- +
C C
NaCl溶液
OH- Cl-
H+ Na+
H2
Cl2
优化
- +
C C
NaCl溶液
淡盐水
Na+
H2
Cl2
阳离子交换膜
氢氧化钠溶液
Cl-
Na+
Cl-
H+
OH-
OH-
电解池的今生
氯碱工业
电解精炼铜
电镀
电化学合成
电解处理废水
电解池电极方程式的书写
(2018广州二模)用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。
电极反应四步书写法:
①辩:分辨电解池的阴、阳极。
②找:根据题目信息或电解质离子放电顺序找出放电微粒并推测出对应产物。
③算:从物质的元素化合价变化算出得失电子数。
④补:根据反应环境补充所需物质,实现电荷守恒和原子守恒
分析溶液中离子种类:阳离子(Na+、H+);
阴离子(NO3-、OH-)
阳极:4OH--4e-=O2↑+2H2O
阴极:2H++2e-=H2↑
?
?
原电池与电解池的异同点
完成导学案P94 活动2 表格
思考
电解质溶液用惰性电极电解的示例:
举 例
电极反应
物质类别
实例
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
无氧酸
HCl
减小
增大
不变
H2O
阳:2Cl- - 2e- =Cl2↑
阴:2H++2e-= H2↑
增大
HCl
不活泼金属的无氧酸盐
CuCl2
阳:2Cl- - 2e- === Cl2↑
阴:Cu2++2e- === Cu↓
增大
CuCl2
活泼金属的无氧酸盐
NaCl
阳:2Cl-- 2e- == Cl2↑
阴:2H2O+ 2e- = H2 ↑ + 2OH-
增大
HCl
不活泼金属的含氧酸盐
CuSO4
阳:2H2O- 4e- = 4H++O2 ↑
阴:2Cu2++4e- = 2Cu↓
减小
CuO
电解水型
复原方法
PH
变化
电解
类型
电解电解质型
放氢生碱型
放氧生酸型
本质:H+ 和OH-放电;
若溶液中本身有大量的H+或OH-,直接写H+或OH-;若H+和OH-来源于水,放电物质写H2O
1.下列关于电解池的叙述中不正确的是( )。 A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.在电解池的阳极发生氧化反应D.电子从电源的负极沿导线流向电解池的阴极
A
练一练:
2.按下图装置将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )。
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应B.甲装置中电子由锌棒经导线流向铜棒C.乙装置的电解质溶液中的氢离子流向锌棒D.甲、乙两个装置的反应原理不同
B
练一练:
某同学按如图所示的装置进行电解实验,下列说法正确的是 (填序号)。?
①电解过程中,铜电极的反应式:Cu-2e- ==Cu2+
②电解初期,主反应:Cu+H2SO4 == CuSO4+H2↑
③电解一定时间后,石墨电极上有铜析出
④整个电解过程中,H+的浓度不断增大
?
①②③
预习检测
1.什么是电解?
2.电解过程中发生的能量转化是?
3.在电解池中,如何定义阴极、阳极?
电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程
电能转化为化学能
阳极:发生氧化反应(与直流电源正极相连)
阴极:发生还原反应(与直流电源负极相连)
第2节 电解池
第1课时 电解原理
第六章 化学反应与能量
学习目标
1.了解电解的概念。
2.了解电解池的构成,理解电解池的工作原理。(重点)
3.掌握电解池电极反应式和电解反应方程式的书写。
自1800年,伏特发明了伏打电池后,科学家们纷纷开始利用伏打电池研究电的化学效应,对水、盐溶液,熔融固体化合物进行通电实验,其中英国化学家戴维在点解释议案中发现了钠、钾、镁、钙、锶、钡等多种元素,成为发现最多新元素的科学家。
电解池的前世今生
1833年,英国科学家法拉第,经过一系列的实验,发现当把电流作用在氯化钠的水溶液时,能够获得氯气,这一发现为氯碱工业的发展有重要的促进作用
石墨
饱和食盐水
电解原理
(阴极)
- +
C C
(阳极)
NaCl溶液
OH- Cl-
H+ Na+
-
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电子流动放向
离子流动放向
阳极→正极
阴极→负极
阳离子(H+ Na+ )→阴极
阴离子(OH- Cl- )→阳极
是否所有的离子都能同时在电极上反应?
-
-
-
学习任务一 电解CuCl2溶液实验探究
完成课本P101 【实验4-2】,思考讨论下列问题:
1、简述实验现象与结论
2、通电前,水中有哪些离子,如何运动?
3.通电后,导线和水中带电粒子如何运动?
4.电极上发生的是什么反应产生Cu和Cl2呢?
电解CuCl2溶液实验
电解原理
通电前后,水中有哪些离子,如何运动?
Ⅰ通电前
① 通电前:
氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,
通电前这些离子在溶液中作自由运动。
- +
阴极
阳极
Ⅱ通电后
② 通电后:
在电场的作用下,溶液中的离子作定向运动,
即Cl-、OH-向阳极(与直流电源正极相连的石墨棒)迁移,
Cu2+、H+向阴极(与直流电源负极相连的石墨棒)迁移。
2Cl- - 2e- = Cl2↑(氧化反应)
阳极:
Cu2+ + 2e- = Cu (还原反应)
阴极:
总反应式:CuCl2 ====== Cu + Cl2↑
电解
电解质离子放电顺序
② 阳极(与电极有关):发生氧化反应,溶液中的阴离子失电子。
① 阴极:发生还原反应,溶液中的阳离子得电子。
氧化性
Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
得到电子,由易到难
还原性
活性电极>S2->I->Fe2+>Br->Cl->OH->含氧酸根(SO42-、NO3-、CO32-)>F-
失去电子,由易到难
电解池模型
阴极
- +
C C
阳极
得到电子
发生还原反应
阴离子→
←阳离子
失去电子
发生氧化反应
结合上述内容,绘制反应电解池工作原理的示意图,包括以下内容
1.注明电解池的组成
2.注明氧化反应和还原反应发生的区域
3.表明电子的运动方向和阴阳离子的迁移方向
⑤能发生氧化还原反应:
可以是自发的反应,
也可以是非自发的反应
两极一液一电源一反应
①具有直流电源;
②两个电极(阴极、阳极);
③电解质溶液或熔融电解质;
④形成闭合回路。
思考
2NaCl+2H2O ====== 2NaOH + H2↑ + Cl2↑
电解
副反应:Cl2与NaOH反应
Cl2与H2反应
如何改进电解池装置,避免电解食盐水过程中副反应的发生?
- +
C C
NaCl溶液
OH- Cl-
H+ Na+
H2
Cl2
优化
- +
C C
NaCl溶液
淡盐水
Na+
H2
Cl2
阳离子交换膜
氢氧化钠溶液
Cl-
Na+
Cl-
H+
OH-
OH-
电解池的今生
氯碱工业
电解精炼铜
电镀
电化学合成
电解处理废水
电解池电极方程式的书写
(2018广州二模)用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。
电极反应四步书写法:
①辩:分辨电解池的阴、阳极。
②找:根据题目信息或电解质离子放电顺序找出放电微粒并推测出对应产物。
③算:从物质的元素化合价变化算出得失电子数。
④补:根据反应环境补充所需物质,实现电荷守恒和原子守恒
分析溶液中离子种类:阳离子(Na+、H+);
阴离子(NO3-、OH-)
阳极:4OH--4e-=O2↑+2H2O
阴极:2H++2e-=H2↑
?
?
原电池与电解池的异同点
完成导学案P94 活动2 表格
思考
电解质溶液用惰性电极电解的示例:
举 例
电极反应
物质类别
实例
含氧酸
H2SO4
强碱
NaOH
活泼金属的含氧酸盐
Na2SO4
无氧酸
HCl
减小
增大
不变
H2O
阳:2Cl- - 2e- =Cl2↑
阴:2H++2e-= H2↑
增大
HCl
不活泼金属的无氧酸盐
CuCl2
阳:2Cl- - 2e- === Cl2↑
阴:Cu2++2e- === Cu↓
增大
CuCl2
活泼金属的无氧酸盐
NaCl
阳:2Cl-- 2e- == Cl2↑
阴:2H2O+ 2e- = H2 ↑ + 2OH-
增大
HCl
不活泼金属的含氧酸盐
CuSO4
阳:2H2O- 4e- = 4H++O2 ↑
阴:2Cu2++4e- = 2Cu↓
减小
CuO
电解水型
复原方法
PH
变化
电解
类型
电解电解质型
放氢生碱型
放氧生酸型
本质:H+ 和OH-放电;
若溶液中本身有大量的H+或OH-,直接写H+或OH-;若H+和OH-来源于水,放电物质写H2O
1.下列关于电解池的叙述中不正确的是( )。 A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.在电解池的阳极发生氧化反应D.电子从电源的负极沿导线流向电解池的阴极
A
练一练:
2.按下图装置将锌棒和铜棒插入稀硫酸中。下列说法正确的是( )。
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应B.甲装置中电子由锌棒经导线流向铜棒C.乙装置的电解质溶液中的氢离子流向锌棒D.甲、乙两个装置的反应原理不同
B
练一练:
某同学按如图所示的装置进行电解实验,下列说法正确的是 (填序号)。?
①电解过程中,铜电极的反应式:Cu-2e- ==Cu2+
②电解初期,主反应:Cu+H2SO4 == CuSO4+H2↑
③电解一定时间后,石墨电极上有铜析出
④整个电解过程中,H+的浓度不断增大
?
①②③
