第九单元溶液单元测试--2021-2022学年九年级化学人教版下册(word版 含解析)
文档属性
| 名称 | 第九单元溶液单元测试--2021-2022学年九年级化学人教版下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 202.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-27 08:36:59 | ||
图片预览




文档简介
第九单元 溶液 单元测试卷
一、单选题
1.利用溶解度曲线,可以获得许多有关物质溶解度的信息。如图是a、b两物质的溶解度曲线。有关叙述正确的是
A.a的溶解度大于b的溶解度
B.当a物质中混有少量b物质时,可以用蒸发结晶的方法除去b
C.将t ℃时a、b的饱和溶液升温至40 ℃,溶液中溶质的质量分数相等
D.10 ℃时,取相同质量的a、b两物质分别配制成饱和溶液所需水的质量是b大于a
2.硝酸钾、氯化钠、硒酸镉的溶解度曲线如图,下列说法正确的是
A.t ℃时,三种物质的溶液的溶质质量分数由大到小的顺序是硝酸钾>硒酸镉>氯化钠
B.硒酸镉的不饱和溶液升温后溶质质量分数会增大
C.t ℃时,等质量的氯化钠、硒酸镉两物质溶液中所含溶质质量相等
D.t ℃时,将等质量的硝酸钾和氯化钠饱和溶液降低相同温度时,析出晶体多的是硝酸钾溶液
3.如图为甲、乙、丙、丁四种物质溶解度曲线图,根据题意,下列说法正确的是
A.30℃时,乙、丙溶质质量分数相等
B.20℃时,6 g丁溶解在50 g水中可以得到饱和溶液
C.当压强一定时,甲可以表示二氧化碳在水中的溶解度
D.乙的溶解度随温度的升高而增大
4.农业上配制 1000g 质量分数为 16%的氯化钠溶液进行选种,下列说法中不正确的是
A.溶解氯化钠时,用玻璃棒搅拌会加速溶解
B.称量的氯化钠若含有杂质,会造成配制的溶液偏稀
C.用托盘天平称量氯化钠时,若指针向左偏,应减少药品至天平平衡
D.仰视读数取水,会造成配制的溶液偏浓
5.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
6.小明用固体氯化钠配制 50 g 溶质质量分数为 6%的氯化钠溶液,下列关于配制的说法正确的是
A.实验中用到的所有玻璃仪器为烧杯、量筒、胶头滴管、细口瓶
B.将氯化钠直接放在托盘天平的左盘上称量3.0 g
C.用 50 mL 的量筒量取47.0 mL水
D.用蒸馏水洗涤烧杯后,立即溶解氯化钠
7.下列说法正确的是
A.长期放置后不会分层的液体一定是溶液
B.汽油能除去油污是因为汽油具有乳化作用
C.一定温度下,同种溶质的饱和溶液一定比不饱和溶液的浓度大
D.喝汽水会打嗝说明气体的溶解度与压强有关
8.若要研究温度对食盐溶解快慢的影响,下图中可以选来进行对照实验的两个装置是
A.甲和乙 B.甲和丙 C.乙和丙 D.丙和丁
9.某同学欲配制50g溶质质量分数为15%的氯化钠溶液,下列说法正确的是
A.称量时,若天平指针向左偏转,则向右盘添加砝码或调节游码至天平平衡
B.量取水时,可用规格为50mL的量筒
C.量取水时,若俯视读数,则会导致所配溶液的溶质质量分数偏小
D.实验中用到的玻璃仪器有烧杯、玻璃棒、量筒、漏斗
10.甲乙两种固体的溶解度曲线如图所示。在一个大烧杯中加入含有甲和乙两种物质的饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由60℃降到20℃。下列说法正确的是
A.杯中固体甲和固体乙的质量都减少 B.杯中固体甲的质量减少、固体乙的质量增多
C.溶液中甲、乙溶质的质量都减少 D.溶液中溶质甲的质量减少、溶质乙的质量增多
11.下列关于水和溶液说法不正确的是
A.外界条件不变,长期放置,溶液中溶质和溶剂不会分离
B.明矾可以促进水中悬浮杂质沉降
C.天然水经过沉降、过滤、杀菌,即可得到纯水
D.通过电解水实验说明水是由氢氧两种元素组成的
12.下列解释正确的是
A.ag氯酸钾与bg二氧化锰充分反应得到cg氧气,残留固体质量为dg,则d﹦a﹣c
B.将100mL酒精与100mL水混合,能形成200mL溶液
C.向饱和的硝酸钾溶液中加入5g硝酸钾固体,升高温度,硝酸钾固体质量增加
D.向10g溶质质量分数为10%的氯化钠溶液中加入10mL蒸馏水后,溶液中溶质的质量为1g
二、填空题
13.食盐溶液里存在的微粒是 (用符号表示)________、________、_______。
“10%食盐溶液”的含义是______________________________ ,其溶质:溶剂=_____________(填质量比)
14.利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
15.下列是实验室常用的几种仪器,请回答有关问题.
粗盐中含少量Ca2+、Mg2+、SO42﹣和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:
(1)①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③_____;④加入适量的______;⑤________________、冷却结晶(填试剂或操作名称).
(2)过滤用到的玻璃仪器有:___、____、___.
(3)蒸发时______(填“能”或“不能”)将溶液直接蒸干.
(4)配置1000g5.85%的NaCl溶液,需_____gNaCl;在准确称取固体后,用量筒量取水时,仰视读数,则所配置溶液溶质质量分时_____(填“偏高”或“偏低”)
16.配制溶质质量分数一定的氯化钠溶液,常按以下操作顺序进行.请回答下列问题:
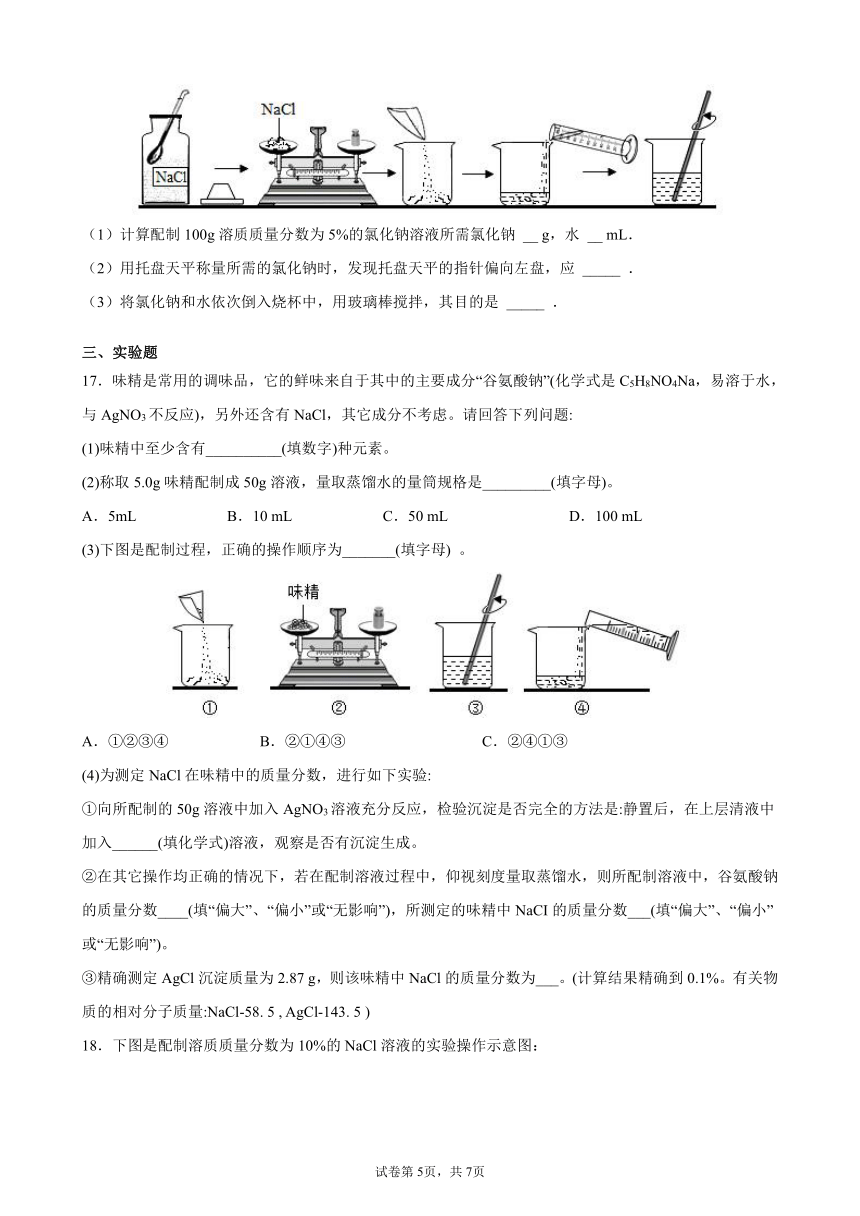
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠 __ g,水 __ mL.
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 _____ .
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 _____ .
三、实验题
17.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B.10 mL C.50 mL D.100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
18.下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_______________________。
(2)图②中,有一种塑料仪器,其名称是___________。
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为______。
(4)根据计算需要量取水的体积是______(水的密度为1g/mL)。量取读数时,下图视线角度正确的是_____。(选填字母标号)
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数____(填“大于”、“小于”或“等于”)10%。
19.实验室要配制50g溶质质量分数为5%的氯化钠溶液。
(1)计算:需要氯化钠的质量为______。
(2)某同学按如图所示步骤依次操作:
其中操作错误的步骤是______(填字母序号);E中玻璃棒的作用是______。
(3)B操作中仪器的规格应为______(填“50mL”或“100mL”),读数时应使视线与______保持水平。
(4)某同学实验后发现所配的溶液浓度小于5%,可能是什么原因?
①______;
②______。
(5)用上述所得的5%的氯化钠溶液和蒸馏水,配制质量分数为1%的氯化钠溶液100g,需要5%的氯化钠溶液的质量为______g。
四、计算题
20.配制溶质的质量分数为30%的硫酸溶液500g,则需要溶质的质量分数为98%的浓硫酸(密度为1.84g/cm3)____ml(填空,结果保留两位小数)
21.某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
(1)生成氧气的质量__________g;
(2)这瓶过氧化氢溶液中溶质的质量分数是__________? (写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.C
【解析】A.未指明温度,无法比较a、b的溶解度。错误。
B.a、b物质的溶解度均随温度的升高而增加。a的溶解度随温度变化较大,b的溶解度随温度变化较小。所以当a物质中混有少量b物质时,可采用降温结晶的方法除去b,错误。
C.温度升高,a、b的溶解度增大,无晶体析出。所以将t ℃时a、b的饱和溶液(因溶解度相同,所以饱和溶液的溶质质量分数相同)升温至40 ℃,溶液中溶质的质量分数不变,即溶液中溶质的质量分数依然相等,正确。
D.10 ℃时,b的溶解度大于a的溶解度。所以相同质量的a、b两物质分别配制成饱和溶液所需水的质量是a大于b。错误。
故选C。
2.D
【解析】A、t℃时,溶解度:硝酸钾>硒酸镉>氯化钠,故该温度下,三种物质的饱和溶液的溶质质量分数由大到小为:硝酸钾>硒酸镉>氯化钠,溶液状态未知,无法比较,不符合题意;
B、硒酸镉的不饱和溶液升温后,溶解度减小,如果无溶质析出,溶质质量分数不变,如果溶质析出,溶质质量分数减小,不符合题意;
C、t ℃时,等质量的氯化钠、硒酸镉两物质溶液,溶液状态未知,无法比较所含溶质质量大小,不符合题意;
D、t ℃时,将等质量的硝酸钾和氯化钠饱和溶液降低相同温度时,硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故析出晶体多的是硝酸钾溶液,符合题意。
故选D。
3.B
【解析】A、由溶解度曲线图可知,30℃时,乙、丙两物质的溶解度相等,在该温度下,乙、丙两物质饱和溶液溶质质量分数相等,故选项说法不正确;
B、20℃时,丁的溶解度为10g,则50 g水中最多溶解5g丁达到饱和状态,所以20℃时,6 g丁溶解在50 g水中可以得到饱和溶液,故选项说法正确;
C、由溶解度曲线图可知,甲的溶解度随温度的升高而增大,而二氧化碳的溶解度随温度的升高而减小,所以当压强一定时,甲不能表示二氧化碳在水中的溶解度,故选项说法不正确;
D、由溶解度曲线图可知,当温度低于40℃时,乙的溶解度随温度的升高而增大,温度高于40℃时,乙的溶解度随温度的升高而减小,故选项说法不正确。
故选B。
4.D
【解析】A、溶解氯化钠时,用玻璃棒搅拌会加速溶解,正确;
B、称量的氯化钠若含有杂质,会造成称量的氯化钠的质量偏小,从而配制的溶液偏稀,正确;
C、用托盘天平称量氯化钠时,若指针向左偏,说明药品多了,应减少药品至天平平衡,正确;
D、仰视读数取水,会造成实际量取的水的体积偏大,从而配制的溶液偏稀,错误。
故选:D。
5.D
【解析】A、由图可知,甲物质的溶解度随温度的升高先增大后减小,不符合题意;
B、由图可知,70℃时,甲物质的溶解度为102g,应指明温度,不符合题意;
C、20℃时,甲物质的溶解度为28g,该温度下,50g水中加入15g甲物质,只能溶解14g,充分溶解后,可得到50g+14g=64g溶液,不符合题意;
D、由图可知,70℃时,甲的溶解度最大,甲的饱和溶液升高温度或降低温度,溶解度均减小,均有晶体析出,符合题意。
故选D。
6.C
【解析】A、配制一定质量分数的溶液,实验步骤有计算、称量、量取、溶解、装瓶帖标签等,在溶解过、装瓶过程中还要用到玻璃棒,选项中给出的玻璃仪器缺少玻璃棒,故A选项错误;
B、称量氯化钠时,要在天平两端各放在小相同的纸,将氯化钠放在纸上称量,故B选项错误;
C、配制 50 g 溶质质量分数为 6%的氯化钠溶液,需要水的体积为:,选择量筒时,其量程要等于或稍大于被测量液体的体积,故C选项正确;
D、用蒸馏水洗涤烧杯后, 立即溶解氯化钠,烧杯中有水,会使配制的溶液的溶质质量分数偏小,故D选项错误;
故选C。
7.C
【分析】
【解析】A、溶液是均一稳定的混合物,如水长期放置后不会分层,但不是溶液,故说法错误;
B、汽油能除去油污是溶解现象,故说法错误;
C、一定温度下,同种溶质的饱和溶液一定比不饱和溶液的浓度大,说法正确;
D、喝汽水会打嗝说明气体的溶解度与温度有关,温度越高,气体的溶解度越小,故说法错误。
故选:C。
【点睛】
明确溶液、乳化的概念、饱和溶液与不饱和溶液及影响气体溶解度的因素是解答本题关键。
8.B
【分析】
运用控制变量法来对影响溶解快慢的因素进行解答即可。
【解析】研究温度对食盐溶解快慢的影响,必须保证实验的质量,水的体积相同,只能有温度一个变量,故可选用甲与丙两个装置进行对照实验;
故选B。
【点睛】
此题考查影响溶解快慢的因素,关键是运用控制变量法来对影响溶解快慢的因素解答。
9.B
【解析】A、称量时,若天平指针向左偏转,此时应减少药品,直到天平平衡,不可向右盘添加砝码或调节游码至天平平衡,说法错误;
B、配制50g溶质质量分数为15%的氯化钠溶液,所需水的质量=50g×(1-15%)=42.5g,合42.5mL,根据选取量筒“一次接近"的原则,可用规格为50mL的量筒,说法正确;
C、量取水时,若俯视读数,读数偏大,所取的水体积偏小 则会导致所配溶液的溶质质量分数偏大,说法错误;
D、实验中用到的玻璃仪器有烧杯、玻璃棒、量筒,不需要漏斗,说法错误。
故选:B.
10.D
【解析】A、甲的溶解度随温度的降低而减小,降温时,甲的溶液中有溶质析出,固体甲质量增加,故A错误;
B、降温时,固体甲的质量增加,乙的溶解度随温度的升高而增大,则烧杯中固体乙的质量减少,故B错误;
C、乙的溶解度随温度的降低而增大,因此降温时,乙的溶液中的固体会溶解,溶液中溶质乙增多,故C错误;
D、由于甲的溶解度随温度的降低而减小,而乙的溶解度随温度的降低而增大,因此降温时,甲的溶液溶质析出,会出现更多的晶体,溶液中溶质甲减少,乙的溶液中的固体会溶解,溶液中溶质乙增多,故D正确。
故选D。
11.C
【解析】A、溶液有稳定性,外界条件不变,长期放置,溶液中溶质和溶剂不会分离,故选项说法正确;
B、明矾有一定的净水能力 ,能促进悬浮杂质的沉降,故选项说法正确;
C天然水经过沉降、过滤、杀菌侯得到的水还有可溶性杂质,属于混合物,故选项说法错误;
D、电解水生成氢气和氧气,说明水是由氢氧两种元素组成的,故选项说法正确。
故选:C。
12.D
【解析】A、二氧化锰是催化剂反应前后质量不变,所以残留固体质量dg=ag+bg-cg。错误。
B、因为分子间有间隔,所以将100mL酒精与100mL水混合,溶液体积小于200mL。错误。
C、硝酸钾溶解度随温度的升高而升高,所以升温后硝酸钾固体继续溶解,质量减少。错误。
D、向10g溶质质量分数为10%的氯化钠溶液中加入10mL蒸馏水后,溶质的质量不变,仍为10g×10%=1g。正确。
故选D。
13.Na+ Cl- H2O 100g 10%的食盐溶液中含10 g食盐(答案合理即可) 1:9
【解析】食盐溶于水解离出钠离子和氯离子,水由水分子构成,所以食盐溶液里的微粒有钠离子、氯离子和水分子,故填Na+、Cl-、H2O;
“10%食盐溶液”的含义是100g 10%的食盐溶液中含10 g食盐,故填100g 10%的食盐溶液中含10 g食盐(答案合理即可);
溶液中溶质和溶剂的质量比为:溶质:溶剂=10%:(1-10%)=1:9.故填1:9。
14.不变 引流 BACD 11.9
【解析】(1)蒸发过程中,氯化钠溶液由不饱和逐渐变成饱和溶液,在没有引入结晶池之前蒸发池中氯化钠的质量会不变,但是质量分数增大;
(2)在过滤操作中玻璃棒的作用是引流,以免液滴飞溅;
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液,正确的实验步骤顺序是:计算,称量及量取,溶解,装瓶贴标签。故填:BACD。
需要再加NaCl的质量是X,则(100×6%+X)÷(100克+X)×100%=16%, X=11.9克.
15.过滤 稀盐酸 蒸发浓缩 A B G 不能 58.5 偏低
【解析】(1)粗盐中含少量Ca2+、Mg2+、SO42﹣和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③过滤除去沉淀;④加入适量的稀盐酸除去过量的氢氧化钠和碳酸钠;⑤蒸发浓缩、冷却结晶得到精盐.
(2)过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒.
(3)蒸发时不能将溶液直接蒸干,以免氯化钠被烧焦,蒸发出现较多固体即可停止加热,利用余热蒸干水分.
(4)配置1000g5.85%的NaCl溶液,需NaCl的质量为:1000g×5.85%=58.5g;在准确称取固体后,用量筒量取水时,仰视读数,使量取的水的体积偏多,则所配置溶液溶质质量分数偏低.
16.5 95 减少药品质量 加速溶解
【解析】(1)配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠质量 需水质量100g-5g=95g水的密度1 故水的体积V=95ml,故填:5;95。
(2)指针偏向那侧说明那侧重,发现托盘天平的指针偏向左盘,说明左盘重药品过量,应减少药品质量,故填:减少药品质量。
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,搅拌的目的加速溶解,故填:加速溶解。
17.6 C B AgNO3 偏小 无影响 23.4%
【解析】味精是常用的调味品,化学式是C5H8NO4Na。(1)味精中至少含有碳、氢、氧、氮、钠和氯6种元素。(2)称取5.0g味精配制成50g溶液,根据就近原则,量取蒸馏水的量筒规格是50 mL,故选C。(3)配制过程,正确的操作顺序为②①④③,故选B。(4)测定NaCl在味精中的质量分数。①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3溶液,与氯化钠反应生成氯化银白色沉淀,观察是否有沉淀生成。②在配制溶液过程中,仰视刻度量取蒸馏水,读数比实际少,则所配制溶液中,谷氨酸钠的质量分数偏小。③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为∶NaCl→AgCl,58. 5→143. 5, = ,x=0.117g, ×100%=23.4%。
点睛∶量筒量程的选择应根据就近原则,量筒读数应平视。味精是常用的调味品,主要成分是谷氨酸钠。
18.②⑤①④③ 药匙 18.2g 90 mL D 小于
【解析】(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,故配制溶液的正确操作顺序是:②⑤①④③。
(2)图②中,塑料仪器为取用粉末状药品的药匙。
(3)根据托盘天平数据的读法,NaCl质量为15g+3.2g=18.2g。
(4)所配制溶液中溶质的质量=100g×10%=10g,则需要水的质量=100g-10g=90g,则需要量取水的体积是:90ml(水的密度为1g/mL);使用量筒量取液体时,视线与凹液面最低处保持在同一水平面上,视线角度正确的是:D。
(5)如果砝码缺损了一个小角,其他操作步骤正确,那么NaCl质量小于小于它的实际质量,而水的质量正确,因此所配溶液的溶质质量分数小于10%。
19.2.5g A、B 搅拌,加速氯化钠的溶解 50mL 凹液面的最低处 量取水时仰视读数 称量时砝码与氯化钠放反了且使用了游码 20
【解析】(1)需要氯化钠的质量为;
(2)在A步骤中砝码与氯化钠的位置颠倒,在B步骤中仰视读数,故操作错误的是步骤A和B;E中玻璃棒的作用是搅拌,加速氯化钠的溶解;
(3)实验中需水的质量为,水的密度是,故水的体积为47.5mL,应选用50mL的量筒;读数时应使视线与量筒内凹液面的最低处保持水平;
(4)质量分数小于5%,可能是溶质少了或水多了,原因主要有称量时砝码与氯化钠放反了且使用了游码;量取水时仰视读数等;
(5)溶液稀释过程中,溶质质量不变,设所需5%的氯化钠溶液的质量为,可得,解得。
20.83.19
【解析】解:设需要98%的浓硫酸的体积为x
500g×30%=x×1.84g/cm3×98%
x≈83.19mL
答:需要98%的浓硫酸的体积为83.19mL。
21.(1)1.6;(2)5%
【解析】(1)根据质量守恒定律反应前后物质的总质量不变,反应生成氧气的质量=68g+2g-68.4g=1.6g;
(2)设68g过氧化氢溶液中含有过氧化氢的质量为x.
68/x=32/1.6g
解得,x=3.4g
过氧化氢溶液的溶质的质量分数为3.4g÷68g×100%=5%
答:该过氧化氢溶液的溶质的质量分数5%。答案第1页,共2页
答案第1页,共2页
一、单选题
1.利用溶解度曲线,可以获得许多有关物质溶解度的信息。如图是a、b两物质的溶解度曲线。有关叙述正确的是
A.a的溶解度大于b的溶解度
B.当a物质中混有少量b物质时,可以用蒸发结晶的方法除去b
C.将t ℃时a、b的饱和溶液升温至40 ℃,溶液中溶质的质量分数相等
D.10 ℃时,取相同质量的a、b两物质分别配制成饱和溶液所需水的质量是b大于a
2.硝酸钾、氯化钠、硒酸镉的溶解度曲线如图,下列说法正确的是
A.t ℃时,三种物质的溶液的溶质质量分数由大到小的顺序是硝酸钾>硒酸镉>氯化钠
B.硒酸镉的不饱和溶液升温后溶质质量分数会增大
C.t ℃时,等质量的氯化钠、硒酸镉两物质溶液中所含溶质质量相等
D.t ℃时,将等质量的硝酸钾和氯化钠饱和溶液降低相同温度时,析出晶体多的是硝酸钾溶液
3.如图为甲、乙、丙、丁四种物质溶解度曲线图,根据题意,下列说法正确的是
A.30℃时,乙、丙溶质质量分数相等
B.20℃时,6 g丁溶解在50 g水中可以得到饱和溶液
C.当压强一定时,甲可以表示二氧化碳在水中的溶解度
D.乙的溶解度随温度的升高而增大
4.农业上配制 1000g 质量分数为 16%的氯化钠溶液进行选种,下列说法中不正确的是
A.溶解氯化钠时,用玻璃棒搅拌会加速溶解
B.称量的氯化钠若含有杂质,会造成配制的溶液偏稀
C.用托盘天平称量氯化钠时,若指针向左偏,应减少药品至天平平衡
D.仰视读数取水,会造成配制的溶液偏浓
5.甲物质的溶解度曲线图如图所示,下列说法中正确的是
A.甲物质的溶解度随温度的升高而增大
B.甲物质的溶解度是102g
C.20℃时,50g水中加入15g甲物质充分溶解可得到65g溶液
D.70℃时,甲的饱和溶液升高温度或降低温度,都有晶体析出
6.小明用固体氯化钠配制 50 g 溶质质量分数为 6%的氯化钠溶液,下列关于配制的说法正确的是
A.实验中用到的所有玻璃仪器为烧杯、量筒、胶头滴管、细口瓶
B.将氯化钠直接放在托盘天平的左盘上称量3.0 g
C.用 50 mL 的量筒量取47.0 mL水
D.用蒸馏水洗涤烧杯后,立即溶解氯化钠
7.下列说法正确的是
A.长期放置后不会分层的液体一定是溶液
B.汽油能除去油污是因为汽油具有乳化作用
C.一定温度下,同种溶质的饱和溶液一定比不饱和溶液的浓度大
D.喝汽水会打嗝说明气体的溶解度与压强有关
8.若要研究温度对食盐溶解快慢的影响,下图中可以选来进行对照实验的两个装置是
A.甲和乙 B.甲和丙 C.乙和丙 D.丙和丁
9.某同学欲配制50g溶质质量分数为15%的氯化钠溶液,下列说法正确的是
A.称量时,若天平指针向左偏转,则向右盘添加砝码或调节游码至天平平衡
B.量取水时,可用规格为50mL的量筒
C.量取水时,若俯视读数,则会导致所配溶液的溶质质量分数偏小
D.实验中用到的玻璃仪器有烧杯、玻璃棒、量筒、漏斗
10.甲乙两种固体的溶解度曲线如图所示。在一个大烧杯中加入含有甲和乙两种物质的饱和溶液,而且杯中还有少量甲和乙的固体存在。现将温度由60℃降到20℃。下列说法正确的是
A.杯中固体甲和固体乙的质量都减少 B.杯中固体甲的质量减少、固体乙的质量增多
C.溶液中甲、乙溶质的质量都减少 D.溶液中溶质甲的质量减少、溶质乙的质量增多
11.下列关于水和溶液说法不正确的是
A.外界条件不变,长期放置,溶液中溶质和溶剂不会分离
B.明矾可以促进水中悬浮杂质沉降
C.天然水经过沉降、过滤、杀菌,即可得到纯水
D.通过电解水实验说明水是由氢氧两种元素组成的
12.下列解释正确的是
A.ag氯酸钾与bg二氧化锰充分反应得到cg氧气,残留固体质量为dg,则d﹦a﹣c
B.将100mL酒精与100mL水混合,能形成200mL溶液
C.向饱和的硝酸钾溶液中加入5g硝酸钾固体,升高温度,硝酸钾固体质量增加
D.向10g溶质质量分数为10%的氯化钠溶液中加入10mL蒸馏水后,溶液中溶质的质量为1g
二、填空题
13.食盐溶液里存在的微粒是 (用符号表示)________、________、_______。
“10%食盐溶液”的含义是______________________________ ,其溶质:溶剂=_____________(填质量比)
14.利用海水提取粗盐的过程如下图所示,回答有关问题
(1)一定质量的海水,通过贮水池引入到蒸发池中,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化 钠的质量会__________(填“增大”、“不变”或“减小”)。
(2)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是________(填“引流”或“加快溶解”)。
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液。
①配制时,涉及以下实验步骤:
A.称量及量取 B.计算 C.溶解 D.装瓶贴标签。
其正确的实验步骤顺序是______________(填字母)
②将已配好的100g质量分数为6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是______________g(计算结果精确到0.1)
15.下列是实验室常用的几种仪器,请回答有关问题.
粗盐中含少量Ca2+、Mg2+、SO42﹣和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:
(1)①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③_____;④加入适量的______;⑤________________、冷却结晶(填试剂或操作名称).
(2)过滤用到的玻璃仪器有:___、____、___.
(3)蒸发时______(填“能”或“不能”)将溶液直接蒸干.
(4)配置1000g5.85%的NaCl溶液,需_____gNaCl;在准确称取固体后,用量筒量取水时,仰视读数,则所配置溶液溶质质量分时_____(填“偏高”或“偏低”)
16.配制溶质质量分数一定的氯化钠溶液,常按以下操作顺序进行.请回答下列问题:
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠 __ g,水 __ mL.
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 _____ .
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 _____ .
三、实验题
17.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B.10 mL C.50 mL D.100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
18.下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用上图表示的序号表示配制溶液的正确操作顺序_______________________。
(2)图②中,有一种塑料仪器,其名称是___________。
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为______。
(4)根据计算需要量取水的体积是______(水的密度为1g/mL)。量取读数时,下图视线角度正确的是_____。(选填字母标号)
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数____(填“大于”、“小于”或“等于”)10%。
19.实验室要配制50g溶质质量分数为5%的氯化钠溶液。
(1)计算:需要氯化钠的质量为______。
(2)某同学按如图所示步骤依次操作:
其中操作错误的步骤是______(填字母序号);E中玻璃棒的作用是______。
(3)B操作中仪器的规格应为______(填“50mL”或“100mL”),读数时应使视线与______保持水平。
(4)某同学实验后发现所配的溶液浓度小于5%,可能是什么原因?
①______;
②______。
(5)用上述所得的5%的氯化钠溶液和蒸馏水,配制质量分数为1%的氯化钠溶液100g,需要5%的氯化钠溶液的质量为______g。
四、计算题
20.配制溶质的质量分数为30%的硫酸溶液500g,则需要溶质的质量分数为98%的浓硫酸(密度为1.84g/cm3)____ml(填空,结果保留两位小数)
21.某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
(1)生成氧气的质量__________g;
(2)这瓶过氧化氢溶液中溶质的质量分数是__________? (写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.C
【解析】A.未指明温度,无法比较a、b的溶解度。错误。
B.a、b物质的溶解度均随温度的升高而增加。a的溶解度随温度变化较大,b的溶解度随温度变化较小。所以当a物质中混有少量b物质时,可采用降温结晶的方法除去b,错误。
C.温度升高,a、b的溶解度增大,无晶体析出。所以将t ℃时a、b的饱和溶液(因溶解度相同,所以饱和溶液的溶质质量分数相同)升温至40 ℃,溶液中溶质的质量分数不变,即溶液中溶质的质量分数依然相等,正确。
D.10 ℃时,b的溶解度大于a的溶解度。所以相同质量的a、b两物质分别配制成饱和溶液所需水的质量是a大于b。错误。
故选C。
2.D
【解析】A、t℃时,溶解度:硝酸钾>硒酸镉>氯化钠,故该温度下,三种物质的饱和溶液的溶质质量分数由大到小为:硝酸钾>硒酸镉>氯化钠,溶液状态未知,无法比较,不符合题意;
B、硒酸镉的不饱和溶液升温后,溶解度减小,如果无溶质析出,溶质质量分数不变,如果溶质析出,溶质质量分数减小,不符合题意;
C、t ℃时,等质量的氯化钠、硒酸镉两物质溶液,溶液状态未知,无法比较所含溶质质量大小,不符合题意;
D、t ℃时,将等质量的硝酸钾和氯化钠饱和溶液降低相同温度时,硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故析出晶体多的是硝酸钾溶液,符合题意。
故选D。
3.B
【解析】A、由溶解度曲线图可知,30℃时,乙、丙两物质的溶解度相等,在该温度下,乙、丙两物质饱和溶液溶质质量分数相等,故选项说法不正确;
B、20℃时,丁的溶解度为10g,则50 g水中最多溶解5g丁达到饱和状态,所以20℃时,6 g丁溶解在50 g水中可以得到饱和溶液,故选项说法正确;
C、由溶解度曲线图可知,甲的溶解度随温度的升高而增大,而二氧化碳的溶解度随温度的升高而减小,所以当压强一定时,甲不能表示二氧化碳在水中的溶解度,故选项说法不正确;
D、由溶解度曲线图可知,当温度低于40℃时,乙的溶解度随温度的升高而增大,温度高于40℃时,乙的溶解度随温度的升高而减小,故选项说法不正确。
故选B。
4.D
【解析】A、溶解氯化钠时,用玻璃棒搅拌会加速溶解,正确;
B、称量的氯化钠若含有杂质,会造成称量的氯化钠的质量偏小,从而配制的溶液偏稀,正确;
C、用托盘天平称量氯化钠时,若指针向左偏,说明药品多了,应减少药品至天平平衡,正确;
D、仰视读数取水,会造成实际量取的水的体积偏大,从而配制的溶液偏稀,错误。
故选:D。
5.D
【解析】A、由图可知,甲物质的溶解度随温度的升高先增大后减小,不符合题意;
B、由图可知,70℃时,甲物质的溶解度为102g,应指明温度,不符合题意;
C、20℃时,甲物质的溶解度为28g,该温度下,50g水中加入15g甲物质,只能溶解14g,充分溶解后,可得到50g+14g=64g溶液,不符合题意;
D、由图可知,70℃时,甲的溶解度最大,甲的饱和溶液升高温度或降低温度,溶解度均减小,均有晶体析出,符合题意。
故选D。
6.C
【解析】A、配制一定质量分数的溶液,实验步骤有计算、称量、量取、溶解、装瓶帖标签等,在溶解过、装瓶过程中还要用到玻璃棒,选项中给出的玻璃仪器缺少玻璃棒,故A选项错误;
B、称量氯化钠时,要在天平两端各放在小相同的纸,将氯化钠放在纸上称量,故B选项错误;
C、配制 50 g 溶质质量分数为 6%的氯化钠溶液,需要水的体积为:,选择量筒时,其量程要等于或稍大于被测量液体的体积,故C选项正确;
D、用蒸馏水洗涤烧杯后, 立即溶解氯化钠,烧杯中有水,会使配制的溶液的溶质质量分数偏小,故D选项错误;
故选C。
7.C
【分析】
【解析】A、溶液是均一稳定的混合物,如水长期放置后不会分层,但不是溶液,故说法错误;
B、汽油能除去油污是溶解现象,故说法错误;
C、一定温度下,同种溶质的饱和溶液一定比不饱和溶液的浓度大,说法正确;
D、喝汽水会打嗝说明气体的溶解度与温度有关,温度越高,气体的溶解度越小,故说法错误。
故选:C。
【点睛】
明确溶液、乳化的概念、饱和溶液与不饱和溶液及影响气体溶解度的因素是解答本题关键。
8.B
【分析】
运用控制变量法来对影响溶解快慢的因素进行解答即可。
【解析】研究温度对食盐溶解快慢的影响,必须保证实验的质量,水的体积相同,只能有温度一个变量,故可选用甲与丙两个装置进行对照实验;
故选B。
【点睛】
此题考查影响溶解快慢的因素,关键是运用控制变量法来对影响溶解快慢的因素解答。
9.B
【解析】A、称量时,若天平指针向左偏转,此时应减少药品,直到天平平衡,不可向右盘添加砝码或调节游码至天平平衡,说法错误;
B、配制50g溶质质量分数为15%的氯化钠溶液,所需水的质量=50g×(1-15%)=42.5g,合42.5mL,根据选取量筒“一次接近"的原则,可用规格为50mL的量筒,说法正确;
C、量取水时,若俯视读数,读数偏大,所取的水体积偏小 则会导致所配溶液的溶质质量分数偏大,说法错误;
D、实验中用到的玻璃仪器有烧杯、玻璃棒、量筒,不需要漏斗,说法错误。
故选:B.
10.D
【解析】A、甲的溶解度随温度的降低而减小,降温时,甲的溶液中有溶质析出,固体甲质量增加,故A错误;
B、降温时,固体甲的质量增加,乙的溶解度随温度的升高而增大,则烧杯中固体乙的质量减少,故B错误;
C、乙的溶解度随温度的降低而增大,因此降温时,乙的溶液中的固体会溶解,溶液中溶质乙增多,故C错误;
D、由于甲的溶解度随温度的降低而减小,而乙的溶解度随温度的降低而增大,因此降温时,甲的溶液溶质析出,会出现更多的晶体,溶液中溶质甲减少,乙的溶液中的固体会溶解,溶液中溶质乙增多,故D正确。
故选D。
11.C
【解析】A、溶液有稳定性,外界条件不变,长期放置,溶液中溶质和溶剂不会分离,故选项说法正确;
B、明矾有一定的净水能力 ,能促进悬浮杂质的沉降,故选项说法正确;
C天然水经过沉降、过滤、杀菌侯得到的水还有可溶性杂质,属于混合物,故选项说法错误;
D、电解水生成氢气和氧气,说明水是由氢氧两种元素组成的,故选项说法正确。
故选:C。
12.D
【解析】A、二氧化锰是催化剂反应前后质量不变,所以残留固体质量dg=ag+bg-cg。错误。
B、因为分子间有间隔,所以将100mL酒精与100mL水混合,溶液体积小于200mL。错误。
C、硝酸钾溶解度随温度的升高而升高,所以升温后硝酸钾固体继续溶解,质量减少。错误。
D、向10g溶质质量分数为10%的氯化钠溶液中加入10mL蒸馏水后,溶质的质量不变,仍为10g×10%=1g。正确。
故选D。
13.Na+ Cl- H2O 100g 10%的食盐溶液中含10 g食盐(答案合理即可) 1:9
【解析】食盐溶于水解离出钠离子和氯离子,水由水分子构成,所以食盐溶液里的微粒有钠离子、氯离子和水分子,故填Na+、Cl-、H2O;
“10%食盐溶液”的含义是100g 10%的食盐溶液中含10 g食盐,故填100g 10%的食盐溶液中含10 g食盐(答案合理即可);
溶液中溶质和溶剂的质量比为:溶质:溶剂=10%:(1-10%)=1:9.故填1:9。
14.不变 引流 BACD 11.9
【解析】(1)蒸发过程中,氯化钠溶液由不饱和逐渐变成饱和溶液,在没有引入结晶池之前蒸发池中氯化钠的质量会不变,但是质量分数增大;
(2)在过滤操作中玻璃棒的作用是引流,以免液滴飞溅;
(3)用氯化钠固体配制100g质量分数为6%的氯化钠溶液,正确的实验步骤顺序是:计算,称量及量取,溶解,装瓶贴标签。故填:BACD。
需要再加NaCl的质量是X,则(100×6%+X)÷(100克+X)×100%=16%, X=11.9克.
15.过滤 稀盐酸 蒸发浓缩 A B G 不能 58.5 偏低
【解析】(1)粗盐中含少量Ca2+、Mg2+、SO42﹣和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:①加水溶解;②依次加入过量的BaCl2、NaOH、Na2CO3溶液;③过滤除去沉淀;④加入适量的稀盐酸除去过量的氢氧化钠和碳酸钠;⑤蒸发浓缩、冷却结晶得到精盐.
(2)过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒.
(3)蒸发时不能将溶液直接蒸干,以免氯化钠被烧焦,蒸发出现较多固体即可停止加热,利用余热蒸干水分.
(4)配置1000g5.85%的NaCl溶液,需NaCl的质量为:1000g×5.85%=58.5g;在准确称取固体后,用量筒量取水时,仰视读数,使量取的水的体积偏多,则所配置溶液溶质质量分数偏低.
16.5 95 减少药品质量 加速溶解
【解析】(1)配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠质量 需水质量100g-5g=95g水的密度1 故水的体积V=95ml,故填:5;95。
(2)指针偏向那侧说明那侧重,发现托盘天平的指针偏向左盘,说明左盘重药品过量,应减少药品质量,故填:减少药品质量。
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,搅拌的目的加速溶解,故填:加速溶解。
17.6 C B AgNO3 偏小 无影响 23.4%
【解析】味精是常用的调味品,化学式是C5H8NO4Na。(1)味精中至少含有碳、氢、氧、氮、钠和氯6种元素。(2)称取5.0g味精配制成50g溶液,根据就近原则,量取蒸馏水的量筒规格是50 mL,故选C。(3)配制过程,正确的操作顺序为②①④③,故选B。(4)测定NaCl在味精中的质量分数。①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3溶液,与氯化钠反应生成氯化银白色沉淀,观察是否有沉淀生成。②在配制溶液过程中,仰视刻度量取蒸馏水,读数比实际少,则所配制溶液中,谷氨酸钠的质量分数偏小。③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为∶NaCl→AgCl,58. 5→143. 5, = ,x=0.117g, ×100%=23.4%。
点睛∶量筒量程的选择应根据就近原则,量筒读数应平视。味精是常用的调味品,主要成分是谷氨酸钠。
18.②⑤①④③ 药匙 18.2g 90 mL D 小于
【解析】(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,要注意在称量前先取出药品才能称量,故配制溶液的正确操作顺序是:②⑤①④③。
(2)图②中,塑料仪器为取用粉末状药品的药匙。
(3)根据托盘天平数据的读法,NaCl质量为15g+3.2g=18.2g。
(4)所配制溶液中溶质的质量=100g×10%=10g,则需要水的质量=100g-10g=90g,则需要量取水的体积是:90ml(水的密度为1g/mL);使用量筒量取液体时,视线与凹液面最低处保持在同一水平面上,视线角度正确的是:D。
(5)如果砝码缺损了一个小角,其他操作步骤正确,那么NaCl质量小于小于它的实际质量,而水的质量正确,因此所配溶液的溶质质量分数小于10%。
19.2.5g A、B 搅拌,加速氯化钠的溶解 50mL 凹液面的最低处 量取水时仰视读数 称量时砝码与氯化钠放反了且使用了游码 20
【解析】(1)需要氯化钠的质量为;
(2)在A步骤中砝码与氯化钠的位置颠倒,在B步骤中仰视读数,故操作错误的是步骤A和B;E中玻璃棒的作用是搅拌,加速氯化钠的溶解;
(3)实验中需水的质量为,水的密度是,故水的体积为47.5mL,应选用50mL的量筒;读数时应使视线与量筒内凹液面的最低处保持水平;
(4)质量分数小于5%,可能是溶质少了或水多了,原因主要有称量时砝码与氯化钠放反了且使用了游码;量取水时仰视读数等;
(5)溶液稀释过程中,溶质质量不变,设所需5%的氯化钠溶液的质量为,可得,解得。
20.83.19
【解析】解:设需要98%的浓硫酸的体积为x
500g×30%=x×1.84g/cm3×98%
x≈83.19mL
答:需要98%的浓硫酸的体积为83.19mL。
21.(1)1.6;(2)5%
【解析】(1)根据质量守恒定律反应前后物质的总质量不变,反应生成氧气的质量=68g+2g-68.4g=1.6g;
(2)设68g过氧化氢溶液中含有过氧化氢的质量为x.
68/x=32/1.6g
解得,x=3.4g
过氧化氢溶液的溶质的质量分数为3.4g÷68g×100%=5%
答:该过氧化氢溶液的溶质的质量分数5%。答案第1页,共2页
答案第1页,共2页
同课章节目录
