6.2金属化学性质-2021-2022学年九年级化学科粤版(2012)下册(含解析)
文档属性
| 名称 | 6.2金属化学性质-2021-2022学年九年级化学科粤版(2012)下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 243.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-27 09:42:32 | ||
图片预览


文档简介
6.2化学性质
一、选择题(共6题)
1.从化学的角度对下列诗句、成语等进行解释,其中不正确的是
A.“遥知不是雪,为有暗香来”——分子在不停地运动
B.“釜底抽薪”(釜:锅:薪:柴禾)——破坏了燃烧的条件
C.“真金不怕火炼”——金(Au)的化学性质不活泼
D.“点石成金”——化学反应改变了元素种类
2.锰(Mn)和镍(Ni)都是金属,将镍丝插入硝酸锰溶液中,无变化;将镍丝插入硫酸铜溶液中,镍丝上有铜析出。则Mn 、Ni 、Cu的金属活动性由弱到强排列正确的是
A.Mn Cu Ni B.Ni Mn Cu C.Cu Ni Mn D.Mn Ni Cu
3.关于以下三个反应的相关说法不正确的是( )
①②③
A.反应①是置换反应,反应②③是化合反应
B.CH4点燃之前需验纯
C.三个反应中的生成物都是氧化物
D.三个反应均属于氧化反应
4.下列物质的分类正确的是( )
A.活泼金属:镁、铝、铜 B.碳单质:金刚石、石墨、C60
C.氧化物:水、氧化铁、熟石灰 D.混合物:空气、石油、甲烷
5.2019年1月3日,嫦娥四号探测器成功软着陆月球背面。月球上含有多种金属元素,如图是铝、钛、铁三种元素在元素周期表中的信息,下列有关说法错误的是
A.铝的相对原子质量为26. 98
B.钛原子的核内有22个质子
C.铁原子核外电子数为26
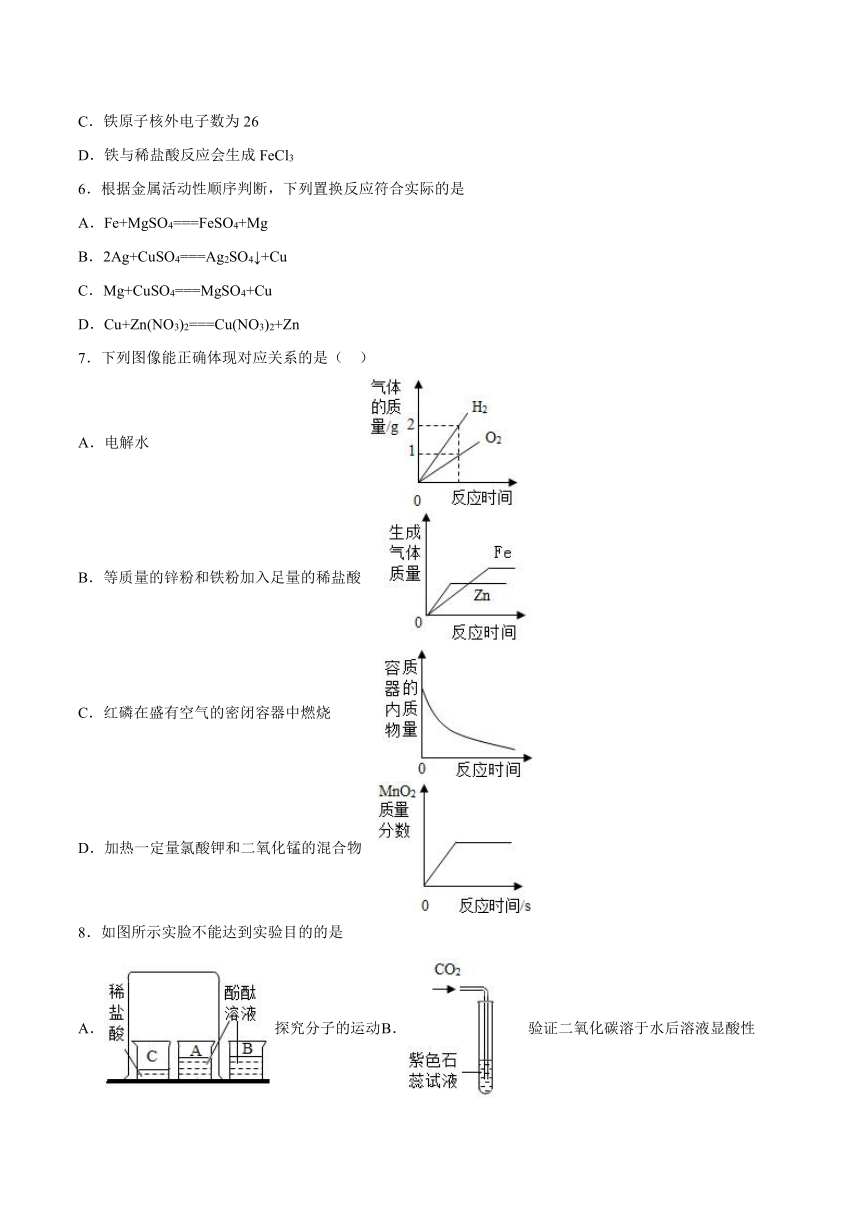
D.铁与稀盐酸反应会生成FeCl3
6.根据金属活动性顺序判断,下列置换反应符合实际的是
A.Fe+MgSO4===FeSO4+Mg
B.2Ag+CuSO4===Ag2SO4↓+Cu
C.Mg+CuSO4===MgSO4+Cu
D.Cu+Zn(NO3)2===Cu(NO3)2+Zn
7.下列图像能正确体现对应关系的是( )
A.电解水
B.等质量的锌粉和铁粉加入足量的稀盐酸
C.红磷在盛有空气的密闭容器中燃烧
D.加热一定量氯酸钾和二氧化锰的混合物
8.如图所示实脸不能达到实验目的的是
A.探究分子的运动 B.验证二氧化碳溶于水后溶液显酸性
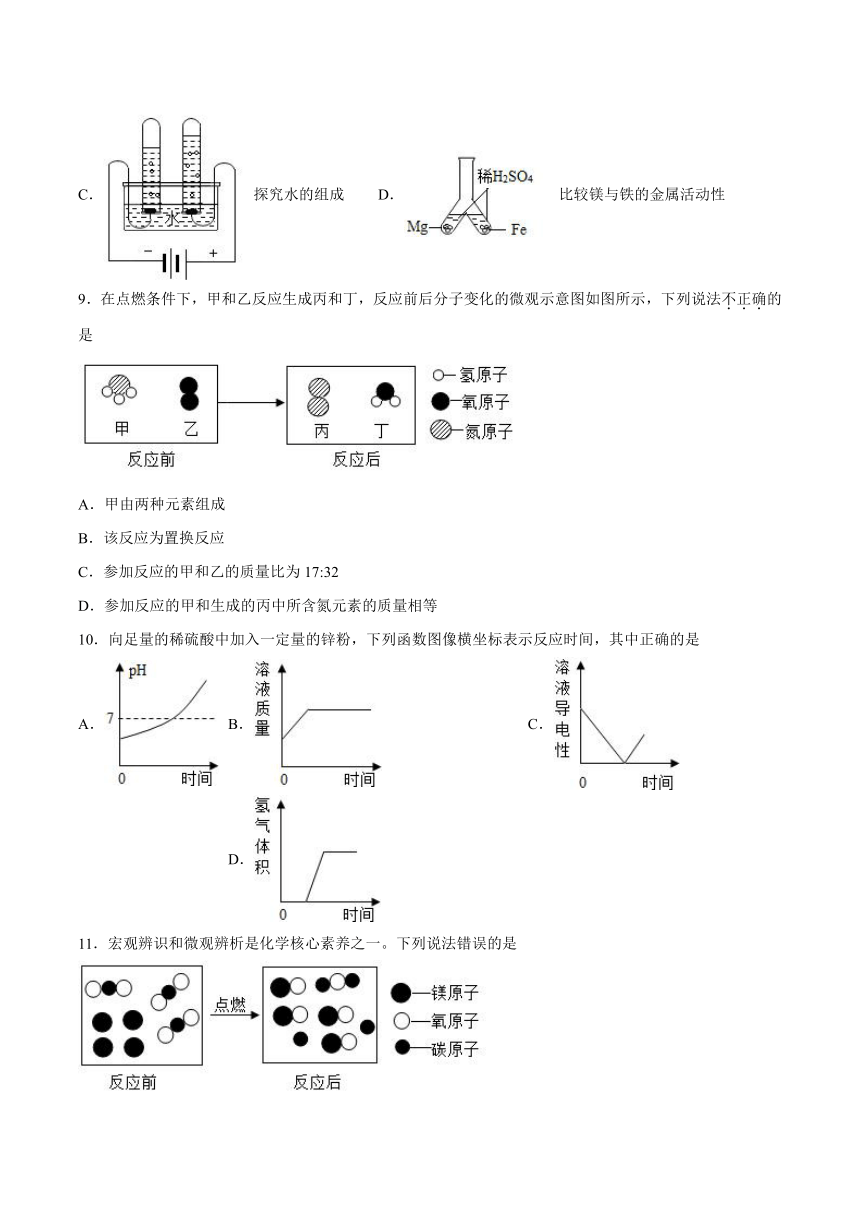
C.探究水的组成 D.比较镁与铁的金属活动性
9.在点燃条件下,甲和乙反应生成丙和丁,反应前后分子变化的微观示意图如图所示,下列说法不正确的是
A.甲由两种元素组成
B.该反应为置换反应
C.参加反应的甲和乙的质量比为17:32
D.参加反应的甲和生成的丙中所含氮元素的质量相等
10.向足量的稀硫酸中加入一定量的锌粉,下列函数图像横坐标表示反应时间,其中正确的是
A. B. C. D.
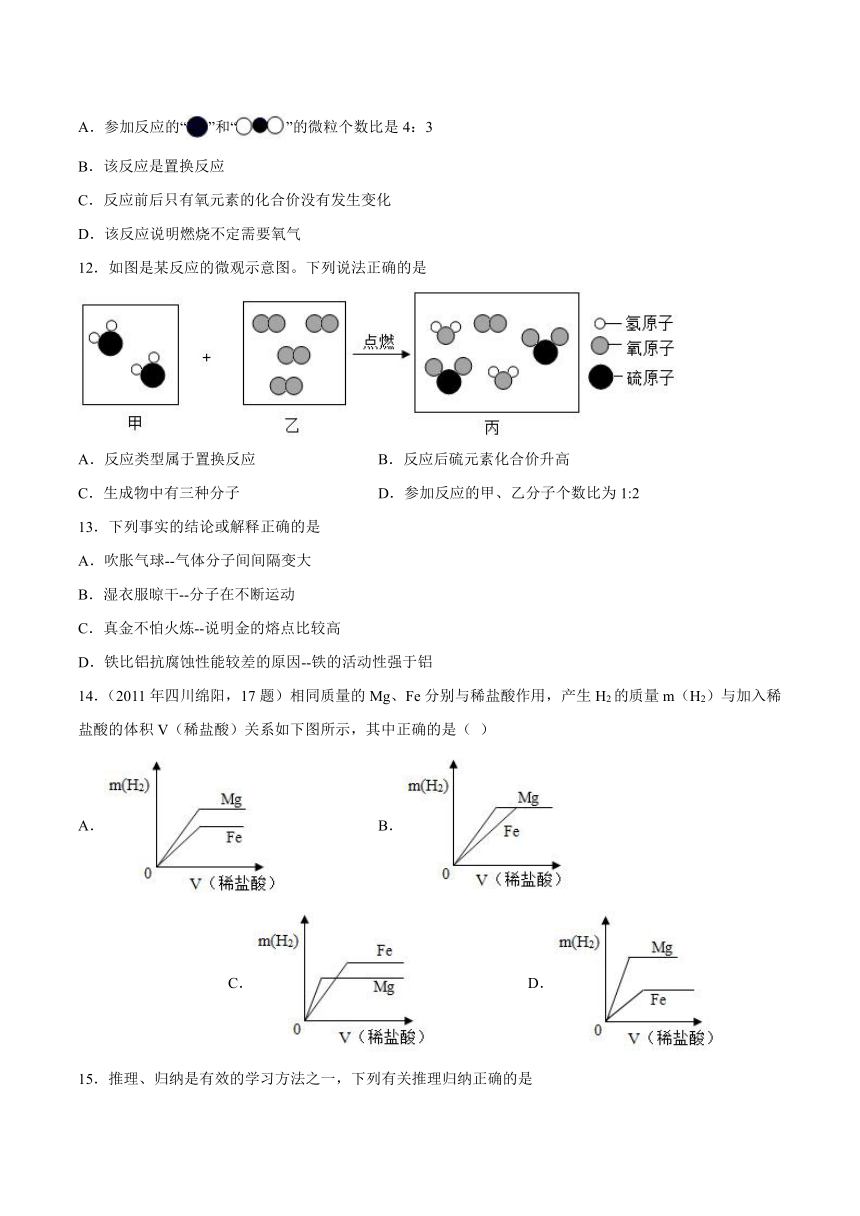
11.宏观辨识和微观辨析是化学核心素养之一。下列说法错误的是
A.参加反应的“”和“”的微粒个数比是4:3
B.该反应是置换反应
C.反应前后只有氧元素的化合价没有发生变化
D.该反应说明燃烧不定需要氧气
12.如图是某反应的微观示意图。下列说法正确的是
A.反应类型属于置换反应 B.反应后硫元素化合价升高
C.生成物中有三种分子 D.参加反应的甲、乙分子个数比为1:2
13.下列事实的结论或解释正确的是
A.吹胀气球--气体分子间间隔变大
B.湿衣服晾干--分子在不断运动
C.真金不怕火炼--说明金的熔点比较高
D.铁比铝抗腐蚀性能较差的原因--铁的活动性强于铝
14.(2011年四川绵阳,17题)相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是( )
A. B. C. D.
15.推理、归纳是有效的学习方法之一,下列有关推理归纳正确的是
A.物质与氧气的反应一定是氧化反应,氧化反应一定是物质与氧气的反应
B.由一种分子构成的物质一定是纯净物,纯净物一定由一种分子构成
C.化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化
D.置换反应中一定生成单质和化合物,有单质和化合物生成的反应一定是置换反应
16.将一定质量的铁粉加入 HCl、ZnCl2 和 CuCl2 的混合溶液中,充分反应后过滤,得到滤液M 和滤渣 N。下列有关判断中,不正确的是
A.滤液 M 中存在 Zn2+ B.滤液 M 中至少含 2 种金属阳离子
C.滤渣 N 中含有 Cu 和 Zn D.滤渣 N 的质量可能等于加入铁粉的质量
二、综合题(共6题)
17.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
18.金属材料在人类活动中已得到越来越广泛的应用.正确使用金属材料,首先应该了解金属.
①地壳中含量最多的金属元素是______填元素符号
②保持铁的化学性质的最小粒子是______.
国家大剧院安装了近2万块被称作“太空金属”的钛金属板,其密度只有钢的钛与稀硫酸反应的化学方程式为:Ti+2H2SO4=Ti(SO4)2+2H2↑
在某稀有气体中,熔融状态下,镁与反应的化学方程式为:TiCl4+2MgMgCl2+Ti,则Mg、Ti、Cu的金属活动性顺序是______.
某实验室废液缸里的废液含有、、,如果将废液直接排放就会造成水污染.几位同学利用课余处理废液,回收硫酸锌和有关金属.实验过程如图:
请回答:
①操作1是______,固体A的成分______.
②固体C是______滤液1和滤液2中溶质相同,该溶质是______.
③写出加入过量锌粉的其中一个反应的化学方程式______;
④加入足量稀硫酸发生反应的化学方程式______.
19.分金属于机金属板中含有Fe、 Cu、 Au、 Ni(银银白色金属等金属,如图是某工厂回收部分金属的流程图。已知2Cu+O2+2H2SO42CuSO4+2H2O
(1)操作①的名称是_____。
(2)固体A的化学式为_____;滤液②中所含的金属阳离子为_____。
(3)写出滤液③和铁粉发生反应的一个化学方程式_____;该反应的基本类型为 _____反应。
(4) Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是_____。
(5)另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有_____。
(6)铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m=_____, 铝合金样品中铝的质量分数为_____。
实验 第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
烧杯中剩余物的质量(g) 119.2 218.4 318.0 m
20.人类文明的发展和社会的进步同金属材料关系十分密切。
(1)下图为探究金属的化学性质所做的四个实验。回答下列问题:
①写出溶液变蓝的反应的化学方程式_____________________。
②由上述实验能得出金属的活动性顺序是_________________(写两组)。
(2)21世纪是钛的世纪,利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程如下:
①该工艺流程所使用的原料中,属于氧化物的是_____________。
②反应Ⅱ可获得海锦钛,化学方程式为TiCl4+2Mg 高温Ti+2MgCl2,该反应需在氩气环境中进行,原因是________________。
③该工艺流程中,可以循环使用的物质有_______________________。
21.某兴趣小组根据下列装置进行实验,请你参与并回答:
(1)②仪器的名称是_____。
(2)若用A装置制取氧气,则①中可观察到的现象是_____(任答一点);写出该反应的化学方程式_____。
(3)B和C装置均可制取CO2,与B相比较,C的主要优点_____。
(4)常用金属锌和稀硫酸反应制取。若实验室要制取少量氢气最好选择发生装置_____(填字母);若用试管排空气法收集氢气,请在D处方框中画出装置图_____(只画试管和导气管)。
(5)某研究性学习小组为了测定某矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)
实 验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
①表格中m的数值是_____。
②求石灰石中碳酸钙的质量分数_____。
22.有人用经过粉碎的含有较多有机物杂质的粗铜,通过下列步骤制取硫酸铜晶体
(1)若步骤①中灼烧温度过高会产生副产物氧化亚铜(铜的化合价为+1价),其化学式为 _____ 。
(2)写出步骤②中氧化铜与稀硫酸反应的化学方程式: _____ 。
(3)步骤②中,铜和稀硫酸不能直接发生置换反应的原因是 ______ 。
(4)反应途径Ⅰ和Ⅱ,分别发生如下反应:
途径Ⅰ:2Cu+O2+2H2SO4△ 2CuSO4+2H2O
途径Ⅱ:Cu+H2O2+ H2SO4="=" CuSO4+2H2O
请选择你认为更适合于实际应用的途径,并说明理 由: _____ 。
(5)根据图2,步骤④的结晶方法为 _______ 。
(6)若800Kg粗制氧化铜(其中单质铜的质量分数为4%),通过途径Ⅱ转化为硫酸铜,计算参加反映的过氧化氢的质量 ____ 。写出计算过程。
参考答案
1.D
【详解】
A、“遥知不是雪,为有暗香来”一一分子在不停地运动,人才能闻到香味,正确;
B、“釜底抽薪”(釜:锅:薪:柴禾)一一破坏了燃烧的条件,隔离了可燃物,正确;
C、“真金不怕火炼”一一金(Au)的化学性质不活泼,正确;
D、化学反应前后元素种类不会发生改变,错误;
故选D。
2.C
【解析】
【详解】
将镍丝插入硫酸锰溶液中,无变化,说明镍的活动性比锰弱;将镍丝插入硫酸铜溶液中,镍丝上有铜析出,说明镍的活动性比铜强,因此这三种金属的金属活动性由弱到强的顺序是Cu3.A
【详解】
A、置换反应是单质和化合物反应生成另一种单质和化合物的反应,反应①生成物都是化合物,不是置换反应,反应②③符合“多变一”的特点,是化合反应,选项错误;
B、CH4是可燃性气体,容易在空气中达到一定值时发生危险,因此CH4点燃之前需验纯,选项正确;
C、由两种元素组成,其中一种元素是氧元素的化合物是氧化物,三个反应中生成物都是氧化物,选项正确;
D、物质与氧气发生的反应叫做氧化反应,三个反应均属于氧化反应,选项正确。
故选A。
4.B
【详解】
A、镁、铝在金属活动性顺序中排在氢之前,属于活泼金属,铜在金属活动性顺序中排在氢之后,属于不活泼金属,选项A不正确;
B、单质是由一种元素组成的纯净物。金刚石、石墨、C60都是由碳元素组成的纯净物,都是碳单质,选项B正确;
C、氧化物是两种元素组成且其中一种是氧元素的化合物,水、氧化铁都是氧化物,熟石灰是氢氧化钙的俗称,由钙、氧、氢三种元素组成,不属于氧化物,选项C不正确;
D、混合物是由两种或两种以上物质混合而成的物质,空气、石油都是混合物,而甲烷是由一种物质组成的纯净物,选项D不正确。故选B。
5.D
【详解】
A、铝的相对原子质量为26.98,不符合题意;
B、左上角是原子序数,原子中,核电荷数=核内质子数=核外电子数=原子序数;钛原子的核内有22个质子,不符合题意;
C、左上角是原子序数,原子中,核电荷数=核内质子数=核外电子数=原子序数;铁原子核外电子数为26,不符合题意;
D、铁与稀盐酸反应会生成FeCl2,符合题意。故选D。
6.C
【详解】
试题分析:根据金属活动性顺序的应用规律,活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,依据此原理结合金属的活动顺序分析即可.
A.金属活动顺序中铁在镁的后面,铁不能置换镁,不符合实际;
B.金属活动顺序中银在铜的后面,银不能置换铜,不符合实际;
C.金属活动顺序中镁在铜的前面,镁可以置换铜,符合实际;
D.金属活动顺序中铜在锌的后面,铜不能置换锌,不符合实际.
考点:金属活动性顺序及其应用
点评:此题是对金属活动顺序的考查,解题的关键是对金属活动顺序表意义的掌握与应用,属于基础性知识的考查题.
7.B
【详解】
A、电解水时生成氢气和氧气的体积比为2:1,而不是质量比,故A错误;
B、锌的活动性比铁强,反应速率快,反应时间短;等质量的锌粉和铁粉加入足量的稀盐酸,铁生成氢气的质量比锌多,故B正确;
C、红磷燃烧消耗装置内的氧气生成五氧化二磷固体,反应前后总质量不变,故C错误;
D、氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,但氧气逸出,固体混合物的质量减少,质量分数不断增大,至完全反应不再发生改变,但原混合物二氧化锰的质量分数不为0,故D错误。故选B。
8.A
【详解】
A、酚酞试液遇酸性溶液不变色,所以AC烧杯中均是无色,不能用于探究分子的运动,选项错误;
B、石蕊试液遇酸性溶液变红,二氧化碳通入石蕊试液中,石蕊试液变红,可验证二氧化碳溶于水后溶液显酸性,选项正确;
C、据质量守恒定律可知,反应前后元素种类不变,水在通电条件下分解生成氢气和氧气,可证明水是由氢元素和氧元素组成的,选项正确;
D、镁比铁反应快,说明镁比铁的金属活动性强,选项正确。
故选A。
9.C
【分析】
根据微观示意图可知,反应物甲的分子为3个H原子和1个N原子构成的NH3分子,乙物质的分子为由2个O原子构成的O2分子;生成物丙为由2个N原子构成的N2分子,物质丁的分子为由2个H原子和1个O原子构成的H2O分子;则示意图所表示的反应为氨气与氧气反应生成氮气和水,该反应的化学方程式为4NH3+3O22N2+6H2O。
【详解】
A、根据化学方程式4NH3+3O22N2+6H2O可知,甲是NH3由氮和氢两种元素组成,故正确;
B、根据化学方程式4NH3+3O22N2+6H2O可知,反应符合置换反应的单质与化合物生成单质与化合物的特点,该反应为置换反应,故正确;
C、根据反应的化学方程式为4NH3+3O22N2+6H2O,反应中甲物质氨气与乙物质氧气的质量比=68:96=17:24≠17:32,故不正确;
D、化学反应前后元素的质量不变,根据化学方程式4NH3+3O22N2+6H2O可知,只有反应的甲和生成的丙中含有氮元素,故正确。
故选C。
10.B
【详解】
A、锌与稀硫酸反应生成硫酸锌和氢气,最后稀硫酸过量,pH一直小于7,不会大于7,不符合题意;
B、锌与稀硫酸反应:,65份的锌置换出2份的氢气,溶液质量逐渐增加,待完全反应后,不再变化,符合题意;
C、锌与稀硫酸反应生成硫酸锌和氢气,溶液中存在锌离子、氢离子、硫酸根离子,溶液的导电性不会减少至零,不符合题意;
D、锌与稀硫酸反应生成硫酸锌和氢气,一开始就有氢气生成,生成氢气的体积从零开始增加,待完全反应后,不再变化,不符合题意。
故选B。
A
【分析】该的微观示意图是镁和二氧化碳反应,化学方程式为。
【详解】
A、从反应方程式分析,参加反应的“”和“”的微粒个数比是2:1,A错误;
B、从反应方程式分析,该反应是单质和化合物反应生成单质和化合物,属于置换反应,B正确;
C、该反应是置换反应,镁元素和碳元素的化合价在反应前后发生了变化,只有氧元素的化合价没有发生变化,C正确;
D、该反应是镁在二氧化碳中燃烧,说明燃烧不定需要氧气,D正确。故选A。
12.B
【分析】
由图可知,该反应为硫化氢在氧气中燃烧生成二氧化硫和水,该反应的化学方程式为:。
【详解】
A、该反应的生成物都是化合物,不属于置换反应,不符合题意;
B、硫化氢中氢元素显+1价,根据化合物中,正、负化合价代数和为零,硫元素显-2价,二氧化硫中硫元素显+4价,故反应后,硫元素化合价升高,符合题意;
C、生成物中有二氧化硫分子和水分子两种分子,不符合题意;
D、由化学方程式可知,参加反应的甲、乙分子个数比为:2:3,不符合题意。
故选B。
13.B
【详解】
A、吹胀气球是因为压缩了气体,压强增大,才能将气体吹进气球,压强大了,分子间距离就一定小了。气球长大是因为其中吹入了过多的气体分子,不是间距大了,而是分子数目多了。该选项说法不正确;
B、混衣服晾干,是因为水分子是不断运动的,该选项说法正确;
C、真金不怕火炼,说明金的化学性质不活泼,该选项说法不正确;
D、铁比铝抗腐蚀性能较差,是因为铝能和空气中的氧气反应生成氧化铝保护膜,而铝比铁活泼,该选项说法不正确。
故选B。
14.D
【详解】
试题分析:由于两种金属都能和盐酸反应,且盐酸足量,相等质量的金属完全反应时得到的氢气不同,得到的氢气应该是镁对应的更多;根据金属活动性强弱关系镁>铁,可判断镁与稀盐酸反应快,铁与稀盐酸反应慢,即金属镁的反应时间最短最先完成、铁完成的反应消耗时间长;而产生的氢气的质量= ×金属质量,二者的化合价相等,镁的相对原子质量小,镁与稀盐酸反应生成的氢气多,故D正确。
15.C
【详解】
A、物质与氧气的反应一定是氧化反应,但是氧化反应不一定是物质与氧气的反应,如氢气还原氧化铜,不符合题意;
B、由一种分子构成的物质一定是纯净物,但是纯净物不一定由一种分子构成,如铁由原子构成,不符合题意;
C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化,符合题意;
D、置换反应中一定生成单质和化合物,有单质和化合物生成的反应不一定是置换反应,如氯酸钾分解生成氯化钾和氧气,属于分解反应,不符合题意。
故选C。
16.C
【详解】
A、铁不能和氯化锌反应,因此滤液中一定含有锌离子,该选项说法正确;
B、滤液M中至少含锌离子、亚铁离子等2种金属阳离子,该选项说法正确;
C、滤渣N中含有Cu,不可能含有Zn,该选项说法不正确;
D、滤渣N的质量可能等于加入铁粉的质量,例如铁和氯化铜反应后滤渣质量增大,和稀盐酸反应后滤渣质量减小,当两种情况下增加的质量和减小的质量相等时,滤渣N的质量等于加入铁粉的质量,该选项说法正确。
故选C。
17.Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
【详解】
(1)方案②中,铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式:Fe+H2SO4=FeSO4+H2↑;
(2)以上两个实验方案中,选择的是②,理由:不产生气泡时,说明铁完全反应,便于观察是否除尽;
(3)两个方案中过滤需要的仪器:漏斗、烧杯、玻璃棒、铁架台(带铁圈);
(4) 详见答案;
(5)铁能被磁铁吸引,铜不能被磁铁吸引。更简单的方法是用磁铁吸引。
18.Al 铁原子 过滤 Cu、Zn、Fe Fe 或 Zn+ H2SO4 =ZnSO4 + H2↑
【详解】
(1)地壳中含量最多的金属元素是铝,金属有原子构成,保持其化学性质的粒子是原子,所以本题答案为:铝,铁原子;
(2)钛与稀硫酸能生成氢气,说明钛在氢前,镁能与反应,说明镁在钛的前面,所以本题答案为:;
(3)①操作1得到了固体和液体,说明是过滤操作,废液含有、、,加入过量的锌粉,则锌能将铜和铁置换出来还有剩余,剩余固体A中含有锌、铜和铁,所以本题答案为:过滤,Cu、Zn、Fe;
②铁能被磁铁吸引,而锌和铜不可以,得到的固体B加硫酸能得到铜,故B中含有锌和铜,而C中含有的是铁,锌能与硫酸反应生成硫酸锌,所以本题答案为:Fe,;
③加入过量锌粉能与硫酸铜反应生成硫酸锌和铜,能与硫酸亚铁反应生成铁和硫酸锌,所以本题答案为:
或;
④加入足量稀硫酸时能与锌反应生成硫酸锌和氢气,所以本题答案为:。
19.过滤 Cu、Fe Fe2+ Fe+CuSO4=FeSO4+Cu 置换 Fe>Ni>Cu Cu、Fe 418.0g 90%
【详解】
⑴、因为是分离可溶性物质和难溶性物质,所以操作①的名称是过滤。
⑵、金属板放到足量硫酸中,得到滤液和滤渣,滤液中含有Fe2+离子和镍离子;滤渣中含有Cu和Au,已知铜和稀硫酸、氧气在加热的情况下生成硫酸铜和水,所以滤液③是硫酸铜溶液,向硫酸铜溶液中加入足量的铁粉,与硫酸铜反应生成硫酸亚铁和铜,所以物体A中铜和铁,固体A的化学式为:Fe、Cu;滤液中含有的镍离子与过量的铁粉反应生成镍和Fe2+离子,所以滤液②中所含的金属阳离子为Fe2+离子。
⑶、滤液③是硫酸铜溶液,向硫酸铜溶液中加入足量的铁粉,与硫酸铜反应生成硫酸亚铁和铜,其化学反应方程式为:;因为此反应由一种单质和一种化合物反应,生成另外一种单质和另外一种化合物,所以该反应的基本类型为置换反应。
⑷、金属板放到足量硫酸中,得到滤液和滤渣,滤液中含有Fe2+离子和镍离子,滤液中含有的镍离子与过量的铁粉反应生成镍和Fe2+离子,这就证明带金属活动顺序表中,Fe在Ni之前,Ni在H之前,而Cu在H之后,所以Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是Fe>Ni>Cu。
⑸、金属锌、铜、铁三种元素在金属活动顺序表中,前后顺序是锌、铁、铜,锌能够与硝酸铜和硝酸铁溶液反应置换出铜和铁,如果滤液中只有一种物质,那只能是硝酸锌,此时,锌把溶液中的铜离子和铁离子全部置换出来,所以被渣中一定含有铜和铁。
⑹、由实验数据对比可知,第一次,第二次每100g稀硫酸反应生成氢气的质量为0.8g,第三次生成氢气的质量为:218.4g+100g-318.0g=0.4g<0.8g,说明第三次稀硫酸有剩余,铝完全发生了反应,第四次加入的稀硫酸不反应,杯中剩余物的质量应为m=318.0g+100g=418.0g;
由表中的数据可知,生成氢气的质量为:20g+300g-318.0g=2.0g,设20g样品中铝的质量为x,
该样品中铝的质量分数为:
20.Cu +2AgNO3 == Cu(NO3)2 + 2Ag Zn〉Cu〉Ag 和Fe〉Cu〉Ag TiO2 防止镁被氧化 Mg和Cl2
【详解】
本题考查了金属活动性的探究和在生产海绵钛情境下金属的性质。
(1)①在A中,由于在金属活动性顺序中铜>银,所以铜可以置换出银,生成了硫酸铜溶液,溶液变成蓝色,反应的方程式是:Cu+2AgNO3═Cu(NO3)2+2Ag;
②在A中,由于铜能把银置换出来,说明了金属的活动性是铜大于银;在B中,由于铁能把铜置换出来,说明了金属的活动性是铁大于铜;在C中,由于锌能把氢置换出来,说明了金属的活动性是锌大于氢;在D中,由于铜不能把氢置换出来,说明了金属的活动性是氢大于铜.由此可得出金属的活动性是:Zn>Cu>Ag和Fe>Cu>Ag;
(2)①该工艺流程所使用的原料中,TiO2由两种元素组成且有一种是氧元素,属于氧化物;
②该反应需要在氩气环境中进行,因为镁比较活泼,容易被氧化,利用氩气做保护气, 防止镁被氧化;
③既是反应物,也是生成物的物质可以循环使用,由工艺流程图可知生成物中的镁和氯气可循环使用。
21.长颈漏斗 固体颜色由暗紫色变为黑色 2KMnO4K2MnO4+MnO2+O2↑ 能随时控制反应的发生和停止 C 4.4 80%
【详解】
(1)②仪器的名称是长颈漏斗。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故用A装置制取氧气,则①中可观察到的现象是固体颜色由暗紫色变为黑色;该反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑。
(3)B和C装置均可制取CO2,与B相比较,C装置含有多孔隔板,在多孔隔板上方放置反应的固体块状药品,多空隔板下方用分液漏斗连通 ,再注入液体药品使液体与固体接触反应。想停止时,关闭导气管的橡胶开关,内部因继续反应产生气体使压强增大,会把液体压到隔板以下使其不与固体接触,停止反应,故主要优点能随时控制反应的发生和停止。
(4)锌和稀硫酸反应生成硫酸锌和氢气,C装置能随时控制反应的发生和停止,若实验室要制取少量氢气最好选择发生装置C;若用试管排空气法收集氢气,在D处方框中装置图为。
(5)①由表格数据可以知道,5g石灰石样品完全反应生成1.76g二氧化碳,第3次加15g石灰石产生4.4g二氧化碳,可以知道第3次样品有剩余,盐酸完全反应,因为第4次与第3次酸的质量一样多,所以生成气体一样,故表格中m的数值是4.4。
②设5g石灰石中碳酸钙的质量分数为x
故石灰石中碳酸钙的质量分数80%。
22.Cu2O CuO+H2SO4==CuSO4+H2O 在金属活动性顺序中,铜排在氢的后面 途径Ⅰ,原料之一是空气,生产成本较低;或途径Ⅱ反应不需加热 ,节约能源或操作相对简单 冷却 17Kg
铜的质量为:800Kg×4%=32Kg
设参加反应的过氧化氢的质量为x
Cu + H2O2 +H2SO4 =CuSO4+2H2O
64 34
32kg x
64/34=32kg/x
x=17Kg
【详解】
(1)若步骤一根据铜元素的化合价,其氧化物的化学式为Cu2O;
(2)氧化铜与稀硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O;
(3)铜不能与稀硫酸直接发生置换反应的原因是在金属活动性顺序中,铜排在氢的后面;
(4)认为更适于实际应用的途径是途径Ⅰ,原料之一是空气,生产成本较低;或途径Ⅱ反应不需加热 ,节约能源或操作相对简单;
(5)因为硝酸钠的溶解度受温度影响较大,故采用冷却结晶;
(6)铜的质量为:800Kg×4%=32Kg
设参加反应的过氧化氢的质量为x
Cu + H2O2 +H2SO4 =CuSO4+2H2O
64 34
32kg x
64/34=32kg/x
x=17Kg
答:参加反应的过氧化氢的质量为17kg
一、选择题(共6题)
1.从化学的角度对下列诗句、成语等进行解释,其中不正确的是
A.“遥知不是雪,为有暗香来”——分子在不停地运动
B.“釜底抽薪”(釜:锅:薪:柴禾)——破坏了燃烧的条件
C.“真金不怕火炼”——金(Au)的化学性质不活泼
D.“点石成金”——化学反应改变了元素种类
2.锰(Mn)和镍(Ni)都是金属,将镍丝插入硝酸锰溶液中,无变化;将镍丝插入硫酸铜溶液中,镍丝上有铜析出。则Mn 、Ni 、Cu的金属活动性由弱到强排列正确的是
A.Mn Cu Ni B.Ni Mn Cu C.Cu Ni Mn D.Mn Ni Cu
3.关于以下三个反应的相关说法不正确的是( )
①②③
A.反应①是置换反应,反应②③是化合反应
B.CH4点燃之前需验纯
C.三个反应中的生成物都是氧化物
D.三个反应均属于氧化反应
4.下列物质的分类正确的是( )
A.活泼金属:镁、铝、铜 B.碳单质:金刚石、石墨、C60
C.氧化物:水、氧化铁、熟石灰 D.混合物:空气、石油、甲烷
5.2019年1月3日,嫦娥四号探测器成功软着陆月球背面。月球上含有多种金属元素,如图是铝、钛、铁三种元素在元素周期表中的信息,下列有关说法错误的是
A.铝的相对原子质量为26. 98
B.钛原子的核内有22个质子
C.铁原子核外电子数为26
D.铁与稀盐酸反应会生成FeCl3
6.根据金属活动性顺序判断,下列置换反应符合实际的是
A.Fe+MgSO4===FeSO4+Mg
B.2Ag+CuSO4===Ag2SO4↓+Cu
C.Mg+CuSO4===MgSO4+Cu
D.Cu+Zn(NO3)2===Cu(NO3)2+Zn
7.下列图像能正确体现对应关系的是( )
A.电解水
B.等质量的锌粉和铁粉加入足量的稀盐酸
C.红磷在盛有空气的密闭容器中燃烧
D.加热一定量氯酸钾和二氧化锰的混合物
8.如图所示实脸不能达到实验目的的是
A.探究分子的运动 B.验证二氧化碳溶于水后溶液显酸性
C.探究水的组成 D.比较镁与铁的金属活动性
9.在点燃条件下,甲和乙反应生成丙和丁,反应前后分子变化的微观示意图如图所示,下列说法不正确的是
A.甲由两种元素组成
B.该反应为置换反应
C.参加反应的甲和乙的质量比为17:32
D.参加反应的甲和生成的丙中所含氮元素的质量相等
10.向足量的稀硫酸中加入一定量的锌粉,下列函数图像横坐标表示反应时间,其中正确的是
A. B. C. D.
11.宏观辨识和微观辨析是化学核心素养之一。下列说法错误的是
A.参加反应的“”和“”的微粒个数比是4:3
B.该反应是置换反应
C.反应前后只有氧元素的化合价没有发生变化
D.该反应说明燃烧不定需要氧气
12.如图是某反应的微观示意图。下列说法正确的是
A.反应类型属于置换反应 B.反应后硫元素化合价升高
C.生成物中有三种分子 D.参加反应的甲、乙分子个数比为1:2
13.下列事实的结论或解释正确的是
A.吹胀气球--气体分子间间隔变大
B.湿衣服晾干--分子在不断运动
C.真金不怕火炼--说明金的熔点比较高
D.铁比铝抗腐蚀性能较差的原因--铁的活动性强于铝
14.(2011年四川绵阳,17题)相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是( )
A. B. C. D.
15.推理、归纳是有效的学习方法之一,下列有关推理归纳正确的是
A.物质与氧气的反应一定是氧化反应,氧化反应一定是物质与氧气的反应
B.由一种分子构成的物质一定是纯净物,纯净物一定由一种分子构成
C.化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化
D.置换反应中一定生成单质和化合物,有单质和化合物生成的反应一定是置换反应
16.将一定质量的铁粉加入 HCl、ZnCl2 和 CuCl2 的混合溶液中,充分反应后过滤,得到滤液M 和滤渣 N。下列有关判断中,不正确的是
A.滤液 M 中存在 Zn2+ B.滤液 M 中至少含 2 种金属阳离子
C.滤渣 N 中含有 Cu 和 Zn D.滤渣 N 的质量可能等于加入铁粉的质量
二、综合题(共6题)
17.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
18.金属材料在人类活动中已得到越来越广泛的应用.正确使用金属材料,首先应该了解金属.
①地壳中含量最多的金属元素是______填元素符号
②保持铁的化学性质的最小粒子是______.
国家大剧院安装了近2万块被称作“太空金属”的钛金属板,其密度只有钢的钛与稀硫酸反应的化学方程式为:Ti+2H2SO4=Ti(SO4)2+2H2↑
在某稀有气体中,熔融状态下,镁与反应的化学方程式为:TiCl4+2MgMgCl2+Ti,则Mg、Ti、Cu的金属活动性顺序是______.
某实验室废液缸里的废液含有、、,如果将废液直接排放就会造成水污染.几位同学利用课余处理废液,回收硫酸锌和有关金属.实验过程如图:
请回答:
①操作1是______,固体A的成分______.
②固体C是______滤液1和滤液2中溶质相同,该溶质是______.
③写出加入过量锌粉的其中一个反应的化学方程式______;
④加入足量稀硫酸发生反应的化学方程式______.
19.分金属于机金属板中含有Fe、 Cu、 Au、 Ni(银银白色金属等金属,如图是某工厂回收部分金属的流程图。已知2Cu+O2+2H2SO42CuSO4+2H2O
(1)操作①的名称是_____。
(2)固体A的化学式为_____;滤液②中所含的金属阳离子为_____。
(3)写出滤液③和铁粉发生反应的一个化学方程式_____;该反应的基本类型为 _____反应。
(4) Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是_____。
(5)另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有_____。
(6)铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m=_____, 铝合金样品中铝的质量分数为_____。
实验 第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
烧杯中剩余物的质量(g) 119.2 218.4 318.0 m
20.人类文明的发展和社会的进步同金属材料关系十分密切。
(1)下图为探究金属的化学性质所做的四个实验。回答下列问题:
①写出溶液变蓝的反应的化学方程式_____________________。
②由上述实验能得出金属的活动性顺序是_________________(写两组)。
(2)21世纪是钛的世纪,利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程如下:
①该工艺流程所使用的原料中,属于氧化物的是_____________。
②反应Ⅱ可获得海锦钛,化学方程式为TiCl4+2Mg 高温Ti+2MgCl2,该反应需在氩气环境中进行,原因是________________。
③该工艺流程中,可以循环使用的物质有_______________________。
21.某兴趣小组根据下列装置进行实验,请你参与并回答:
(1)②仪器的名称是_____。
(2)若用A装置制取氧气,则①中可观察到的现象是_____(任答一点);写出该反应的化学方程式_____。
(3)B和C装置均可制取CO2,与B相比较,C的主要优点_____。
(4)常用金属锌和稀硫酸反应制取。若实验室要制取少量氢气最好选择发生装置_____(填字母);若用试管排空气法收集氢气,请在D处方框中画出装置图_____(只画试管和导气管)。
(5)某研究性学习小组为了测定某矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质不与稀盐酸反应)
实 验 1 2 3 4
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
①表格中m的数值是_____。
②求石灰石中碳酸钙的质量分数_____。
22.有人用经过粉碎的含有较多有机物杂质的粗铜,通过下列步骤制取硫酸铜晶体
(1)若步骤①中灼烧温度过高会产生副产物氧化亚铜(铜的化合价为+1价),其化学式为 _____ 。
(2)写出步骤②中氧化铜与稀硫酸反应的化学方程式: _____ 。
(3)步骤②中,铜和稀硫酸不能直接发生置换反应的原因是 ______ 。
(4)反应途径Ⅰ和Ⅱ,分别发生如下反应:
途径Ⅰ:2Cu+O2+2H2SO4△ 2CuSO4+2H2O
途径Ⅱ:Cu+H2O2+ H2SO4="=" CuSO4+2H2O
请选择你认为更适合于实际应用的途径,并说明理 由: _____ 。
(5)根据图2,步骤④的结晶方法为 _______ 。
(6)若800Kg粗制氧化铜(其中单质铜的质量分数为4%),通过途径Ⅱ转化为硫酸铜,计算参加反映的过氧化氢的质量 ____ 。写出计算过程。
参考答案
1.D
【详解】
A、“遥知不是雪,为有暗香来”一一分子在不停地运动,人才能闻到香味,正确;
B、“釜底抽薪”(釜:锅:薪:柴禾)一一破坏了燃烧的条件,隔离了可燃物,正确;
C、“真金不怕火炼”一一金(Au)的化学性质不活泼,正确;
D、化学反应前后元素种类不会发生改变,错误;
故选D。
2.C
【解析】
【详解】
将镍丝插入硫酸锰溶液中,无变化,说明镍的活动性比锰弱;将镍丝插入硫酸铜溶液中,镍丝上有铜析出,说明镍的活动性比铜强,因此这三种金属的金属活动性由弱到强的顺序是Cu
【详解】
A、置换反应是单质和化合物反应生成另一种单质和化合物的反应,反应①生成物都是化合物,不是置换反应,反应②③符合“多变一”的特点,是化合反应,选项错误;
B、CH4是可燃性气体,容易在空气中达到一定值时发生危险,因此CH4点燃之前需验纯,选项正确;
C、由两种元素组成,其中一种元素是氧元素的化合物是氧化物,三个反应中生成物都是氧化物,选项正确;
D、物质与氧气发生的反应叫做氧化反应,三个反应均属于氧化反应,选项正确。
故选A。
4.B
【详解】
A、镁、铝在金属活动性顺序中排在氢之前,属于活泼金属,铜在金属活动性顺序中排在氢之后,属于不活泼金属,选项A不正确;
B、单质是由一种元素组成的纯净物。金刚石、石墨、C60都是由碳元素组成的纯净物,都是碳单质,选项B正确;
C、氧化物是两种元素组成且其中一种是氧元素的化合物,水、氧化铁都是氧化物,熟石灰是氢氧化钙的俗称,由钙、氧、氢三种元素组成,不属于氧化物,选项C不正确;
D、混合物是由两种或两种以上物质混合而成的物质,空气、石油都是混合物,而甲烷是由一种物质组成的纯净物,选项D不正确。故选B。
5.D
【详解】
A、铝的相对原子质量为26.98,不符合题意;
B、左上角是原子序数,原子中,核电荷数=核内质子数=核外电子数=原子序数;钛原子的核内有22个质子,不符合题意;
C、左上角是原子序数,原子中,核电荷数=核内质子数=核外电子数=原子序数;铁原子核外电子数为26,不符合题意;
D、铁与稀盐酸反应会生成FeCl2,符合题意。故选D。
6.C
【详解】
试题分析:根据金属活动性顺序的应用规律,活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,依据此原理结合金属的活动顺序分析即可.
A.金属活动顺序中铁在镁的后面,铁不能置换镁,不符合实际;
B.金属活动顺序中银在铜的后面,银不能置换铜,不符合实际;
C.金属活动顺序中镁在铜的前面,镁可以置换铜,符合实际;
D.金属活动顺序中铜在锌的后面,铜不能置换锌,不符合实际.
考点:金属活动性顺序及其应用
点评:此题是对金属活动顺序的考查,解题的关键是对金属活动顺序表意义的掌握与应用,属于基础性知识的考查题.
7.B
【详解】
A、电解水时生成氢气和氧气的体积比为2:1,而不是质量比,故A错误;
B、锌的活动性比铁强,反应速率快,反应时间短;等质量的锌粉和铁粉加入足量的稀盐酸,铁生成氢气的质量比锌多,故B正确;
C、红磷燃烧消耗装置内的氧气生成五氧化二磷固体,反应前后总质量不变,故C错误;
D、氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,但氧气逸出,固体混合物的质量减少,质量分数不断增大,至完全反应不再发生改变,但原混合物二氧化锰的质量分数不为0,故D错误。故选B。
8.A
【详解】
A、酚酞试液遇酸性溶液不变色,所以AC烧杯中均是无色,不能用于探究分子的运动,选项错误;
B、石蕊试液遇酸性溶液变红,二氧化碳通入石蕊试液中,石蕊试液变红,可验证二氧化碳溶于水后溶液显酸性,选项正确;
C、据质量守恒定律可知,反应前后元素种类不变,水在通电条件下分解生成氢气和氧气,可证明水是由氢元素和氧元素组成的,选项正确;
D、镁比铁反应快,说明镁比铁的金属活动性强,选项正确。
故选A。
9.C
【分析】
根据微观示意图可知,反应物甲的分子为3个H原子和1个N原子构成的NH3分子,乙物质的分子为由2个O原子构成的O2分子;生成物丙为由2个N原子构成的N2分子,物质丁的分子为由2个H原子和1个O原子构成的H2O分子;则示意图所表示的反应为氨气与氧气反应生成氮气和水,该反应的化学方程式为4NH3+3O22N2+6H2O。
【详解】
A、根据化学方程式4NH3+3O22N2+6H2O可知,甲是NH3由氮和氢两种元素组成,故正确;
B、根据化学方程式4NH3+3O22N2+6H2O可知,反应符合置换反应的单质与化合物生成单质与化合物的特点,该反应为置换反应,故正确;
C、根据反应的化学方程式为4NH3+3O22N2+6H2O,反应中甲物质氨气与乙物质氧气的质量比=68:96=17:24≠17:32,故不正确;
D、化学反应前后元素的质量不变,根据化学方程式4NH3+3O22N2+6H2O可知,只有反应的甲和生成的丙中含有氮元素,故正确。
故选C。
10.B
【详解】
A、锌与稀硫酸反应生成硫酸锌和氢气,最后稀硫酸过量,pH一直小于7,不会大于7,不符合题意;
B、锌与稀硫酸反应:,65份的锌置换出2份的氢气,溶液质量逐渐增加,待完全反应后,不再变化,符合题意;
C、锌与稀硫酸反应生成硫酸锌和氢气,溶液中存在锌离子、氢离子、硫酸根离子,溶液的导电性不会减少至零,不符合题意;
D、锌与稀硫酸反应生成硫酸锌和氢气,一开始就有氢气生成,生成氢气的体积从零开始增加,待完全反应后,不再变化,不符合题意。
故选B。
A
【分析】该的微观示意图是镁和二氧化碳反应,化学方程式为。
【详解】
A、从反应方程式分析,参加反应的“”和“”的微粒个数比是2:1,A错误;
B、从反应方程式分析,该反应是单质和化合物反应生成单质和化合物,属于置换反应,B正确;
C、该反应是置换反应,镁元素和碳元素的化合价在反应前后发生了变化,只有氧元素的化合价没有发生变化,C正确;
D、该反应是镁在二氧化碳中燃烧,说明燃烧不定需要氧气,D正确。故选A。
12.B
【分析】
由图可知,该反应为硫化氢在氧气中燃烧生成二氧化硫和水,该反应的化学方程式为:。
【详解】
A、该反应的生成物都是化合物,不属于置换反应,不符合题意;
B、硫化氢中氢元素显+1价,根据化合物中,正、负化合价代数和为零,硫元素显-2价,二氧化硫中硫元素显+4价,故反应后,硫元素化合价升高,符合题意;
C、生成物中有二氧化硫分子和水分子两种分子,不符合题意;
D、由化学方程式可知,参加反应的甲、乙分子个数比为:2:3,不符合题意。
故选B。
13.B
【详解】
A、吹胀气球是因为压缩了气体,压强增大,才能将气体吹进气球,压强大了,分子间距离就一定小了。气球长大是因为其中吹入了过多的气体分子,不是间距大了,而是分子数目多了。该选项说法不正确;
B、混衣服晾干,是因为水分子是不断运动的,该选项说法正确;
C、真金不怕火炼,说明金的化学性质不活泼,该选项说法不正确;
D、铁比铝抗腐蚀性能较差,是因为铝能和空气中的氧气反应生成氧化铝保护膜,而铝比铁活泼,该选项说法不正确。
故选B。
14.D
【详解】
试题分析:由于两种金属都能和盐酸反应,且盐酸足量,相等质量的金属完全反应时得到的氢气不同,得到的氢气应该是镁对应的更多;根据金属活动性强弱关系镁>铁,可判断镁与稀盐酸反应快,铁与稀盐酸反应慢,即金属镁的反应时间最短最先完成、铁完成的反应消耗时间长;而产生的氢气的质量= ×金属质量,二者的化合价相等,镁的相对原子质量小,镁与稀盐酸反应生成的氢气多,故D正确。
15.C
【详解】
A、物质与氧气的反应一定是氧化反应,但是氧化反应不一定是物质与氧气的反应,如氢气还原氧化铜,不符合题意;
B、由一种分子构成的物质一定是纯净物,但是纯净物不一定由一种分子构成,如铁由原子构成,不符合题意;
C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化,符合题意;
D、置换反应中一定生成单质和化合物,有单质和化合物生成的反应不一定是置换反应,如氯酸钾分解生成氯化钾和氧气,属于分解反应,不符合题意。
故选C。
16.C
【详解】
A、铁不能和氯化锌反应,因此滤液中一定含有锌离子,该选项说法正确;
B、滤液M中至少含锌离子、亚铁离子等2种金属阳离子,该选项说法正确;
C、滤渣N中含有Cu,不可能含有Zn,该选项说法不正确;
D、滤渣N的质量可能等于加入铁粉的质量,例如铁和氯化铜反应后滤渣质量增大,和稀盐酸反应后滤渣质量减小,当两种情况下增加的质量和减小的质量相等时,滤渣N的质量等于加入铁粉的质量,该选项说法正确。
故选C。
17.Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
【详解】
(1)方案②中,铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式:Fe+H2SO4=FeSO4+H2↑;
(2)以上两个实验方案中,选择的是②,理由:不产生气泡时,说明铁完全反应,便于观察是否除尽;
(3)两个方案中过滤需要的仪器:漏斗、烧杯、玻璃棒、铁架台(带铁圈);
(4) 详见答案;
(5)铁能被磁铁吸引,铜不能被磁铁吸引。更简单的方法是用磁铁吸引。
18.Al 铁原子 过滤 Cu、Zn、Fe Fe 或 Zn+ H2SO4 =ZnSO4 + H2↑
【详解】
(1)地壳中含量最多的金属元素是铝,金属有原子构成,保持其化学性质的粒子是原子,所以本题答案为:铝,铁原子;
(2)钛与稀硫酸能生成氢气,说明钛在氢前,镁能与反应,说明镁在钛的前面,所以本题答案为:;
(3)①操作1得到了固体和液体,说明是过滤操作,废液含有、、,加入过量的锌粉,则锌能将铜和铁置换出来还有剩余,剩余固体A中含有锌、铜和铁,所以本题答案为:过滤,Cu、Zn、Fe;
②铁能被磁铁吸引,而锌和铜不可以,得到的固体B加硫酸能得到铜,故B中含有锌和铜,而C中含有的是铁,锌能与硫酸反应生成硫酸锌,所以本题答案为:Fe,;
③加入过量锌粉能与硫酸铜反应生成硫酸锌和铜,能与硫酸亚铁反应生成铁和硫酸锌,所以本题答案为:
或;
④加入足量稀硫酸时能与锌反应生成硫酸锌和氢气,所以本题答案为:。
19.过滤 Cu、Fe Fe2+ Fe+CuSO4=FeSO4+Cu 置换 Fe>Ni>Cu Cu、Fe 418.0g 90%
【详解】
⑴、因为是分离可溶性物质和难溶性物质,所以操作①的名称是过滤。
⑵、金属板放到足量硫酸中,得到滤液和滤渣,滤液中含有Fe2+离子和镍离子;滤渣中含有Cu和Au,已知铜和稀硫酸、氧气在加热的情况下生成硫酸铜和水,所以滤液③是硫酸铜溶液,向硫酸铜溶液中加入足量的铁粉,与硫酸铜反应生成硫酸亚铁和铜,所以物体A中铜和铁,固体A的化学式为:Fe、Cu;滤液中含有的镍离子与过量的铁粉反应生成镍和Fe2+离子,所以滤液②中所含的金属阳离子为Fe2+离子。
⑶、滤液③是硫酸铜溶液,向硫酸铜溶液中加入足量的铁粉,与硫酸铜反应生成硫酸亚铁和铜,其化学反应方程式为:;因为此反应由一种单质和一种化合物反应,生成另外一种单质和另外一种化合物,所以该反应的基本类型为置换反应。
⑷、金属板放到足量硫酸中,得到滤液和滤渣,滤液中含有Fe2+离子和镍离子,滤液中含有的镍离子与过量的铁粉反应生成镍和Fe2+离子,这就证明带金属活动顺序表中,Fe在Ni之前,Ni在H之前,而Cu在H之后,所以Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是Fe>Ni>Cu。
⑸、金属锌、铜、铁三种元素在金属活动顺序表中,前后顺序是锌、铁、铜,锌能够与硝酸铜和硝酸铁溶液反应置换出铜和铁,如果滤液中只有一种物质,那只能是硝酸锌,此时,锌把溶液中的铜离子和铁离子全部置换出来,所以被渣中一定含有铜和铁。
⑹、由实验数据对比可知,第一次,第二次每100g稀硫酸反应生成氢气的质量为0.8g,第三次生成氢气的质量为:218.4g+100g-318.0g=0.4g<0.8g,说明第三次稀硫酸有剩余,铝完全发生了反应,第四次加入的稀硫酸不反应,杯中剩余物的质量应为m=318.0g+100g=418.0g;
由表中的数据可知,生成氢气的质量为:20g+300g-318.0g=2.0g,设20g样品中铝的质量为x,
该样品中铝的质量分数为:
20.Cu +2AgNO3 == Cu(NO3)2 + 2Ag Zn〉Cu〉Ag 和Fe〉Cu〉Ag TiO2 防止镁被氧化 Mg和Cl2
【详解】
本题考查了金属活动性的探究和在生产海绵钛情境下金属的性质。
(1)①在A中,由于在金属活动性顺序中铜>银,所以铜可以置换出银,生成了硫酸铜溶液,溶液变成蓝色,反应的方程式是:Cu+2AgNO3═Cu(NO3)2+2Ag;
②在A中,由于铜能把银置换出来,说明了金属的活动性是铜大于银;在B中,由于铁能把铜置换出来,说明了金属的活动性是铁大于铜;在C中,由于锌能把氢置换出来,说明了金属的活动性是锌大于氢;在D中,由于铜不能把氢置换出来,说明了金属的活动性是氢大于铜.由此可得出金属的活动性是:Zn>Cu>Ag和Fe>Cu>Ag;
(2)①该工艺流程所使用的原料中,TiO2由两种元素组成且有一种是氧元素,属于氧化物;
②该反应需要在氩气环境中进行,因为镁比较活泼,容易被氧化,利用氩气做保护气, 防止镁被氧化;
③既是反应物,也是生成物的物质可以循环使用,由工艺流程图可知生成物中的镁和氯气可循环使用。
21.长颈漏斗 固体颜色由暗紫色变为黑色 2KMnO4K2MnO4+MnO2+O2↑ 能随时控制反应的发生和停止 C 4.4 80%
【详解】
(1)②仪器的名称是长颈漏斗。
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故用A装置制取氧气,则①中可观察到的现象是固体颜色由暗紫色变为黑色;该反应的化学方程式为2KMnO4K2MnO4+MnO2+O2↑。
(3)B和C装置均可制取CO2,与B相比较,C装置含有多孔隔板,在多孔隔板上方放置反应的固体块状药品,多空隔板下方用分液漏斗连通 ,再注入液体药品使液体与固体接触反应。想停止时,关闭导气管的橡胶开关,内部因继续反应产生气体使压强增大,会把液体压到隔板以下使其不与固体接触,停止反应,故主要优点能随时控制反应的发生和停止。
(4)锌和稀硫酸反应生成硫酸锌和氢气,C装置能随时控制反应的发生和停止,若实验室要制取少量氢气最好选择发生装置C;若用试管排空气法收集氢气,在D处方框中装置图为。
(5)①由表格数据可以知道,5g石灰石样品完全反应生成1.76g二氧化碳,第3次加15g石灰石产生4.4g二氧化碳,可以知道第3次样品有剩余,盐酸完全反应,因为第4次与第3次酸的质量一样多,所以生成气体一样,故表格中m的数值是4.4。
②设5g石灰石中碳酸钙的质量分数为x
故石灰石中碳酸钙的质量分数80%。
22.Cu2O CuO+H2SO4==CuSO4+H2O 在金属活动性顺序中,铜排在氢的后面 途径Ⅰ,原料之一是空气,生产成本较低;或途径Ⅱ反应不需加热 ,节约能源或操作相对简单 冷却 17Kg
铜的质量为:800Kg×4%=32Kg
设参加反应的过氧化氢的质量为x
Cu + H2O2 +H2SO4 =CuSO4+2H2O
64 34
32kg x
64/34=32kg/x
x=17Kg
【详解】
(1)若步骤一根据铜元素的化合价,其氧化物的化学式为Cu2O;
(2)氧化铜与稀硫酸反应的化学方程式为:CuO+H2SO4=CuSO4+H2O;
(3)铜不能与稀硫酸直接发生置换反应的原因是在金属活动性顺序中,铜排在氢的后面;
(4)认为更适于实际应用的途径是途径Ⅰ,原料之一是空气,生产成本较低;或途径Ⅱ反应不需加热 ,节约能源或操作相对简单;
(5)因为硝酸钠的溶解度受温度影响较大,故采用冷却结晶;
(6)铜的质量为:800Kg×4%=32Kg
设参加反应的过氧化氢的质量为x
Cu + H2O2 +H2SO4 =CuSO4+2H2O
64 34
32kg x
64/34=32kg/x
x=17Kg
答:参加反应的过氧化氢的质量为17kg
