备战2022 浙教版科学 中考一轮 第30课时 空气、氧气、二氧化碳(一) 知识梳理(课件 23张ppt)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮 第30课时 空气、氧气、二氧化碳(一) 知识梳理(课件 23张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-28 10:58:07 | ||
图片预览







文档简介
(共24张PPT)
第30课时 空气、氧气、二氧化碳(一)
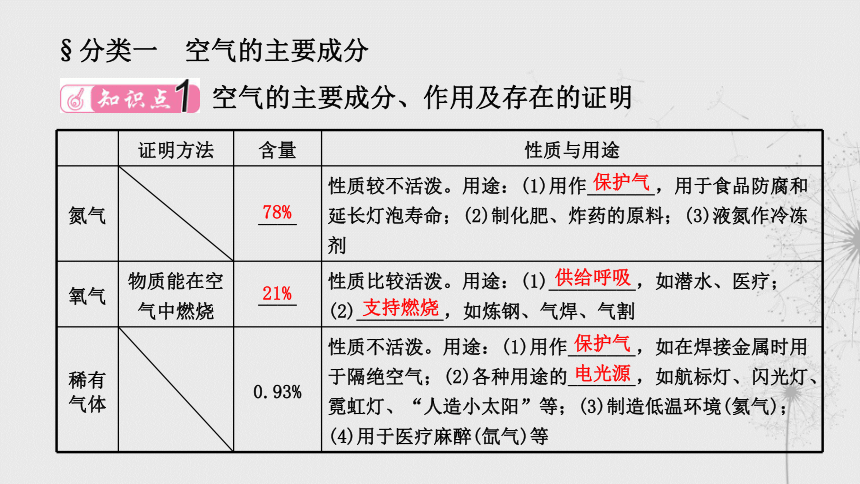
§分类一 空气的主要成分
空气的主要成分、作用及存在的证明
证明方法 含量 性质与用途
氮气 ____ 性质较不活泼。用途:(1)用作_______,用于食品防腐和延长灯泡寿命;(2)制化肥、炸药的原料;(3)液氮作冷冻剂
氧气 物质能在空气中燃烧 ____ 性质比较活泼。用途:(1)_________,如潜水、医疗;(2)_________,如炼钢、气焊、气割
稀有
气体 0.93% 性质不活泼。用途:(1)用作_______,如在焊接金属时用于隔绝空气;(2)各种用途的_______,如航标灯、闪光灯、霓虹灯、“人造小太阳”等;(3)制造低温环境(氦气);(4)用于医疗麻醉(氙气)等
78%
保护气
21%
供给呼吸
支持燃烧
保护气
电光源
证明方法 含量 性质与用途
二氧
化碳 空气通入石灰水中,石灰水会变浑浊 0.04% 用途:(1)是_________ 的原料;(2)固态CO2(俗称
_____)作制冷剂;(3)工业上用于制纯碱、尿素、汽水
水蒸气 无水硫酸铜暴露于空气中会变蓝 成云致雨的原料
光合作用
干冰
测定空气中氧气的含量
1.测定原理:用_____(或_____)在密闭的容器中燃烧,消耗氧
气,生成 _______________(填名称与状态),容器内压强减小,
打开止水夹,烧杯中的水在_______的作用下,被压入瓶内,进
入瓶内水的体积就代表了___________的体积。
红磷
白磷
五氧化二磷固体
大气压
被消耗氧气
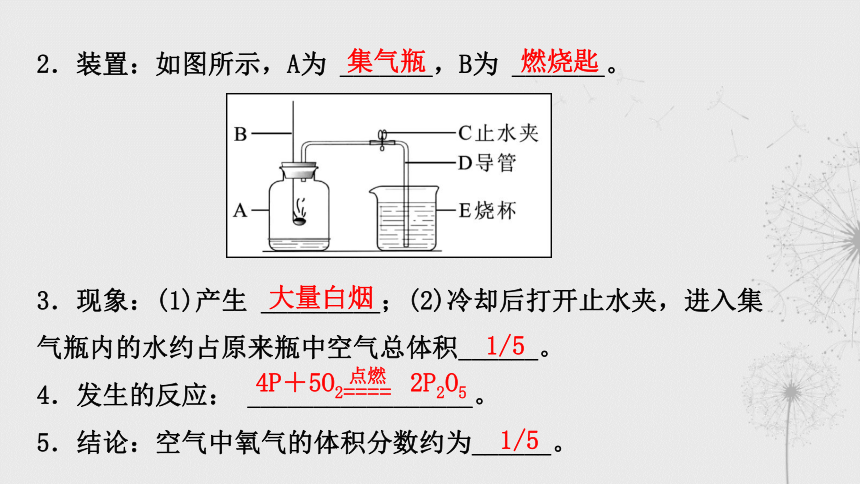
2.装置:如图所示,A为 _______,B为 _______。
3.现象:(1)产生 _________;(2)冷却后打开止水夹,进入集
气瓶内的水约占原来瓶中空气总体积______。
4.发生的反应: _________________。
5.结论:空气中氧气的体积分数约为______。
====
点燃
集气瓶
燃烧匙
大量白烟
1/5
4P+5O2 2P2O5
1/5
§分类二 氧气
氧气的主要物理性质
1.氧气是一种无色无味的气体。
2.密度比空气 _____,故可以用 ___________法收集氧气。
3._______溶于水,故可以用_______法收集氧气;另外水中生
物过多易_______也是这个原因。
4.降温可以变成液态,液态氧呈_______色。
略大
向上排空气
不易
排水
缺氧
淡蓝
氧气的主要化学性质
1.氧气是一种化学性质 _________的气体,能与许多物质发生反应。
2.部分物质在空气和氧气中反应的现象对比(如下表所示)
比较活泼
反应物 反应物
颜色 在空气中燃烧的现象 在氧气中燃烧的现象 与氧气反应的化学方程式
木炭 黑色 木炭红热,放热,生成
_____________________
的气体 _________,_______
___,_____,_______
___________________
_______ ____________
硫 黄色 产生微弱的___________,放热,生成___________
___的气体 ___________________
___,_____,_________
_______________ ____________
===
点燃
===
点燃
能使澄清石灰水变浑浊
剧烈燃烧
发出白
光
放热
生成能
使澄清石灰水变浑浊
的气体
C+O2 CO2
淡蓝色火焰
有刺激性气
味
产生明亮的蓝紫色火
焰
放热
生成有刺
激性气味的气体
S+O2 SO2
反应物 反应物
颜色 在空气中燃烧的现象 在氧气中燃烧的现象 与氧气反应的化学方程式
红磷 暗红色 放热,产生_________ 发出白光(产生的白烟很浓,常掩盖了火光),放热,产生_________ _____________
_____
铁 银白色 在空气中不会燃烧 _________,_______
___,_____,_______
_______ _____________
_____
===
点燃
===
点燃
大量白烟
大量白烟
4P+5O2
2P2O5
剧烈燃烧
火星四
射
放热
生成黑
色固体
3Fe+2O2
Fe3O4
【注意】 “烟”与“雾”的区别,烟是固体小颗粒悬浮在空气中形成的现象,雾是小液滴悬浮在空气中形成的现象。
“光”与“火焰”的区别:火焰是气态物质燃烧时产生的特有现象。易汽化的固体、液体,燃烧时除发光发热外都有火焰,如氢气、酒精、硫等,而不易汽化的可燃物如铁,燃烧时则只会发光(或火星四射)而没有火焰。
氧气的用途及与其性质的关系
在下图氧气的各种用途中,利用氧气能供给呼吸的是_________
_______________,利用氧气能支持燃烧的是 _______________
_________。
医疗、登
山、潜水、宇航
航空、炼钢、宇
航、气焊
氧气的实验室制备及检验方法
1.制氧气的步骤:
查——装——定——点——收——移——熄
(1)查:检查装置的气密性
图①中观察到_________________,图②中观察到_____________
_________________,表示装置气密性良好。
导管口有气泡冒出
分液漏斗中形
成一段稳定的水柱
(2)装:装入药品,固体粉末可用_____送入试管。用高锰酸钾制
氧气,还要在试管口塞_________,防止_________________。
纸槽
一团棉花
固体粉末进入导管
(3)定:固定装置,试管口_____________,防止_____________
_________。
(4)点:点燃酒精灯,要先 _________,然后用外焰对着药品部
位加热。
(5)收:_______或_____________收集氧气。若是排水法收集,
要等到 _____________后收集;若是用向上排空气法收集,则
需 _______________________,以提高收集气体的纯度。
(6)移:将导管从水槽中拿出。
(7)熄:熄灭酒精灯。
要略向下倾斜
冷凝水倒流使
试管破裂
均匀预热
排水法
向上排空气法
气泡均匀冒出
将导管伸入到集气瓶底部
【注意】 (6)(7)调换顺序会使水倒流进入试管,造成试管破
裂。
2.验满与检验操作的区别:验满时要将带火星的木条放在
_________,检验则要将带火星的木条____________________
____。
集气瓶口
伸入到气体中(集气瓶
中)
工业制氧气的方法:空气冷冻分
离法
1.原理:利用氧气与氮气的_______不同。
2.变化:属于 _________。
3.过程:
沸点
物理变化
催化剂的概念及在化学反应中的作用
1.概念:在化学反应中,只改变其他物质的反应速率,本身的
_______和 __________在反应前后都没有发生改变的物质。
2.特征:一变(改变___________);二不变( ___________与
___________)。
质量
化学性质
反应速率
本身的质量
化学性质
缓慢氧化、剧烈氧化(燃烧、爆炸)、自燃,燃烧的条件及灭火、火灾自救
1.燃烧必须同时满足的三个条件:一是有_______;二是要有
_______,常用的助燃剂为_____;三是温度达到可燃物的_____
___。
由此可知,灭火的方法:一是 ___________,二是 _________,
三是 _____________________________。
可燃物
助燃剂
氧气
着火
点
撤去可燃物
隔绝空气
将可燃物温度降到其着火点以下
2.火灾自救
急速离开现场,沿途要_______,以减低火势及烟雾蔓延的速度,
同时切勿 _______以免停电被困;无法离开火灾现场时,应采取
下列措施自救:
(1)室内浓烟密布时,应 _______________________________。
(2)暂时躲在室内时要 _________________________________,
以免浓烟渗入。
(3)打开窗户,在窗前呼救,不可盲目跳楼。
关上门
乘电梯
用湿毛巾掩盖口鼻俯伏在地上爬行
用湿毛巾等物品封住门和窗户的缝隙
第30课时 空气、氧气、二氧化碳(一)
§分类一 空气的主要成分
空气的主要成分、作用及存在的证明
证明方法 含量 性质与用途
氮气 ____ 性质较不活泼。用途:(1)用作_______,用于食品防腐和延长灯泡寿命;(2)制化肥、炸药的原料;(3)液氮作冷冻剂
氧气 物质能在空气中燃烧 ____ 性质比较活泼。用途:(1)_________,如潜水、医疗;(2)_________,如炼钢、气焊、气割
稀有
气体 0.93% 性质不活泼。用途:(1)用作_______,如在焊接金属时用于隔绝空气;(2)各种用途的_______,如航标灯、闪光灯、霓虹灯、“人造小太阳”等;(3)制造低温环境(氦气);(4)用于医疗麻醉(氙气)等
78%
保护气
21%
供给呼吸
支持燃烧
保护气
电光源
证明方法 含量 性质与用途
二氧
化碳 空气通入石灰水中,石灰水会变浑浊 0.04% 用途:(1)是_________ 的原料;(2)固态CO2(俗称
_____)作制冷剂;(3)工业上用于制纯碱、尿素、汽水
水蒸气 无水硫酸铜暴露于空气中会变蓝 成云致雨的原料
光合作用
干冰
测定空气中氧气的含量
1.测定原理:用_____(或_____)在密闭的容器中燃烧,消耗氧
气,生成 _______________(填名称与状态),容器内压强减小,
打开止水夹,烧杯中的水在_______的作用下,被压入瓶内,进
入瓶内水的体积就代表了___________的体积。
红磷
白磷
五氧化二磷固体
大气压
被消耗氧气
2.装置:如图所示,A为 _______,B为 _______。
3.现象:(1)产生 _________;(2)冷却后打开止水夹,进入集
气瓶内的水约占原来瓶中空气总体积______。
4.发生的反应: _________________。
5.结论:空气中氧气的体积分数约为______。
====
点燃
集气瓶
燃烧匙
大量白烟
1/5
4P+5O2 2P2O5
1/5
§分类二 氧气
氧气的主要物理性质
1.氧气是一种无色无味的气体。
2.密度比空气 _____,故可以用 ___________法收集氧气。
3._______溶于水,故可以用_______法收集氧气;另外水中生
物过多易_______也是这个原因。
4.降温可以变成液态,液态氧呈_______色。
略大
向上排空气
不易
排水
缺氧
淡蓝
氧气的主要化学性质
1.氧气是一种化学性质 _________的气体,能与许多物质发生反应。
2.部分物质在空气和氧气中反应的现象对比(如下表所示)
比较活泼
反应物 反应物
颜色 在空气中燃烧的现象 在氧气中燃烧的现象 与氧气反应的化学方程式
木炭 黑色 木炭红热,放热,生成
_____________________
的气体 _________,_______
___,_____,_______
___________________
_______ ____________
硫 黄色 产生微弱的___________,放热,生成___________
___的气体 ___________________
___,_____,_________
_______________ ____________
===
点燃
===
点燃
能使澄清石灰水变浑浊
剧烈燃烧
发出白
光
放热
生成能
使澄清石灰水变浑浊
的气体
C+O2 CO2
淡蓝色火焰
有刺激性气
味
产生明亮的蓝紫色火
焰
放热
生成有刺
激性气味的气体
S+O2 SO2
反应物 反应物
颜色 在空气中燃烧的现象 在氧气中燃烧的现象 与氧气反应的化学方程式
红磷 暗红色 放热,产生_________ 发出白光(产生的白烟很浓,常掩盖了火光),放热,产生_________ _____________
_____
铁 银白色 在空气中不会燃烧 _________,_______
___,_____,_______
_______ _____________
_____
===
点燃
===
点燃
大量白烟
大量白烟
4P+5O2
2P2O5
剧烈燃烧
火星四
射
放热
生成黑
色固体
3Fe+2O2
Fe3O4
【注意】 “烟”与“雾”的区别,烟是固体小颗粒悬浮在空气中形成的现象,雾是小液滴悬浮在空气中形成的现象。
“光”与“火焰”的区别:火焰是气态物质燃烧时产生的特有现象。易汽化的固体、液体,燃烧时除发光发热外都有火焰,如氢气、酒精、硫等,而不易汽化的可燃物如铁,燃烧时则只会发光(或火星四射)而没有火焰。
氧气的用途及与其性质的关系
在下图氧气的各种用途中,利用氧气能供给呼吸的是_________
_______________,利用氧气能支持燃烧的是 _______________
_________。
医疗、登
山、潜水、宇航
航空、炼钢、宇
航、气焊
氧气的实验室制备及检验方法
1.制氧气的步骤:
查——装——定——点——收——移——熄
(1)查:检查装置的气密性
图①中观察到_________________,图②中观察到_____________
_________________,表示装置气密性良好。
导管口有气泡冒出
分液漏斗中形
成一段稳定的水柱
(2)装:装入药品,固体粉末可用_____送入试管。用高锰酸钾制
氧气,还要在试管口塞_________,防止_________________。
纸槽
一团棉花
固体粉末进入导管
(3)定:固定装置,试管口_____________,防止_____________
_________。
(4)点:点燃酒精灯,要先 _________,然后用外焰对着药品部
位加热。
(5)收:_______或_____________收集氧气。若是排水法收集,
要等到 _____________后收集;若是用向上排空气法收集,则
需 _______________________,以提高收集气体的纯度。
(6)移:将导管从水槽中拿出。
(7)熄:熄灭酒精灯。
要略向下倾斜
冷凝水倒流使
试管破裂
均匀预热
排水法
向上排空气法
气泡均匀冒出
将导管伸入到集气瓶底部
【注意】 (6)(7)调换顺序会使水倒流进入试管,造成试管破
裂。
2.验满与检验操作的区别:验满时要将带火星的木条放在
_________,检验则要将带火星的木条____________________
____。
集气瓶口
伸入到气体中(集气瓶
中)
工业制氧气的方法:空气冷冻分
离法
1.原理:利用氧气与氮气的_______不同。
2.变化:属于 _________。
3.过程:
沸点
物理变化
催化剂的概念及在化学反应中的作用
1.概念:在化学反应中,只改变其他物质的反应速率,本身的
_______和 __________在反应前后都没有发生改变的物质。
2.特征:一变(改变___________);二不变( ___________与
___________)。
质量
化学性质
反应速率
本身的质量
化学性质
缓慢氧化、剧烈氧化(燃烧、爆炸)、自燃,燃烧的条件及灭火、火灾自救
1.燃烧必须同时满足的三个条件:一是有_______;二是要有
_______,常用的助燃剂为_____;三是温度达到可燃物的_____
___。
由此可知,灭火的方法:一是 ___________,二是 _________,
三是 _____________________________。
可燃物
助燃剂
氧气
着火
点
撤去可燃物
隔绝空气
将可燃物温度降到其着火点以下
2.火灾自救
急速离开现场,沿途要_______,以减低火势及烟雾蔓延的速度,
同时切勿 _______以免停电被困;无法离开火灾现场时,应采取
下列措施自救:
(1)室内浓烟密布时,应 _______________________________。
(2)暂时躲在室内时要 _________________________________,
以免浓烟渗入。
(3)打开窗户,在窗前呼救,不可盲目跳楼。
关上门
乘电梯
用湿毛巾掩盖口鼻俯伏在地上爬行
用湿毛巾等物品封住门和窗户的缝隙
同课章节目录
