备战2022 浙教版科学 中考一轮 第28课时 物质的变化与性质 知识梳理(课件 22张ppt)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮 第28课时 物质的变化与性质 知识梳理(课件 22张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-28 10:59:20 | ||
图片预览








文档简介
(共22张PPT)
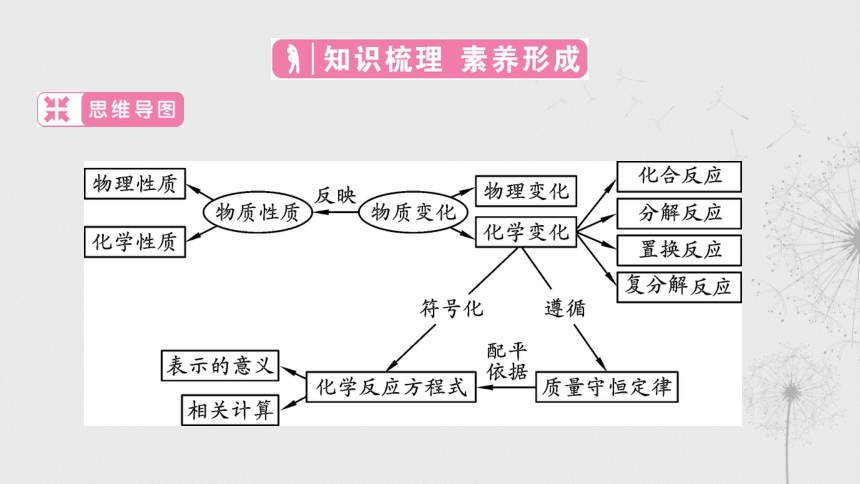
第28课时 物质的变化与性质
§分类一 物质的变化 (七上第4章第8节)
物质的物理变化与化学变化
物理变化 化学变化
区别 概念 _____________生成的变化 ___________生成的变化
微观 构成物质的分子本身_______,
只是分子之间的_______改变 构成物质的分子本身_____
现象 一般是物质的颜色、状态等变化 伴随有发光、放热、变色、
产生_____或_____等现象
实例 水蒸发、蜡烛受热熔化等 水电解、蜡烛燃烧、铁生锈等
判断依据 ①宏观角度:是否有_________生成
②微观角度:构成物质的___________是否发生改变
没有新物质
有新物质
不变
间隙
改变
气体
沉淀
新物质
分子本身
§分类二 物质的性质(七上第4章第8节)
物质的物理性质和化学性质
物理性质 化学性质
概念 物质_____________________就能表现出来的性质 物质在___________过程中表现出来的性质
内容 颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性、导电性、导热性、延展性等 _________、_________、助燃性、稳定性、氧化性、还原性、毒性等
判断 直接观察或用物理方法测定 利用化学变化来观察和测定
变化、性质与
用途的关系
不需要发生化学变化
化学变化
酸碱性
可燃性
§分类三 质量守恒定律 (八下第3章第3节)
应用质量守恒定律解释常见现象,从微观角度解释质量守恒定律
1.内容:在化学反应中,_____________的各物质的质量总和
等于 ___________的各物质的质量总和。一切化学反应都遵循
这个规律。
参加化学反应
反应后生成
2.实质(微观解释):化学反应的过程就是反应物分子里的原
子 _________成生成物分子的过程。反应前后原子的_______和
_______既没有改变也没有增减,所以原子的质量没有变化,化
学反应前后各物质的质量总和必然相等。
重新组合
种类
数目
化学反应中的守恒与变化
§分类四 化学反应方程式 (八下第3章第3节)
常见的化学反应方程式
1.定义:用化学式来表示化学反应的方程式。
2.书写化学方程式的原则
(1)以客观事实为依据写出反应物和生成物,化学式书写以
_________为依据。
(2)要遵循___________定律,通过配平使式子左、右两边各
原子的 ___________相等。
(3)说明反应条件和生成物的状态。
化合价
质量守恒
种类与数目
化学反应方程式表示的意义
以碳在氧气中燃烧为例:C+O2 CO2
参加反应的物质是 _________;生成的物质是 _________;各
物质间微粒的个数比为 ________;反应物、生成物各物质间的
质量比为 _________;反应进行的条件是_______。
====
点燃
碳和氧气
二氧化碳
1∶1∶1
3∶8∶11
点燃
化学方程式的有关计算
1.计算原理
化学反应方程式表示出反应物和生成物之间的质量比是一定的。
2.解题步骤
(1)设:设未知量;
(2)写:写出反应的化学方程式(一定要仔细检查方程式是否配平);
(3)找:找出题中的已知量和未知量;
(4)标:在相应位置标出有关物质的相对分子质量,以及相关的量;
(5)列:列出比例式并求解;
(6)答:简明地写出答案。
3.计算题型
(1)由一种纯净的反应物(或生成物)的质量求生成物(或反应物)的质量;
(2)含一定杂质(杂质不参加反应)的反应物或生成物的量的计算。
【注意】 ①代入方程式计算的必须是纯净物质量,纯净物质量=混合物质量× 物质的质量分数 。
②代入方程式计算的必须是真正参加反应或反应后生成的物质质量。
③若涉及物质的体积,可用公式:质量=密度×体积,进行换算。
§分类五 化学反应的基本类型
四大基本反应类型的特点
练习1:海绵铁是多孔隙的块状固体物质,主要成分是铁单质,常用
于除去工业循环冷却水中的溶解氧,当含有氧气的水通过海绵铁
时,其中铁单质跟氧气等物质发生化合反应,生成不溶于水的红
褐色氢氧化物。请回答:
(1)写出上述生成红褐色氢氧化物的化学方程式:___________
_______________。
(2)海绵铁除去溶解氧的反应中,氧气表现了_____(填“氧化”
或“还原”)性,跟成分相同的普通铁块相比较,海绵铁除氧效果
要好得多,原因是_______________________________________
_______________________。
4Fe+6H2O+
3O2=== 4Fe(OH)3
氧化
海绵铁中多孔隙,增大了跟反应物的接触面
积,从而加快了反应速率
练习2:某兴趣小组设计如下实验探究质量守恒定律。
(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取
下烧杯,把铁钉放入试管中,一段时间后,再把烧杯放回天平左
盘,最后天平是否平衡?_____。反应后试管内溶液的质量_____
(填“增加”“减少”或“不变”)。
平衡
减少
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾
斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平
左盘,发现天平不再平衡,其原因是_________________________
___。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,
装置气密性良好)。你认为能否验证质量守恒定律并阐述理由:
_________________________________________________________。
产生的二氧化碳从烧杯中逸
出
不能,气球体积变大,受到空气对它的浮力增大,天平不再平衡
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应)。(结果精确到0.1%)
练习3:我国环境空气质量标准对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限制如表所示。
浓度限值(mg/m3)
一级标准 二级标准 三级标准
0.15 0.50 0.70
为测定当地空气中二氧化硫的含量,某校环保小组按上图所示的装置进行实验:向装置中加入含碘 1.27mg 的碘溶液,再加入 2~3滴淀粉溶液, 通过抽气装置抽气, 使空气由导气管进入装置与碘溶液充分反应(反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)。
(1)实验时,空气应该从____(填“a”或“b”)端进入装置。
(2)已知 H2SO4 和 HI 均为无色溶液,且不与碘发生反应。当装
置内出现 _______________________(填现象),说明恰好完全反应。
a
溶液刚好由蓝色变为无色
(3)当实验过程中进入装置内的空气的总体积为1000L时,恰好完全反应。请通过计算判断此空气中二氧化硫的浓度级别。
第28课时 物质的变化与性质
§分类一 物质的变化 (七上第4章第8节)
物质的物理变化与化学变化
物理变化 化学变化
区别 概念 _____________生成的变化 ___________生成的变化
微观 构成物质的分子本身_______,
只是分子之间的_______改变 构成物质的分子本身_____
现象 一般是物质的颜色、状态等变化 伴随有发光、放热、变色、
产生_____或_____等现象
实例 水蒸发、蜡烛受热熔化等 水电解、蜡烛燃烧、铁生锈等
判断依据 ①宏观角度:是否有_________生成
②微观角度:构成物质的___________是否发生改变
没有新物质
有新物质
不变
间隙
改变
气体
沉淀
新物质
分子本身
§分类二 物质的性质(七上第4章第8节)
物质的物理性质和化学性质
物理性质 化学性质
概念 物质_____________________就能表现出来的性质 物质在___________过程中表现出来的性质
内容 颜色、状态、气味、密度、硬度、熔点、沸点、溶解性、挥发性、导电性、导热性、延展性等 _________、_________、助燃性、稳定性、氧化性、还原性、毒性等
判断 直接观察或用物理方法测定 利用化学变化来观察和测定
变化、性质与
用途的关系
不需要发生化学变化
化学变化
酸碱性
可燃性
§分类三 质量守恒定律 (八下第3章第3节)
应用质量守恒定律解释常见现象,从微观角度解释质量守恒定律
1.内容:在化学反应中,_____________的各物质的质量总和
等于 ___________的各物质的质量总和。一切化学反应都遵循
这个规律。
参加化学反应
反应后生成
2.实质(微观解释):化学反应的过程就是反应物分子里的原
子 _________成生成物分子的过程。反应前后原子的_______和
_______既没有改变也没有增减,所以原子的质量没有变化,化
学反应前后各物质的质量总和必然相等。
重新组合
种类
数目
化学反应中的守恒与变化
§分类四 化学反应方程式 (八下第3章第3节)
常见的化学反应方程式
1.定义:用化学式来表示化学反应的方程式。
2.书写化学方程式的原则
(1)以客观事实为依据写出反应物和生成物,化学式书写以
_________为依据。
(2)要遵循___________定律,通过配平使式子左、右两边各
原子的 ___________相等。
(3)说明反应条件和生成物的状态。
化合价
质量守恒
种类与数目
化学反应方程式表示的意义
以碳在氧气中燃烧为例:C+O2 CO2
参加反应的物质是 _________;生成的物质是 _________;各
物质间微粒的个数比为 ________;反应物、生成物各物质间的
质量比为 _________;反应进行的条件是_______。
====
点燃
碳和氧气
二氧化碳
1∶1∶1
3∶8∶11
点燃
化学方程式的有关计算
1.计算原理
化学反应方程式表示出反应物和生成物之间的质量比是一定的。
2.解题步骤
(1)设:设未知量;
(2)写:写出反应的化学方程式(一定要仔细检查方程式是否配平);
(3)找:找出题中的已知量和未知量;
(4)标:在相应位置标出有关物质的相对分子质量,以及相关的量;
(5)列:列出比例式并求解;
(6)答:简明地写出答案。
3.计算题型
(1)由一种纯净的反应物(或生成物)的质量求生成物(或反应物)的质量;
(2)含一定杂质(杂质不参加反应)的反应物或生成物的量的计算。
【注意】 ①代入方程式计算的必须是纯净物质量,纯净物质量=混合物质量× 物质的质量分数 。
②代入方程式计算的必须是真正参加反应或反应后生成的物质质量。
③若涉及物质的体积,可用公式:质量=密度×体积,进行换算。
§分类五 化学反应的基本类型
四大基本反应类型的特点
练习1:海绵铁是多孔隙的块状固体物质,主要成分是铁单质,常用
于除去工业循环冷却水中的溶解氧,当含有氧气的水通过海绵铁
时,其中铁单质跟氧气等物质发生化合反应,生成不溶于水的红
褐色氢氧化物。请回答:
(1)写出上述生成红褐色氢氧化物的化学方程式:___________
_______________。
(2)海绵铁除去溶解氧的反应中,氧气表现了_____(填“氧化”
或“还原”)性,跟成分相同的普通铁块相比较,海绵铁除氧效果
要好得多,原因是_______________________________________
_______________________。
4Fe+6H2O+
3O2=== 4Fe(OH)3
氧化
海绵铁中多孔隙,增大了跟反应物的接触面
积,从而加快了反应速率
练习2:某兴趣小组设计如下实验探究质量守恒定律。
(1)如图甲,小柯将烧杯放在天平左盘,使天平重新平衡。然后取
下烧杯,把铁钉放入试管中,一段时间后,再把烧杯放回天平左
盘,最后天平是否平衡?_____。反应后试管内溶液的质量_____
(填“增加”“减少”或“不变”)。
平衡
减少
(2)如图乙,小妍将烧杯放在天平左盘,使天平重新平衡。然后倾
斜烧杯使盐酸与石灰石粉末混合,一段时间后再把烧杯放回天平
左盘,发现天平不再平衡,其原因是_________________________
___。小柯对该实验装置进行改进,把烧杯换成锥形瓶(如图丙,
装置气密性良好)。你认为能否验证质量守恒定律并阐述理由:
_________________________________________________________。
产生的二氧化碳从烧杯中逸
出
不能,气球体积变大,受到空气对它的浮力增大,天平不再平衡
(3)小妍想测定实验所用石灰石中碳酸钙的质量分数,取6克石灰石粉末与足量的稀盐酸充分反应,反应后总质量减少2.2克。求石灰石中碳酸钙的质量分数(杂质与稀盐酸不反应)。(结果精确到0.1%)
练习3:我国环境空气质量标准对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限制如表所示。
浓度限值(mg/m3)
一级标准 二级标准 三级标准
0.15 0.50 0.70
为测定当地空气中二氧化硫的含量,某校环保小组按上图所示的装置进行实验:向装置中加入含碘 1.27mg 的碘溶液,再加入 2~3滴淀粉溶液, 通过抽气装置抽气, 使空气由导气管进入装置与碘溶液充分反应(反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)。
(1)实验时,空气应该从____(填“a”或“b”)端进入装置。
(2)已知 H2SO4 和 HI 均为无色溶液,且不与碘发生反应。当装
置内出现 _______________________(填现象),说明恰好完全反应。
a
溶液刚好由蓝色变为无色
(3)当实验过程中进入装置内的空气的总体积为1000L时,恰好完全反应。请通过计算判断此空气中二氧化硫的浓度级别。
同课章节目录
