碳酸钠的性质与应用[1]
图片预览







文档简介
课件25张PPT。第二单元 钠、镁及其化合物第二节 碳酸钠的性质与应用小苏打 苏打 大苏打小苏打:NaHCO3
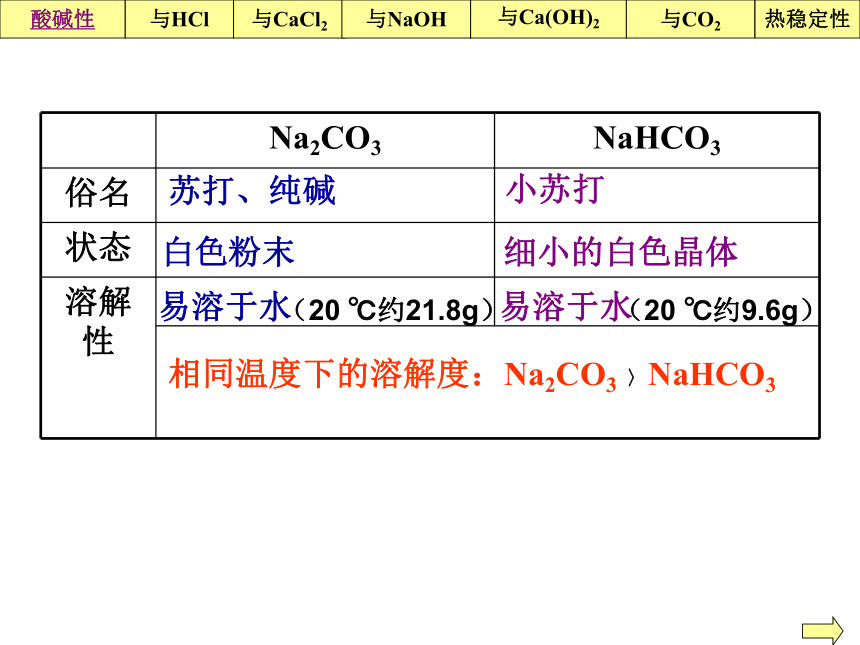
苏打: Na2CO3(又称纯碱)中国历史上著名人物“三苏”分别是谁?苏洵、苏轼、苏辙化学中也有“三苏”Na2CO3+ Ca(OH)2 =2 NaOH+ CaCO3↓Na2CO3 + CaCl2 = CaCO3 ↓ +2NaCl Na2CO3 + BaCl2 = BaCO3 ↓ +2NaCl 2 与碱反应3 与盐反应回顾初中所学知识:碳酸钠有哪些化学性质,写出反应方程式?1 与酸反应Na2CO3+ 2HCl=2 NaCl+ H2O+CO2↑一、碳酸钠与碳酸氢钠的性质俗名、颜色状态、溶解度
溶液的酸碱性
与盐酸反应
与澄清石灰水反应
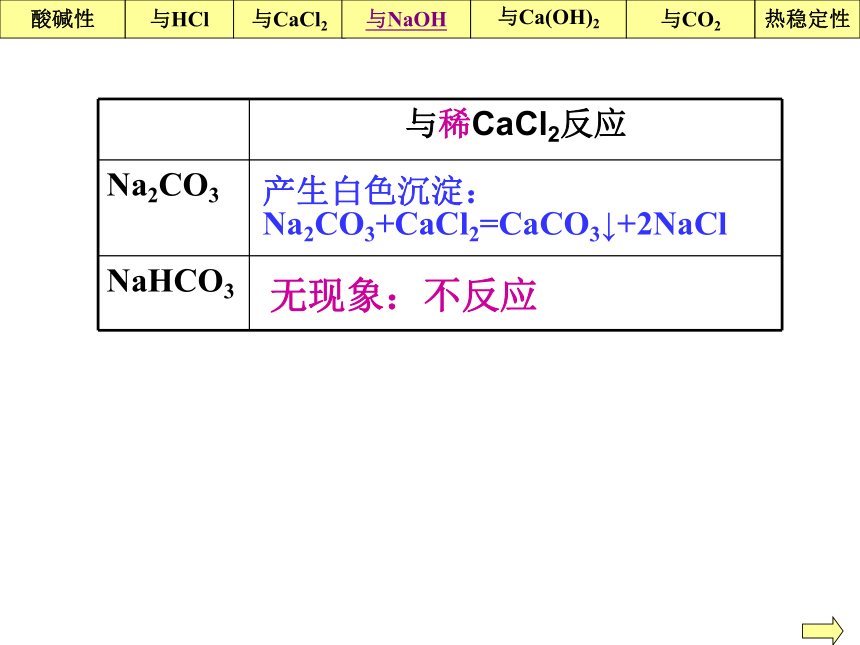
与氯化钙溶液反应
与氢氧化钠溶液反应
与二氧化碳反应
热稳定性苏打、纯碱小苏打白色粉末 细小的白色晶体易溶于水 易溶于水相同温度下的溶解度:Na2CO3 〉NaHCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl(20 ℃约21.8g)(20 ℃约9.6g)碱性碱性碱性(同浓度):Na2CO3 ﹥NaHCO3生活小常识:Na2CO3·10H2O俗称石碱,可直接用作洗涤剂。酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl石碱手工石碱香皂礼盒实验4:用热的纯碱溶液清洗沾
满油污的铜片(P51)Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O与同浓度的盐酸反应时,碳酸氢钠
反应更剧烈,放出气体的速度更快等物质的量的Na2CO3和NaHCO3与足量的盐酸反应,
生成的CO2 。等质量的Na2CO3和NaHCO3,生成的CO2 多。等质量的Na2CO3和NaHCO3, 消耗的HCl 多产生等量CO2所需HCl的量: 为 的两倍一样多NaHCO3Na2CO 3Na2CO3NaHCO3?酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl产生白色沉淀:Na2CO3+CaCl2=CaCO3↓+2NaCl无现象:不反应酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl不反应反应,但无明显现象NaHCO3+ NaOH=Na2CO3+H2O用澄清石灰水可以鉴别碳酸钠和碳酸氢钠吗?★注意:碳酸氢钠即可以跟强酸反应,又可以跟强碱反应:遇酸成酸,遇碱成盐。酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HClNa2CO3+ Ca(OH)2=CaCO3↓+2NaOH均出现白色沉淀NaHCO3+ Ca(OH)2(足量)=CaCO3 ↓+NaOH+H2O2NaHCO3(足量)+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O?CaCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HClNa2CO3 + CO2+H2O= 2NaHCO3不反应举一反三:向亚硫酸钠溶液中通入SO2气体,写出反应的方程式Na2SO3 + SO2+H2O= 2NaHSO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl实验稳定,加热时不分解不稳定,加热时易分解Na2CO3 或NaHCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl实验为了比较碳酸钠和碳酸氢钠固体的热稳定性,有同学设计了如下装置(加热、夹持等仪器略去):
⑴大试管中应盛放 固体。
⑵当A试管中溶液 ,B试管中溶液 时,可以说明碳酸钠热稳定性比碳酸氢钠强。 Na2CO3依然保持澄清变浑浊如何实现碳酸钠与碳酸氢钠的相互转化?Na2CO3 NaHCO31. 如何除去下列物质中所含的少量杂质?
⑴ 碳酸氢钠溶液中的少量碳酸钠;
⑵ 碳酸钠固体中的少量碳酸氢钠;
⑶ 二氧化碳中的少量氯化氢。通入CO2加热通过NaHCO3饱和溶液巩固练习二、碳酸钠和碳酸氢钠的用途(P52)洗涤剂;制玻璃、造纸、纺织等。制发酵粉;治疗胃酸过多;泡沫灭火剂巩固练习 2.不能用来鉴别Na2CO3和NaHCO3的方法是 ( )
A.分别加热 B.加澄清石灰
C.加稀盐酸 D.加BaCl2B中国化学工业的先驱: 在中国化学工业史上,有一位杰出的科学家,他为祖国的化工事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成 。碳酸钠侯德榜
二. 侯氏制碱法(联合制碱法)(P53)1. 原理:
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑ 2. 步骤NaHCO3NH4Cl(主要) NaCl(少量)
NaHCO3(少量)通入氨气NH4ClNaCl 根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在 5℃~10℃时,向母液中加入食盐细粉,通入NH3,而使NH4Cl单独结晶析出供做氮肥。优点:使食盐的利用率大大提高;NH4Cl可做氮肥;可与合成氨厂联合, NH3由合成氨厂提供。实验室中,用侯氏制碱原理制Na2CO3和NH4Cl的步骤为:⑴向滤液1中通入氨气的作用是
。
⑵ 操作①②的顺序_______(填能或不能)颠倒, 其原因为
________________________________________。
⑶ 连续化生产的循环步骤是 _____(填操作序号) 。不能 CO2在水中溶解度比NH3在水中溶解度小得多,而CO2在氨水中被吸收的量比在水中大。请回答:⑥通入氨气 a.增大NH4+的浓度,使NH4Cl更多的析出;b.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 3.将19g Na2CO3和NaHCO3的混合物加热到质量不再减少为止,称得剩余固体质量为15.9g,求原混合物中NaHCO3的质量分数。解:设原混合物中NaHCO3的质量为x
2NaHCO3 = Na2CO3+H2O+CO2↑ △m
168 62
x (19-15.9)g
x=8.4g
NaHCO3%= 8.4g/19g= 44.2%差量法巩固练习小结:NaNa2ONa2O2NaOHNa2CO3 NaHCO3 作业完成讲义 碳酸盐的溶解性SNa2CO3>SNaHCO3SCa(HCO3)2>SCaCO3可溶性碳酸盐 S正盐>S酸式盐不溶性碳酸盐 S酸式盐>S正盐注:碳酸盐的正盐除Na+、K+、NH4+外,多数是不溶于水的,而碳酸盐中的酸式盐却都溶于水。
苏打: Na2CO3(又称纯碱)中国历史上著名人物“三苏”分别是谁?苏洵、苏轼、苏辙化学中也有“三苏”Na2CO3+ Ca(OH)2 =2 NaOH+ CaCO3↓Na2CO3 + CaCl2 = CaCO3 ↓ +2NaCl Na2CO3 + BaCl2 = BaCO3 ↓ +2NaCl 2 与碱反应3 与盐反应回顾初中所学知识:碳酸钠有哪些化学性质,写出反应方程式?1 与酸反应Na2CO3+ 2HCl=2 NaCl+ H2O+CO2↑一、碳酸钠与碳酸氢钠的性质俗名、颜色状态、溶解度
溶液的酸碱性
与盐酸反应
与澄清石灰水反应
与氯化钙溶液反应
与氢氧化钠溶液反应
与二氧化碳反应
热稳定性苏打、纯碱小苏打白色粉末 细小的白色晶体易溶于水 易溶于水相同温度下的溶解度:Na2CO3 〉NaHCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl(20 ℃约21.8g)(20 ℃约9.6g)碱性碱性碱性(同浓度):Na2CO3 ﹥NaHCO3生活小常识:Na2CO3·10H2O俗称石碱,可直接用作洗涤剂。酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl石碱手工石碱香皂礼盒实验4:用热的纯碱溶液清洗沾
满油污的铜片(P51)Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O与同浓度的盐酸反应时,碳酸氢钠
反应更剧烈,放出气体的速度更快等物质的量的Na2CO3和NaHCO3与足量的盐酸反应,
生成的CO2 。等质量的Na2CO3和NaHCO3,生成的CO2 多。等质量的Na2CO3和NaHCO3, 消耗的HCl 多产生等量CO2所需HCl的量: 为 的两倍一样多NaHCO3Na2CO 3Na2CO3NaHCO3?酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl产生白色沉淀:Na2CO3+CaCl2=CaCO3↓+2NaCl无现象:不反应酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl不反应反应,但无明显现象NaHCO3+ NaOH=Na2CO3+H2O用澄清石灰水可以鉴别碳酸钠和碳酸氢钠吗?★注意:碳酸氢钠即可以跟强酸反应,又可以跟强碱反应:遇酸成酸,遇碱成盐。酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HClNa2CO3+ Ca(OH)2=CaCO3↓+2NaOH均出现白色沉淀NaHCO3+ Ca(OH)2(足量)=CaCO3 ↓+NaOH+H2O2NaHCO3(足量)+ Ca(OH)2=CaCO3↓+Na2CO3+2H2O?CaCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HClNa2CO3 + CO2+H2O= 2NaHCO3不反应举一反三:向亚硫酸钠溶液中通入SO2气体,写出反应的方程式Na2SO3 + SO2+H2O= 2NaHSO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl实验稳定,加热时不分解不稳定,加热时易分解Na2CO3 或NaHCO3酸碱性与CaCl2与Ca(OH)2与NaOH与CO2热稳定性与HCl实验为了比较碳酸钠和碳酸氢钠固体的热稳定性,有同学设计了如下装置(加热、夹持等仪器略去):
⑴大试管中应盛放 固体。
⑵当A试管中溶液 ,B试管中溶液 时,可以说明碳酸钠热稳定性比碳酸氢钠强。 Na2CO3依然保持澄清变浑浊如何实现碳酸钠与碳酸氢钠的相互转化?Na2CO3 NaHCO31. 如何除去下列物质中所含的少量杂质?
⑴ 碳酸氢钠溶液中的少量碳酸钠;
⑵ 碳酸钠固体中的少量碳酸氢钠;
⑶ 二氧化碳中的少量氯化氢。通入CO2加热通过NaHCO3饱和溶液巩固练习二、碳酸钠和碳酸氢钠的用途(P52)洗涤剂;制玻璃、造纸、纺织等。制发酵粉;治疗胃酸过多;泡沫灭火剂巩固练习 2.不能用来鉴别Na2CO3和NaHCO3的方法是 ( )
A.分别加热 B.加澄清石灰
C.加稀盐酸 D.加BaCl2B中国化学工业的先驱: 在中国化学工业史上,有一位杰出的科学家,他为祖国的化工事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成 。碳酸钠侯德榜
二. 侯氏制碱法(联合制碱法)(P53)1. 原理:
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl 2NaHCO3 = Na2CO3+H2O+CO2↑ 2. 步骤NaHCO3NH4Cl(主要) NaCl(少量)
NaHCO3(少量)通入氨气NH4ClNaCl 根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在 5℃~10℃时,向母液中加入食盐细粉,通入NH3,而使NH4Cl单独结晶析出供做氮肥。优点:使食盐的利用率大大提高;NH4Cl可做氮肥;可与合成氨厂联合, NH3由合成氨厂提供。实验室中,用侯氏制碱原理制Na2CO3和NH4Cl的步骤为:⑴向滤液1中通入氨气的作用是
。
⑵ 操作①②的顺序_______(填能或不能)颠倒, 其原因为
________________________________________。
⑶ 连续化生产的循环步骤是 _____(填操作序号) 。不能 CO2在水中溶解度比NH3在水中溶解度小得多,而CO2在氨水中被吸收的量比在水中大。请回答:⑥通入氨气 a.增大NH4+的浓度,使NH4Cl更多的析出;b.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 3.将19g Na2CO3和NaHCO3的混合物加热到质量不再减少为止,称得剩余固体质量为15.9g,求原混合物中NaHCO3的质量分数。解:设原混合物中NaHCO3的质量为x
2NaHCO3 = Na2CO3+H2O+CO2↑ △m
168 62
x (19-15.9)g
x=8.4g
NaHCO3%= 8.4g/19g= 44.2%差量法巩固练习小结:NaNa2ONa2O2NaOHNa2CO3 NaHCO3 作业完成讲义 碳酸盐的溶解性SNa2CO3>SNaHCO3SCa(HCO3)2>SCaCO3可溶性碳酸盐 S正盐>S酸式盐不溶性碳酸盐 S酸式盐>S正盐注:碳酸盐的正盐除Na+、K+、NH4+外,多数是不溶于水的,而碳酸盐中的酸式盐却都溶于水。
