化学平衡章末复习(练习)(有答案)
文档属性
| 名称 | 化学平衡章末复习(练习)(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 274.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-10-31 12:59:08 | ||
图片预览


文档简介
高二化学练习(六)
内容:化学反应速率和化学平衡 2012.10.29--10.31
命题人:黄敏 审题:陈银珠
1、将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:
3A(g) + B(g)xC(g) + 2D(g),5 min后反应达到平衡状态,容器内的压强变小,已知D在平衡时的物质的量为1 mol, 填写下列空白:
(1) x= _____________; (2)A 的平均反应速率为 _____________
(3)平衡时B的转化率为 (4)该温度下的平衡常数为
(5)平衡时,容器内的压强与原容器内压强的比值为 ______ _____
2、向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t 4阶段为使用催化剂;
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
各阶段平衡时对应的平衡常数如下表所示:
t1—t2
t2—t3
t3—t4
t4—t5
t5—t6
K1
K 2
K3
K4
K5
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(3)t5—t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式 。
3、(16分)(1)已知2A(g)+B(g)2C(g) ,向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,10min后达平衡时测得c(C)=0.040 mol·L-1。
①能说明上述反应已经达到化学平衡状态的是 (填写序号)。
a.v(C)=2 v (B); b.容器内压强保持不变
c.v逆(A)=2 v正(B) d.容器内气体的密度保持不变
②已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,
A的转化率 (填“增大”、“减小”或“不变”);
③某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示。平衡状态由a变到b时,化学平衡常数
K(a)_______K(b)(填“>”、“<”或“=”)。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO2CO2+N2。△H<0 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
0
1
2
3
4
5
c(NO)(mol/L)
1.00×10-3
4.50×10-4
2.50×10-4
1.50×10-4
1.00×10-4
1.00×10-4
c(CO)(mol/L)
3.60×10-3
3.05×10-3
2.85×10-3
2.75×10-3
2.70×10-3
2.70×10-3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2)= 。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验
编号
T(℃)
NO初始浓度
(mol/L)
CO初始浓度
(mol/L)
催化剂的比表面积(m2/g)
Ⅰ
280
1.20×10-3
5.80×10-3
82
Ⅱ
124
Ⅲ
350
124
(i)请在上表空格中填入剩余的实验条件数据。
(ii)请在给出的坐标图中,画出上表中的三个实验条件
下混合气体中NO浓度随时间变化的趋势曲线图,并标
明各条曲线的实验编号。
4、甲醇是一种可再生能源,具有广泛的开发和应用前景。在容积为2L的密闭容器中充入 lmolCO2molH2在催化剂作用下反应生成甲醇:, CO平衡转化率与温度、压强的关系如图示;
(1) Pl__ __P2(填大于、小于或等于) (2) 若Pl为1标准大气压,反应温度为100℃,此条件下反 应达到平衡:
①达到平衡所需的时间为5min,用H2表示的平均反应速率为____ ____。
②反应的平衡常数K= 。
③平衡时,测得其能量的变化量为akJ。则该反应的热化学方程式是: 。
(3) 恒容恒温情况下,再增加lmol CO与2molH2,达到新平衡时.CO的转化率 .(填“增大”、“减小”或“不变”),平衡常数_ ___。(填“增大”、“减小”或“不变”)
(4) 为了寻找一定催化剂下合成甲醇的适宜温度条件,某同学设计了一组实验,该实验中应控制的不变量是 。
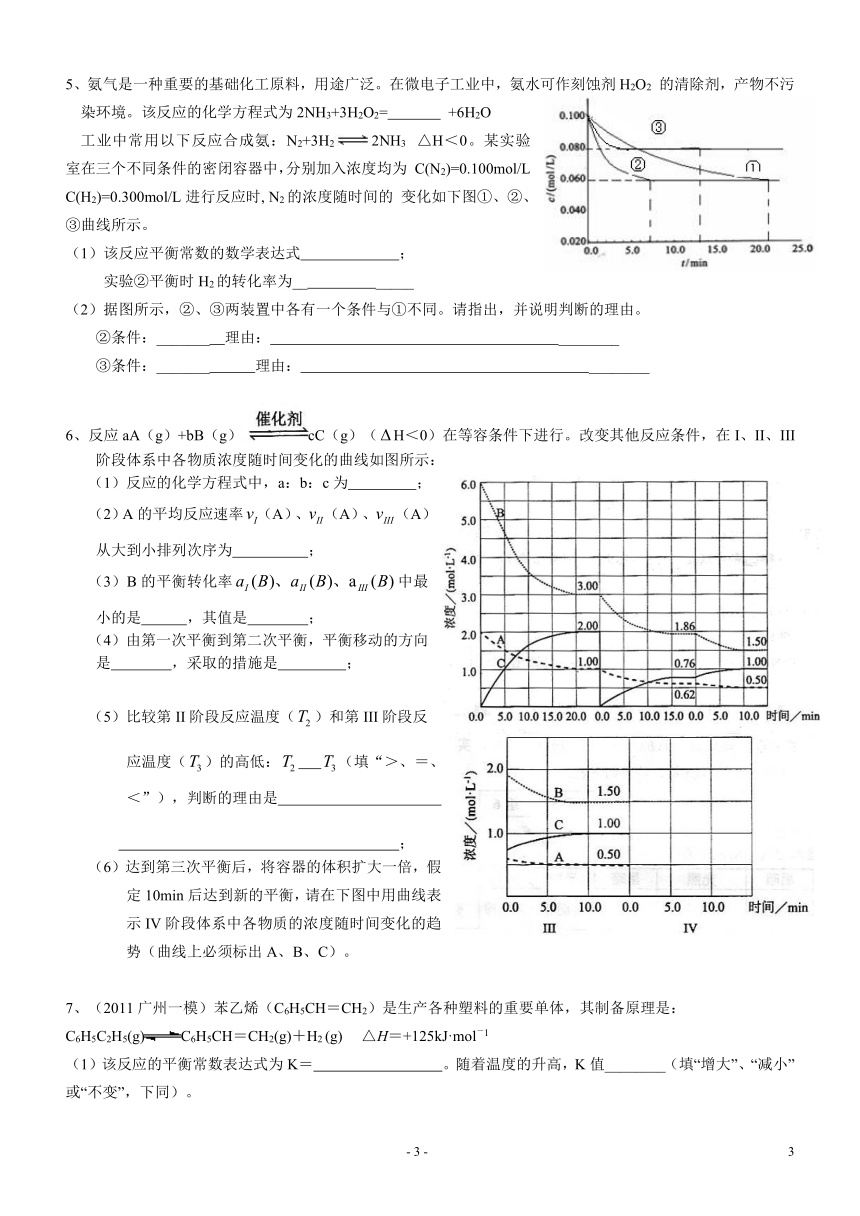
5、氨气是一种重要的基础化工原料,用途广泛。在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
工业中常用以下反应合成氨:N2+3H22NH3 △H<0。某实验 室在三个不同条件的密闭容器中,分别加入浓度均为 C(N2)=0.100mol/L, C(H2)=0.300mol/L进行反应时, N2的浓度随时间的 变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式 ;
实验②平衡时H2的转化率为__ _____
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
6、反应aA(g)+bB(g)cC(g)(H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率(A)、(A)、(A)从大到小排列次序为 ;
(3)B的平衡转化率中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第II阶段反应温度()和第III阶段反应温度()的高低: (填“>、=、<”),判断的理由是
;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
7、(2011广州一模)苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是: C6H5C2H5(g)C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1 (1)该反应的平衡常数表达式为K= 。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。 ①由上图可得出: 结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______; 结论二:__________________________________________________。 ②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________
_____ ___。 (3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于
提高C6H5C2H5的平衡转化率。试解释其原因:_________________
_______________________ _______。
8、(2007年广东卷改)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 F 移出氧气
(3)反应:2SO2(g)+O2(g)2SO3(g) △H<0
SO2的转化率在起始温度T1=673K下随反应时间(t)的变化
如右图,其他条件不变,仅改变起始温度为T2=723K,在图中
画出温度T2下SO2的转化率随反应时间变化的预期示意图。
高二化学练习(五)参考答案
1、(1)x=1 (2)0.15 mol·L-1·min-1 (3)20% (4) 4/27 (5)10:11
2、(1)0.02mol·L—1·min—1 (2)减小压强; 1.0 mol ; K=0.84(单位可省), K1=K2=K3=K 4 (3)2A(g)+B(g) 3C(g);△H=+200aKJ·mol-1
3、(16分)(1)①bc (2分) ②放热 (2分) 减小 (2分) ③=(2分)
(2)①1.88×10-4 mol·L-1·S-1;(2分)
②(i)280(1分);1.20×10-3(0.5分);5.80×10-3(0.5分);
1.20×10-3(0.5分);5.80×10-3(0.5分);
(ii)如图:(3分)
4、(1) 小于(2分)
(2)①O.1mol/(L·min)(3分) ②4(mol/L)-2(3分)
②(3分)
(3) 增大、不变(2分) (4) 催化剂的用量、CO和H2的浓度、压强(3分)
5、 N2
(1)K=
40.0%
(2)②加了催化剂;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同。(4分)
③温度高;该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①(4分)
6、(1)1:3:2 (2)
(3) (4)向正反应方向;从反应体系中移出产物C。
(5)> 此反应为放热反应,降低温度,平衡向正反应方向移动。
(6)(注:只要曲线能表示平衡向逆反应方向移动及各物质浓度的相对变化比例即可)。
7、(1);增大 (2)①高;其他条件不变,体系总压强越大,平衡转化率越小。 ②总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体 物质的量增大的方向移动,C6H5C2H5的平衡转化率增大 (或答:总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,浓度商的计算结果小于平衡常数K,故平衡向正反应方向移动,C6H5C2H5的平衡转化率增大。) (3)O2将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动。 8、(1)解: 2SO2(g) + O2(g) 2SO3(g)
起始浓度/ mol·L-1 0.050 0.030 0
转化浓度/ mol·L-1 0.040 0.020 0.040
平衡浓度/ mol·L-1 0.010 0.010 0.040
K == = 1.6×103 mol·L-1。
??SO2 转化率 =×100% = 80% 。
(2)B、C
(3)
内容:化学反应速率和化学平衡 2012.10.29--10.31
命题人:黄敏 审题:陈银珠
1、将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:
3A(g) + B(g)xC(g) + 2D(g),5 min后反应达到平衡状态,容器内的压强变小,已知D在平衡时的物质的量为1 mol, 填写下列空白:
(1) x= _____________; (2)A 的平均反应速率为 _____________
(3)平衡时B的转化率为 (4)该温度下的平衡常数为
(5)平衡时,容器内的压强与原容器内压强的比值为 ______ _____
2、向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t 4阶段为使用催化剂;
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
各阶段平衡时对应的平衡常数如下表所示:
t1—t2
t2—t3
t3—t4
t4—t5
t5—t6
K1
K 2
K3
K4
K5
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(3)t5—t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式 。
3、(16分)(1)已知2A(g)+B(g)2C(g) ,向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,10min后达平衡时测得c(C)=0.040 mol·L-1。
①能说明上述反应已经达到化学平衡状态的是 (填写序号)。
a.v(C)=2 v (B); b.容器内压强保持不变
c.v逆(A)=2 v正(B) d.容器内气体的密度保持不变
②已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,
A的转化率 (填“增大”、“减小”或“不变”);
③某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示。平衡状态由a变到b时,化学平衡常数
K(a)_______K(b)(填“>”、“<”或“=”)。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO2CO2+N2。△H<0 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
0
1
2
3
4
5
c(NO)(mol/L)
1.00×10-3
4.50×10-4
2.50×10-4
1.50×10-4
1.00×10-4
1.00×10-4
c(CO)(mol/L)
3.60×10-3
3.05×10-3
2.85×10-3
2.75×10-3
2.70×10-3
2.70×10-3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2)= 。
②研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验
编号
T(℃)
NO初始浓度
(mol/L)
CO初始浓度
(mol/L)
催化剂的比表面积(m2/g)
Ⅰ
280
1.20×10-3
5.80×10-3
82
Ⅱ
124
Ⅲ
350
124
(i)请在上表空格中填入剩余的实验条件数据。
(ii)请在给出的坐标图中,画出上表中的三个实验条件
下混合气体中NO浓度随时间变化的趋势曲线图,并标
明各条曲线的实验编号。
4、甲醇是一种可再生能源,具有广泛的开发和应用前景。在容积为2L的密闭容器中充入 lmolCO2molH2在催化剂作用下反应生成甲醇:, CO平衡转化率与温度、压强的关系如图示;
(1) Pl__ __P2(填大于、小于或等于) (2) 若Pl为1标准大气压,反应温度为100℃,此条件下反 应达到平衡:
①达到平衡所需的时间为5min,用H2表示的平均反应速率为____ ____。
②反应的平衡常数K= 。
③平衡时,测得其能量的变化量为akJ。则该反应的热化学方程式是: 。
(3) 恒容恒温情况下,再增加lmol CO与2molH2,达到新平衡时.CO的转化率 .(填“增大”、“减小”或“不变”),平衡常数_ ___。(填“增大”、“减小”或“不变”)
(4) 为了寻找一定催化剂下合成甲醇的适宜温度条件,某同学设计了一组实验,该实验中应控制的不变量是 。
5、氨气是一种重要的基础化工原料,用途广泛。在微电子工业中,氨水可作刻蚀剂H2O2 的清除剂,产物不污染环境。该反应的化学方程式为2NH3+3H2O2= +6H2O
工业中常用以下反应合成氨:N2+3H22NH3 △H<0。某实验 室在三个不同条件的密闭容器中,分别加入浓度均为 C(N2)=0.100mol/L, C(H2)=0.300mol/L进行反应时, N2的浓度随时间的 变化如下图①、②、③曲线所示。
(1)该反应平衡常数的数学表达式 ;
实验②平衡时H2的转化率为__ _____
(2)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
6、反应aA(g)+bB(g)cC(g)(H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
(1)反应的化学方程式中,a:b:c为 ;
(2)A的平均反应速率(A)、(A)、(A)从大到小排列次序为 ;
(3)B的平衡转化率中最小的是 ,其值是 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)比较第II阶段反应温度()和第III阶段反应温度()的高低: (填“>、=、<”),判断的理由是
;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
7、(2011广州一模)苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是: C6H5C2H5(g)C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1 (1)该反应的平衡常数表达式为K= 。随着温度的升高,K值________(填“增大”、“减小”或“不变”,下同)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。 ①由上图可得出: 结论一:其他条件不变,水蒸气的用量越大,平衡转化率越______; 结论二:__________________________________________________。 ②加入稀释剂能影响C6H5C2H5平衡转化率的原因是:_______________
_____ ___。 (3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于
提高C6H5C2H5的平衡转化率。试解释其原因:_________________
_______________________ _______。
8、(2007年广东卷改)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 F 移出氧气
(3)反应:2SO2(g)+O2(g)2SO3(g) △H<0
SO2的转化率在起始温度T1=673K下随反应时间(t)的变化
如右图,其他条件不变,仅改变起始温度为T2=723K,在图中
画出温度T2下SO2的转化率随反应时间变化的预期示意图。
高二化学练习(五)参考答案
1、(1)x=1 (2)0.15 mol·L-1·min-1 (3)20% (4) 4/27 (5)10:11
2、(1)0.02mol·L—1·min—1 (2)减小压强; 1.0 mol ; K=0.84(单位可省), K1=K2=K3=K 4
3、(16分)(1)①bc (2分) ②放热 (2分) 减小 (2分) ③=(2分)
(2)①1.88×10-4 mol·L-1·S-1;(2分)
②(i)280(1分);1.20×10-3(0.5分);5.80×10-3(0.5分);
1.20×10-3(0.5分);5.80×10-3(0.5分);
(ii)如图:(3分)
4、(1) 小于(2分)
(2)①O.1mol/(L·min)(3分) ②4(mol/L)-2(3分)
②(3分)
(3) 增大、不变(2分) (4) 催化剂的用量、CO和H2的浓度、压强(3分)
5、 N2
(1)K=
40.0%
(2)②加了催化剂;因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同。(4分)
③温度高;该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①(4分)
6、(1)1:3:2 (2)
(3) (4)向正反应方向;从反应体系中移出产物C。
(5)> 此反应为放热反应,降低温度,平衡向正反应方向移动。
(6)(注:只要曲线能表示平衡向逆反应方向移动及各物质浓度的相对变化比例即可)。
7、(1);增大 (2)①高;其他条件不变,体系总压强越大,平衡转化率越小。 ②总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体 物质的量增大的方向移动,C6H5C2H5的平衡转化率增大 (或答:总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,浓度商的计算结果小于平衡常数K,故平衡向正反应方向移动,C6H5C2H5的平衡转化率增大。) (3)O2将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动。 8、(1)解: 2SO2(g) + O2(g) 2SO3(g)
起始浓度/ mol·L-1 0.050 0.030 0
转化浓度/ mol·L-1 0.040 0.020 0.040
平衡浓度/ mol·L-1 0.010 0.010 0.040
K == = 1.6×103 mol·L-1。
??SO2 转化率 =×100% = 80% 。
(2)B、C
(3)
