备战2022 浙教版科学 中考一轮 第36课时 物质间的循环与转化 知识梳理(课件 23张PPT)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮 第36课时 物质间的循环与转化 知识梳理(课件 23张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-29 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
第36课时 物质间的循环与转化
§分类一 自然界中的碳循环和氧循环
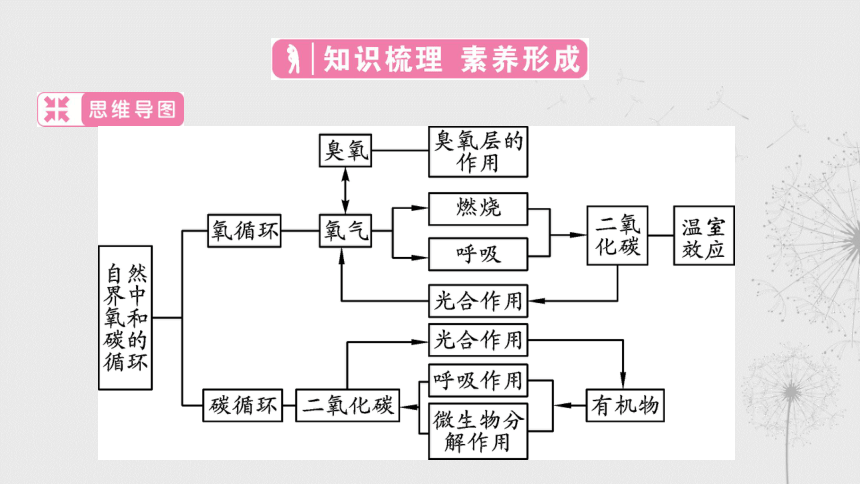
自然界中碳循环和氧循环的主要途径
1.自然界中的碳循环主要表现在 _________的循环。二氧化碳来
自动物、植物、微生物的呼吸作用;来自煤、石油、天然气等可
燃物的燃烧;还来自微生物的分解。二氧化碳消耗的主要途径是
_________________。
2.大自然中氧气的含量会随着生物的_______作用和可燃物质的
_______而减少,但又会随着植物的 _________而增加,这就构成
了自然界中的氧循环。
二氧化碳
植物的光合作用
呼吸
燃烧
光合作用
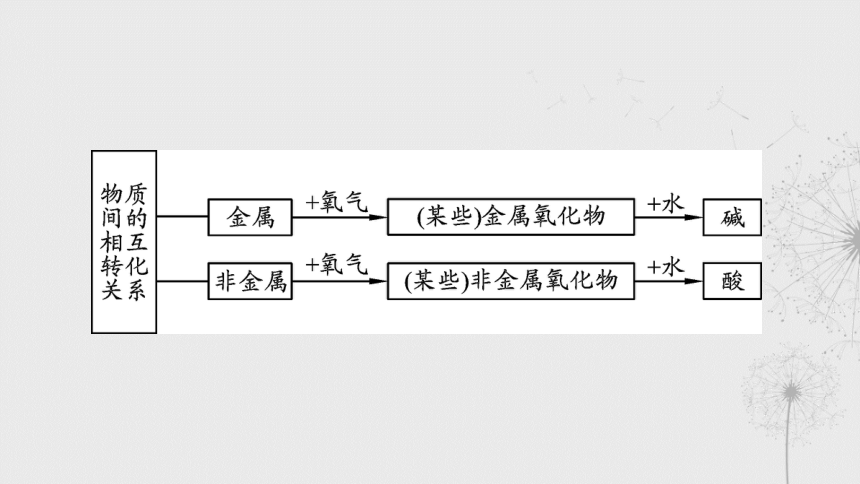
§分类二 常见无机物之间的相互关系
金属、金属氧化物、碱之间的转化关系;非金属、非金属氧化物、酸之间的转化关系
①~④和⑤~⑧是各类物质间的相互转化关系,⑨~ 是各类物质间的相互反应关系。
(1)写出⑨~ 的生成物:_________________________________
_____________________________________________________和
_____。
(2)各类物质之间的转化与反应是需要一定的条件才能发生的,
以下几点需要特别注意:
②金属氧化物→碱,只有可溶性碱对应的金属氧化物才能与水
反应,如 __________________。
⑨盐、⑩盐和水、 盐和水、 盐和
水、 盐和酸、 盐和碱、 两种新盐、 盐和金属、 盐
氢气
CaO+H2O===Ca(OH)2
④碱→金属氧化物,只有不溶性碱易分解,如 ________________
___。
⑥非金属氧化物→酸,如 _______________,但SiO2不会与水反
应。
金属+盐→另一种金属+另一种盐
只有活动性强的金属才能将另一种活动性弱的金属从它的盐溶液
中置换出来。
反应物中的盐要求是可溶性的盐。
活泼金属(K、Ca、Na等)由于会和水反应,要除外。
====
△
Cu(OH)2 CuO+
H2O
CO2+H2O===H2CO3
金属+酸→盐+氢气
在金属活动性顺序里,只有位于 _______的金属能置换出酸溶液里的氢。
、 、 、 发生的均是复分解反应,故要从复分解反应发生的条件去判断反应能否进行。
从常见无机物之间的相互关系,可以推测物质的性质及物质可能的制取方法。
氢前面
练习1:SO2是一种大气污染物,也是形成酸雨的主要物质。对含SO2
的工业废气进行的无害化处理是打赢蓝天保卫战和保护绿水青山
的重要措施。
(1)向含SO2的工业废气中喷洒石灰浆[Ca(OH)2]可有效吸收SO2,
生成CaSO3,反应的化学方程式为________________________,
CaSO3可用于制备石膏。
SO2+Ca(OH)2===CaSO3+H2O
(2)用主要成分为Na2CO3的工业废液吸收工业废气中的SO2可得到
Na2SO3,实现了资源的综合利用。反应过程中溶液组成变化如图
所示:
①吸收初期(通入废气体积小于V1),发生反应的化学方程式为
____________________________________;
②不断通入废气,最终产物是________。
2Na2CO3+H2O+SO2===2NaHCO3+Na2SO3
NaHSO3
练习2:某化工厂利用含有1%~2%BaCO3的废料制取 BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中 Ba2+含量达到规定标准才能作
为固体废弃物处理,检验Ba2+的试剂可用 ___________________
__________,洗涤滤渣的主要目的是________________________
___________________。
Na2SO4(可溶性硫酸盐
或稀硫酸)
洗涤表面附着的 BaCl2,使
废弃物达到处理标准
练习3:有一包白色固体可能含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠中的一种或几种。某科学兴趣小组为探究其成分做了以下实验:
①取少量固体于烧杯中,加足量的水溶解,烧杯内有固体残留并得到无色溶液甲;
②取少量无色溶液甲于试管中,滴加酚酞试液,溶液不变色;
③继续向①的烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图所示。
(1)仅通过①可以得出的结论是:原白色固体中一定有________。
(2)无色溶液甲中一定不存在的物质是______(填字母)。
A.碳酸钠 B.硫酸钠
C.硝酸钡 D.氢氧化钠
Ba(NO3)2
ABD
练习4:现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
(1)推测下列物质的化学式:B____,D _____,F_____。
(2)写出C→A转化的化学方程式: _________________。
(3)写出C+E→B+D的化学方程式: ______________________。
====
点燃
H2
FeSO4
Cu
3Fe+2O2 Fe3O4
Fe+H2SO4===FeSO4+H2↑
练习5:某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水,也不与稀盐酸反应)。
请回答下列问题:
(1)溶液A中共含有____种阳离子;写出矿石中的任意一种金属氧
化物与稀盐酸反应的化学方程式:_________________________
__________________________________________________。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳
离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关
pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,
所得溶液B的pH的取值范围为 _________。
4
MgO+2HCl===MgCl2+H2O(或
Fe2O3+6HCl===2FeCl3+3H2O;CuO+2HCl===CuCl2+H2O)
6.7~8.6
(3)写出溶液B中加入熟石灰发生的化学反应方程式:
____________________________________。
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2
练习6:图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8克。将NaOH溶液渐渐加入到C中,生成蓝色絮状沉淀E的质量与加入的NaOH溶液的质量关系如图乙所示。在D中加入Ba(NO3)2 溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)A溶液中溶质的化学式是 _____ 。
(2)操作Ⅰ的名称是 _____ 。
(3)NaOH溶液中溶质的质量分数是多少?
(4)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液中溶质的质量是多少?
H2SO4
过滤
第36课时 物质间的循环与转化
§分类一 自然界中的碳循环和氧循环
自然界中碳循环和氧循环的主要途径
1.自然界中的碳循环主要表现在 _________的循环。二氧化碳来
自动物、植物、微生物的呼吸作用;来自煤、石油、天然气等可
燃物的燃烧;还来自微生物的分解。二氧化碳消耗的主要途径是
_________________。
2.大自然中氧气的含量会随着生物的_______作用和可燃物质的
_______而减少,但又会随着植物的 _________而增加,这就构成
了自然界中的氧循环。
二氧化碳
植物的光合作用
呼吸
燃烧
光合作用
§分类二 常见无机物之间的相互关系
金属、金属氧化物、碱之间的转化关系;非金属、非金属氧化物、酸之间的转化关系
①~④和⑤~⑧是各类物质间的相互转化关系,⑨~ 是各类物质间的相互反应关系。
(1)写出⑨~ 的生成物:_________________________________
_____________________________________________________和
_____。
(2)各类物质之间的转化与反应是需要一定的条件才能发生的,
以下几点需要特别注意:
②金属氧化物→碱,只有可溶性碱对应的金属氧化物才能与水
反应,如 __________________。
⑨盐、⑩盐和水、 盐和水、 盐和
水、 盐和酸、 盐和碱、 两种新盐、 盐和金属、 盐
氢气
CaO+H2O===Ca(OH)2
④碱→金属氧化物,只有不溶性碱易分解,如 ________________
___。
⑥非金属氧化物→酸,如 _______________,但SiO2不会与水反
应。
金属+盐→另一种金属+另一种盐
只有活动性强的金属才能将另一种活动性弱的金属从它的盐溶液
中置换出来。
反应物中的盐要求是可溶性的盐。
活泼金属(K、Ca、Na等)由于会和水反应,要除外。
====
△
Cu(OH)2 CuO+
H2O
CO2+H2O===H2CO3
金属+酸→盐+氢气
在金属活动性顺序里,只有位于 _______的金属能置换出酸溶液里的氢。
、 、 、 发生的均是复分解反应,故要从复分解反应发生的条件去判断反应能否进行。
从常见无机物之间的相互关系,可以推测物质的性质及物质可能的制取方法。
氢前面
练习1:SO2是一种大气污染物,也是形成酸雨的主要物质。对含SO2
的工业废气进行的无害化处理是打赢蓝天保卫战和保护绿水青山
的重要措施。
(1)向含SO2的工业废气中喷洒石灰浆[Ca(OH)2]可有效吸收SO2,
生成CaSO3,反应的化学方程式为________________________,
CaSO3可用于制备石膏。
SO2+Ca(OH)2===CaSO3+H2O
(2)用主要成分为Na2CO3的工业废液吸收工业废气中的SO2可得到
Na2SO3,实现了资源的综合利用。反应过程中溶液组成变化如图
所示:
①吸收初期(通入废气体积小于V1),发生反应的化学方程式为
____________________________________;
②不断通入废气,最终产物是________。
2Na2CO3+H2O+SO2===2NaHCO3+Na2SO3
NaHSO3
练习2:某化工厂利用含有1%~2%BaCO3的废料制取 BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中 Ba2+含量达到规定标准才能作
为固体废弃物处理,检验Ba2+的试剂可用 ___________________
__________,洗涤滤渣的主要目的是________________________
___________________。
Na2SO4(可溶性硫酸盐
或稀硫酸)
洗涤表面附着的 BaCl2,使
废弃物达到处理标准
练习3:有一包白色固体可能含有碳酸钠、硫酸钠、硝酸钡、氢氧化钠中的一种或几种。某科学兴趣小组为探究其成分做了以下实验:
①取少量固体于烧杯中,加足量的水溶解,烧杯内有固体残留并得到无色溶液甲;
②取少量无色溶液甲于试管中,滴加酚酞试液,溶液不变色;
③继续向①的烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸质量的变化如图所示。
(1)仅通过①可以得出的结论是:原白色固体中一定有________。
(2)无色溶液甲中一定不存在的物质是______(填字母)。
A.碳酸钠 B.硫酸钠
C.硝酸钡 D.氢氧化钠
Ba(NO3)2
ABD
练习4:现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
(1)推测下列物质的化学式:B____,D _____,F_____。
(2)写出C→A转化的化学方程式: _________________。
(3)写出C+E→B+D的化学方程式: ______________________。
====
点燃
H2
FeSO4
Cu
3Fe+2O2 Fe3O4
Fe+H2SO4===FeSO4+H2↑
练习5:某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水,也不与稀盐酸反应)。
请回答下列问题:
(1)溶液A中共含有____种阳离子;写出矿石中的任意一种金属氧
化物与稀盐酸反应的化学方程式:_________________________
__________________________________________________。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳
离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关
pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,
所得溶液B的pH的取值范围为 _________。
4
MgO+2HCl===MgCl2+H2O(或
Fe2O3+6HCl===2FeCl3+3H2O;CuO+2HCl===CuCl2+H2O)
6.7~8.6
(3)写出溶液B中加入熟石灰发生的化学反应方程式:
____________________________________。
氢氧化物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀的pH 1.5 4.2 8.6
完全沉淀的pH 3.2 6.7 11.1
MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2
练习6:图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8克。将NaOH溶液渐渐加入到C中,生成蓝色絮状沉淀E的质量与加入的NaOH溶液的质量关系如图乙所示。在D中加入Ba(NO3)2 溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)A溶液中溶质的化学式是 _____ 。
(2)操作Ⅰ的名称是 _____ 。
(3)NaOH溶液中溶质的质量分数是多少?
(4)C溶液中加入NaOH溶液至恰好完全反应时,所得溶液中溶质的质量是多少?
H2SO4
过滤
同课章节目录
