备战2022 浙教版科学 中考一轮 第32课时 水和溶液 知识梳理(课件 20张PPT)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮 第32课时 水和溶液 知识梳理(课件 20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-29 21:33:59 | ||
图片预览






文档简介
(共20张PPT)
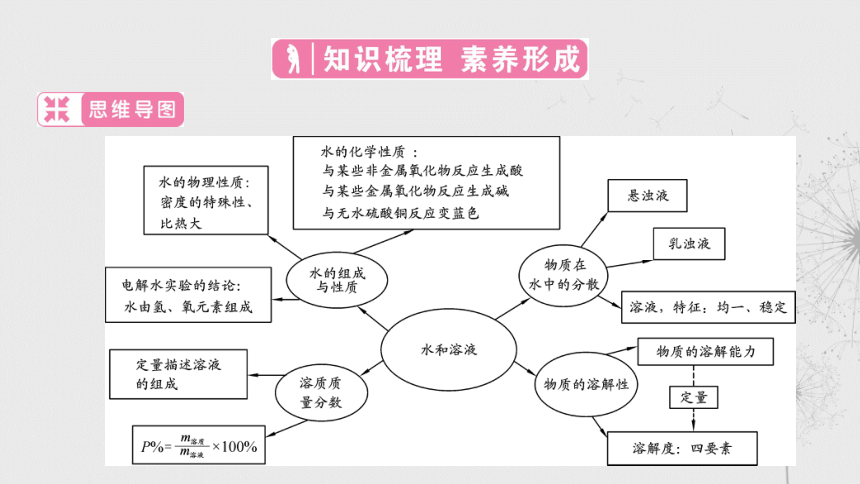
第32课时 水和溶液
§分类一 水的组成和主要性质
水电解后的产物,水的组成
电解水实验
(1)现象:通电后,两个电极表面出现_____,一段
时间后,正极与负极的气体体积比约为 _____。
气泡
1∶2
(2)气体检验:用 _____________检验与正极相连的管中的气体,
发现 _________,证明此气体是 ______;用 ___________检验
与负极相连的管中的气体,发现该气体能_____,产生 _______
_____,证明此气体是_______。
(3)实验结论:水在通电的条件下生成 _____和 _____,说明水是
由_______和 _______组成的,同时也证明在化学变化中_______
可再分,而_______不可再分。化学变化的本质是_______分成
_______,_______重新组合成新的分子。
带火星的木条
木条复燃
氧气
燃着的木条
燃烧
淡蓝色
火焰
氢气
氢气
氧气
氢元素
氧元素
分子
原子
分子
原子
原子
水的化学性质
1.在通电时能发生分解反应。
化学方程式: ____________________。
2.常温下与某些氧化物反应。
(1)与某些非金属氧化物反应生成相应的酸,例:
_________________, _______________。
(2)与某些金属氧化物反应生成相应的碱,例:
____________________。
====
通电
2H2O 2H2↑+O2↑
SO3+H2O===H2SO4
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
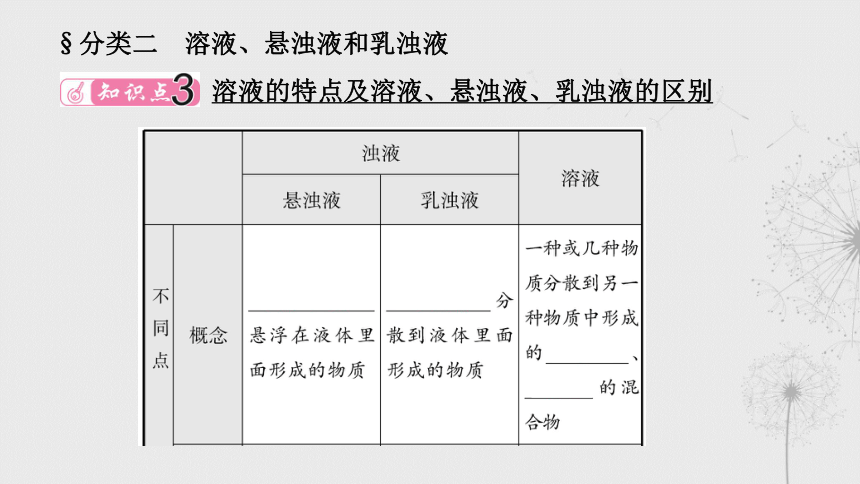
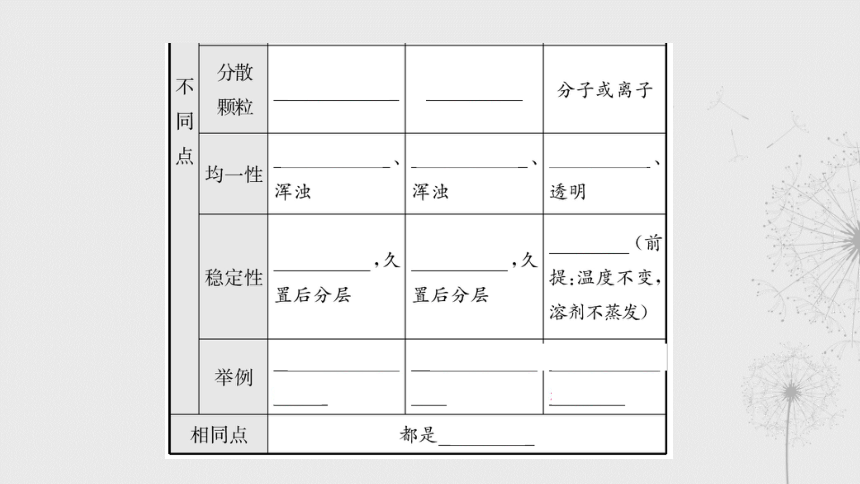
§分类二 溶液、悬浊液和乳浊液
溶液的特点及溶液、悬浊液、乳浊液的区别
§分类三 饱和溶液与不饱和溶液、物质的溶解性及溶解度
饱和溶液与不饱和溶液的区别
1.饱和溶液与不饱和溶液
(1)在_________下,向一定量的溶剂里加入某溶质,当溶质
_______________时所得到的溶液叫做这种溶质的饱和溶液;
溶质还能_________,则该溶液叫做这种溶质的不饱和溶液。
(2)饱和溶液和不饱和溶液相互转化的条件和方法:
一定温度
不能再继续溶解
继续溶解
2.列举影响物质溶解性的一些因素
影响物质溶解性的因素有_______、_______的种类和温度。
【注意】比较不同物质的溶解性,必须在一定的温度、一定量的溶剂及该溶质不能再继续溶解的条件下进行比较。还要注意溶解性的大小不要与溶解的速度混淆,如振荡可以加快溶解,但不影响溶解性。
溶质
溶剂
物质溶解度的含义
1.引入溶解度的概念是为了能定量地表示物质的溶解性,有严格
的变量控制,在 ___________下,某物质在 ______溶剂中达到
___________时所溶解的_______为该物质在这种溶剂里的溶解
度。溶解度越大,表明该温度下物质的溶解性越_____。
2.温度对物质溶解度的影响
大部分固体物质的溶解度随温度的升高而______,如_______;
有的物质溶解度随温度变化很小,如 _______;个别固体物质
的溶解度随温度的升高而减小,如 _________。气体物质的溶
解度随温度的升高而 _____。
一定的温度
100克
饱和状态
质量
强
增大
硝酸钾
氯化钠
氢氧化钙
减小
§分类四 溶质的质量分数
关于“溶质的质量分数=溶质质量/溶液质量”的简单计算
溶质的质量分数是定量表示溶液浓度的一种方法。
1.概念:溶质的质量分数是 _________与 _________之比。
2.公式:
(1)溶液质量= _____的质量+_______的质量。
溶质质量
溶液质量
溶质
溶剂
3.溶液的质量、体积、密度的关系
溶液的质量m(溶液)= ______________。
ρ(溶液)×V(溶液)
配制一定溶质质量分数的溶液及有关配制方案、步
骤与操作方法
1.用食盐和水配制10%的食盐水50克(即固体物质与水配成溶液)
所需仪器:_________、_____、_______、_____、药匙、胶头滴
管等。
托盘天平
烧杯
玻璃棒
量筒
步骤:
(1)计算:配制此溶液需要氯化钠____克,水_____毫升。
(2)称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。
注意氯化钠放天平左盘,砝码放天平右盘。用50mL的量筒量取
所需的水,当倒入的水接近45mL时,改用 _________加水。
(3)溶解:将用量筒量取的水倒入盛有氯化钠的烧杯里,用_____
___搅拌。待氯化钠完全溶解时,10%的氯化钠溶液就配制好了。
5
45
胶头滴管
玻璃
棒
2.配制一定质量分数的稀硫酸
通过稀释的方法配制溶液,关键是抓住稀释前后,_____的质量
相等。用公式表示为: __________________。
溶质
m稀×ω稀=m浓×ω浓
§分类五 水污染
水体污染及防治;净化水的常用方法
1.水体有一定的自我净化能力,但当进入水体中的污染物超过
水体的自我净化能力时,就会造成水污染。水污染主要来源:
工业生产中的“三废”排放;生活污水的任意排放;农业生产
中_______、_______的滥用等。
2.水污染的危害:污染水源;氮、磷元素过多造成水体的
___________污染,形成“水华”和“赤潮”。
农药
化肥
富营养化
3.水污染的防治措施:控制污水的任意排放,对污水进行净化
处理,改善用水制度,研究无污染绿色新工业,合理、科学地
施用化肥和农药等。
4.水的净化方法:常见的有 _______、 _______、 _______、
_______ 。
5.水是生命之源,应建立节约用水和防治水污染的意识。
吸附法
沉淀法
过滤法
蒸馏法
练习1:下图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
(1)该硫酸未开启前质量为______克(盛装的瓶子除外);其中
溶质的质量是________克。
(2)欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升?
解:设需要这种硫酸的体积为V,则
1.84g/cm3×V×98%=600g×19.6%
V≈65.2cm3=65.2mL
答:需要这种硫酸65.2毫升。
920
901.6
练习2:下表是氢氧化钠溶液的密度与其质量分数对照表(20℃)。
回答下列问题:
(1)20℃时,随着溶质质量分数增大,氢氧化钠溶液的密度逐渐
变_____。
(2)配制100克10%的氢氧化钠溶液,需要氢氧化钠固体_____g。
(3)10℃时,体积为100毫升的氢氧化钠溶液质量为______g。
质量分数/% 10 20 30 40 50
密度/(克/厘米3) 1.11 1.22 1.33 1.43 1.53
大
10
111
第32课时 水和溶液
§分类一 水的组成和主要性质
水电解后的产物,水的组成
电解水实验
(1)现象:通电后,两个电极表面出现_____,一段
时间后,正极与负极的气体体积比约为 _____。
气泡
1∶2
(2)气体检验:用 _____________检验与正极相连的管中的气体,
发现 _________,证明此气体是 ______;用 ___________检验
与负极相连的管中的气体,发现该气体能_____,产生 _______
_____,证明此气体是_______。
(3)实验结论:水在通电的条件下生成 _____和 _____,说明水是
由_______和 _______组成的,同时也证明在化学变化中_______
可再分,而_______不可再分。化学变化的本质是_______分成
_______,_______重新组合成新的分子。
带火星的木条
木条复燃
氧气
燃着的木条
燃烧
淡蓝色
火焰
氢气
氢气
氧气
氢元素
氧元素
分子
原子
分子
原子
原子
水的化学性质
1.在通电时能发生分解反应。
化学方程式: ____________________。
2.常温下与某些氧化物反应。
(1)与某些非金属氧化物反应生成相应的酸,例:
_________________, _______________。
(2)与某些金属氧化物反应生成相应的碱,例:
____________________。
====
通电
2H2O 2H2↑+O2↑
SO3+H2O===H2SO4
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
§分类二 溶液、悬浊液和乳浊液
溶液的特点及溶液、悬浊液、乳浊液的区别
§分类三 饱和溶液与不饱和溶液、物质的溶解性及溶解度
饱和溶液与不饱和溶液的区别
1.饱和溶液与不饱和溶液
(1)在_________下,向一定量的溶剂里加入某溶质,当溶质
_______________时所得到的溶液叫做这种溶质的饱和溶液;
溶质还能_________,则该溶液叫做这种溶质的不饱和溶液。
(2)饱和溶液和不饱和溶液相互转化的条件和方法:
一定温度
不能再继续溶解
继续溶解
2.列举影响物质溶解性的一些因素
影响物质溶解性的因素有_______、_______的种类和温度。
【注意】比较不同物质的溶解性,必须在一定的温度、一定量的溶剂及该溶质不能再继续溶解的条件下进行比较。还要注意溶解性的大小不要与溶解的速度混淆,如振荡可以加快溶解,但不影响溶解性。
溶质
溶剂
物质溶解度的含义
1.引入溶解度的概念是为了能定量地表示物质的溶解性,有严格
的变量控制,在 ___________下,某物质在 ______溶剂中达到
___________时所溶解的_______为该物质在这种溶剂里的溶解
度。溶解度越大,表明该温度下物质的溶解性越_____。
2.温度对物质溶解度的影响
大部分固体物质的溶解度随温度的升高而______,如_______;
有的物质溶解度随温度变化很小,如 _______;个别固体物质
的溶解度随温度的升高而减小,如 _________。气体物质的溶
解度随温度的升高而 _____。
一定的温度
100克
饱和状态
质量
强
增大
硝酸钾
氯化钠
氢氧化钙
减小
§分类四 溶质的质量分数
关于“溶质的质量分数=溶质质量/溶液质量”的简单计算
溶质的质量分数是定量表示溶液浓度的一种方法。
1.概念:溶质的质量分数是 _________与 _________之比。
2.公式:
(1)溶液质量= _____的质量+_______的质量。
溶质质量
溶液质量
溶质
溶剂
3.溶液的质量、体积、密度的关系
溶液的质量m(溶液)= ______________。
ρ(溶液)×V(溶液)
配制一定溶质质量分数的溶液及有关配制方案、步
骤与操作方法
1.用食盐和水配制10%的食盐水50克(即固体物质与水配成溶液)
所需仪器:_________、_____、_______、_____、药匙、胶头滴
管等。
托盘天平
烧杯
玻璃棒
量筒
步骤:
(1)计算:配制此溶液需要氯化钠____克,水_____毫升。
(2)称量和量取:用托盘天平称取所需的氯化钠,放入烧杯中。
注意氯化钠放天平左盘,砝码放天平右盘。用50mL的量筒量取
所需的水,当倒入的水接近45mL时,改用 _________加水。
(3)溶解:将用量筒量取的水倒入盛有氯化钠的烧杯里,用_____
___搅拌。待氯化钠完全溶解时,10%的氯化钠溶液就配制好了。
5
45
胶头滴管
玻璃
棒
2.配制一定质量分数的稀硫酸
通过稀释的方法配制溶液,关键是抓住稀释前后,_____的质量
相等。用公式表示为: __________________。
溶质
m稀×ω稀=m浓×ω浓
§分类五 水污染
水体污染及防治;净化水的常用方法
1.水体有一定的自我净化能力,但当进入水体中的污染物超过
水体的自我净化能力时,就会造成水污染。水污染主要来源:
工业生产中的“三废”排放;生活污水的任意排放;农业生产
中_______、_______的滥用等。
2.水污染的危害:污染水源;氮、磷元素过多造成水体的
___________污染,形成“水华”和“赤潮”。
农药
化肥
富营养化
3.水污染的防治措施:控制污水的任意排放,对污水进行净化
处理,改善用水制度,研究无污染绿色新工业,合理、科学地
施用化肥和农药等。
4.水的净化方法:常见的有 _______、 _______、 _______、
_______ 。
5.水是生命之源,应建立节约用水和防治水污染的意识。
吸附法
沉淀法
过滤法
蒸馏法
练习1:下图是某学校实验室从化学试剂商店买回的硫酸试剂的标签上的部分内容,请阅读后计算:
(1)该硫酸未开启前质量为______克(盛装的瓶子除外);其中
溶质的质量是________克。
(2)欲配制600克溶质质量分数为19.6%的稀硫酸,需要这种硫酸多少毫升?
解:设需要这种硫酸的体积为V,则
1.84g/cm3×V×98%=600g×19.6%
V≈65.2cm3=65.2mL
答:需要这种硫酸65.2毫升。
920
901.6
练习2:下表是氢氧化钠溶液的密度与其质量分数对照表(20℃)。
回答下列问题:
(1)20℃时,随着溶质质量分数增大,氢氧化钠溶液的密度逐渐
变_____。
(2)配制100克10%的氢氧化钠溶液,需要氢氧化钠固体_____g。
(3)10℃时,体积为100毫升的氢氧化钠溶液质量为______g。
质量分数/% 10 20 30 40 50
密度/(克/厘米3) 1.11 1.22 1.33 1.43 1.53
大
10
111
同课章节目录
