备战2022 浙教版科学 中考一轮 第33课时 酸和碱 酸和碱之间的反应 知识梳理(课件 25张PPT)
文档属性
| 名称 | 备战2022 浙教版科学 中考一轮 第33课时 酸和碱 酸和碱之间的反应 知识梳理(课件 25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-12-29 21:34:47 | ||
图片预览







文档简介
(共26张PPT)
第33课时 酸和碱 酸和碱之间的反应
§分类一 物质的酸碱性与酸碱度
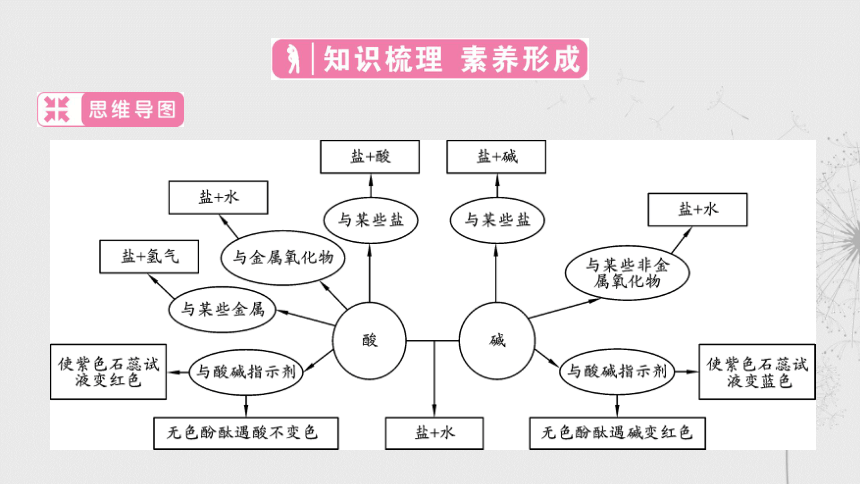
物质的酸碱性及判断方法
1.知道物质的酸碱性
酸性物质都含有共同的离子是 ___,碱性物质都含有共同的离
子是 ____。
2.溶液酸碱性的判定
实验室常用酸碱指示剂判定溶液的酸碱性,其中 _________和
___________是两种常用的酸碱指示剂。
H+
OH-
石蕊试液
酚酞试液
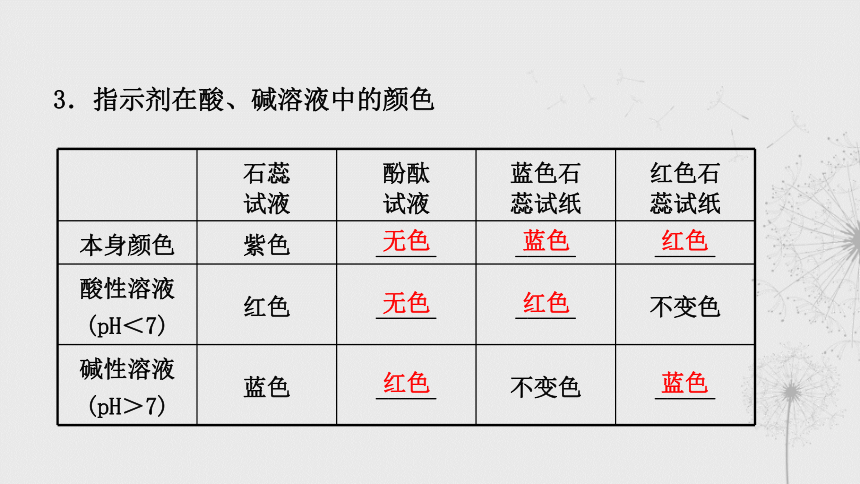
3.指示剂在酸、碱溶液中的颜色
石蕊
试液 酚酞
试液 蓝色石
蕊试纸 红色石
蕊试纸
本身颜色 紫色 _____ _____ _____
酸性溶液(pH<7) 红色 _____ _____ 不变色
碱性溶液(pH>7) 蓝色 _____ 不变色 _____
无色
蓝色
红色
无色
红色
红色
蓝色
用酸碱指示剂和pH试纸测定溶液的酸碱性
1.pH是反映物质酸碱性强弱的指标,它的范围通常在______之间。
(1)酸性溶液的pH_____7,pH越低,_____性越强。
(2)碱性溶液的pH_____7,pH越高,_____性越强。
(3)中性溶液的pH_____7。
0~14
<
酸
>
碱
=
测定的方法是:在白瓷板或玻璃片上放一小片pH试纸,用_______
_______蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与
___________对照,即可得出被测溶液的pH,此法测得的pH为整
数。注意pH试纸本身是_____,遇酸性物质颜色总体向 _______方
向变化;遇碱性物质,颜色总体向 _______方向变化。
洁净的
玻璃棒
标准比色卡
黄色
黄红色
蓝绿色
2.溶液酸碱度的应用
(1)化工生产中许多反应必须在一定pH溶液里才能进行。
(2)在农业生产中,农作物一般适宜在pH接近或等于7的土壤中
生长。
(3)测定雨水的pH:洁净的天然降水呈_____性,原因是_____
___________(用化学方程式表示)。酸雨的pH ______。
弱酸
CO2+
H2O===H2CO3
<5.6
§分类二 常见的酸
稀盐酸、稀硫酸的化学性质及其相似性
1.酸的含义:酸溶于水生成的阳离子全是 ___________,所以
它们在水溶液中表现相似的化学性质。
2.酸的通性
(1)与酸碱指示剂作用:使紫色石蕊试液变_____色,使无色酚酞
试液_______色。
氢离子(H+)
红
不变
(2)能与金属活动性顺序排在___以前的金属发生_____反应,生成
_____和___。如:铁与盐酸反应: ______________________,
锌与硫酸反应: ______________________(实验室制氢气的原理)。
(3)能与金属氧化物反应生成盐和水。如用盐酸除铁锈:
_________________________;稀硫酸与氧化铜反应:
CuO+H2SO4=== __________。
(4)能与碱发生中和反应生成盐和水。如
____________===NaCl+H2O;Ca(OH)2+H2SO4===___________。
氢
置换
氢气
盐
Fe+2HCl===FeCl2+H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe2O3+6HCl===2FeCl3+3H2O
CuSO4+H2O
NaOH+HCl
CaSO4+2H2O
(5)能与某些盐反应生成另一种盐和另一种酸。
①盐酸和硝酸银作用:_________________________(检验氯离子的原理);
②盐酸与碳酸钙作用:______________________________(实验室制二氧化碳的原理);
③硫酸与氯化钡作用:___________________________(检验硫酸根离子的原理)。
HCl+AgNO3===AgCl↓+HNO3
2HCl+CaCO3===CaCl2+H2O+CO2↑
H2SO4+BaCl2===BaSO4↓+2HCl
酸的个性
浓硫酸 浓盐酸
颜色状态 无色黏稠油状液体 无色液体
气味 无 _______气味
水溶性 溶于水,放出热量 溶于水,无明显放热
吸水性 _____________ 无
挥发性 无 易 _____,产生 _____
脱水性 ___ ___
腐蚀性 很强 强
刺激性
有很强吸水性
挥发
白雾
有
无
浓硫酸敞口放置,结果因_______使溶液质量增加,溶质质量分
数_______;浓盐酸敞口放置,会看到瓶口产生 _____,这是由于
___________________________________________________,结
果使溶液质量 _____,溶质质量分数 _____。所以两者都必须密
封保存。
吸水
降低
白雾
挥发的氯化氢气体吸收空气中的水蒸气产生的盐酸小液滴
减小
降低
浓硫酸的特性
1.吸水性:浓硫酸能吸收某些气体中的水分,常用作某些气体的
_______,如可干燥 ___________及 _________等。但不可干燥
氨气,原因是硫酸与氨气可以发生反应生成铵盐[(NH4)2SO4],其
化学反应方程式为 ______________________。
2.脱水性:浓硫酸能将植物纤维、人的皮肤等中的氢元素和氧元
素“脱出”结合成水。
干燥剂
氧气、氢气
二氧化碳
H2SO4+2NH3===(NH4)2SO4
3.腐蚀性:浓硫酸有强烈的腐蚀性,如不慎将浓硫酸溅到衣服或
皮肤上时,要先用 _____拭去,再用 _________冲洗,最后涂上
3%~5%的小苏打(NaHCO3)溶液。
4.浓硫酸的稀释:由于浓硫酸的密度比水的密度_____且溶于水
时 _____________。因此,稀释浓硫酸时,一定要把 _______注
入_____中,并用玻璃棒不断_______。
干布
大量的水
大
放出大量的热
浓硫酸
水
搅拌
酸的用途
盐酸可用于化工产品、除锈、胃液中帮助消化等;硫酸可用于化工原料、生产化肥、农药、火药、除锈、精炼石油等。
盐酸与硫酸的区别
由于硝酸银遇硫酸生成的硫酸银是微溶的,可能形成沉淀,所以
区别盐酸与硫酸应选用 _______试剂,不选用 _______试剂。
氯化钡
硝酸银
§分类三 常见的碱
碱的相似性
1.碱的含义:解离时生成阴离子全是________________的化合
物。碱的水溶液中有共同的 ________________,所以表现相似
的化学性质。
2.碱的通性
(1)可溶性碱能与酸碱指示剂作用,使紫色石蕊试液变_____色,
使无色酚酞变_____色。
氢氧根离子(OH-)
氢氧根离子(OH-)
蓝
红
(2)可溶性碱能与某些非金属氧化物反应,生成_____和水。如:
CO2与NaOH反应的化学方程式为(吸收二氧化碳):
_________________________;
SO2与NaOH反应的化学方程式为(吸收二氧化硫):
_________________________;
CO2与Ca(OH)2反应的化学方程式为(检验二氧化碳):
____________________________。
盐
2NaOH+CO2===Na2CO3+H2O
2NaOH+SO2===Na2SO3+H2O
Ca(OH)2+CO2===CaCO3↓+H2O
(3)能与酸发生中和反应生成盐和水。如:
NaOH与稀硫酸反应的化学方程式为:
__________________________;
Ca(OH)2与稀硫酸反应的化学方程式为:
_____________________________。(中和酸性土壤)
(4)可溶性碱和某些可溶性盐发生复分解反应。如:
NaOH与CuSO4反应的化学方程式为:
__________________________________;
Ca(OH)2与Na2CO3反应的化学方程式为(制少量烧碱):
__________________________________。
2NaOH+H2SO4===Na2SO4+2H2O
Ca(OH)2+H2SO4===CaSO4+2H2O
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
氢氧化钠和氢氧化钙
氢氧化钠 氢氧化钙
俗称 ___________________ _________________
颜色状态 白色块状或片状,固体 白色粉末,固体
溶解性 _____,溶解时 _____________ _____
腐蚀性 _____,不慎将NaOH溶液溅到皮肤上,要先用较多的水冲洗,再涂上硼酸溶液 较强
苛性钠、火碱、烧碱
熟石灰 、 消石灰
易溶
放出大量的热
微溶
很强
氢氧化钠 氢氧化钙
吸水性 _____,暴露在空气中易_____,且
同时吸收 _________而变质。氢氧
化钠可作为某些气体的 _______ 无吸水性,暴露在空
气中会吸收_________ 而变质
用途 作干燥剂;作化工原料,应用于
_____、 _________、 _____、制锅等工业 作建筑材料、改良
_______土壤等
制取 电解食盐水:
2NaCl+2H2O2NaOH+H2↑+Cl2↑ 生石灰与水反应:
____________________
很强
潮解
二氧化碳
干燥剂
二氧化碳
制皂
精炼石油
造纸
酸性
CaO+H2O===Ca(OH)2
(1)NaOH必须密封保存,碱液不能存放在玻璃瓶塞的试剂瓶中;
(2)由于NaOH易溶、Ca(OH)2微溶,故实验室常用NaOH溶液吸收CO2,而用Ca(OH)2溶液检验CO2。
§分类四 酸和碱之间发生的反应
酸和碱反应的实质
1.酸碱反应的特点
酸与碱作用一定生成 _______。
2.氢氧化钠溶液与稀盐酸、稀硫酸的反应
实验中滴加酚酞的作用是 _______________________。
3.实质:酸溶液中的 ___和碱溶液中的 ____结合生成_____的
过程。
盐和水
指示酸碱中和反应的发生
H+
OH-
H2O
酸碱反应在生产、生活中的应用
1.改变土壤的酸碱性。用_________来改良酸性土壤。
2.处理工业废水。用熟石灰来处理含硫酸的工业废水,化学反
应方程式为:
_____________________________。
3.用于医药。常用含Al(OH)3的药物来中和胃酸,化学反应方
程式为:
_____________________________。
Ca(OH)2
Ca(OH)2+H2SO4===CaSO4+2H2O
Al(OH)3+3HCl===AlCl3+3H2O
第33课时 酸和碱 酸和碱之间的反应
§分类一 物质的酸碱性与酸碱度
物质的酸碱性及判断方法
1.知道物质的酸碱性
酸性物质都含有共同的离子是 ___,碱性物质都含有共同的离
子是 ____。
2.溶液酸碱性的判定
实验室常用酸碱指示剂判定溶液的酸碱性,其中 _________和
___________是两种常用的酸碱指示剂。
H+
OH-
石蕊试液
酚酞试液
3.指示剂在酸、碱溶液中的颜色
石蕊
试液 酚酞
试液 蓝色石
蕊试纸 红色石
蕊试纸
本身颜色 紫色 _____ _____ _____
酸性溶液(pH<7) 红色 _____ _____ 不变色
碱性溶液(pH>7) 蓝色 _____ 不变色 _____
无色
蓝色
红色
无色
红色
红色
蓝色
用酸碱指示剂和pH试纸测定溶液的酸碱性
1.pH是反映物质酸碱性强弱的指标,它的范围通常在______之间。
(1)酸性溶液的pH_____7,pH越低,_____性越强。
(2)碱性溶液的pH_____7,pH越高,_____性越强。
(3)中性溶液的pH_____7。
0~14
<
酸
>
碱
=
测定的方法是:在白瓷板或玻璃片上放一小片pH试纸,用_______
_______蘸取被测试的溶液,滴在pH试纸上,将试纸显示的颜色与
___________对照,即可得出被测溶液的pH,此法测得的pH为整
数。注意pH试纸本身是_____,遇酸性物质颜色总体向 _______方
向变化;遇碱性物质,颜色总体向 _______方向变化。
洁净的
玻璃棒
标准比色卡
黄色
黄红色
蓝绿色
2.溶液酸碱度的应用
(1)化工生产中许多反应必须在一定pH溶液里才能进行。
(2)在农业生产中,农作物一般适宜在pH接近或等于7的土壤中
生长。
(3)测定雨水的pH:洁净的天然降水呈_____性,原因是_____
___________(用化学方程式表示)。酸雨的pH ______。
弱酸
CO2+
H2O===H2CO3
<5.6
§分类二 常见的酸
稀盐酸、稀硫酸的化学性质及其相似性
1.酸的含义:酸溶于水生成的阳离子全是 ___________,所以
它们在水溶液中表现相似的化学性质。
2.酸的通性
(1)与酸碱指示剂作用:使紫色石蕊试液变_____色,使无色酚酞
试液_______色。
氢离子(H+)
红
不变
(2)能与金属活动性顺序排在___以前的金属发生_____反应,生成
_____和___。如:铁与盐酸反应: ______________________,
锌与硫酸反应: ______________________(实验室制氢气的原理)。
(3)能与金属氧化物反应生成盐和水。如用盐酸除铁锈:
_________________________;稀硫酸与氧化铜反应:
CuO+H2SO4=== __________。
(4)能与碱发生中和反应生成盐和水。如
____________===NaCl+H2O;Ca(OH)2+H2SO4===___________。
氢
置换
氢气
盐
Fe+2HCl===FeCl2+H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe2O3+6HCl===2FeCl3+3H2O
CuSO4+H2O
NaOH+HCl
CaSO4+2H2O
(5)能与某些盐反应生成另一种盐和另一种酸。
①盐酸和硝酸银作用:_________________________(检验氯离子的原理);
②盐酸与碳酸钙作用:______________________________(实验室制二氧化碳的原理);
③硫酸与氯化钡作用:___________________________(检验硫酸根离子的原理)。
HCl+AgNO3===AgCl↓+HNO3
2HCl+CaCO3===CaCl2+H2O+CO2↑
H2SO4+BaCl2===BaSO4↓+2HCl
酸的个性
浓硫酸 浓盐酸
颜色状态 无色黏稠油状液体 无色液体
气味 无 _______气味
水溶性 溶于水,放出热量 溶于水,无明显放热
吸水性 _____________ 无
挥发性 无 易 _____,产生 _____
脱水性 ___ ___
腐蚀性 很强 强
刺激性
有很强吸水性
挥发
白雾
有
无
浓硫酸敞口放置,结果因_______使溶液质量增加,溶质质量分
数_______;浓盐酸敞口放置,会看到瓶口产生 _____,这是由于
___________________________________________________,结
果使溶液质量 _____,溶质质量分数 _____。所以两者都必须密
封保存。
吸水
降低
白雾
挥发的氯化氢气体吸收空气中的水蒸气产生的盐酸小液滴
减小
降低
浓硫酸的特性
1.吸水性:浓硫酸能吸收某些气体中的水分,常用作某些气体的
_______,如可干燥 ___________及 _________等。但不可干燥
氨气,原因是硫酸与氨气可以发生反应生成铵盐[(NH4)2SO4],其
化学反应方程式为 ______________________。
2.脱水性:浓硫酸能将植物纤维、人的皮肤等中的氢元素和氧元
素“脱出”结合成水。
干燥剂
氧气、氢气
二氧化碳
H2SO4+2NH3===(NH4)2SO4
3.腐蚀性:浓硫酸有强烈的腐蚀性,如不慎将浓硫酸溅到衣服或
皮肤上时,要先用 _____拭去,再用 _________冲洗,最后涂上
3%~5%的小苏打(NaHCO3)溶液。
4.浓硫酸的稀释:由于浓硫酸的密度比水的密度_____且溶于水
时 _____________。因此,稀释浓硫酸时,一定要把 _______注
入_____中,并用玻璃棒不断_______。
干布
大量的水
大
放出大量的热
浓硫酸
水
搅拌
酸的用途
盐酸可用于化工产品、除锈、胃液中帮助消化等;硫酸可用于化工原料、生产化肥、农药、火药、除锈、精炼石油等。
盐酸与硫酸的区别
由于硝酸银遇硫酸生成的硫酸银是微溶的,可能形成沉淀,所以
区别盐酸与硫酸应选用 _______试剂,不选用 _______试剂。
氯化钡
硝酸银
§分类三 常见的碱
碱的相似性
1.碱的含义:解离时生成阴离子全是________________的化合
物。碱的水溶液中有共同的 ________________,所以表现相似
的化学性质。
2.碱的通性
(1)可溶性碱能与酸碱指示剂作用,使紫色石蕊试液变_____色,
使无色酚酞变_____色。
氢氧根离子(OH-)
氢氧根离子(OH-)
蓝
红
(2)可溶性碱能与某些非金属氧化物反应,生成_____和水。如:
CO2与NaOH反应的化学方程式为(吸收二氧化碳):
_________________________;
SO2与NaOH反应的化学方程式为(吸收二氧化硫):
_________________________;
CO2与Ca(OH)2反应的化学方程式为(检验二氧化碳):
____________________________。
盐
2NaOH+CO2===Na2CO3+H2O
2NaOH+SO2===Na2SO3+H2O
Ca(OH)2+CO2===CaCO3↓+H2O
(3)能与酸发生中和反应生成盐和水。如:
NaOH与稀硫酸反应的化学方程式为:
__________________________;
Ca(OH)2与稀硫酸反应的化学方程式为:
_____________________________。(中和酸性土壤)
(4)可溶性碱和某些可溶性盐发生复分解反应。如:
NaOH与CuSO4反应的化学方程式为:
__________________________________;
Ca(OH)2与Na2CO3反应的化学方程式为(制少量烧碱):
__________________________________。
2NaOH+H2SO4===Na2SO4+2H2O
Ca(OH)2+H2SO4===CaSO4+2H2O
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
氢氧化钠和氢氧化钙
氢氧化钠 氢氧化钙
俗称 ___________________ _________________
颜色状态 白色块状或片状,固体 白色粉末,固体
溶解性 _____,溶解时 _____________ _____
腐蚀性 _____,不慎将NaOH溶液溅到皮肤上,要先用较多的水冲洗,再涂上硼酸溶液 较强
苛性钠、火碱、烧碱
熟石灰 、 消石灰
易溶
放出大量的热
微溶
很强
氢氧化钠 氢氧化钙
吸水性 _____,暴露在空气中易_____,且
同时吸收 _________而变质。氢氧
化钠可作为某些气体的 _______ 无吸水性,暴露在空
气中会吸收_________ 而变质
用途 作干燥剂;作化工原料,应用于
_____、 _________、 _____、制锅等工业 作建筑材料、改良
_______土壤等
制取 电解食盐水:
2NaCl+2H2O2NaOH+H2↑+Cl2↑ 生石灰与水反应:
____________________
很强
潮解
二氧化碳
干燥剂
二氧化碳
制皂
精炼石油
造纸
酸性
CaO+H2O===Ca(OH)2
(1)NaOH必须密封保存,碱液不能存放在玻璃瓶塞的试剂瓶中;
(2)由于NaOH易溶、Ca(OH)2微溶,故实验室常用NaOH溶液吸收CO2,而用Ca(OH)2溶液检验CO2。
§分类四 酸和碱之间发生的反应
酸和碱反应的实质
1.酸碱反应的特点
酸与碱作用一定生成 _______。
2.氢氧化钠溶液与稀盐酸、稀硫酸的反应
实验中滴加酚酞的作用是 _______________________。
3.实质:酸溶液中的 ___和碱溶液中的 ____结合生成_____的
过程。
盐和水
指示酸碱中和反应的发生
H+
OH-
H2O
酸碱反应在生产、生活中的应用
1.改变土壤的酸碱性。用_________来改良酸性土壤。
2.处理工业废水。用熟石灰来处理含硫酸的工业废水,化学反
应方程式为:
_____________________________。
3.用于医药。常用含Al(OH)3的药物来中和胃酸,化学反应方
程式为:
_____________________________。
Ca(OH)2
Ca(OH)2+H2SO4===CaSO4+2H2O
Al(OH)3+3HCl===AlCl3+3H2O
同课章节目录
