第九单元 溶液 复习与测试—2021-2022学年九年级化学人教版下册(word版 含解析)
文档属性
| 名称 | 第九单元 溶液 复习与测试—2021-2022学年九年级化学人教版下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 128.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-12-29 09:35:11 | ||
图片预览




文档简介
第九单元复习与测试
一、选择题(共16题)
1.把下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.碘 B.面粉
C.蔗糖 D.花生油
2.将80g溶质质量分数为36%的浓盐酸稀释成18%的稀盐酸,需加水的质量为( )
A.80g
B.100g
C.200g
D.280g
3.下列各组物质混合后,可形成溶液的是( )
A.石灰水与CO2 B.KMnO4与水 C.豆浆与水 D.面粉与水
4.将下列物质放入水中,不能形成溶液的是
A.食盐 B.味精 C.蔗糖 D.花生油
5.下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水
C.白醋 D.自来水
6.在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
A.氯化钠的取用
B.氯化钠的称量
C.水的取用
D.氯化钠的溶解
7.下列关于溶液的说法不正确的是( )
A.可以用肥皂水区分硬水和软水 B.饱和溶液一定比不饱和溶液浓
C.氢氧化钠固体溶于水会放出热量 D.溶液一定是混合物
8.下列物质溶于水,能使溶液温度降低的是( )
A.硝酸铵 B.氧化钙 C.氢氧化钠 D.浓硫酸
9.将80g质量分数为35%的浓盐酸,稀释成14%的稀盐酸,需加水的质量为( )
A.80g B.100g C.120g D.200g
10.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
11.几种物质的溶解度曲线如下图。则下列说法正确的是 ( )
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,等质量的三种饱和溶液,硫酸钠析出晶体最多
12.通过学习化学,要学会善于用化学知识去分析、解决生产生活中的问题。从化学的角度看,下列说法错误的是( )
A.洗洁净等含表面活性剂的物质对油污有乳化作用
B.用燃着的火柴检查液化气钢瓶是否漏气
C.进入山洞探险,先做灯火实验
D.室内起火时不要急于打开所有门窗
13.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是( )
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
14.下列有关溶液的说法中,正确的是( )
A.不饱和溶液转化为饱和溶液,其溶液质量分数一定增大
B.饱和溶液析出晶体后其溶质质量分数一定减少
C.温度升高,某饱和溶液中溶质的质量分数一定减少
D.降温时饱和溶液可能无晶体析出
15.下列比较中,不符合实际的是( )
A.钢片比纯铁片的硬度大
B.食盐水的导电能力比酒精溶液强
C.20℃时,饱和硝酸钾溶液的浓度大于饱和石灰水的浓度
D.地壳中铝的含量比硅多
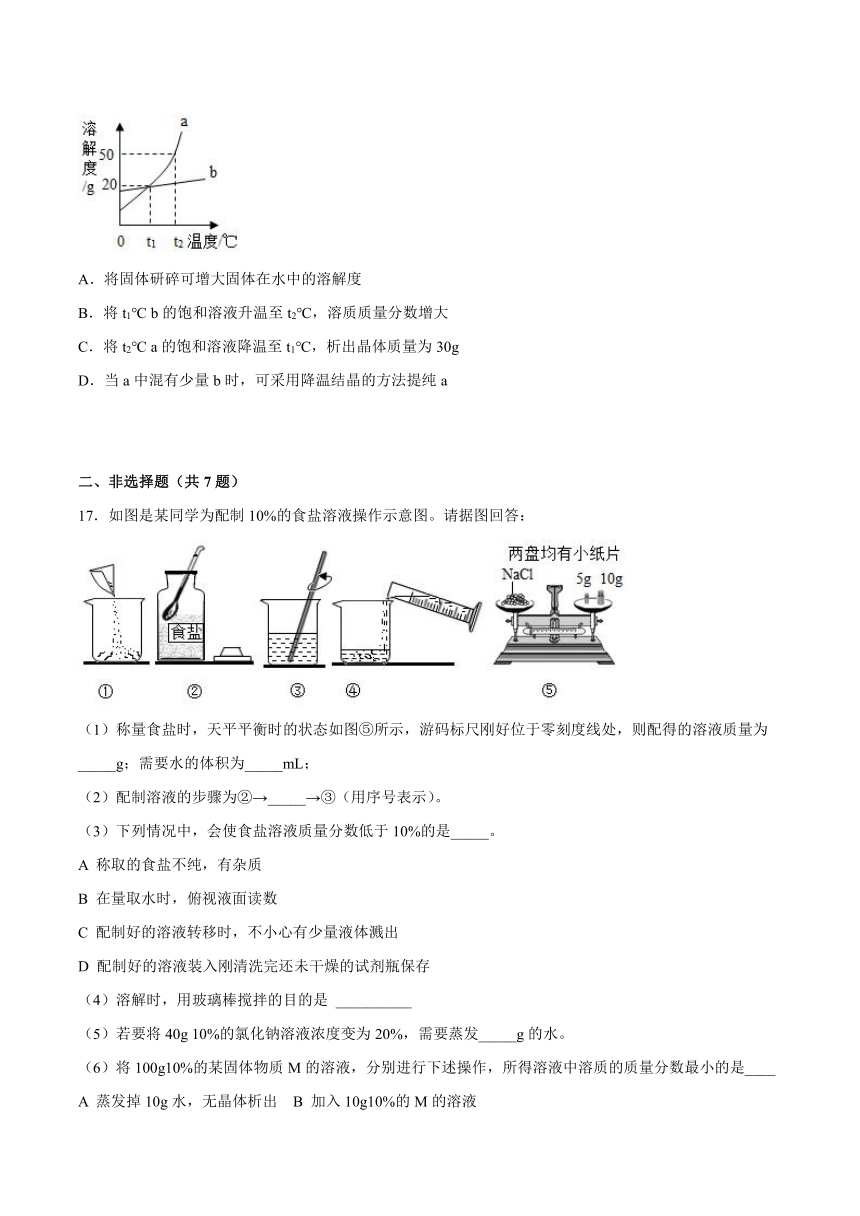
16.如图是a、b两种固体的溶解度曲线,下列说法正确的是( )
A.将固体研碎可增大固体在水中的溶解度
B.将t1℃ b的饱和溶液升温至t2℃,溶质质量分数增大
C.将t2℃ a的饱和溶液降温至t1℃,析出晶体质量为30g
D.当a中混有少量b时,可采用降温结晶的方法提纯a
二、非选择题(共7题)
17.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)称量食盐时,天平平衡时的状态如图⑤所示,游码标尺刚好位于零刻度线处,则配得的溶液质量为_____g;需要水的体积为_____mL;
(2)配制溶液的步骤为②→_____→③(用序号表示)。
(3)下列情况中,会使食盐溶液质量分数低于10%的是_____。
A 称取的食盐不纯,有杂质
B 在量取水时,俯视液面读数
C 配制好的溶液转移时,不小心有少量液体溅出
D 配制好的溶液装入刚清洗完还未干燥的试剂瓶保存
(4)溶解时,用玻璃棒搅拌的目的是 __________
(5)若要将40g 10%的氯化钠溶液浓度变为20%,需要蒸发_____g的水。
(6)将100g10%的某固体物质M的溶液,分别进行下述操作,所得溶液中溶质的质量分数最小的是____
A 蒸发掉10g水,无晶体析出 B 加入10g10%的M的溶液
C 加入10g固体M,并使之完全溶解 D 加入10g水
18.20℃时,在盛有100g水的烧杯中加入30g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时所得溶液的质量。测定结果记录如下表。
溶液的温度/℃ 20 35 50 65 75
所得溶液质量/g 111 120 128 130 130
若不考虑水蒸发对实验的影响,请回答下列问题。
① 35℃时,溶质的质量是__________g;
② 65℃时,该溶液是_________ (选填编号);
Ⅰ.饱和溶液 Ⅱ.不饱和溶液 Ⅲ.无法判断
③ 根据下表溶解度与溶解性的关系,可知X属于_____________ 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度 (20℃,g/100g水) >10 1—10 0.01—1 <0.01
④ 35℃时,使烧杯中未溶解的固体X全部溶解,至少加入__________g水;
⑤ 20℃时,配制100g溶质质量分数为5%的X溶液,需X固体粉末 _______克 ,水____克。
19.请你各举出一个实例,说明下列有关溶液的叙述是错误的。
①溶液一定是无色的。实例:溶液不是无色的;_____
②均一、稳定的液体都是溶液。实例:是液体,但不是溶液;_____
③溶液中的溶质一定是固体。实例:可做溶质,但不是固体。_____。
20.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
21.水与溶液在生产生活中有广泛的用途。
(1)将硬水转化为软水的原理是将硬水中溶有较多含 ________ (填元素符号,下同)、 ________ 的物质除去。
(2)在水中加入洗涤剂可增强去油污的能力,这是因为洗涤剂有 ________ 作用。
(3)自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为 ________ 。
(4)如图为甲、乙、丙三种物质的溶解度曲线。
①在30℃时,向30g甲物质中加入50g水,充分搅拌后,需再加入 ________ g水恰好形成饱和溶液。
②若甲中混有少量乙,采用 ________ 的方法提纯甲。
③30℃时,将甲、乙、丙的饱和溶液降温到10℃,所得溶液的溶质质量分数最小的是 _______ 。
22.取100g溶质质量分数为8%的氢氧化钠溶液,加入一定量溶质质量分数为20%的硫酸铜溶液,恰好完全反应,反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,求:
(1)反应生成沉淀的质量为__________。
(2)反应后所得溶液中溶质的质量分数为__________。(精确到0.1%)
23.无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。现有西红柿无土栽培营养液中,含硝酸钾(KNO3)的溶质质量分数为5%,请填空:
(1)硝酸钾由 _____ 种元素组成,其中氮、氧两种元素质量比为(最简整数比) _____ ;
(2)某同学练习配制该无土栽培营养液80g,需KNO3_______ g.
下图是该同学配制的实验操作示意图:
(3)量取所需要的水应选择 ____ (选填“10mL”“50mL”或“100mL”)量筒.用上述图示的序号表示配制溶液的操作顺序: ____ ;
(4)要使该溶液的质量分数增大一倍,可以采用增加溶质和 ____ 等方法。请你选取其中一种方法通过计算说明(要有解题过程和必要的文字说明;所选方法如有小数,请保留小数点后两位数)
参考答案
1.C
【详解】
A、碘几乎不溶于水,与水混合形成悬浊液,故A错;B、面粉不溶于水,与水混合形成悬浊液,故B错;C、蔗糖易溶于水,形成均一稳定的混合物,属于溶液,故C正确;
D、花生油不溶于水,与水混合形成乳浊液,故D错;故选C。
2.A
【详解】
设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,则80g×36%=(80g+x)×18% x=80g。故选A。
3.B
【详解】
A、石灰水与二氧化碳发生反应生成难溶于水的碳酸钙,不能形成均一、稳定的混合物,故选项错误;
B、高锰酸钾易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液.故选项正确;
C、豆浆不溶于水,不能形成均一、稳定的混合物.故选项错误;
D、面粉不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.故选项错误;
故选B。
4.D
【详解】
A、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故A错误;
B、味精易溶于水,形成均一、稳定的混合物,属于溶液,故B错误;
C、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故C错误;
D、花生油难溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故D正确。
5.A
【详解】
A、洗洁精对油污有乳化作用,可以将油污分散成细小液滴扩散到水中,而被冲洗掉,选项正确;
B、食盐水对油污没有洗涤作用,选项错误;
C、白醋对油污没有洗涤作用,选项错误;
D、自来水对油污没有洗涤作用,选项错误。
故选A。
6.C
【详解】
A、取用氯化钠时,瓶塞应倒放,用药匙取药品,图中实验操作正确;
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作正确;
C、量取水时,量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中视线没有与量筒内液体的凹液面的最低处保持水平,所示操作错误;
D、溶解氯化钠时,为了加速其溶解,可以用玻璃棒搅拌,图中实验操作正确。故选C。
7.B
【详解】
A. 可以用肥皂水区分硬水和软水,硬水有浮渣,泡沫少;软水无浮渣,泡沫多;说法正确,故不符合题意;
B. 饱和溶液不一定比不饱和溶液浓,如氢氧化钙饱和溶液比氢氧化钠的不饱和溶液浓度要小,这里还要看温度和溶解度,说法不正确,故符合题意;
C. 氢氧化钠固体溶于水会放出热量,使得溶液温度升高,说法正确,故不符合题意;
D. 溶液是均一的、稳定的混合物,故溶液一定是混合物,说法正确;故不符合题意;
故选B
8.A
【详解】
物质溶于水有三种现象如氧化钙、氢氧化钠、浓硫酸溶于水放热,使溶液的温度升高;硝酸铵溶于水吸热溶液的温度降低;绝大部分物质溶于水温度变化不大。
故选A。
9.C
【详解】
根据溶液稀释前后溶质不变,80g×35%=14%×﹙80g+x﹚,x=120g.故选C。
10.D
【详解】
A.根据图示可知,甲的溶解度是102.5g没有指明是在70℃时,选项A不正确;
B.甲的溶解度在0℃到70℃时随温度的升高而增大,当温度大于70℃时,其溶解度随温度的升高而减小,选项B不正确;
C.20℃时,甲的溶解度为28.6 g 。即:在20℃时在100 g水中溶解28.6 g甲可达到饱和,20℃时,100 g甲的饱和溶液中溶质质量小于28.6 g,选项C不正确;
D.因为70℃时甲的溶解度最大,所以将其饱和溶液升高温度或降低温度,都会因为溶解度减小而使甲无法完全溶解,都有晶体析出,选项D正确。故选D。
11.D
【详解】
说溶解度大小必须指明温度,故A错误
高于40℃时,硫酸钠的溶解度变小,故B错误。
40摄氏度时,硫酸钠的溶解度为50克,指的是在100克水中最多能溶解50克硫酸钠,其饱和溶液的质量分数为50/150,不可能是50%,故C错误。
40℃时饱和溶液降温到20℃时,硫酸钠的溶解度变化最大,所以,等质量的三种饱和溶液,硫酸钠析出晶体最多故D正确。
12.B
【详解】
A、洗洁净中有乳化剂,能把油污变成细小的油滴,即有乳化作用,正确;
B、可燃性的气体与空气混合后点燃易爆炸,用燃着的火柴检查可燃的液化气是否泄漏,有爆炸的危险,错误;C、二氧化碳的密度比空气大,易聚集于山洞中,且二氧化碳不能供给呼吸,浓度过大会窒息死亡,二氧化碳不能燃烧也不能支持燃烧,做灯火实验可知山洞中二氧化碳浓度是否过高,正确。D、室内起火时,打开所有门窗通风,会使室内空气对流,为燃烧提供了大量的氧气,会引起火势蔓延,室内起火时不要急于打开所有门窗,正确。故选B。
13.A
【详解】
配制一定溶质质量分数的溶液,正确的操作步骤为:1、计算溶质和溶剂的质量,2、用托盘天平称量所需溶质的质量,倒入烧杯中,3、把水的密度近似看作1g/cm3,用量筒和胶头滴管量取所需的水,4、用玻璃棒搅拌。故选A。
14.D
【详解】
A、溶液不一定是无色透明的,如硫酸铜溶液是蓝色的,故选项说法错误;B、当采取改变温度使饱和溶液析出晶体时,溶液中的溶质质量减少而溶剂质量不变,溶液的溶质质量分数减小,而采取恒温蒸发溶剂的方法使饱和溶液析出晶体时,由于温度不变物质的溶解度不变,根据饱和溶液的溶质质量分数=溶解度100g+溶解度×100%,饱和溶液的溶质质量分数也不变,故B错误;C、大多数物质的溶解度随着温度的降低而增大,温度升高,若有溶质继续溶解,该饱和溶液中溶质的质量分数增大;若溶质继续溶解,该饱和溶液中溶质的质量分数不变,故选项说法错误;D、有些物质的饱和溶液随着温度的降低而增大,降温时,溶解度增大,饱和溶液无晶体析出,故选项说法正确;故选D。
15.D
【解析】A. 钢是铁的合金,合金的硬度比纯的金属大,所以钢片比纯铁片的硬度大; B. 食盐水中有钠离子和氯离子能导电,酒精溶液中微粒是酒精分子、水分子,没有自由带电荷微粒,导电能力比酒精溶液强;C. 影响溶解度的因素有温度,溶质、溶剂的种类,硝酸钾属于易溶物,氢氧化钙是微溶物,20℃时,饱和硝酸钾溶液的浓度大于饱和石灰水的浓度。 D. 地壳中元素的含量按质量分数由多到少的顺序是,氧、硅、铝、铁、钙……铝的含量比硅低。选D
16.D
【分析】
A、根据物质的溶解度只随温度的变化而变化分析;
B、根据b物质的溶解度随温度升高而增大,及溶质的质量分数变化分析;
C、根据溶解度曲线图,判断晶体析出情况;
D、根据物质的溶解度随温度变化情况分析。
【详解】
A、物质的溶解度只随温度的变化而变化,将固体研碎不能增大固体在水中的溶解度,故A选项说法错误;
B、由图可知:b的溶解度随温度的升高变化不大,将t1℃时b物质的饱和溶液升温至t2℃(溶剂量不变),b变为不饱和溶液,溶质的质量不变,溶剂的质量不变,则溶液中溶质质量分数不变,故B选项说法错误;
C、将t2℃ a的饱和溶液降温至t1℃,析出晶体质量不一定为30g,选项中没有说明饱和溶液的质量,故C选项说法错误;
D、a的溶解度随温度的升高而增大,b的溶解度受温度影响不大,当a中混有少量b时,可采用降温结晶的方法提纯a,故D选项说法正确。故选D。
17.150 135 ⑤①④ AD 加速溶解 20 D
【详解】
(1)溶液质量= ,水的质量 ,故水体积135mL;
(2)配制溶液的步骤为:先从广口瓶中取食盐,将取得的食盐放在天平左盘,将称得的食盐放在烧杯中,用量筒量取水,倒入烧杯中,用玻璃棒搅拌即可,用序号表示为:②⑤①④③,故填:⑤①④
(3) A、 称取的食盐不纯,有杂质会使食盐溶液质量分数低于10%符合题意;
B、 在量取水时俯视液面读数水偏少,会使溶液质量分数高于10%,不符合题意;
C、溶液转移时不小心有少量液体溅出对溶质质量分数没影响,不符合题意;
D、 配制好的溶液装入刚清洗完还未干燥的试剂瓶保存,溶液被稀释会使食盐溶液质量分数低于10%符合题意,故选:AD。
(4)溶解时,用玻璃棒搅拌的目的是加速溶解,故填:加速溶解;
(5)设需蒸发水的质量为x故:
故填:20
(6)A、蒸发掉10g水后溶质质量分数增大,大于10%;
B、加入10g10%的M溶液,等浓度混合质量分数不变还是10%;
C、加入10g固体M溶液浓度增大大于10%;
D、加入10g水,溶液被稀释浓度变小质量分数小于10%;故D最小选D。
18.20 Ⅲ 易溶 50 5 95
【解析】
①根据表格提供的数据可以知道,在35℃时,溶液的质量为120g,溶质的质量为120g-100g=20g;②65℃时,该溶液中不存在未溶解的固体,不能确定溶液是否饱和;③20℃时,溶液的质量为111g,溶质的质量为111g-100g=11g,说明在该温度下X的溶解度是11g,11g>10g,属于易溶物质;④在35℃时,溶液的质量为120g,溶质的质量为120g-100g=20g,说明在该温度下X的溶解度是20g,剩余固体的质量=30g-20g=10g,使烧杯中未溶解的固体X全部溶解,需要水的质量==50 g;⑤20℃时,配制100g溶质质量分数为5%的X溶液,需X固体粉末的质量=100g5%=5g;需要水的质量=100g-5g=95 g。
19.(1)硫酸铜溶液(或碘酒)
(2)蒸馏水
(3)氯化氢气体(或酒精)
【详解】
(1)硫酸铜溶液是蓝色的;
(2)水是均一、稳定的液体不是溶液,属于纯净物;
(3)酒精溶液中溶质是液体。
20.③ 硝酸钾(或KNO3) 不饱和溶液
【详解】
(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响,这就需要控制其他因素保持不变。
(2)①从表中数据可知,氯化钠和硝酸钾两种物质中,溶解度受温度影响较大的是硝酸钾。②20℃时,NaCl的溶解度大于KNO3的溶解度,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,烧杯甲中有有固体未溶解完,乙烧杯中的物质全部溶解,故烧杯甲中溶质是硝酸钾,因此加入的物质质量31.6g<m≤36g,而50℃时,硝酸钾的溶解度是85.5g,故50℃时甲烧杯中的溶液一定是不饱和溶液。
21.Ca、Mg 乳化 CaO + H2O=Ca(OH)2 25 冷却热饱和溶液 丙
【详解】
(1)将硬水转化为软水的原理是:将硬水中溶有较多含Ca、Mg的物质除去;故答案为Ca;Mg;
(2)在水中加入洗涤剂可增强去油污的能力,这是因为洗涤剂有乳化作用;故答案为乳化;
(3)生石灰与水反应生成熟石灰;故答案为 ;
(4)①设30℃时,30g甲物质到达饱和状态需要水的质量为x, ,x=75g,75g﹣50g=25g;②若甲中混有少量乙,采用降温结晶或冷却热饱和溶液的方法提纯甲,因为甲的溶解度受温度的影响变化比较大;③30℃时,将甲、乙、丙的饱和溶液降温到10℃,所得溶液的溶质质量分数最小的是丙,因为降温后丙的质量分数不变,还是最小;故答案为①25;②降温结晶或冷却热饱和溶液;③丙。
22.9.8g
解:设反应消耗的CuSO4的质量为x,反应生成的Cu(OH)2的质量为y,生成Na2SO4的质量为z,则
8.3%
因此硫酸铜溶液的质量为16g÷20%=80g
反应后溶液的质量为100g+80g-9.8g=170.2g
所以,反应后所得溶液中溶质的质量分数为×100% ≈8.3%
答:反应生成的沉淀的质量为9.8g;反应后所得溶液中溶质的质量分数为8.3%。
【详解】
(1)见答案;
(2)见答案。
23.3 7:24 4 100mL ④①②⑤③ 采用蒸发水的方法使其溶质的质量分数增大一倍,设需要蒸发水的质量为x,则
=10% x=40g;
采用加入溶质的方法使其溶质的质量分数增大一倍,设需要加入硝酸钾的质量为y,则
=10% y=4.44g。
答:可蒸发掉40g水或加入4.44g硝酸钾
【分析】
根据量筒的选择依据以及配制溶液的方法来分析;可以利用蒸发水和加溶质的方法使之浓度变大。
【详解】
(1)根据硝酸钾的化学式可知,硝酸钾由钾、氮、氧3种元素组成,其中氮、氧两种元素质量比=14:16×3=7:24;
(2)配制该无土栽培营养液80g,需KNO3的质量=80g×5%=4g;
(3)配制该无土栽培营养液80g,需KNO3=80g×5%=4g,需水的质量=80g-4g=76g,则水的体积为76mL,应选用100mL量筒;由配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,可知配制溶液的操作顺序是:④①②⑤③;
(4)采用蒸发水的方法使其溶质的质量分数增大一倍,设需要蒸发水的质量为x,则
=10% x=40g;
采用加入溶质的方法使其溶质的质量分数增大一倍,设需要加入硝酸钾的质量为y,则
=10% y=4.44g。
答:可蒸发掉40g水或加入4.44g硝酸钾。
一、选择题(共16题)
1.把下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.碘 B.面粉
C.蔗糖 D.花生油
2.将80g溶质质量分数为36%的浓盐酸稀释成18%的稀盐酸,需加水的质量为( )
A.80g
B.100g
C.200g
D.280g
3.下列各组物质混合后,可形成溶液的是( )
A.石灰水与CO2 B.KMnO4与水 C.豆浆与水 D.面粉与水
4.将下列物质放入水中,不能形成溶液的是
A.食盐 B.味精 C.蔗糖 D.花生油
5.下列液体去除油污效果最好的是( )
A.洗洁精 B.食盐水
C.白醋 D.自来水
6.在配制一定溶质质量分数的氯化钠溶液的实验中,下列实验操作不正确的是( )
A.氯化钠的取用
B.氯化钠的称量
C.水的取用
D.氯化钠的溶解
7.下列关于溶液的说法不正确的是( )
A.可以用肥皂水区分硬水和软水 B.饱和溶液一定比不饱和溶液浓
C.氢氧化钠固体溶于水会放出热量 D.溶液一定是混合物
8.下列物质溶于水,能使溶液温度降低的是( )
A.硝酸铵 B.氧化钙 C.氢氧化钠 D.浓硫酸
9.将80g质量分数为35%的浓盐酸,稀释成14%的稀盐酸,需加水的质量为( )
A.80g B.100g C.120g D.200g
10.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
11.几种物质的溶解度曲线如下图。则下列说法正确的是 ( )
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,等质量的三种饱和溶液,硫酸钠析出晶体最多
12.通过学习化学,要学会善于用化学知识去分析、解决生产生活中的问题。从化学的角度看,下列说法错误的是( )
A.洗洁净等含表面活性剂的物质对油污有乳化作用
B.用燃着的火柴检查液化气钢瓶是否漏气
C.进入山洞探险,先做灯火实验
D.室内起火时不要急于打开所有门窗
13.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是( )
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
14.下列有关溶液的说法中,正确的是( )
A.不饱和溶液转化为饱和溶液,其溶液质量分数一定增大
B.饱和溶液析出晶体后其溶质质量分数一定减少
C.温度升高,某饱和溶液中溶质的质量分数一定减少
D.降温时饱和溶液可能无晶体析出
15.下列比较中,不符合实际的是( )
A.钢片比纯铁片的硬度大
B.食盐水的导电能力比酒精溶液强
C.20℃时,饱和硝酸钾溶液的浓度大于饱和石灰水的浓度
D.地壳中铝的含量比硅多
16.如图是a、b两种固体的溶解度曲线,下列说法正确的是( )
A.将固体研碎可增大固体在水中的溶解度
B.将t1℃ b的饱和溶液升温至t2℃,溶质质量分数增大
C.将t2℃ a的饱和溶液降温至t1℃,析出晶体质量为30g
D.当a中混有少量b时,可采用降温结晶的方法提纯a
二、非选择题(共7题)
17.如图是某同学为配制10%的食盐溶液操作示意图。请据图回答:
(1)称量食盐时,天平平衡时的状态如图⑤所示,游码标尺刚好位于零刻度线处,则配得的溶液质量为_____g;需要水的体积为_____mL;
(2)配制溶液的步骤为②→_____→③(用序号表示)。
(3)下列情况中,会使食盐溶液质量分数低于10%的是_____。
A 称取的食盐不纯,有杂质
B 在量取水时,俯视液面读数
C 配制好的溶液转移时,不小心有少量液体溅出
D 配制好的溶液装入刚清洗完还未干燥的试剂瓶保存
(4)溶解时,用玻璃棒搅拌的目的是 __________
(5)若要将40g 10%的氯化钠溶液浓度变为20%,需要蒸发_____g的水。
(6)将100g10%的某固体物质M的溶液,分别进行下述操作,所得溶液中溶质的质量分数最小的是____
A 蒸发掉10g水,无晶体析出 B 加入10g10%的M的溶液
C 加入10g固体M,并使之完全溶解 D 加入10g水
18.20℃时,在盛有100g水的烧杯中加入30g固体X(不含杂质),充分溶解后,逐渐升温,并测定不同温度时所得溶液的质量。测定结果记录如下表。
溶液的温度/℃ 20 35 50 65 75
所得溶液质量/g 111 120 128 130 130
若不考虑水蒸发对实验的影响,请回答下列问题。
① 35℃时,溶质的质量是__________g;
② 65℃时,该溶液是_________ (选填编号);
Ⅰ.饱和溶液 Ⅱ.不饱和溶液 Ⅲ.无法判断
③ 根据下表溶解度与溶解性的关系,可知X属于_____________ 物质;
溶解性 易溶 可溶 微溶 难溶(或不溶)
溶解度 (20℃,g/100g水) >10 1—10 0.01—1 <0.01
④ 35℃时,使烧杯中未溶解的固体X全部溶解,至少加入__________g水;
⑤ 20℃时,配制100g溶质质量分数为5%的X溶液,需X固体粉末 _______克 ,水____克。
19.请你各举出一个实例,说明下列有关溶液的叙述是错误的。
①溶液一定是无色的。实例:溶液不是无色的;_____
②均一、稳定的液体都是溶液。实例:是液体,但不是溶液;_____
③溶液中的溶质一定是固体。实例:可做溶质,但不是固体。_____。
20.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) 20 40 50
溶解度/g NaCl 36.0 36.6 37.0
KNO3 31.6 63.9 85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
21.水与溶液在生产生活中有广泛的用途。
(1)将硬水转化为软水的原理是将硬水中溶有较多含 ________ (填元素符号,下同)、 ________ 的物质除去。
(2)在水中加入洗涤剂可增强去油污的能力,这是因为洗涤剂有 ________ 作用。
(3)自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为 ________ 。
(4)如图为甲、乙、丙三种物质的溶解度曲线。
①在30℃时,向30g甲物质中加入50g水,充分搅拌后,需再加入 ________ g水恰好形成饱和溶液。
②若甲中混有少量乙,采用 ________ 的方法提纯甲。
③30℃时,将甲、乙、丙的饱和溶液降温到10℃,所得溶液的溶质质量分数最小的是 _______ 。
22.取100g溶质质量分数为8%的氢氧化钠溶液,加入一定量溶质质量分数为20%的硫酸铜溶液,恰好完全反应,反应的化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,求:
(1)反应生成沉淀的质量为__________。
(2)反应后所得溶液中溶质的质量分数为__________。(精确到0.1%)
23.无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。现有西红柿无土栽培营养液中,含硝酸钾(KNO3)的溶质质量分数为5%,请填空:
(1)硝酸钾由 _____ 种元素组成,其中氮、氧两种元素质量比为(最简整数比) _____ ;
(2)某同学练习配制该无土栽培营养液80g,需KNO3_______ g.
下图是该同学配制的实验操作示意图:
(3)量取所需要的水应选择 ____ (选填“10mL”“50mL”或“100mL”)量筒.用上述图示的序号表示配制溶液的操作顺序: ____ ;
(4)要使该溶液的质量分数增大一倍,可以采用增加溶质和 ____ 等方法。请你选取其中一种方法通过计算说明(要有解题过程和必要的文字说明;所选方法如有小数,请保留小数点后两位数)
参考答案
1.C
【详解】
A、碘几乎不溶于水,与水混合形成悬浊液,故A错;B、面粉不溶于水,与水混合形成悬浊液,故B错;C、蔗糖易溶于水,形成均一稳定的混合物,属于溶液,故C正确;
D、花生油不溶于水,与水混合形成乳浊液,故D错;故选C。
2.A
【详解】
设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,则80g×36%=(80g+x)×18% x=80g。故选A。
3.B
【详解】
A、石灰水与二氧化碳发生反应生成难溶于水的碳酸钙,不能形成均一、稳定的混合物,故选项错误;
B、高锰酸钾易溶于水,能和水形成均一、稳定的混合物,即能够形成溶液.故选项正确;
C、豆浆不溶于水,不能形成均一、稳定的混合物.故选项错误;
D、面粉不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液.故选项错误;
故选B。
4.D
【详解】
A、食盐易溶于水,形成均一、稳定的混合物,属于溶液,故A错误;
B、味精易溶于水,形成均一、稳定的混合物,属于溶液,故B错误;
C、蔗糖易溶于水,形成均一、稳定的混合物,属于溶液,故C错误;
D、花生油难溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故D正确。
5.A
【详解】
A、洗洁精对油污有乳化作用,可以将油污分散成细小液滴扩散到水中,而被冲洗掉,选项正确;
B、食盐水对油污没有洗涤作用,选项错误;
C、白醋对油污没有洗涤作用,选项错误;
D、自来水对油污没有洗涤作用,选项错误。
故选A。
6.C
【详解】
A、取用氯化钠时,瓶塞应倒放,用药匙取药品,图中实验操作正确;
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作正确;
C、量取水时,量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中视线没有与量筒内液体的凹液面的最低处保持水平,所示操作错误;
D、溶解氯化钠时,为了加速其溶解,可以用玻璃棒搅拌,图中实验操作正确。故选C。
7.B
【详解】
A. 可以用肥皂水区分硬水和软水,硬水有浮渣,泡沫少;软水无浮渣,泡沫多;说法正确,故不符合题意;
B. 饱和溶液不一定比不饱和溶液浓,如氢氧化钙饱和溶液比氢氧化钠的不饱和溶液浓度要小,这里还要看温度和溶解度,说法不正确,故符合题意;
C. 氢氧化钠固体溶于水会放出热量,使得溶液温度升高,说法正确,故不符合题意;
D. 溶液是均一的、稳定的混合物,故溶液一定是混合物,说法正确;故不符合题意;
故选B
8.A
【详解】
物质溶于水有三种现象如氧化钙、氢氧化钠、浓硫酸溶于水放热,使溶液的温度升高;硝酸铵溶于水吸热溶液的温度降低;绝大部分物质溶于水温度变化不大。
故选A。
9.C
【详解】
根据溶液稀释前后溶质不变,80g×35%=14%×﹙80g+x﹚,x=120g.故选C。
10.D
【详解】
A.根据图示可知,甲的溶解度是102.5g没有指明是在70℃时,选项A不正确;
B.甲的溶解度在0℃到70℃时随温度的升高而增大,当温度大于70℃时,其溶解度随温度的升高而减小,选项B不正确;
C.20℃时,甲的溶解度为28.6 g 。即:在20℃时在100 g水中溶解28.6 g甲可达到饱和,20℃时,100 g甲的饱和溶液中溶质质量小于28.6 g,选项C不正确;
D.因为70℃时甲的溶解度最大,所以将其饱和溶液升高温度或降低温度,都会因为溶解度减小而使甲无法完全溶解,都有晶体析出,选项D正确。故选D。
11.D
【详解】
说溶解度大小必须指明温度,故A错误
高于40℃时,硫酸钠的溶解度变小,故B错误。
40摄氏度时,硫酸钠的溶解度为50克,指的是在100克水中最多能溶解50克硫酸钠,其饱和溶液的质量分数为50/150,不可能是50%,故C错误。
40℃时饱和溶液降温到20℃时,硫酸钠的溶解度变化最大,所以,等质量的三种饱和溶液,硫酸钠析出晶体最多故D正确。
12.B
【详解】
A、洗洁净中有乳化剂,能把油污变成细小的油滴,即有乳化作用,正确;
B、可燃性的气体与空气混合后点燃易爆炸,用燃着的火柴检查可燃的液化气是否泄漏,有爆炸的危险,错误;C、二氧化碳的密度比空气大,易聚集于山洞中,且二氧化碳不能供给呼吸,浓度过大会窒息死亡,二氧化碳不能燃烧也不能支持燃烧,做灯火实验可知山洞中二氧化碳浓度是否过高,正确。D、室内起火时,打开所有门窗通风,会使室内空气对流,为燃烧提供了大量的氧气,会引起火势蔓延,室内起火时不要急于打开所有门窗,正确。故选B。
13.A
【详解】
配制一定溶质质量分数的溶液,正确的操作步骤为:1、计算溶质和溶剂的质量,2、用托盘天平称量所需溶质的质量,倒入烧杯中,3、把水的密度近似看作1g/cm3,用量筒和胶头滴管量取所需的水,4、用玻璃棒搅拌。故选A。
14.D
【详解】
A、溶液不一定是无色透明的,如硫酸铜溶液是蓝色的,故选项说法错误;B、当采取改变温度使饱和溶液析出晶体时,溶液中的溶质质量减少而溶剂质量不变,溶液的溶质质量分数减小,而采取恒温蒸发溶剂的方法使饱和溶液析出晶体时,由于温度不变物质的溶解度不变,根据饱和溶液的溶质质量分数=溶解度100g+溶解度×100%,饱和溶液的溶质质量分数也不变,故B错误;C、大多数物质的溶解度随着温度的降低而增大,温度升高,若有溶质继续溶解,该饱和溶液中溶质的质量分数增大;若溶质继续溶解,该饱和溶液中溶质的质量分数不变,故选项说法错误;D、有些物质的饱和溶液随着温度的降低而增大,降温时,溶解度增大,饱和溶液无晶体析出,故选项说法正确;故选D。
15.D
【解析】A. 钢是铁的合金,合金的硬度比纯的金属大,所以钢片比纯铁片的硬度大; B. 食盐水中有钠离子和氯离子能导电,酒精溶液中微粒是酒精分子、水分子,没有自由带电荷微粒,导电能力比酒精溶液强;C. 影响溶解度的因素有温度,溶质、溶剂的种类,硝酸钾属于易溶物,氢氧化钙是微溶物,20℃时,饱和硝酸钾溶液的浓度大于饱和石灰水的浓度。 D. 地壳中元素的含量按质量分数由多到少的顺序是,氧、硅、铝、铁、钙……铝的含量比硅低。选D
16.D
【分析】
A、根据物质的溶解度只随温度的变化而变化分析;
B、根据b物质的溶解度随温度升高而增大,及溶质的质量分数变化分析;
C、根据溶解度曲线图,判断晶体析出情况;
D、根据物质的溶解度随温度变化情况分析。
【详解】
A、物质的溶解度只随温度的变化而变化,将固体研碎不能增大固体在水中的溶解度,故A选项说法错误;
B、由图可知:b的溶解度随温度的升高变化不大,将t1℃时b物质的饱和溶液升温至t2℃(溶剂量不变),b变为不饱和溶液,溶质的质量不变,溶剂的质量不变,则溶液中溶质质量分数不变,故B选项说法错误;
C、将t2℃ a的饱和溶液降温至t1℃,析出晶体质量不一定为30g,选项中没有说明饱和溶液的质量,故C选项说法错误;
D、a的溶解度随温度的升高而增大,b的溶解度受温度影响不大,当a中混有少量b时,可采用降温结晶的方法提纯a,故D选项说法正确。故选D。
17.150 135 ⑤①④ AD 加速溶解 20 D
【详解】
(1)溶液质量= ,水的质量 ,故水体积135mL;
(2)配制溶液的步骤为:先从广口瓶中取食盐,将取得的食盐放在天平左盘,将称得的食盐放在烧杯中,用量筒量取水,倒入烧杯中,用玻璃棒搅拌即可,用序号表示为:②⑤①④③,故填:⑤①④
(3) A、 称取的食盐不纯,有杂质会使食盐溶液质量分数低于10%符合题意;
B、 在量取水时俯视液面读数水偏少,会使溶液质量分数高于10%,不符合题意;
C、溶液转移时不小心有少量液体溅出对溶质质量分数没影响,不符合题意;
D、 配制好的溶液装入刚清洗完还未干燥的试剂瓶保存,溶液被稀释会使食盐溶液质量分数低于10%符合题意,故选:AD。
(4)溶解时,用玻璃棒搅拌的目的是加速溶解,故填:加速溶解;
(5)设需蒸发水的质量为x故:
故填:20
(6)A、蒸发掉10g水后溶质质量分数增大,大于10%;
B、加入10g10%的M溶液,等浓度混合质量分数不变还是10%;
C、加入10g固体M溶液浓度增大大于10%;
D、加入10g水,溶液被稀释浓度变小质量分数小于10%;故D最小选D。
18.20 Ⅲ 易溶 50 5 95
【解析】
①根据表格提供的数据可以知道,在35℃时,溶液的质量为120g,溶质的质量为120g-100g=20g;②65℃时,该溶液中不存在未溶解的固体,不能确定溶液是否饱和;③20℃时,溶液的质量为111g,溶质的质量为111g-100g=11g,说明在该温度下X的溶解度是11g,11g>10g,属于易溶物质;④在35℃时,溶液的质量为120g,溶质的质量为120g-100g=20g,说明在该温度下X的溶解度是20g,剩余固体的质量=30g-20g=10g,使烧杯中未溶解的固体X全部溶解,需要水的质量==50 g;⑤20℃时,配制100g溶质质量分数为5%的X溶液,需X固体粉末的质量=100g5%=5g;需要水的质量=100g-5g=95 g。
19.(1)硫酸铜溶液(或碘酒)
(2)蒸馏水
(3)氯化氢气体(或酒精)
【详解】
(1)硫酸铜溶液是蓝色的;
(2)水是均一、稳定的液体不是溶液,属于纯净物;
(3)酒精溶液中溶质是液体。
20.③ 硝酸钾(或KNO3) 不饱和溶液
【详解】
(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响,这就需要控制其他因素保持不变。
(2)①从表中数据可知,氯化钠和硝酸钾两种物质中,溶解度受温度影响较大的是硝酸钾。②20℃时,NaCl的溶解度大于KNO3的溶解度,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,烧杯甲中有有固体未溶解完,乙烧杯中的物质全部溶解,故烧杯甲中溶质是硝酸钾,因此加入的物质质量31.6g<m≤36g,而50℃时,硝酸钾的溶解度是85.5g,故50℃时甲烧杯中的溶液一定是不饱和溶液。
21.Ca、Mg 乳化 CaO + H2O=Ca(OH)2 25 冷却热饱和溶液 丙
【详解】
(1)将硬水转化为软水的原理是:将硬水中溶有较多含Ca、Mg的物质除去;故答案为Ca;Mg;
(2)在水中加入洗涤剂可增强去油污的能力,这是因为洗涤剂有乳化作用;故答案为乳化;
(3)生石灰与水反应生成熟石灰;故答案为 ;
(4)①设30℃时,30g甲物质到达饱和状态需要水的质量为x, ,x=75g,75g﹣50g=25g;②若甲中混有少量乙,采用降温结晶或冷却热饱和溶液的方法提纯甲,因为甲的溶解度受温度的影响变化比较大;③30℃时,将甲、乙、丙的饱和溶液降温到10℃,所得溶液的溶质质量分数最小的是丙,因为降温后丙的质量分数不变,还是最小;故答案为①25;②降温结晶或冷却热饱和溶液;③丙。
22.9.8g
解:设反应消耗的CuSO4的质量为x,反应生成的Cu(OH)2的质量为y,生成Na2SO4的质量为z,则
8.3%
因此硫酸铜溶液的质量为16g÷20%=80g
反应后溶液的质量为100g+80g-9.8g=170.2g
所以,反应后所得溶液中溶质的质量分数为×100% ≈8.3%
答:反应生成的沉淀的质量为9.8g;反应后所得溶液中溶质的质量分数为8.3%。
【详解】
(1)见答案;
(2)见答案。
23.3 7:24 4 100mL ④①②⑤③ 采用蒸发水的方法使其溶质的质量分数增大一倍,设需要蒸发水的质量为x,则
=10% x=40g;
采用加入溶质的方法使其溶质的质量分数增大一倍,设需要加入硝酸钾的质量为y,则
=10% y=4.44g。
答:可蒸发掉40g水或加入4.44g硝酸钾
【分析】
根据量筒的选择依据以及配制溶液的方法来分析;可以利用蒸发水和加溶质的方法使之浓度变大。
【详解】
(1)根据硝酸钾的化学式可知,硝酸钾由钾、氮、氧3种元素组成,其中氮、氧两种元素质量比=14:16×3=7:24;
(2)配制该无土栽培营养液80g,需KNO3的质量=80g×5%=4g;
(3)配制该无土栽培营养液80g,需KNO3=80g×5%=4g,需水的质量=80g-4g=76g,则水的体积为76mL,应选用100mL量筒;由配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放,可知配制溶液的操作顺序是:④①②⑤③;
(4)采用蒸发水的方法使其溶质的质量分数增大一倍,设需要蒸发水的质量为x,则
=10% x=40g;
采用加入溶质的方法使其溶质的质量分数增大一倍,设需要加入硝酸钾的质量为y,则
=10% y=4.44g。
答:可蒸发掉40g水或加入4.44g硝酸钾。
同课章节目录
