氧化还原反应
图片预览





文档简介
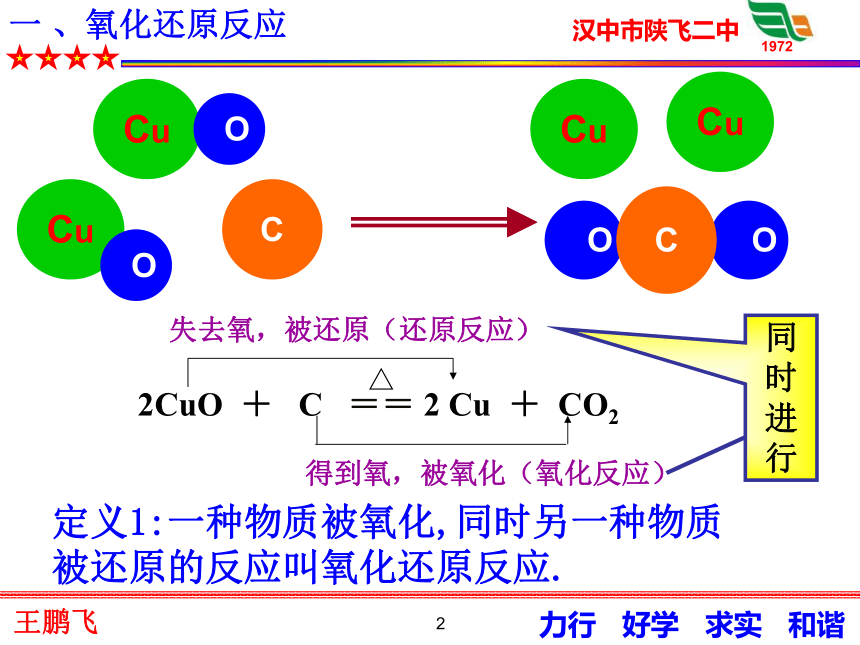
课件40张PPT。1第三节 氧化还原反应2一 、氧化还原反应Cu OCuC O OCCu OCu得到氧,被氧化(氧化反应)△2CuO + C == 2 Cu + CO2 失去氧,被还原(还原反应)定义1:一种物质被氧化,同时另一种物质被还原的反应叫氧化还原反应.同
时
进
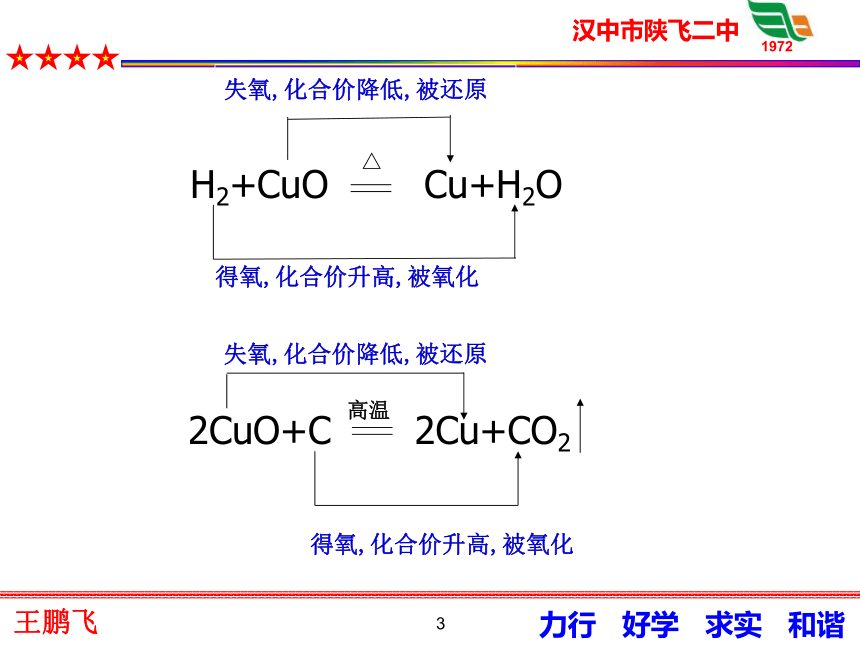
行3失氧,化合价降低,被还原得氧,化合价升高,被氧化失氧,化合价降低,被还原得氧,化合价升高,被氧化4结论物质得到氧,元素化合价升高,被氧化。
物质失去氧,元素化合价降低,被还原。【思考】请从化合价升降角度分析如下氧化还原反应:
Fe2O3+3CO 2Fe+3CO2↑模仿上述分析方法分析:
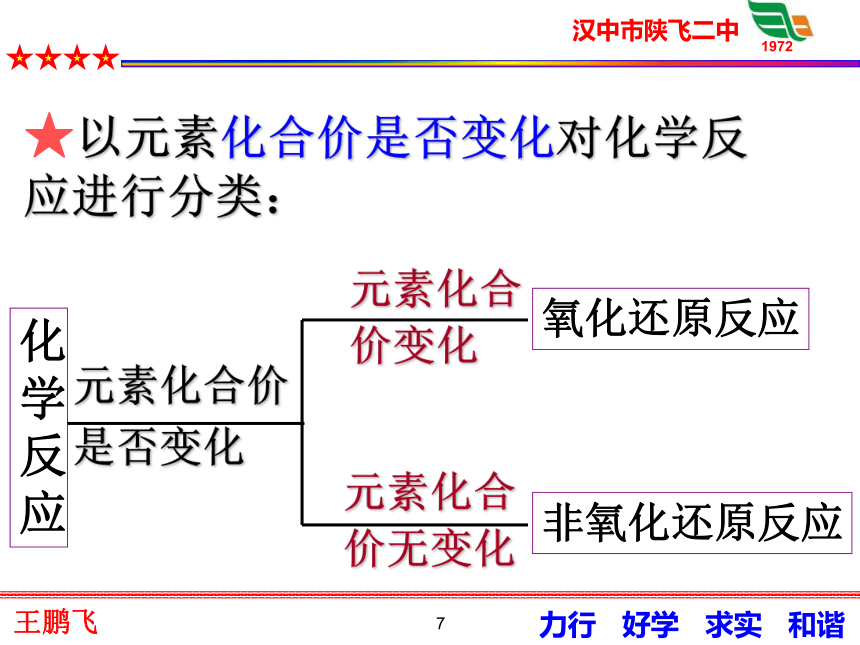
5化合价降低化合价升高化合价降低化合价升高被还原被还原被氧化被氧化6有元素化合价升降的反应,叫氧化还原反应.定义2:氧化还原反应的判断依据(特征)是:有无化合价的升降7化学反应氧化还原反应非氧化还原反应★以元素化合价是否变化对化学反应进行分类:元素化合价
是否变化元素化合
价变化元素化合
价无变化8 1、下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑
B、CaCO3 CaO+CO2↑
C、Na2O+H2O=2NaOH
D、Mg+2HCl=MgCl2+H2↑ 练习D2、下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
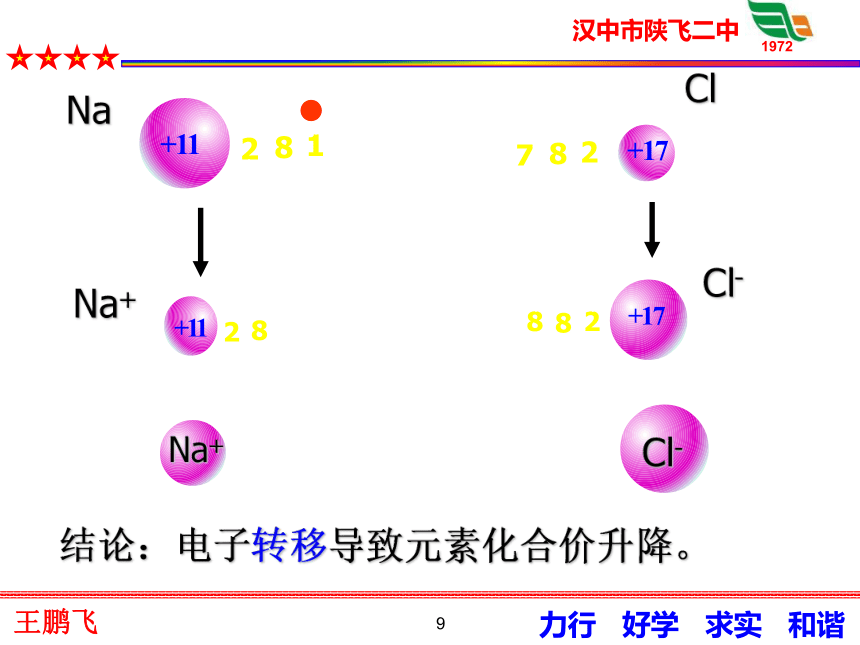
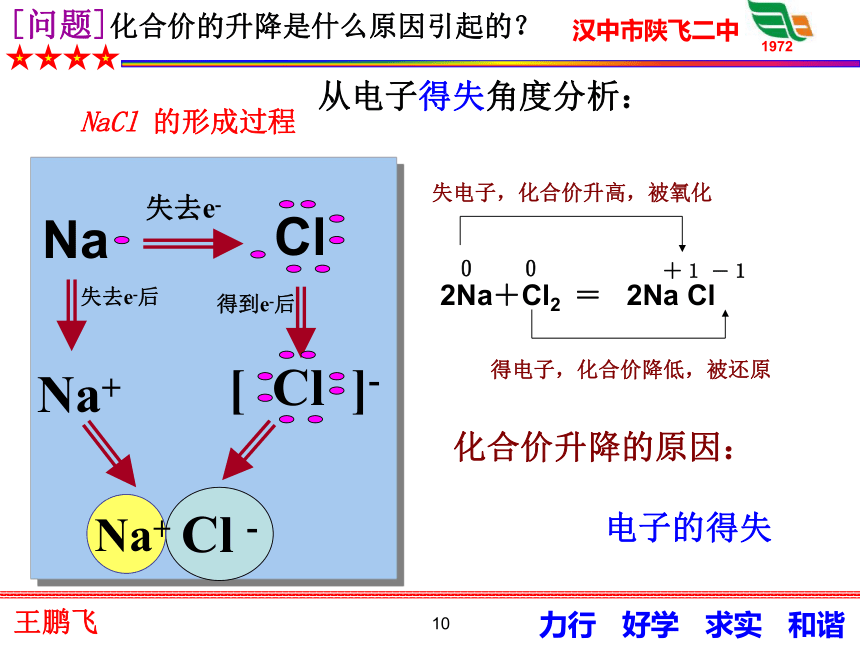
2H2+Cl2 = 2HCl9NaCl-Na+ClNa+Cl-结论:电子转移导致元素化合价升降。10[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
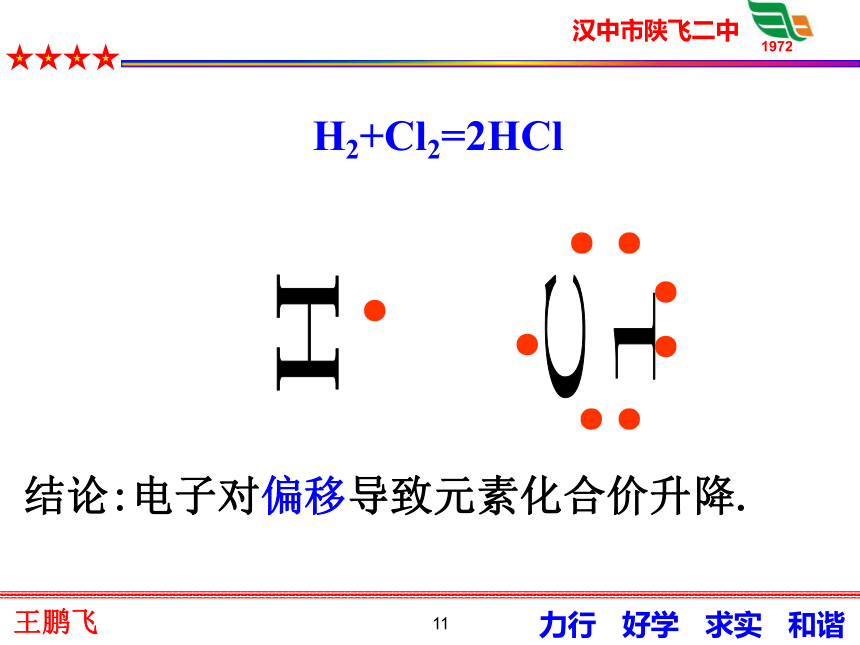
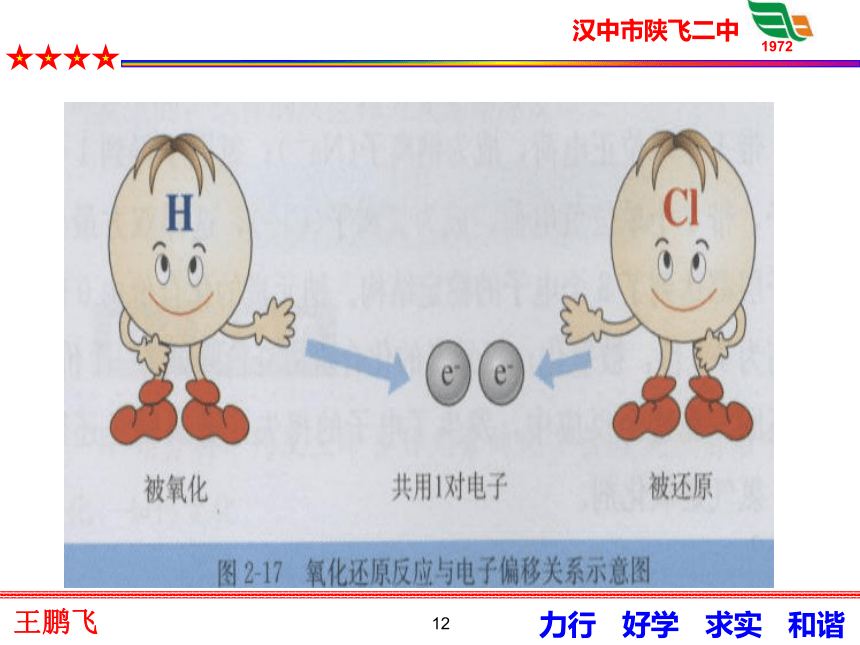
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:11H2+Cl2=2HClHCl●●●●●●●●结论:电子对偏移导致元素化合价升降.1213原来是因为我!!!14定义3: 有电子转移(得失或偏移)的反应都是氧化还原反应.思考:氧化还原反应的实质 ?15(否)(是)(否)(是)(是)(是)(否)(否)请判断!是否是氧化还原反应16氧化还原反应和四大基本反应类型的关系?分解反应化合反应复分解反应置换反应氧化还原反应17 ? ? 得电子(或电子对偏向) 表现在发生失电子(或电子对偏离)化合价升高氧化反应表现在发生 化合价降低 还原反应同时发生小结反思18谢谢19请同学们判断哪些反应是氧化还原反应,哪些不是?CaCO3=CaO+CO2
2KClO3=2KCl+O2
CO2+H2O=H2CO3
C+O2=CO2
CuO+H2=Cu+H2O
3C+Fe2O3=2Fe+3CO2
HCl+NaOH=NaCl+H2O
2HCl+CaCO3=CaCl2+H2O+CO2√
√
√
√20基本概念1、氧化剂:反应中得电子的物质,表现氧化性,具有氧化能力,起氧化作用。
还原剂:反应中失电子的物质,表现还原性,具有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物
还原产物:氧化剂得电子被还原对应生成物
氧化剂(有氧化性)--→还原产物
还原剂(有还原性)--→氧化产物21常见的氧化剂和还原剂
1.常见氧化剂
(1)部分活泼非金属单质:如 、 等。
(2)含有高价态元素的化合物:如 、
、 、 等。
2.常见还原剂
(1)活泼的金属单质,如 、 、 等。
(2)某些非金属单质,如 、 等。
(3)某些非金属氧化物,如 、 等。
(4)含低价金属阳离子的化合物 等
(5)含有较低化合价元素的化合物 、 、 、 等
Cl2O2H2SO4HNO3KMnO4FeCl3AlZnFeH2CCOSO2FeCl2HClNa2SKINH322 “双线桥”法步骤:1.标出变价元素的化合价2.用双箭号表示,箭头从反应物指向生成物的同一种元素。3.标出“失去”、“得到”的电子总数注意:失电子数=得电子数Mg + Cl2 = MgCl2 Mg + Cl2 = MgCl200+2-1失去2e-得到2e-23练习: 用“双线桥”法标出电子转移的情况,并指出氧化剂及还原剂。24表示反应过程中电子在反应物之间的转移情况。
注意:
①单线桥必须画在反应物中,且箭号从还原剂中指向氧化剂中。
②箭号表示电子转移的方向,线桥不必注明得失。
③数字表示某原子失去电子(也是另一元素得到电子)的总数。单线桥法:25失去电子氧化反应还
原
剂氧
化
产
物产物反应反应物化合价升高小结26得到电子还原反应氧
化
剂还
原
产
物产物反应反应物化合价降低小结27谢谢281.根据氧化还原反应方程式进行判断
在同一反应中
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物;
如:Fe+H2SO4===FeSO4+H2↑
氧化性:H2SO4>FeSO4,还原性:Fe>H2
292.根据物质活动性顺序比较判断
(1)根据金属活动性顺序进行判断(2)根据非金属活动性顺序进行判断(常见元素):303.根据产物的价态判断氧化性:Cl2>I24.根据氧化还原反应进行的难易程度(或剧烈程度)
的不同进行判断 2Na + 2H2O = 2NaOH + H2↑ Mg+2H2O Mg(OH)2+H2↑ 前者比后者容易发生,可判断还原性:Na>Mg315.根据元素的价态判断 氧化性:Fe3+>Fe2+,H2SO4(浓)>H2SO3,(特例:HClO > HClO3 > HClO4)
还原性:Fe>Fe2+,S2->S>SO26.根据反应条件判断 【例如】
①温度:氧化性 热的浓H2SO4>冷的浓H2SO4
②浓度:氧化性 浓HNO3>稀HNO3;浓H2SO4>稀H2SO4 还原性 浓盐酸>稀盐酸。32③酸碱性:如KMnO4溶液的氧化性随溶液的酸性的增强而增强。一般来讲KMnO4、KCr2O7、KClO3 氧化HCl中的Cl-,不能氧化NaCl中的Cl-,NO3-在酸性条件下有强氧化性,氧化SO32- 、S2- 、Fe2+、I- ,SO32- 、S2-与H+不共存。 当不同的氧化剂(或还原剂)作用于同一还原剂(或氧化剂)
时,氧化产物(或还原产物)价态相同,可根据反应条件的
难易进行判断,条件越简单,氧化性(或还原性)越强。33练习1、根据反应式:
(1)2Fe2+ + I2 = 2Fe3+ + 2I-(2)Br2+2Fe2+ = 2Fe3+ + 2Br -,可判断离子的还原性从强到弱的顺序是 ( ) A.Br - 、Fe2+ 、I- B.I- 、 Fe2+、 Br - C.Br -、 I- 、Fe2+ D.Fe2+、 I- 、 Br –2、今有三个氧化还原反应: (1)2FeCl3+2KI=2FeCl2+2KCl+I2 (2)2FeCl2+Cl2=2FeCl3 (3)KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中有Fe2+和I-共存,要氧化除去I-离子而又不影
响Fe2+和Cl-,可加入的试剂是 ( ) A.Cl2 B.KMnO4 C.FeCl3 D.HClBC345.已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+ == Fe3++Ce3+Sn2++2Fe3+== 2Fe2++Sn4+由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到
弱的顺序是 ( )A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+A35谢谢361、自身氧化还原反应2、歧化反应【例如】NH4NO3 ==== 2H2O + N2O↑2KClO3 2KCl+3O2【例如】Cl2 + 2NaOH === NaCl + NaClO +H2O 3N2O + H2O === 2HNO3 + NO↑373、归中反应4、部分氧化还原反应C + CO2 = 2CO SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O H2S + 3H2SO4(浓) = 4SO2+4H2O 2Fe3++Fe=3Fe2+Cu + 4HNO3(浓) == Cu(NO3)2 + NO2↑ + 2H2O 3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ + 4H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O381、电子守恒规律2、表现性质规律3、性质强弱规律4、反应先后规律5、价态归中规律39小结40谢谢
时
进
行3失氧,化合价降低,被还原得氧,化合价升高,被氧化失氧,化合价降低,被还原得氧,化合价升高,被氧化4结论物质得到氧,元素化合价升高,被氧化。
物质失去氧,元素化合价降低,被还原。【思考】请从化合价升降角度分析如下氧化还原反应:
Fe2O3+3CO 2Fe+3CO2↑模仿上述分析方法分析:
5化合价降低化合价升高化合价降低化合价升高被还原被还原被氧化被氧化6有元素化合价升降的反应,叫氧化还原反应.定义2:氧化还原反应的判断依据(特征)是:有无化合价的升降7化学反应氧化还原反应非氧化还原反应★以元素化合价是否变化对化学反应进行分类:元素化合价
是否变化元素化合
价变化元素化合
价无变化8 1、下列反应属于氧化还原反应的是( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑
B、CaCO3 CaO+CO2↑
C、Na2O+H2O=2NaOH
D、Mg+2HCl=MgCl2+H2↑ 练习D2、下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl9NaCl-Na+ClNa+Cl-结论:电子转移导致元素化合价升降。10[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:11H2+Cl2=2HClHCl●●●●●●●●结论:电子对偏移导致元素化合价升降.1213原来是因为我!!!14定义3: 有电子转移(得失或偏移)的反应都是氧化还原反应.思考:氧化还原反应的实质 ?15(否)(是)(否)(是)(是)(是)(否)(否)请判断!是否是氧化还原反应16氧化还原反应和四大基本反应类型的关系?分解反应化合反应复分解反应置换反应氧化还原反应17 ? ? 得电子(或电子对偏向) 表现在发生失电子(或电子对偏离)化合价升高氧化反应表现在发生 化合价降低 还原反应同时发生小结反思18谢谢19请同学们判断哪些反应是氧化还原反应,哪些不是?CaCO3=CaO+CO2
2KClO3=2KCl+O2
CO2+H2O=H2CO3
C+O2=CO2
CuO+H2=Cu+H2O
3C+Fe2O3=2Fe+3CO2
HCl+NaOH=NaCl+H2O
2HCl+CaCO3=CaCl2+H2O+CO2√
√
√
√20基本概念1、氧化剂:反应中得电子的物质,表现氧化性,具有氧化能力,起氧化作用。
还原剂:反应中失电子的物质,表现还原性,具有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物
还原产物:氧化剂得电子被还原对应生成物
氧化剂(有氧化性)--→还原产物
还原剂(有还原性)--→氧化产物21常见的氧化剂和还原剂
1.常见氧化剂
(1)部分活泼非金属单质:如 、 等。
(2)含有高价态元素的化合物:如 、
、 、 等。
2.常见还原剂
(1)活泼的金属单质,如 、 、 等。
(2)某些非金属单质,如 、 等。
(3)某些非金属氧化物,如 、 等。
(4)含低价金属阳离子的化合物 等
(5)含有较低化合价元素的化合物 、 、 、 等
Cl2O2H2SO4HNO3KMnO4FeCl3AlZnFeH2CCOSO2FeCl2HClNa2SKINH322 “双线桥”法步骤:1.标出变价元素的化合价2.用双箭号表示,箭头从反应物指向生成物的同一种元素。3.标出“失去”、“得到”的电子总数注意:失电子数=得电子数Mg + Cl2 = MgCl2 Mg + Cl2 = MgCl200+2-1失去2e-得到2e-23练习: 用“双线桥”法标出电子转移的情况,并指出氧化剂及还原剂。24表示反应过程中电子在反应物之间的转移情况。
注意:
①单线桥必须画在反应物中,且箭号从还原剂中指向氧化剂中。
②箭号表示电子转移的方向,线桥不必注明得失。
③数字表示某原子失去电子(也是另一元素得到电子)的总数。单线桥法:25失去电子氧化反应还
原
剂氧
化
产
物产物反应反应物化合价升高小结26得到电子还原反应氧
化
剂还
原
产
物产物反应反应物化合价降低小结27谢谢281.根据氧化还原反应方程式进行判断
在同一反应中
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物;
如:Fe+H2SO4===FeSO4+H2↑
氧化性:H2SO4>FeSO4,还原性:Fe>H2
292.根据物质活动性顺序比较判断
(1)根据金属活动性顺序进行判断(2)根据非金属活动性顺序进行判断(常见元素):303.根据产物的价态判断氧化性:Cl2>I24.根据氧化还原反应进行的难易程度(或剧烈程度)
的不同进行判断 2Na + 2H2O = 2NaOH + H2↑ Mg+2H2O Mg(OH)2+H2↑ 前者比后者容易发生,可判断还原性:Na>Mg315.根据元素的价态判断 氧化性:Fe3+>Fe2+,H2SO4(浓)>H2SO3,(特例:HClO > HClO3 > HClO4)
还原性:Fe>Fe2+,S2->S>SO26.根据反应条件判断 【例如】
①温度:氧化性 热的浓H2SO4>冷的浓H2SO4
②浓度:氧化性 浓HNO3>稀HNO3;浓H2SO4>稀H2SO4 还原性 浓盐酸>稀盐酸。32③酸碱性:如KMnO4溶液的氧化性随溶液的酸性的增强而增强。一般来讲KMnO4、KCr2O7、KClO3 氧化HCl中的Cl-,不能氧化NaCl中的Cl-,NO3-在酸性条件下有强氧化性,氧化SO32- 、S2- 、Fe2+、I- ,SO32- 、S2-与H+不共存。 当不同的氧化剂(或还原剂)作用于同一还原剂(或氧化剂)
时,氧化产物(或还原产物)价态相同,可根据反应条件的
难易进行判断,条件越简单,氧化性(或还原性)越强。33练习1、根据反应式:
(1)2Fe2+ + I2 = 2Fe3+ + 2I-(2)Br2+2Fe2+ = 2Fe3+ + 2Br -,可判断离子的还原性从强到弱的顺序是 ( ) A.Br - 、Fe2+ 、I- B.I- 、 Fe2+、 Br - C.Br -、 I- 、Fe2+ D.Fe2+、 I- 、 Br –2、今有三个氧化还原反应: (1)2FeCl3+2KI=2FeCl2+2KCl+I2 (2)2FeCl2+Cl2=2FeCl3 (3)KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若某溶液中有Fe2+和I-共存,要氧化除去I-离子而又不影
响Fe2+和Cl-,可加入的试剂是 ( ) A.Cl2 B.KMnO4 C.FeCl3 D.HClBC345.已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+ == Fe3++Ce3+Sn2++2Fe3+== 2Fe2++Sn4+由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到
弱的顺序是 ( )A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+C.Ce3+、Fe2+ 、Sn2+ D.Fe3+、Sn2+、Ce3+A35谢谢361、自身氧化还原反应2、歧化反应【例如】NH4NO3 ==== 2H2O + N2O↑2KClO3 2KCl+3O2【例如】Cl2 + 2NaOH === NaCl + NaClO +H2O 3N2O + H2O === 2HNO3 + NO↑373、归中反应4、部分氧化还原反应C + CO2 = 2CO SO2+2H2S=3S↓+2H2O
H2SO3+2H2S=3S↓+3H2O H2S + 3H2SO4(浓) = 4SO2+4H2O 2Fe3++Fe=3Fe2+Cu + 4HNO3(浓) == Cu(NO3)2 + NO2↑ + 2H2O 3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ + 4H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O381、电子守恒规律2、表现性质规律3、性质强弱规律4、反应先后规律5、价态归中规律39小结40谢谢
