2021-2022学年高一上学期化学鲁科版(2019)必修第一册 期末非选择题综合训练(word版含答案)
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册 期末非选择题综合训练(word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 810.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 20:41:59 | ||
图片预览




文档简介
高一化学上学期期末非选择题综合训练
一、填空题
1.(2021·山东菏泽·高一期末)氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答下列问题:
(1).与氮氧化物有关的全球或区域性大气环境问题有___________(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2).是重要的含氮化合物,写出氨合成塔中发生反应的化学方程式_____________________________;氧化炉中所发生反应的化学方程式为_______________________________________。
(3).吸收塔中发生反应共转移个电子,则参加反应的NO的物质的量为____________。
(4).将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出两种气体,写出生成NO的反应化学方程式_______________________________________________________;若生成NO、的体积比为,则分别生成NO、的两个反应中消耗硝酸的物质的量之比是_______________。
2.(2021·山东德州·高一期末)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(1).图1中与图2中M、N对应的物质分别是_____________、______________。
(2).X与Y反应中氧化剂与还原剂的物质的量之比为______________。
(3).Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是____________________。
(4).硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲,中铜和浓硫酸反应的化学方程式是___________________________________________________。
该反应体现了浓硫酸的____________性。
②这两种方案,你认为哪一种方案更合理 ______________。理由是_________________________________
____________________。
二、实验题
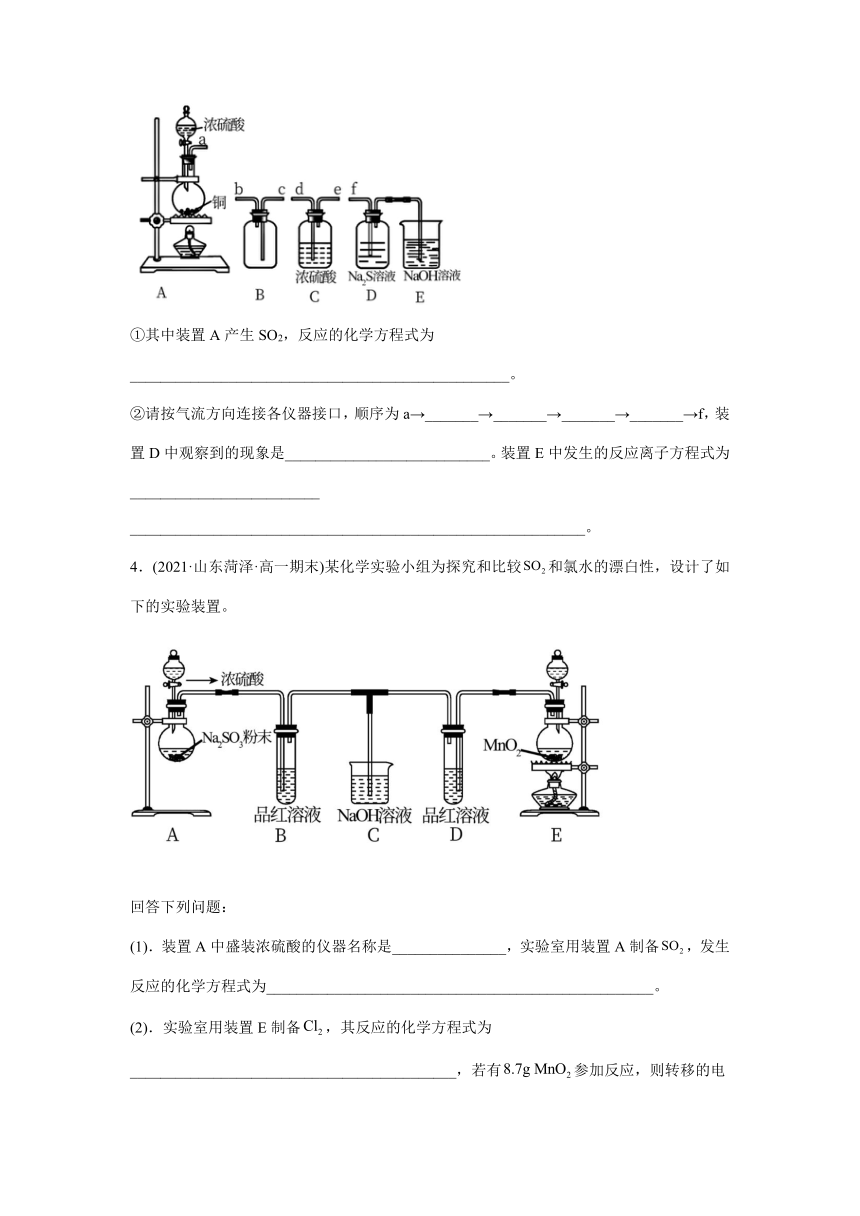
3.(2021·山东菏泽·高一期末)黄铜矿()是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为。
(1).若中的化合价为+2,反应中被还原的元素是__________(填元素符号)。
(2).上述冶炼过程产生大量。下列处理方案中合理的是__________(填代号)
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制 d.用浓硫酸吸收
(3).实验室制备、收集干燥的,并探究与溶液的反应,所需仪器如下。
①其中装置A产生SO2,反应的化学方程式为__________________________________________________。
②请按气流方向连接各仪器接口,顺序为a→_______→_______→_______→_______→f,装置D中观察到的现象是___________________________。装置E中发生的反应离子方程式为_________________________
____________________________________________________________。
4.(2021·山东菏泽·高一期末)某化学实验小组为探究和比较和氯水的漂白性,设计了如下的实验装置。
回答下列问题:
(1).装置A中盛装浓硫酸的仪器名称是_______________,实验室用装置A制备,发生反应的化学方程式为___________________________________________________。
(2).实验室用装置E制备,其反应的化学方程式为___________________________________________,若有参加反应,则转移的电子总数为___________________。
(3).反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B________________________,D_______________________。
(4).小组中甲同学认为和氯水都有漂白性,若二者混合使用,漂白性会更强。为验证甲同学的推断,在同温同压下,他们同时将和等体积通入到品红溶液中,结果发现品红溶液几乎不褪色,出现上述现象的原因是_______________________________________________________(用化学方程式表示)。
5.氨基钠(NaNH2)是一种化工原料,常温下为白色晶体,熔点210℃,沸点为400℃,露置空气中易吸收水分而失效。实验室可用氨气和钠反应制得。某化学实验小组拟采用如图所示的装置制备氨基钠,回答下列相关问题:
(1).实验时,组装好仪器后,紧跟着进行的下一步的操作是_________________。A中反应的化学方程式为_____________________________________________________。
(2).装置B中盛放的药品是_____________(写名称),装置E的作用是_____________________________。
(3).装置A与C加热的先后顺序是____________________。
(4).若用如图装置代替上述A装置,装置中加入试剂合理的是________。 a.浓氨水 b.浓氨水与CaO c.NH4Cl与Ca(OH)2
(5).C中反应的化学方程式为______________________________________________。
6.(2021·山东潍坊·高一期末)某化学实验小组同学用如图所示装置制备NO2,并探究NO2与水反应的产物(夹持装置略、装置气密性良好、所有阀门关闭)。
回答下列问题:
(1).步骤①:打开K1和___________,通入N2,一段时间后关闭K1。
步骤②:向锥形瓶中加入浓HNO3,其操作方法是__________________________________。
步骤③:证明三颈烧瓶中反应有NO生成,操作是__________________________,现象是_______________
____________________________。
步骤④:传感器数据显示c()随反应时间逐渐增大,证明NO2与水反应生成。
(2).甲同学认为步骤④的结论有缺陷,该同学的判断依据是________________________________。
(3).乙同学查阅资料得知反应后三颈烧瓶溶液中可能含有HNO2。证明HNO2存在的实施方案是________
____________________________________________________________________________________。
7.(2021·山东·高一阶段练习)SO2和Cl2在工业上用途广泛,某同学为探究 Cl2、SO2的性质,设计如下装置进行实验。
(1).图中仪器a的名称______________,E中发生反应的化学方程式为______________________________
_____________________________________________。
(2).若C中加入淀粉碘化钾溶液,关闭 K2,打开K1,使A产生的气体进入C,则C中实验现象为____
________________________________________。
(3).若要实现硫元素由+4 价转化为0价,需关闭K1,打开K2,在C中加入___________溶液,此过程体现了SO2的___________性。
(4).若C中加入品红溶液,打开K1、K2,使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为_____________________________________________________(用离子方程式表示)。
(5).若C中加入BaCl2 溶液,先打开K2,使E产生的气体进入C,观察到C中无明显现象,再打开K1,使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为______________(填化学式)。
(6).该同学设计的装置有一处明显的缺陷是____________________________________________。
三、工业流程题
8.(2021·山东·临朐县实验中学高一阶段练习)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
回答下列问题:
(1).过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为_______________。
(2).滤渣1成分的化学式为_______________;试剂Y为__________________。
(3).可替代气体Z的试剂为__________________(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4).写出FeCl3溶液腐蚀覆铜板的离子方程式_____________________________________________。
(5).用实验证明滤液1中只含有Fe2+__________________________________________________________
______________________________。
9.(2021·山东·高一阶段练习)七水合硫酸亚铁()是一种重要的食品或饲料添加剂,颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
回答下列问题:
(1).工业烧渣与稀硫酸反应的离子反应有:,____________________________。
(2).加入的试剂X是__________,写出发生的反应离子方程式___________________________________。
A. B. C. D.
(3).若需检验还原后的溶液中是否存在有,可选择的方法是取2~3mL试液,在其中滴加_______溶液(填名称),当___________________时(填实验现象),说明溶液中存在。
(4).从溶液中得到产品,应进行的操作依次是______________、过滤、洗涤、干燥。
(5).利用工业烧渣还可以制得一种重要的净水剂,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与、烧碱在40℃反应,即可制备,其中被还原成,此方法称为“湿法”。请写出湿法制备的化学方程式_________________________________________________。
10.(2021·山东德州·高一期末)绿矾(FeSO4 7H2O)是制备缺铁性补血剂的主要原料。工业上以硫铁矿(主要成分为FeS2)为原料制备绿矾的工艺流程如图:
(1).试剂X是__________________(写化学式)。
(2).实验室过滤时用到的玻璃仪器除烧杯外,还有___________________________。
(3).从还原得到的溶液中获得绿矾的操作是蒸发浓缩、________、过滤、________、干燥(填操作名称)。
(4).某研究性学习小组对绿矾热分解进行研究,将绿矾样品装入图中的硬质玻璃管中,打开K1和K2,缓缓通人N2,加热。实验完毕后装置A中还残留红棕色固体。
①装置D球形干燥管的作用____________________________________。
②C装置中高锰酸钾溶液的作用是____________________________________。
③硫酸亚铁分解还生成另一物质SO3,写出绿矾受热分解的化学方程式______________________________。
11.(2021·山东潍坊·高一期末)电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如图:
回答下列问题:
(1).检验腐蚀废液中含有Fe3+常用试剂是________________。
(2).滤渣的成份是____________(填化学式)。从滤渣中获得铜单质,可选用的试剂是________(填标号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3).向溶液a中通入Cl2发生反应的离子方程式为______________________________________________。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为__________。
(4).甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是______
____________________________________________________(用离子方程式表示)。
12.水合肼(N2H4 H2O)是一种精细化工原料,常用于医药、农药、染料、航天等领域。实验室模拟尿素法制备N2H4 H2O,并进一步制取副产品Na2SO3的流程图如图所示。
已知:①N2H4 H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4 H2O。
③尿素中氮元素为-3价。
回答下列问题:
(1).吸收塔内发生反应的离子方程式为_______________________________________________。
(2).为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是_____________(填操作名称),选用的试剂是___________________。
(3).反应器内生成水合肼的化学方程式为_____________________________________________。
(4).制备过程中要控制反应器内NaClO溶液的供给量,其主要目的是______________________________
__________________________________(用离子方程式表示)。
(5).副产品Na2SO3常用作还原性漂白剂。在测定某液体葡萄糖中Na2SO3残留量时,取50.0mL样品,先通入足量Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为___________________________________________________,该样品中Na2SO3残留量为______________g L-1(以SO2计,结果保留1位小数)
参考答案
1.ac
2.CaSO4 2H2O、Na2SO4 10H2O CuFeS2 1:2 取少量溶液于试管中,向其中加入过量稀盐酸,再滴加BaCl2溶液,如果产生白色沉淀,证明混有Na2SO4 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 强氧化性、酸性 方案乙 无污染产生,原料利用率高
3.、 bc d e c b 生成淡黄色沉淀
4.分液漏斗 B中褪色的品红溶液又恢复成红色 D无明显现象
5.检查装置的气密性 Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O 碱石灰 吸收氨气防止污染环境,同时吸收空气中的水分,防止进入C装置中与氨基钠反应 先加热A后加热C b 2Na+2NH32NaNH2+H2↑
6.K3、K5 打开分液漏斗顶部的塞子,同时K2 打开K4,通过导气管向三颈烧瓶中通入O2 三颈烧瓶中气体红棕色加深 浓硝酸具有挥发性,故传感器检测除c()可能是挥发的硝酸电离产生的 取少量待测溶液,向其中滴加酸性高锰酸钾溶液,若溶液紫色褪色,说明其中含有HNO2。
7.分液漏斗 2H2SO4(浓)+CuCuSO4+2H2O+SO2 溶液变蓝 Na2S或 H2S(其它合理答案均得分) 氧化性 SO2+Cl2+2H2O=4H++2Cl-+ BaSO4 缺少尾气处理装置
8.玻璃棒、漏斗 Fe、Cu 盐酸(或HCl) C 2Fe3+ +Cu=2Fe2+ + Cu2+ 取少量滤液1于试管中,先滴加KSCN溶液,不显红色,再滴加氯水后显红色,证明原溶液只含有Fe2+
9. D 硫氰酸钾 溶液变为红色(血红色) 蒸发浓缩、冷却结晶
10.Fe 玻璃棒 冷却结晶 洗涤 防止氢氧化钠溶液倒吸 检验二氧化硫的存在 2FeSO4 7H2OFe2O3+SO2↑+SO3↑+14H2O
11.KSCN Fe和Cu AD 2Fe2+ + Cl2=2Fe3+ + 2Cl- 1∶2 10Cl- +2+16H+=5Cl2↑+2Mn2++8H2O
12.Cl2+2OH-=Cl-+ClO-+H2O 洗气 饱和氯化钠溶液 CO(NH2)2+NaClO+2NaOH=N2H4 H2O+Na2CO3+NaCl 2ClO-+N2H4 H2O= 2Cl-+ N2↑+3H2O Cl2+SO+H2O=SO+2H++2Cl- 0.6
- 2 -
一、填空题
1.(2021·山东菏泽·高一期末)氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答下列问题:
(1).与氮氧化物有关的全球或区域性大气环境问题有___________(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2).是重要的含氮化合物,写出氨合成塔中发生反应的化学方程式_____________________________;氧化炉中所发生反应的化学方程式为_______________________________________。
(3).吸收塔中发生反应共转移个电子,则参加反应的NO的物质的量为____________。
(4).将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出两种气体,写出生成NO的反应化学方程式_______________________________________________________;若生成NO、的体积比为,则分别生成NO、的两个反应中消耗硝酸的物质的量之比是_______________。
2.(2021·山东德州·高一期末)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(1).图1中与图2中M、N对应的物质分别是_____________、______________。
(2).X与Y反应中氧化剂与还原剂的物质的量之比为______________。
(3).Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是____________________。
(4).硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲,中铜和浓硫酸反应的化学方程式是___________________________________________________。
该反应体现了浓硫酸的____________性。
②这两种方案,你认为哪一种方案更合理 ______________。理由是_________________________________
____________________。
二、实验题
3.(2021·山东菏泽·高一期末)黄铜矿()是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。冶炼侗的反应为。
(1).若中的化合价为+2,反应中被还原的元素是__________(填元素符号)。
(2).上述冶炼过程产生大量。下列处理方案中合理的是__________(填代号)
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制 d.用浓硫酸吸收
(3).实验室制备、收集干燥的,并探究与溶液的反应,所需仪器如下。
①其中装置A产生SO2,反应的化学方程式为__________________________________________________。
②请按气流方向连接各仪器接口,顺序为a→_______→_______→_______→_______→f,装置D中观察到的现象是___________________________。装置E中发生的反应离子方程式为_________________________
____________________________________________________________。
4.(2021·山东菏泽·高一期末)某化学实验小组为探究和比较和氯水的漂白性,设计了如下的实验装置。
回答下列问题:
(1).装置A中盛装浓硫酸的仪器名称是_______________,实验室用装置A制备,发生反应的化学方程式为___________________________________________________。
(2).实验室用装置E制备,其反应的化学方程式为___________________________________________,若有参加反应,则转移的电子总数为___________________。
(3).反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B________________________,D_______________________。
(4).小组中甲同学认为和氯水都有漂白性,若二者混合使用,漂白性会更强。为验证甲同学的推断,在同温同压下,他们同时将和等体积通入到品红溶液中,结果发现品红溶液几乎不褪色,出现上述现象的原因是_______________________________________________________(用化学方程式表示)。
5.氨基钠(NaNH2)是一种化工原料,常温下为白色晶体,熔点210℃,沸点为400℃,露置空气中易吸收水分而失效。实验室可用氨气和钠反应制得。某化学实验小组拟采用如图所示的装置制备氨基钠,回答下列相关问题:
(1).实验时,组装好仪器后,紧跟着进行的下一步的操作是_________________。A中反应的化学方程式为_____________________________________________________。
(2).装置B中盛放的药品是_____________(写名称),装置E的作用是_____________________________。
(3).装置A与C加热的先后顺序是____________________。
(4).若用如图装置代替上述A装置,装置中加入试剂合理的是________。 a.浓氨水 b.浓氨水与CaO c.NH4Cl与Ca(OH)2
(5).C中反应的化学方程式为______________________________________________。
6.(2021·山东潍坊·高一期末)某化学实验小组同学用如图所示装置制备NO2,并探究NO2与水反应的产物(夹持装置略、装置气密性良好、所有阀门关闭)。
回答下列问题:
(1).步骤①:打开K1和___________,通入N2,一段时间后关闭K1。
步骤②:向锥形瓶中加入浓HNO3,其操作方法是__________________________________。
步骤③:证明三颈烧瓶中反应有NO生成,操作是__________________________,现象是_______________
____________________________。
步骤④:传感器数据显示c()随反应时间逐渐增大,证明NO2与水反应生成。
(2).甲同学认为步骤④的结论有缺陷,该同学的判断依据是________________________________。
(3).乙同学查阅资料得知反应后三颈烧瓶溶液中可能含有HNO2。证明HNO2存在的实施方案是________
____________________________________________________________________________________。
7.(2021·山东·高一阶段练习)SO2和Cl2在工业上用途广泛,某同学为探究 Cl2、SO2的性质,设计如下装置进行实验。
(1).图中仪器a的名称______________,E中发生反应的化学方程式为______________________________
_____________________________________________。
(2).若C中加入淀粉碘化钾溶液,关闭 K2,打开K1,使A产生的气体进入C,则C中实验现象为____
________________________________________。
(3).若要实现硫元素由+4 价转化为0价,需关闭K1,打开K2,在C中加入___________溶液,此过程体现了SO2的___________性。
(4).若C中加入品红溶液,打开K1、K2,使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为_____________________________________________________(用离子方程式表示)。
(5).若C中加入BaCl2 溶液,先打开K2,使E产生的气体进入C,观察到C中无明显现象,再打开K1,使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为______________(填化学式)。
(6).该同学设计的装置有一处明显的缺陷是____________________________________________。
三、工业流程题
8.(2021·山东·临朐县实验中学高一阶段练习)电子工业中,人们常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。实验室模拟流程如图所示:
回答下列问题:
(1).过滤操作除铁架台(附铁圈)、烧杯、滤纸外还需要的仪器为_______________。
(2).滤渣1成分的化学式为_______________;试剂Y为__________________。
(3).可替代气体Z的试剂为__________________(填序号)
A.硝酸 B.酸性高锰酸钾 C.过氧化氢
(4).写出FeCl3溶液腐蚀覆铜板的离子方程式_____________________________________________。
(5).用实验证明滤液1中只含有Fe2+__________________________________________________________
______________________________。
9.(2021·山东·高一阶段练习)七水合硫酸亚铁()是一种重要的食品或饲料添加剂,颜料及电子工业的原材料。某同学设计了利用工业烧渣并采用如图流程来制备七水合硫酸亚铁:
回答下列问题:
(1).工业烧渣与稀硫酸反应的离子反应有:,____________________________。
(2).加入的试剂X是__________,写出发生的反应离子方程式___________________________________。
A. B. C. D.
(3).若需检验还原后的溶液中是否存在有,可选择的方法是取2~3mL试液,在其中滴加_______溶液(填名称),当___________________时(填实验现象),说明溶液中存在。
(4).从溶液中得到产品,应进行的操作依次是______________、过滤、洗涤、干燥。
(5).利用工业烧渣还可以制得一种重要的净水剂,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与、烧碱在40℃反应,即可制备,其中被还原成,此方法称为“湿法”。请写出湿法制备的化学方程式_________________________________________________。
10.(2021·山东德州·高一期末)绿矾(FeSO4 7H2O)是制备缺铁性补血剂的主要原料。工业上以硫铁矿(主要成分为FeS2)为原料制备绿矾的工艺流程如图:
(1).试剂X是__________________(写化学式)。
(2).实验室过滤时用到的玻璃仪器除烧杯外,还有___________________________。
(3).从还原得到的溶液中获得绿矾的操作是蒸发浓缩、________、过滤、________、干燥(填操作名称)。
(4).某研究性学习小组对绿矾热分解进行研究,将绿矾样品装入图中的硬质玻璃管中,打开K1和K2,缓缓通人N2,加热。实验完毕后装置A中还残留红棕色固体。
①装置D球形干燥管的作用____________________________________。
②C装置中高锰酸钾溶液的作用是____________________________________。
③硫酸亚铁分解还生成另一物质SO3,写出绿矾受热分解的化学方程式______________________________。
11.(2021·山东潍坊·高一期末)电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如图:
回答下列问题:
(1).检验腐蚀废液中含有Fe3+常用试剂是________________。
(2).滤渣的成份是____________(填化学式)。从滤渣中获得铜单质,可选用的试剂是________(填标号)。
A.稀盐酸 B.浓硫酸 C.稀硝酸 D.氯化铜溶液
(3).向溶液a中通入Cl2发生反应的离子方程式为______________________________________________。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为__________。
(4).甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是______
____________________________________________________(用离子方程式表示)。
12.水合肼(N2H4 H2O)是一种精细化工原料,常用于医药、农药、染料、航天等领域。实验室模拟尿素法制备N2H4 H2O,并进一步制取副产品Na2SO3的流程图如图所示。
已知:①N2H4 H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4 H2O。
③尿素中氮元素为-3价。
回答下列问题:
(1).吸收塔内发生反应的离子方程式为_______________________________________________。
(2).为提高吸收塔内NaOH的有效利用率,将二氧化锰和浓盐酸制取的Cl2通入吸收塔前应进行的操作是_____________(填操作名称),选用的试剂是___________________。
(3).反应器内生成水合肼的化学方程式为_____________________________________________。
(4).制备过程中要控制反应器内NaClO溶液的供给量,其主要目的是______________________________
__________________________________(用离子方程式表示)。
(5).副产品Na2SO3常用作还原性漂白剂。在测定某液体葡萄糖中Na2SO3残留量时,取50.0mL样品,先通入足量Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为___________________________________________________,该样品中Na2SO3残留量为______________g L-1(以SO2计,结果保留1位小数)
参考答案
1.ac
2.CaSO4 2H2O、Na2SO4 10H2O CuFeS2 1:2 取少量溶液于试管中,向其中加入过量稀盐酸,再滴加BaCl2溶液,如果产生白色沉淀,证明混有Na2SO4 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 强氧化性、酸性 方案乙 无污染产生,原料利用率高
3.、 bc d e c b 生成淡黄色沉淀
4.分液漏斗 B中褪色的品红溶液又恢复成红色 D无明显现象
5.检查装置的气密性 Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O 碱石灰 吸收氨气防止污染环境,同时吸收空气中的水分,防止进入C装置中与氨基钠反应 先加热A后加热C b 2Na+2NH32NaNH2+H2↑
6.K3、K5 打开分液漏斗顶部的塞子,同时K2 打开K4,通过导气管向三颈烧瓶中通入O2 三颈烧瓶中气体红棕色加深 浓硝酸具有挥发性,故传感器检测除c()可能是挥发的硝酸电离产生的 取少量待测溶液,向其中滴加酸性高锰酸钾溶液,若溶液紫色褪色,说明其中含有HNO2。
7.分液漏斗 2H2SO4(浓)+CuCuSO4+2H2O+SO2 溶液变蓝 Na2S或 H2S(其它合理答案均得分) 氧化性 SO2+Cl2+2H2O=4H++2Cl-+ BaSO4 缺少尾气处理装置
8.玻璃棒、漏斗 Fe、Cu 盐酸(或HCl) C 2Fe3+ +Cu=2Fe2+ + Cu2+ 取少量滤液1于试管中,先滴加KSCN溶液,不显红色,再滴加氯水后显红色,证明原溶液只含有Fe2+
9. D 硫氰酸钾 溶液变为红色(血红色) 蒸发浓缩、冷却结晶
10.Fe 玻璃棒 冷却结晶 洗涤 防止氢氧化钠溶液倒吸 检验二氧化硫的存在 2FeSO4 7H2OFe2O3+SO2↑+SO3↑+14H2O
11.KSCN Fe和Cu AD 2Fe2+ + Cl2=2Fe3+ + 2Cl- 1∶2 10Cl- +2+16H+=5Cl2↑+2Mn2++8H2O
12.Cl2+2OH-=Cl-+ClO-+H2O 洗气 饱和氯化钠溶液 CO(NH2)2+NaClO+2NaOH=N2H4 H2O+Na2CO3+NaCl 2ClO-+N2H4 H2O= 2Cl-+ N2↑+3H2O Cl2+SO+H2O=SO+2H++2Cl- 0.6
- 2 -
同课章节目录
