黑龙江省大庆市名校2021-2022学年高二上学期期末联考化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省大庆市名校2021-2022学年高二上学期期末联考化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 586.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 20:57:28 | ||
图片预览

文档简介
大庆市名校2021-2022学年高二上学期期末联考
化学试题
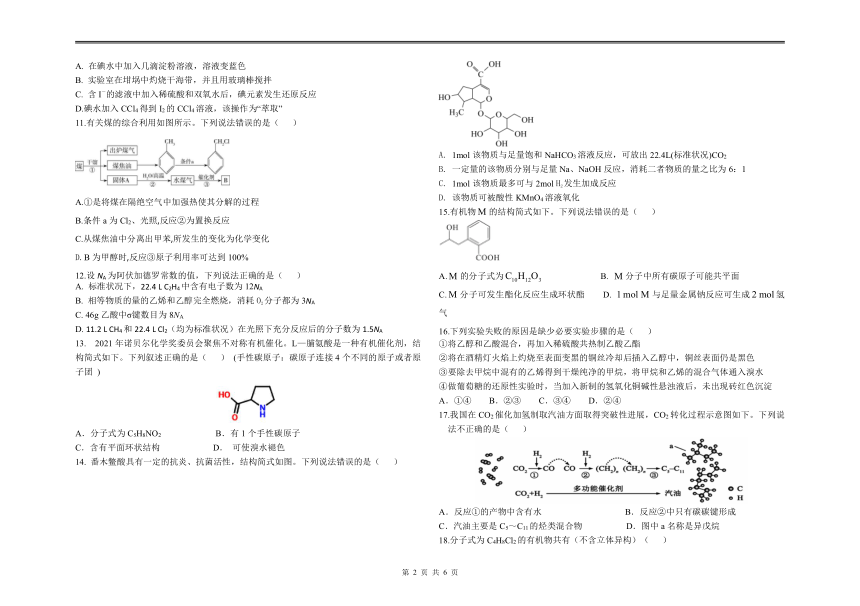
试题说明:1、本试题满分100分,答题时间90分钟。
请将答案填写在答题卡上,考试结束后只交答题卡。
可能用到的相对分子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mg 24 Ca 40
第Ⅰ卷 选择题部分
一、选择题(每小题只有一个选项正确,1-10题每小题2分,11-20题每小题3分,共50分。)
1.在现代食品工业中,食品添加剂的合理使用满足了人们对食品多样化的需求。下列食品添加剂与类别对应错误的是( )
A.糖果中添加的苋菜红、柠檬黄、靛蓝等属于着色剂
B.加工馒头、面包、饼干时添加的碳酸氢钠属于增味剂
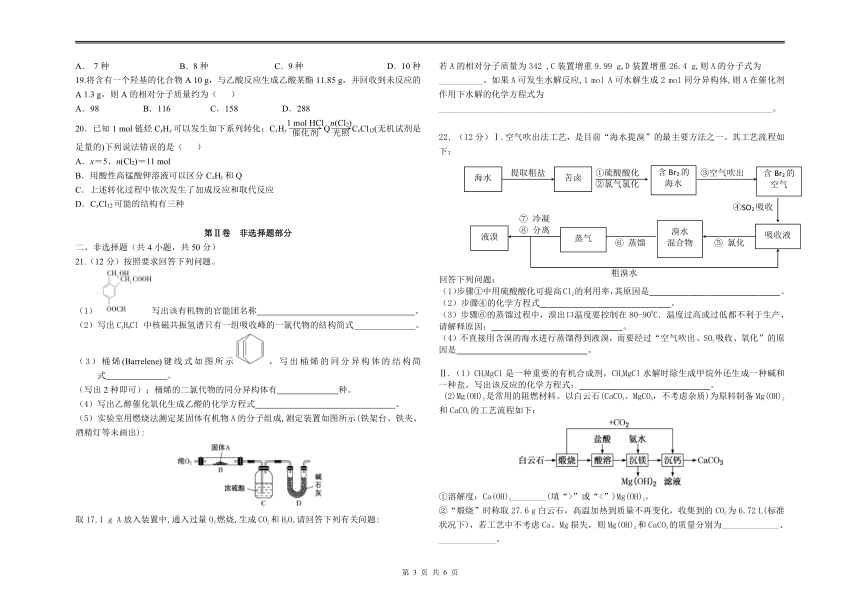
C.加工腊肉、香肠时添加的亚硝酸钠属于防腐剂
D.食盐中添加的碘酸钾、奶粉中添加维生素属于营养强化剂
2.“碳中和”是指CO2的排放总量和减少总量相当。下列措施对实现“碳中和”具有直接贡献的是( )
A.大规模开采可燃冰作为新能源 B.通过清洁煤技术减少煤燃烧污染
C.将重质油裂解为轻质油作为燃料 D.研发催化剂将CO2还原为甲醇
3.下列有关自然资源的开发利用的说法中正确的是( )
A.天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源
B. 石油经分馏获得的汽油、煤油、柴油等轻质油都是纯净物
C. “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
D.Cu、Al、Hg可以分别用热还原CuO、Al2O3、HgO的方法得到
4.下列化学用语表示正确的是( )
A. 乙酸的分子式:CH3COOH B.羟基的电子式:
C. 乙烯的结构简式:CH2CH2 D.丙烷的空间充填模型:
5.下列说法正确的是( )
A.棉花和羊毛的燃烧产物都只有二氧化碳和水 B. 葡萄糖可水解生成乙醇和二氧化碳
C.蔗糖和淀粉水解的最终产物都只有葡萄糖 D.可用碘水检验淀粉是否水解完全
6. 下列有机物结构与性质分析正确的是( )
A.乙烯和环己烷()的分子组成符合通式CnH2n,因此它们互为同系物
B.CH3CH=CH2碳原子杂化方式为有sp3 、sp2和sp杂化
C.分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有5种
D.油脂与浓NaOH反应制高级脂肪酸钠属于取代反应
7.下列有机反应中,C—H σ键发生断裂的是( )
A.乙烯与溴的四氯化碳溶液反应
B.乙烷与氯气在光照条件下反应
C.乙炔与氯化氢在催化剂和加热条件下反应
D.乙醇与乙酸在浓硫酸和加热条件下反应
8.初步提纯下列物质(括号内为少量杂质),选用的试剂和分离方法均正确的是( )
序号 物质 试剂 分离方法
① 乙酸乙酯(乙酸) 饱和Na2CO3溶液 分液
② 乙烷(乙烯) 酸性KMnO4溶液 洗气
③ 乙醇(水) 生石灰 蒸馏
④ 乙醇(乙酸) KOH溶液 分液
A.①② B.①③ C.②③ D.③④
9.下列由实验得出的结论正确的是( )
实验 结论
A. 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B. 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C. 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性
D. 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
10.从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法不正确的是( )
A. 在碘水中加入几滴淀粉溶液,溶液变蓝色
B. 实验室在坩埚中灼烧干海带,并且用玻璃棒搅拌
C. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
11.有关煤的综合利用如图所示。下列说法错误的是( )
A.①是将煤在隔绝空气中加强热使其分解的过程
B.条件a为Cl2、光照,反应②为置换反应
C.从煤焦油中分离出甲苯,所发生的变化为化学变化
D.B为甲醇时,反应③原子利用率可达到100%
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L C2H4中含有电子数为12NA
B. 相等物质的量的乙烯和乙醇完全燃烧,消耗O2分子都为3NA
C. 46g乙酸中σ键数目为8NA
D. 11.2 L CH4和22.4 L Cl2(均为标准状况)在光照下充分反应后的分子数为1.5NA
13. 2021年诺贝尔化学奖委员会聚焦不对称有机催化。L—脯氨酸是一种有机催化剂,结构简式如下。下列叙述正确的是( ) (手性碳原子:碳原子连接4个不同的原子或者原子团 )
A.分子式为C5H8NO2 B.有1个手性碳原子
C.含有平面环状结构 D. 可使溴水褪色
14. 番木鳖酸具有一定的抗炎、抗菌活性,结构简式如图。下列说法错误的是( )
A. 1mol该物质与足量饱和NaHCO3溶液反应,可放出22.4L(标准状况)CO2
B. 一定量的该物质分别与足量Na、NaOH反应,消耗二者物质的量之比为6:1
C. 1mol该物质最多可与2mol H2发生加成反应
D. 该物质可被酸性KMnO4溶液氧化
15.有机物的结构简式如下。下列说法错误的是( )
A.的分子式为 B. 分子中所有碳原子可能共平面
C.分子可发生酯化反应生成环状酯 D. 与足量金属钠反应可生成氢气
16.下列实验失败的原因是缺少必要实验步骤的是( )
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②将在酒精灯火焰上灼烧至表面变黑的铜丝冷却后插入乙醇中,铜丝表面仍是黑色
③要除去甲烷中混有的乙烯得到干燥纯净的甲烷,将甲烷和乙烯的混合气体通入溴水
④做葡萄糖的还原性实验时,当加入新制的氢氧化铜碱性悬浊液后,未出现砖红色沉淀
A.①④ B.②③ C.③④ D.②④
17.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下。下列说法不正确的是( )
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a名称是异戊烷
18.分子式为C4H8Cl2的有机物共有(不含立体异构)( )
A. 7种 B.8种 C.9种 D.10种
19.将含有一个羟基的化合物A 10 g,与乙酸反应生成乙酸某酯11.85 g,并回收到未反应的A 1.3 g,则A的相对分子质量约为( )
A.98 B.116 C.158 D.288
20.已知1 mol链烃CxHy可以发生如下系列转化:CxHyQCxCl12(无机试剂是足量的)下列说法错误的是( )
A.x=5、n(Cl2)=11 mol
B.用酸性高锰酸钾溶液可以区分CxHy和Q
C.上述转化过程中依次发生了加成反应和取代反应
D.CxCl12可能的结构有三种
第Ⅱ卷 非选择题部分
二、非选择题(共4小题,共50分)
21.(12分)按照要求回答下列问题。
(1)写出该有机物的官能团名称 。
(2)写出C4H9Cl 中核磁共振氢谱只有一组吸收峰的一氯代物的结构简式______________。
(3)桶烯(Barrelene)键线式如图所示,写出桶烯的同分异构体的结构简式 。
(写出2种即可);桶烯的二氯代物的同分异构体有 种。
(4)写出乙醇催化氧化生成乙醛的化学方程式 。
(5)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
若A的相对分子质量为342 ,C装置增重9.99 g,D装置增重26.4 g,则A的分子式为__________。如果A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为____________________________________________________________________________。
22.(12分)Ⅰ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
回答下列问题:
(1)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是______________________________。
(2)步骤④的化学方程式______________________________。
(3)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:______________________________。
(4)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是______________________________。
Ⅱ.(1)CH3MgCl是一种重要的有机合成剂,CH3MgCl水解时除生成甲烷外还生成一种碱和一种盐。写出该反应的化学方程式:______________________________。
(2)Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3,不考虑杂质)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
①溶解度:Ca(OH)2________(填“>”或“<”)Mg(OH)2。
②“煅烧”时称取27.6 g白云石,高温加热到质量不再变化,收集到的CO2为6.72 L(标准状况下),若工艺中不考虑Ca、Mg损失,则Mg(OH)2和CaCO3的质量分别为_____________、_____________。
23.(14分) Ⅰ. (3分) 有机物A的质谱图和红外光谱图分别如下:
图1 质谱图 图2 红外光谱图
(1)A的结构简式为________。
(2)相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测 图3 核磁共振氢谱图
发现B的氢谱如图3:B的结构简式为________。
Ⅱ.(11分)A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
(1)A中官能团的名称为______________;
B的结构简式为______________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是___________________。
(4)丙烯酸乙酯的结构简式为_____________________________。
(5)写出下列反应方程式和有机反应基本类型:
③___________________________,___________反应;
⑤___________________________,___________ 反应。
24.(12分)苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
+2KMnO4 +KOH+2MnO2↓+H2O ; +HCl→+KCl
已知有关化合物的相关数据如表所示:
化合物 相对分子质量 密度(g cm﹣3) 溶解性 沸点(℃)
甲苯 92 0.87 难溶于水 110.0
苯甲酸钾 160 ﹣ 易溶于水 ﹣
苯甲酸 122 1.26 微溶于水 248.0
苯甲酸在100g水中的溶解度:0.18g(4℃),0.27g(18℃),2.2g(75℃)。
实验步骤:
(1)合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
(2)对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
(3)对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④ →⑤过滤→⑥洗涤→⑦干燥。
请回答下列有关问题:
根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)冷凝管a处水流方向是 (填“进水”或“出水”);
对反应混合物进行分离过程中,“洗涤滤渣”一步中滤渣的主要成分是____________。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由____________。
(4)当回流液不再出现油珠即可判断反应已完成,其判断理由是____________。
(5)对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是____________;
“④”的操作名称是____________;可证明“⑥洗涤”步骤已洗涤干净的方法是____________。
(6)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为____________。(保留两位有效数字)
大庆市名校2021-2022学年高二上学期期末联考
化学试题答案
参考答案 1-5 BDCBD 6-10 DBBAC 11-15 CDBCD 16-20 CBCBD
21.(12分)
(1)羟基、羧基、酯基(1分)
(2)略(1分)
(3)略,每个1分(2分) ;6种(2分)
(4)2CH3CH2OH+O22CH3CHO+2H2O(2分)
(5)C12H22O11 (2分) C12H22O11(蔗糖)+H2OC6H12O6(葡萄糖)+C6H12O6(果糖) (2分)
22.(12分)
Ⅰ.(1)酸化可以抑制Cl2、Br2与水反应(1分)
(2)Br2+SO2+2H2O=2 HBr+ H2SO4(1分)
(3)温度过高大量水蒸气随之排出,溴气中水分增加;温度过低溴不能完全蒸出,产率低(2分)
(4)富集(或浓缩)溴元素;(1分)
Ⅱ. (1) 2CH3MgCl+2H2O===2CH4↑+MgCl2+Mg(OH)2。(2分)
(2)①溶解度:Ca(OH)2>Mg(OH)2。(1分)②8.7 g(2分)、15 g(2分)
23.(14分)
Ⅰ、(3分) CH3CH2OCH2CH3 (1分)(2分)
Ⅱ、(11分)
(1) 碳碳双键(1分) CH3CH2OH (1分)
(2)ABCD (1分)
(3)Na2CO3或NaHCO3溶液或紫色石蕊试液(答案合理均给分)(1分)
(4)CH2=CHCOOCH2CH3 (1分)
(5) ③CH3COOH+CH3CH2OH CH3COOC2H5+H2O (2分) 酯化或取代 (1分)
⑤ (2分) (反应条件可以写一定条件)
加聚 (1分)
24.(12分)
(1)B (1分) (2) 进水(1分) MnO2(1分)
(3)避免反应过快,使反应液从回流管上端喷出(1分)
(4)无油珠说明不溶于水的甲苯已经被完全氧化(1分)
(5) 除去活性炭,减少苯甲酸结晶析出 ;(2分)两个点各占1分
冷却结晶 ;(1分) 取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净(2分)取样1分,检验1分。(6) 60% (2分)
海水
苦卤
提取粗盐
①硫酸酸化
②氯气氯化
含Br2的
海水
③空气吹出
含Br2的
空气
④SO2吸收
吸收液
⑤ 氯化
溴水
混合物
⑥ 蒸馏
蒸气
液溴
⑦ 冷凝
⑧ 分离
粗溴水
化学试题
试题说明:1、本试题满分100分,答题时间90分钟。
请将答案填写在答题卡上,考试结束后只交答题卡。
可能用到的相对分子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Mg 24 Ca 40
第Ⅰ卷 选择题部分
一、选择题(每小题只有一个选项正确,1-10题每小题2分,11-20题每小题3分,共50分。)
1.在现代食品工业中,食品添加剂的合理使用满足了人们对食品多样化的需求。下列食品添加剂与类别对应错误的是( )
A.糖果中添加的苋菜红、柠檬黄、靛蓝等属于着色剂
B.加工馒头、面包、饼干时添加的碳酸氢钠属于增味剂
C.加工腊肉、香肠时添加的亚硝酸钠属于防腐剂
D.食盐中添加的碘酸钾、奶粉中添加维生素属于营养强化剂
2.“碳中和”是指CO2的排放总量和减少总量相当。下列措施对实现“碳中和”具有直接贡献的是( )
A.大规模开采可燃冰作为新能源 B.通过清洁煤技术减少煤燃烧污染
C.将重质油裂解为轻质油作为燃料 D.研发催化剂将CO2还原为甲醇
3.下列有关自然资源的开发利用的说法中正确的是( )
A.天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源
B. 石油经分馏获得的汽油、煤油、柴油等轻质油都是纯净物
C. “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
D.Cu、Al、Hg可以分别用热还原CuO、Al2O3、HgO的方法得到
4.下列化学用语表示正确的是( )
A. 乙酸的分子式:CH3COOH B.羟基的电子式:
C. 乙烯的结构简式:CH2CH2 D.丙烷的空间充填模型:
5.下列说法正确的是( )
A.棉花和羊毛的燃烧产物都只有二氧化碳和水 B. 葡萄糖可水解生成乙醇和二氧化碳
C.蔗糖和淀粉水解的最终产物都只有葡萄糖 D.可用碘水检验淀粉是否水解完全
6. 下列有机物结构与性质分析正确的是( )
A.乙烯和环己烷()的分子组成符合通式CnH2n,因此它们互为同系物
B.CH3CH=CH2碳原子杂化方式为有sp3 、sp2和sp杂化
C.分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有5种
D.油脂与浓NaOH反应制高级脂肪酸钠属于取代反应
7.下列有机反应中,C—H σ键发生断裂的是( )
A.乙烯与溴的四氯化碳溶液反应
B.乙烷与氯气在光照条件下反应
C.乙炔与氯化氢在催化剂和加热条件下反应
D.乙醇与乙酸在浓硫酸和加热条件下反应
8.初步提纯下列物质(括号内为少量杂质),选用的试剂和分离方法均正确的是( )
序号 物质 试剂 分离方法
① 乙酸乙酯(乙酸) 饱和Na2CO3溶液 分液
② 乙烷(乙烯) 酸性KMnO4溶液 洗气
③ 乙醇(水) 生石灰 蒸馏
④ 乙醇(乙酸) KOH溶液 分液
A.①② B.①③ C.②③ D.③④
9.下列由实验得出的结论正确的是( )
实验 结论
A. 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B. 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C. 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性
D. 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
10.从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法不正确的是( )
A. 在碘水中加入几滴淀粉溶液,溶液变蓝色
B. 实验室在坩埚中灼烧干海带,并且用玻璃棒搅拌
C. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
11.有关煤的综合利用如图所示。下列说法错误的是( )
A.①是将煤在隔绝空气中加强热使其分解的过程
B.条件a为Cl2、光照,反应②为置换反应
C.从煤焦油中分离出甲苯,所发生的变化为化学变化
D.B为甲醇时,反应③原子利用率可达到100%
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L C2H4中含有电子数为12NA
B. 相等物质的量的乙烯和乙醇完全燃烧,消耗O2分子都为3NA
C. 46g乙酸中σ键数目为8NA
D. 11.2 L CH4和22.4 L Cl2(均为标准状况)在光照下充分反应后的分子数为1.5NA
13. 2021年诺贝尔化学奖委员会聚焦不对称有机催化。L—脯氨酸是一种有机催化剂,结构简式如下。下列叙述正确的是( ) (手性碳原子:碳原子连接4个不同的原子或者原子团 )
A.分子式为C5H8NO2 B.有1个手性碳原子
C.含有平面环状结构 D. 可使溴水褪色
14. 番木鳖酸具有一定的抗炎、抗菌活性,结构简式如图。下列说法错误的是( )
A. 1mol该物质与足量饱和NaHCO3溶液反应,可放出22.4L(标准状况)CO2
B. 一定量的该物质分别与足量Na、NaOH反应,消耗二者物质的量之比为6:1
C. 1mol该物质最多可与2mol H2发生加成反应
D. 该物质可被酸性KMnO4溶液氧化
15.有机物的结构简式如下。下列说法错误的是( )
A.的分子式为 B. 分子中所有碳原子可能共平面
C.分子可发生酯化反应生成环状酯 D. 与足量金属钠反应可生成氢气
16.下列实验失败的原因是缺少必要实验步骤的是( )
①将乙醇和乙酸混合,再加入稀硫酸共热制乙酸乙酯
②将在酒精灯火焰上灼烧至表面变黑的铜丝冷却后插入乙醇中,铜丝表面仍是黑色
③要除去甲烷中混有的乙烯得到干燥纯净的甲烷,将甲烷和乙烯的混合气体通入溴水
④做葡萄糖的还原性实验时,当加入新制的氢氧化铜碱性悬浊液后,未出现砖红色沉淀
A.①④ B.②③ C.③④ D.②④
17.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下。下列说法不正确的是( )
A.反应①的产物中含有水 B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物 D.图中a名称是异戊烷
18.分子式为C4H8Cl2的有机物共有(不含立体异构)( )
A. 7种 B.8种 C.9种 D.10种
19.将含有一个羟基的化合物A 10 g,与乙酸反应生成乙酸某酯11.85 g,并回收到未反应的A 1.3 g,则A的相对分子质量约为( )
A.98 B.116 C.158 D.288
20.已知1 mol链烃CxHy可以发生如下系列转化:CxHyQCxCl12(无机试剂是足量的)下列说法错误的是( )
A.x=5、n(Cl2)=11 mol
B.用酸性高锰酸钾溶液可以区分CxHy和Q
C.上述转化过程中依次发生了加成反应和取代反应
D.CxCl12可能的结构有三种
第Ⅱ卷 非选择题部分
二、非选择题(共4小题,共50分)
21.(12分)按照要求回答下列问题。
(1)写出该有机物的官能团名称 。
(2)写出C4H9Cl 中核磁共振氢谱只有一组吸收峰的一氯代物的结构简式______________。
(3)桶烯(Barrelene)键线式如图所示,写出桶烯的同分异构体的结构简式 。
(写出2种即可);桶烯的二氯代物的同分异构体有 种。
(4)写出乙醇催化氧化生成乙醛的化学方程式 。
(5)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
若A的相对分子质量为342 ,C装置增重9.99 g,D装置增重26.4 g,则A的分子式为__________。如果A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为____________________________________________________________________________。
22.(12分)Ⅰ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
回答下列问题:
(1)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是______________________________。
(2)步骤④的化学方程式______________________________。
(3)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:______________________________。
(4)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是______________________________。
Ⅱ.(1)CH3MgCl是一种重要的有机合成剂,CH3MgCl水解时除生成甲烷外还生成一种碱和一种盐。写出该反应的化学方程式:______________________________。
(2)Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3,不考虑杂质)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
①溶解度:Ca(OH)2________(填“>”或“<”)Mg(OH)2。
②“煅烧”时称取27.6 g白云石,高温加热到质量不再变化,收集到的CO2为6.72 L(标准状况下),若工艺中不考虑Ca、Mg损失,则Mg(OH)2和CaCO3的质量分别为_____________、_____________。
23.(14分) Ⅰ. (3分) 有机物A的质谱图和红外光谱图分别如下:
图1 质谱图 图2 红外光谱图
(1)A的结构简式为________。
(2)相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测 图3 核磁共振氢谱图
发现B的氢谱如图3:B的结构简式为________。
Ⅱ.(11分)A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
(1)A中官能团的名称为______________;
B的结构简式为______________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是___________________。
(4)丙烯酸乙酯的结构简式为_____________________________。
(5)写出下列反应方程式和有机反应基本类型:
③___________________________,___________反应;
⑤___________________________,___________ 反应。
24.(12分)苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
+2KMnO4 +KOH+2MnO2↓+H2O ; +HCl→+KCl
已知有关化合物的相关数据如表所示:
化合物 相对分子质量 密度(g cm﹣3) 溶解性 沸点(℃)
甲苯 92 0.87 难溶于水 110.0
苯甲酸钾 160 ﹣ 易溶于水 ﹣
苯甲酸 122 1.26 微溶于水 248.0
苯甲酸在100g水中的溶解度:0.18g(4℃),0.27g(18℃),2.2g(75℃)。
实验步骤:
(1)合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
(2)对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
(3)对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④ →⑤过滤→⑥洗涤→⑦干燥。
请回答下列有关问题:
根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)冷凝管a处水流方向是 (填“进水”或“出水”);
对反应混合物进行分离过程中,“洗涤滤渣”一步中滤渣的主要成分是____________。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由____________。
(4)当回流液不再出现油珠即可判断反应已完成,其判断理由是____________。
(5)对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是____________;
“④”的操作名称是____________;可证明“⑥洗涤”步骤已洗涤干净的方法是____________。
(6)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为____________。(保留两位有效数字)
大庆市名校2021-2022学年高二上学期期末联考
化学试题答案
参考答案 1-5 BDCBD 6-10 DBBAC 11-15 CDBCD 16-20 CBCBD
21.(12分)
(1)羟基、羧基、酯基(1分)
(2)略(1分)
(3)略,每个1分(2分) ;6种(2分)
(4)2CH3CH2OH+O22CH3CHO+2H2O(2分)
(5)C12H22O11 (2分) C12H22O11(蔗糖)+H2OC6H12O6(葡萄糖)+C6H12O6(果糖) (2分)
22.(12分)
Ⅰ.(1)酸化可以抑制Cl2、Br2与水反应(1分)
(2)Br2+SO2+2H2O=2 HBr+ H2SO4(1分)
(3)温度过高大量水蒸气随之排出,溴气中水分增加;温度过低溴不能完全蒸出,产率低(2分)
(4)富集(或浓缩)溴元素;(1分)
Ⅱ. (1) 2CH3MgCl+2H2O===2CH4↑+MgCl2+Mg(OH)2。(2分)
(2)①溶解度:Ca(OH)2>Mg(OH)2。(1分)②8.7 g(2分)、15 g(2分)
23.(14分)
Ⅰ、(3分) CH3CH2OCH2CH3 (1分)(2分)
Ⅱ、(11分)
(1) 碳碳双键(1分) CH3CH2OH (1分)
(2)ABCD (1分)
(3)Na2CO3或NaHCO3溶液或紫色石蕊试液(答案合理均给分)(1分)
(4)CH2=CHCOOCH2CH3 (1分)
(5) ③CH3COOH+CH3CH2OH CH3COOC2H5+H2O (2分) 酯化或取代 (1分)
⑤ (2分) (反应条件可以写一定条件)
加聚 (1分)
24.(12分)
(1)B (1分) (2) 进水(1分) MnO2(1分)
(3)避免反应过快,使反应液从回流管上端喷出(1分)
(4)无油珠说明不溶于水的甲苯已经被完全氧化(1分)
(5) 除去活性炭,减少苯甲酸结晶析出 ;(2分)两个点各占1分
冷却结晶 ;(1分) 取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净(2分)取样1分,检验1分。(6) 60% (2分)
海水
苦卤
提取粗盐
①硫酸酸化
②氯气氯化
含Br2的
海水
③空气吹出
含Br2的
空气
④SO2吸收
吸收液
⑤ 氯化
溴水
混合物
⑥ 蒸馏
蒸气
液溴
⑦ 冷凝
⑧ 分离
粗溴水
同课章节目录
