新疆维吾尔自治区喀什第六高级中学2021-2022学年高二上学期12月月考化学试题(Word版含答案)
文档属性
| 名称 | 新疆维吾尔自治区喀什第六高级中学2021-2022学年高二上学期12月月考化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 20:59:29 | ||
图片预览


文档简介
喀什第六高级中学2021-2022学年高二上学期12月月考
化学试题
(时间:90分钟 满分:100分)
一、单选题
1.常温下,下列各组离子在相应的条件下一定能大量共存的是
A.无色透明溶液中:、K+、Cl-、Al3+
B.=10-10mol/L的溶液中:Na+、I-、Cl-、Ba2+
C.在c(OH-)/c(H+)=1×10-12的溶液中:、Fe2+、Cl-、
D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:、Mg2+、Na+、
2.已知25°C时有关弱酸的电离平衡常数如表所示。
弱酸 HClO HF CH3COOH HNO2
电离常数 3.0×10-8 6.8×10-4 1.6×10-5 6.4×10-6
下列说法错误的是
A.酸性:HF>CH3COOH>HNO2>HClO
B.反应2HF+Ca(ClO)2=2HClO+CaF2↓可以发生
C.相同物质的量浓度的四种溶液中由水电离出的c(H+):HClO溶液>HNO2溶液>CH3COOH溶液>HF溶液
D.ClO-与H+的结合能力弱于F-与H+的结合能力
3.X、Y、Z、M、R为原子序数依次增大的短周期元素,X原子最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,Y、Z的某种离子化合物能与水发生氧化还原反应,M的离子半径在同周期中最小,R的原子序数比M大4。下列说法正确的是
A.简单氢化物的热稳定性:X>Y
B.工业电解制备M时,用含的助熔剂来降低的熔融温度
C.由X、R组成的物质是常用的有机溶剂,易挥发易燃烧
D.Y、Z、R形成的化合物中存在离子键和共价键
4.25℃时,下列说法正确的是
A.某强碱弱酸盐NaA溶液,随着温度升高,pH一定增大
B.的硫酸溶液中
C.0.1 mol/L的某酸H2A溶液中可能存在:
D.pH=7的CH3COOH和CH3COONa混合溶液加水稀释,溶液的pH增大
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是
A.4.5gSiO2中含有的硅氧键的数目为0.3NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为4NA
C.100mL1.0mol L-1Na2CO3溶液中所含氧原子数目为0.3NA
D.加热条件下,将足量Fe投入含有1mol硫酸的浓硫酸中,生成0.5NA个SO2分子
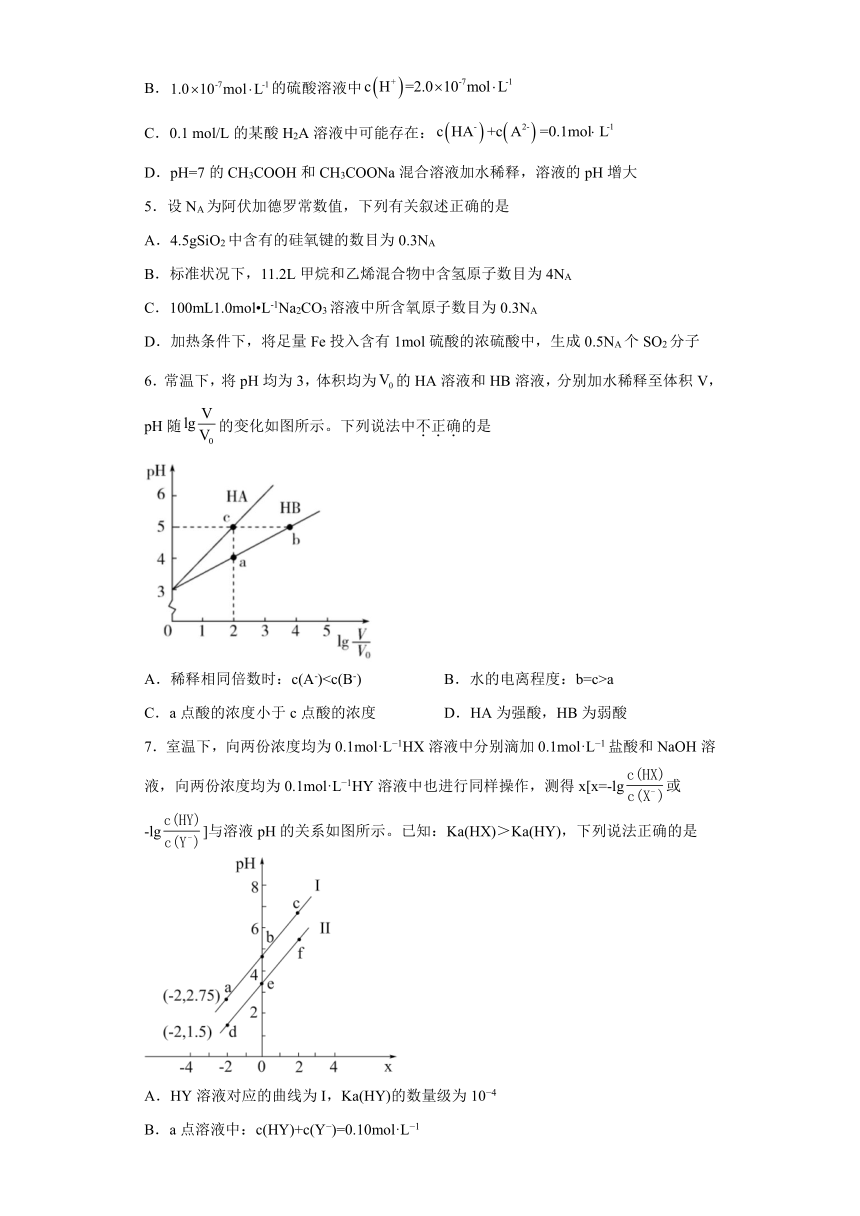
6.常温下,将pH均为3,体积均为的HA溶液和HB溶液,分别加水稀释至体积V,pH随的变化如图所示。下列说法中不正确的是
A.稀释相同倍数时:c(A-)a
C.a点酸的浓度小于c点酸的浓度 D.HA为强酸,HB为弱酸
7.室温下,向两份浓度均为0.1mol·L 1HX溶液中分别滴加0.1mol·L 1盐酸和NaOH溶液,向两份浓度均为0.1mol·L 1HY溶液中也进行同样操作,测得x[x=-lg或-lg]与溶液pH的关系如图所示。已知:Ka(HX)>Ka(HY),下列说法正确的是
A.HY溶液对应的曲线为I,Ka(HY)的数量级为10 4
B.a点溶液中:c(HY)+c(Y )=0.10mol·L 1
C.溶液中水的电离程度:e>f>d
D.e点溶液中:c(Na+)<c(HX),NaX的Kh=1.0×10 10.5
8.25℃时,下列说法错误的是
A.pH均为2的醋酸和盐酸中,水的电离程度相等
B.NaHX溶液显碱性,则溶液中一定存在HX-的水解平衡
C.NH4Y溶液显中性,升高溶液温度,水电离出的c(H+)不变
D.pH=2的醋酸和pH=12的NaOH溶液等体积混合后溶液中c(H+)>c(OH-)
9.下列实验过程可以达到实验目的的是
实验目的 实验过程
A 根据褪色时间来研究浓度对反应速率的影响 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的KMnO4溶液
B 比较HClO和CH3COOH酸性的强弱 常温下,用pH试纸分别测定等物质的量浓度的NaClO溶液和CH3COONa溶液的pH
C 证明HA是弱酸 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多
D 得到Al2O3固体 将NaAlO2溶液蒸干并灼烧
A.A B.B C.C D.D
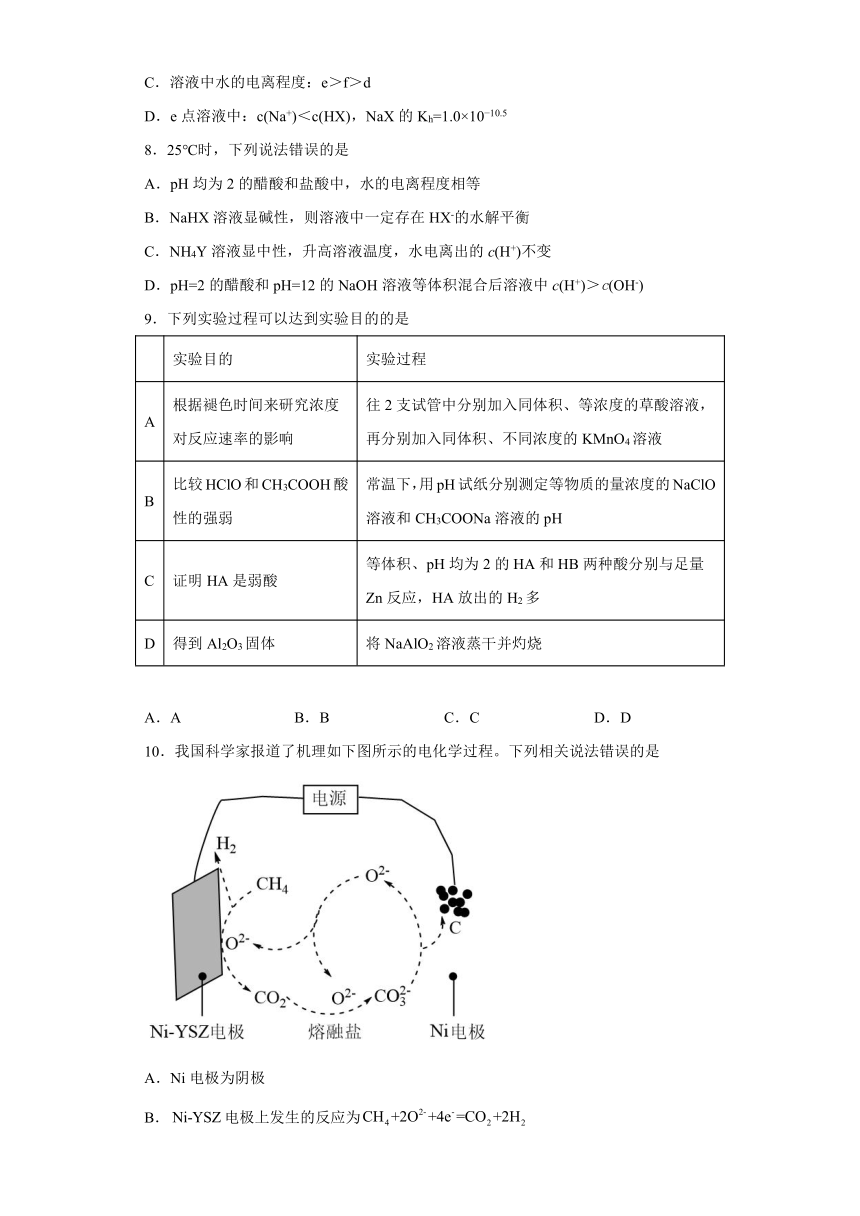
10.我国科学家报道了机理如下图所示的电化学过程。下列相关说法错误的是
A.Ni电极为阴极
B.电极上发生的反应为
C.理论上,每有与结合,电路中转移4mol电子
D.该电化学过程的总反应为
11.下列有关原子核外电子排布的说法,正确的是
A.电子排布为的中性原子是基态原子
B.2p、3p、4p能级的轨道数依次增多
C.电子排布式(21Sc)违反了能量最低原理
D.原子结构示意图为的原子,核外电子云有3种不同形状
12.25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中:、、MnO、CO。
B.的溶液中:、、SO、NO
C.滴入甲基橙显红色的溶液中:NH、、NO、SO
D.0.1mol/L的溶液中:、、、SO
13.下列说法正确的是
A.太阳能、氢能、核能、地热能都属于资源丰富、可以再生的未来新能源
B.需要加热才能发生的反应一定是吸热反应
C.化学反应中必然伴随发生能量变化
D.化学反应中能量变化的大小与反应物的质量多少无关
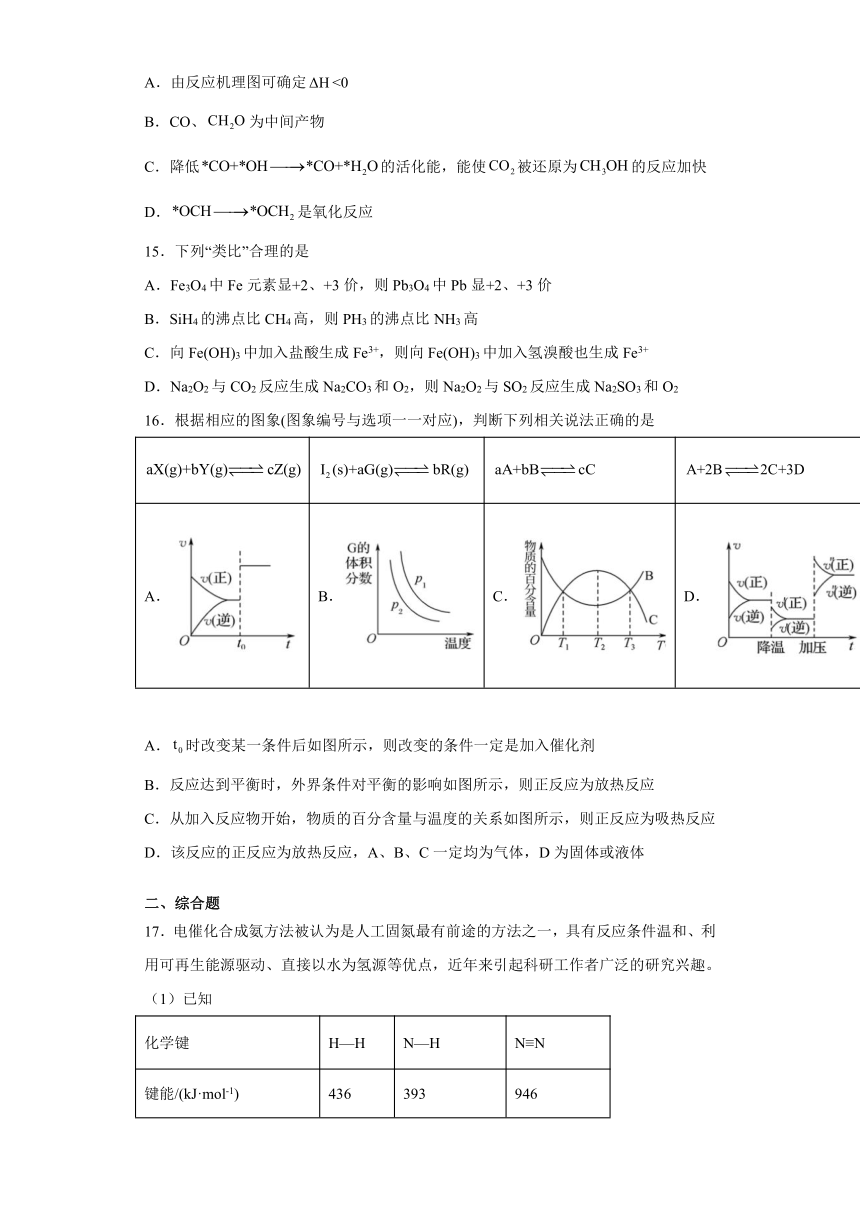
14.在外加能量的前提下,磷化硼纳米材料可实现与合成甲醇: ,其中被还原过程的反应机理如下图所示。
下列说法正确的是
A.由反应机理图可确定<0
B.CO、为中间产物
C.降低的活化能,能使被还原为的反应加快
D.是氧化反应
15.下列“类比”合理的是
A.Fe3O4中Fe元素显+2、+3价,则Pb3O4中Pb显+2、+3价
B.SiH4的沸点比CH4高,则PH3的沸点比NH3高
C.向Fe(OH)3中加入盐酸生成Fe3+,则向Fe(OH)3中加入氢溴酸也生成Fe3+
D.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2
16.根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是
A. B. C. D.
A.时改变某一条件后如图所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡的影响如图所示,则正反应为放热反应
C.从加入反应物开始,物质的百分含量与温度的关系如图所示,则正反应为吸热反应
D.该反应的正反应为放热反应,A、B、C一定均为气体,D为固体或液体
二、综合题
17.电催化合成氨方法被认为是人工固氮最有前途的方法之一,具有反应条件温和、利用可再生能源驱动、直接以水为氢源等优点,近年来引起科研工作者广泛的研究兴趣。
(1)已知
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 393 946
请计算反应N2(g)+3H2(g)2NH3(g)的△H=___________。
(2)向一恒定温度的密闭容器中充入平均相对分子质量为15的N2和H2的混合气体,保持30MPa条件下反应:
①下列哪些选项可以判断反应已达到平衡:___________。
A.3v(H2)正=2v(NH3)逆 B.N2的体积分数不再变化
C.N2和H2的浓度比为定值 D.混合气体的密度不再变化
②上述混合气体中氢气的转化率如图所示,图中曲线I为氢气的平衡转化率与温度的关系,曲线II表示不同温度下经过相同反应时间后的氢气转化率,请说明随着温度的升高,曲线II向曲线I逼近,于M点重合,其原因是___________。
③上述条件下,在不同催化剂作用下,相同时间内H2的转化率随温度的变化如图所示,催化剂效果最佳的是催化剂_________(填“I”“II”“III”)。b点v正_______v逆(填“>”“<”或“=”)。图中测得a点混合气体平均相对分子质量为18.75,a点对应温度下反应的平衡常数Kp=______。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(3)东南大学王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气的还原合成氨。
已知:第一步:(快)(吸附在催化剂表面的物种用*表示)
第二步:中间体(吸附在催化剂表面)(慢)
第三步:___________(快)
第三步的方程式为_______,上述三步中的决速步为第二步,原因是________。该法在合成氨的过程中能量的转化形式是________,较传统工业合成氨法,具有能耗小、环境友好的优点。
18.碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。工业上用铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
已知TeOSO4为正盐。
(1)已知此工艺中“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2;TeO2+H2SO4=TeOSO4+H2O。“含碲浸出液”的溶质成分除了TeOSO4外,主要是________________________________________________________________(填化学式)。
(2)操作Ⅰ的分离方法是___________。
(3)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初级阶段阴极的主要电极反应式是____________________________。
(4)通过图像分析,你认为工业上该过程持续的时段最好是________。
A.20 h B.30 h
C.35 h D.40 h
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,该过程生成粗碲的离子方程式:__________________________________。
19.W、X、Y、Z、M、R、Q均为短周期主族元素,其原子序数与原子半径关系如图所示。
请回答下列问题:
(1)R在元素周期表中的位置是___________;X的质量数分别为16和18的两种核素互为___________。
(2)Z与X形成的原子个数比为1∶1的化合物与水反应的化学方程式为___________。
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,被称为“对角线规则”。根据元素周期表的“对角线规则”,W单质及其化合物的性质与M单质及其化合物的性质相似。写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式___________。
(4)用电子式表示的形成过程___________;与水反应生成两种酸,其中一种为含氧酸且,写出此反应的化学方程式___________。
(5)X、Y、Q的简单氢化物的沸点由高到低的顺序为___________。
20.硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域等。某化学实验小组用如图1装置制备。
已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图2所示。
(1)若要检验a处混合气体中的CO2,实验方法是:将混合气体___________。
(2)三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的___________。
(3)设计以下实验测定以上制备的纯度:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸德水溶解,再加入5mLmol L-1H2SO4和20mL10%KI溶液使铭元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:)
①写出“步骤2”中反应的离子方程式___________。
②试计算的纯度(写出计算过程)___________
(4)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,___________,洗涤、干燥得晶体。(实验中须使用的试剂及仪器有:氧气、pH计)
参考答案
B 2.D 3.D 4.C 5.A 6.C 7.D 8.C 9.C 10.B 11.C 12.C 13.C 14.C 15.C 16.D
17.
(1)-104 kJ/mol
(2) CD 温度升高,反应速率加快,达到平衡所需的时间缩短,故曲线Ⅱ 向曲线Ⅰ靠近,M 点为平衡状态 I > 0.0089 MPa -2
(3) *N2H2 +4H +4e- =2NH3 N2与*H 反应过程中N≡N键断裂需要较高的能量 电能转化为化学能
18.
(1)CuSO4
(2)过滤
(3)Cu2++2e-=Cu
(4)C
(5)TeO2++2SO2+3H2O=Te↓+2SO+6H+
19.
(1) 第三周期第ⅣA族 同位素
(2)
(3)
(4)
(5)
20.
(1)先通入足量的高锰酸钾溶液中,在通入澄清石灰水中,若澄清石灰水变浑浊,则含有二氧化碳
(2)硫化钠易被氧化,先溶解碳酸钠,使硫化钠溶解时间缩短,而且抑制了硫化钠的水解
(3) 93%
(4)30度左右加热浓缩,冰水冷却降温,过滤
化学试题
(时间:90分钟 满分:100分)
一、单选题
1.常温下,下列各组离子在相应的条件下一定能大量共存的是
A.无色透明溶液中:、K+、Cl-、Al3+
B.=10-10mol/L的溶液中:Na+、I-、Cl-、Ba2+
C.在c(OH-)/c(H+)=1×10-12的溶液中:、Fe2+、Cl-、
D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:、Mg2+、Na+、
2.已知25°C时有关弱酸的电离平衡常数如表所示。
弱酸 HClO HF CH3COOH HNO2
电离常数 3.0×10-8 6.8×10-4 1.6×10-5 6.4×10-6
下列说法错误的是
A.酸性:HF>CH3COOH>HNO2>HClO
B.反应2HF+Ca(ClO)2=2HClO+CaF2↓可以发生
C.相同物质的量浓度的四种溶液中由水电离出的c(H+):HClO溶液>HNO2溶液>CH3COOH溶液>HF溶液
D.ClO-与H+的结合能力弱于F-与H+的结合能力
3.X、Y、Z、M、R为原子序数依次增大的短周期元素,X原子最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,Y、Z的某种离子化合物能与水发生氧化还原反应,M的离子半径在同周期中最小,R的原子序数比M大4。下列说法正确的是
A.简单氢化物的热稳定性:X>Y
B.工业电解制备M时,用含的助熔剂来降低的熔融温度
C.由X、R组成的物质是常用的有机溶剂,易挥发易燃烧
D.Y、Z、R形成的化合物中存在离子键和共价键
4.25℃时,下列说法正确的是
A.某强碱弱酸盐NaA溶液,随着温度升高,pH一定增大
B.的硫酸溶液中
C.0.1 mol/L的某酸H2A溶液中可能存在:
D.pH=7的CH3COOH和CH3COONa混合溶液加水稀释,溶液的pH增大
5.设NA为阿伏加德罗常数值,下列有关叙述正确的是
A.4.5gSiO2中含有的硅氧键的数目为0.3NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为4NA
C.100mL1.0mol L-1Na2CO3溶液中所含氧原子数目为0.3NA
D.加热条件下,将足量Fe投入含有1mol硫酸的浓硫酸中,生成0.5NA个SO2分子
6.常温下,将pH均为3,体积均为的HA溶液和HB溶液,分别加水稀释至体积V,pH随的变化如图所示。下列说法中不正确的是
A.稀释相同倍数时:c(A-)
C.a点酸的浓度小于c点酸的浓度 D.HA为强酸,HB为弱酸
7.室温下,向两份浓度均为0.1mol·L 1HX溶液中分别滴加0.1mol·L 1盐酸和NaOH溶液,向两份浓度均为0.1mol·L 1HY溶液中也进行同样操作,测得x[x=-lg或-lg]与溶液pH的关系如图所示。已知:Ka(HX)>Ka(HY),下列说法正确的是
A.HY溶液对应的曲线为I,Ka(HY)的数量级为10 4
B.a点溶液中:c(HY)+c(Y )=0.10mol·L 1
C.溶液中水的电离程度:e>f>d
D.e点溶液中:c(Na+)<c(HX),NaX的Kh=1.0×10 10.5
8.25℃时,下列说法错误的是
A.pH均为2的醋酸和盐酸中,水的电离程度相等
B.NaHX溶液显碱性,则溶液中一定存在HX-的水解平衡
C.NH4Y溶液显中性,升高溶液温度,水电离出的c(H+)不变
D.pH=2的醋酸和pH=12的NaOH溶液等体积混合后溶液中c(H+)>c(OH-)
9.下列实验过程可以达到实验目的的是
实验目的 实验过程
A 根据褪色时间来研究浓度对反应速率的影响 往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的KMnO4溶液
B 比较HClO和CH3COOH酸性的强弱 常温下,用pH试纸分别测定等物质的量浓度的NaClO溶液和CH3COONa溶液的pH
C 证明HA是弱酸 等体积、pH均为2的HA和HB两种酸分别与足量Zn反应,HA放出的H2多
D 得到Al2O3固体 将NaAlO2溶液蒸干并灼烧
A.A B.B C.C D.D
10.我国科学家报道了机理如下图所示的电化学过程。下列相关说法错误的是
A.Ni电极为阴极
B.电极上发生的反应为
C.理论上,每有与结合,电路中转移4mol电子
D.该电化学过程的总反应为
11.下列有关原子核外电子排布的说法,正确的是
A.电子排布为的中性原子是基态原子
B.2p、3p、4p能级的轨道数依次增多
C.电子排布式(21Sc)违反了能量最低原理
D.原子结构示意图为的原子,核外电子云有3种不同形状
12.25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中:、、MnO、CO。
B.的溶液中:、、SO、NO
C.滴入甲基橙显红色的溶液中:NH、、NO、SO
D.0.1mol/L的溶液中:、、、SO
13.下列说法正确的是
A.太阳能、氢能、核能、地热能都属于资源丰富、可以再生的未来新能源
B.需要加热才能发生的反应一定是吸热反应
C.化学反应中必然伴随发生能量变化
D.化学反应中能量变化的大小与反应物的质量多少无关
14.在外加能量的前提下,磷化硼纳米材料可实现与合成甲醇: ,其中被还原过程的反应机理如下图所示。
下列说法正确的是
A.由反应机理图可确定<0
B.CO、为中间产物
C.降低的活化能,能使被还原为的反应加快
D.是氧化反应
15.下列“类比”合理的是
A.Fe3O4中Fe元素显+2、+3价,则Pb3O4中Pb显+2、+3价
B.SiH4的沸点比CH4高,则PH3的沸点比NH3高
C.向Fe(OH)3中加入盐酸生成Fe3+,则向Fe(OH)3中加入氢溴酸也生成Fe3+
D.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应生成Na2SO3和O2
16.根据相应的图象(图象编号与选项一一对应),判断下列相关说法正确的是
A. B. C. D.
A.时改变某一条件后如图所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡的影响如图所示,则正反应为放热反应
C.从加入反应物开始,物质的百分含量与温度的关系如图所示,则正反应为吸热反应
D.该反应的正反应为放热反应,A、B、C一定均为气体,D为固体或液体
二、综合题
17.电催化合成氨方法被认为是人工固氮最有前途的方法之一,具有反应条件温和、利用可再生能源驱动、直接以水为氢源等优点,近年来引起科研工作者广泛的研究兴趣。
(1)已知
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 393 946
请计算反应N2(g)+3H2(g)2NH3(g)的△H=___________。
(2)向一恒定温度的密闭容器中充入平均相对分子质量为15的N2和H2的混合气体,保持30MPa条件下反应:
①下列哪些选项可以判断反应已达到平衡:___________。
A.3v(H2)正=2v(NH3)逆 B.N2的体积分数不再变化
C.N2和H2的浓度比为定值 D.混合气体的密度不再变化
②上述混合气体中氢气的转化率如图所示,图中曲线I为氢气的平衡转化率与温度的关系,曲线II表示不同温度下经过相同反应时间后的氢气转化率,请说明随着温度的升高,曲线II向曲线I逼近,于M点重合,其原因是___________。
③上述条件下,在不同催化剂作用下,相同时间内H2的转化率随温度的变化如图所示,催化剂效果最佳的是催化剂_________(填“I”“II”“III”)。b点v正_______v逆(填“>”“<”或“=”)。图中测得a点混合气体平均相对分子质量为18.75,a点对应温度下反应的平衡常数Kp=______。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(3)东南大学王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气的还原合成氨。
已知:第一步:(快)(吸附在催化剂表面的物种用*表示)
第二步:中间体(吸附在催化剂表面)(慢)
第三步:___________(快)
第三步的方程式为_______,上述三步中的决速步为第二步,原因是________。该法在合成氨的过程中能量的转化形式是________,较传统工业合成氨法,具有能耗小、环境友好的优点。
18.碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。工业上用铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
已知TeOSO4为正盐。
(1)已知此工艺中“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2;TeO2+H2SO4=TeOSO4+H2O。“含碲浸出液”的溶质成分除了TeOSO4外,主要是________________________________________________________________(填化学式)。
(2)操作Ⅰ的分离方法是___________。
(3)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初级阶段阴极的主要电极反应式是____________________________。
(4)通过图像分析,你认为工业上该过程持续的时段最好是________。
A.20 h B.30 h
C.35 h D.40 h
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72 g·L-1下降到0.10 g·L-1,该过程生成粗碲的离子方程式:__________________________________。
19.W、X、Y、Z、M、R、Q均为短周期主族元素,其原子序数与原子半径关系如图所示。
请回答下列问题:
(1)R在元素周期表中的位置是___________;X的质量数分别为16和18的两种核素互为___________。
(2)Z与X形成的原子个数比为1∶1的化合物与水反应的化学方程式为___________。
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,被称为“对角线规则”。根据元素周期表的“对角线规则”,W单质及其化合物的性质与M单质及其化合物的性质相似。写出W的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式___________。
(4)用电子式表示的形成过程___________;与水反应生成两种酸,其中一种为含氧酸且,写出此反应的化学方程式___________。
(5)X、Y、Q的简单氢化物的沸点由高到低的顺序为___________。
20.硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域等。某化学实验小组用如图1装置制备。
已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图2所示。
(1)若要检验a处混合气体中的CO2,实验方法是:将混合气体___________。
(2)三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的___________。
(3)设计以下实验测定以上制备的纯度:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100mL溶液。
步骤2:准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸德水溶解,再加入5mLmol L-1H2SO4和20mL10%KI溶液使铭元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:)
①写出“步骤2”中反应的离子方程式___________。
②试计算的纯度(写出计算过程)___________
(4)利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,___________,洗涤、干燥得晶体。(实验中须使用的试剂及仪器有:氧气、pH计)
参考答案
B 2.D 3.D 4.C 5.A 6.C 7.D 8.C 9.C 10.B 11.C 12.C 13.C 14.C 15.C 16.D
17.
(1)-104 kJ/mol
(2) CD 温度升高,反应速率加快,达到平衡所需的时间缩短,故曲线Ⅱ 向曲线Ⅰ靠近,M 点为平衡状态 I > 0.0089 MPa -2
(3) *N2H2 +4H +4e- =2NH3 N2与*H 反应过程中N≡N键断裂需要较高的能量 电能转化为化学能
18.
(1)CuSO4
(2)过滤
(3)Cu2++2e-=Cu
(4)C
(5)TeO2++2SO2+3H2O=Te↓+2SO+6H+
19.
(1) 第三周期第ⅣA族 同位素
(2)
(3)
(4)
(5)
20.
(1)先通入足量的高锰酸钾溶液中,在通入澄清石灰水中,若澄清石灰水变浑浊,则含有二氧化碳
(2)硫化钠易被氧化,先溶解碳酸钠,使硫化钠溶解时间缩短,而且抑制了硫化钠的水解
(3) 93%
(4)30度左右加热浓缩,冰水冷却降温,过滤
同课章节目录
