3.3元素同步练习-2021-2022学年九年级化学人教版上册(word版 解析版)
文档属性
| 名称 | 3.3元素同步练习-2021-2022学年九年级化学人教版上册(word版 解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 144.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-01 23:56:15 | ||
图片预览




文档简介
3.3、元素
一、选择题(共16题)
1.水加热成水蒸气的过程中,发生变化的是( )
A.物质种类 B.元素种类 C.分子种类 D.分子间隔
2.2020年6月23日,我国成功发射北斗三号最后一颗卫星。锶等材料制成的原子钟被用于北斗三号卫星的精确计时,其精准度世界第一、锶在元素周期表中的信息如图所示,下列说法正确的是( )
A.元素符号为sR B.原子序数为38
C.原子的质子数为50 D.相对原子质量为87.62g
3.各种元素在地壳中的含量差别很大,按质量计,含量最多的元素是( )
A.铝 B.硅 C.氧 D.铁
4.为了预防碘缺乏疾病,主要防治措施是在食盐中加碘,这里的“碘”应理解为
A.元素 B.分子 C.单质 D.离子
5.小明同学今天在超市里买了“高钙牛奶”,这里的“钙”指的是( )
A.单质 B.元素 C.分子 D.原子
6.元素周期表是学习化学的重要工具。右下图是元素周期表中的一格,从中获取的信息错误的是( )
A.该元素属于金属元素 B.该元素原子的核电荷数为20
C.该元素的原子序数为20 D.该元素的原子的相对原子质量为40.08g
7.市场上食用钙片、补铁酱油中的 “钙”、“铁”指的是( )
A.分子 B.原子 C.单质 D.元素
8.2021年4月24日是第六个“中国航天日”,“航天日”的设立激发了全民族探索创新热情,旨在实现中国航天梦。在航天飞机和火箭上用到了稀罕的钪钛合金。钪(Sc)在元素周期表中的信息如图所示,关于钪的有关说法正确的是( )
A.钪属于非金属元素 B.钪的相对原子质量为44.96g
C.钪的核外电子数为21 D.钪位于元素周期表第三周期
9.下列有关分子原子、离子、元素的说法中,正确的是( )
A.原子都是由质子、中子和核外电子构成的
B.同种元素的原子核内质子数和中子数一定相等
C.原子是化学变化中的最小粒子
D.保持水的化学性质的最小粒子是氢原子和氧原子
10.化学家根据门捷列夫的预言,发现了镓在元素周期表中的位置以及原子结构示意图如图所示,下列说法错误的是( )
A.镓原子在化学反应中易得到电子 B.镓原子核中的质子数为 31
C.镓原子核外有四层电子层 D.镓的元素符号是 Ga
11.2017年5月,中科院、国家语委会和全国科技名词委正式为118号元素定名,其部分信息如图所示.则下列有关说法正确的是( )
A.元素符号为og B.原子核外电子数为118
C.原子的质子数为179 D.原子的相对原子质量为297 g
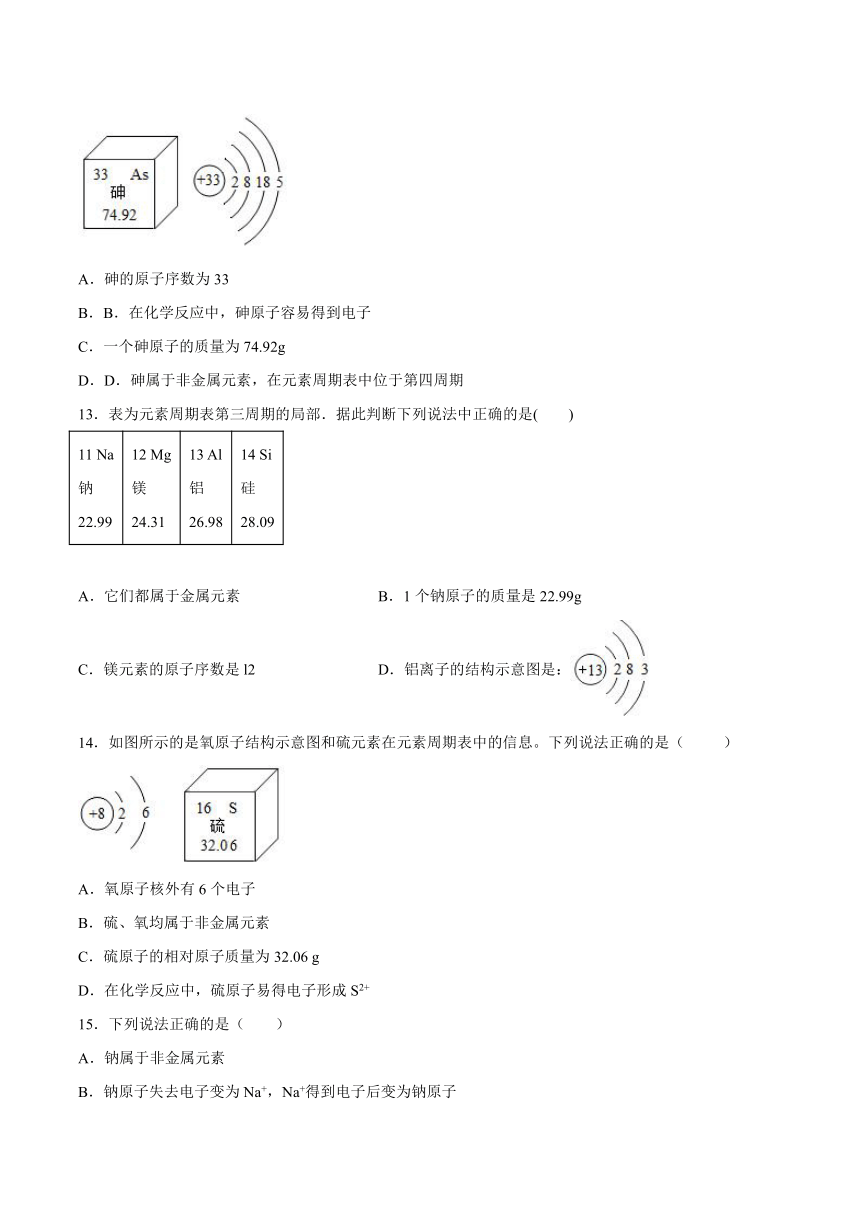
12.科学家利用“基因剪刀”技术降低了水稻中砷的含量。下图为砷元素在元素周期表中的单元格与砷原子的结构示意图,下列说法不正确的是( )
砷的原子序数为33
B.在化学反应中,砷原子容易得到电子
一个砷原子的质量为74.92g
D.砷属于非金属元素,在元素周期表中位于第四周期
13.表为元素周期表第三周期的局部.据此判断下列说法中正确的是( )
11 Na 钠 22.99 12 Mg 镁 24.31 13 Al 铝 26.98 14 Si 硅 28.09
A.它们都属于金属元素 B.1个钠原子的质量是22.99g
C.镁元素的原子序数是l2 D.铝离子的结构示意图是:
14.如图所示的是氧原子结构示意图和硫元素在元素周期表中的信息。下列说法正确的是( )
A.氧原子核外有6个电子
B.硫、氧均属于非金属元素
C.硫原子的相对原子质量为32.06 g
D.在化学反应中,硫原子易得电子形成S2+
15.下列说法正确的是( )
A.钠属于非金属元素
B.钠原子失去电子变为Na+,Na+得到电子后变为钠原子
C.钠的相对原子质量为23g
D.钠原子核内有11个质子,一定也有11个中子
16.下列关于微粒结构示意图的说法正确的是( )
A.①③属于金属元素
B.①④可以形成化合物
C.③④是阴离子
D.②④是稳定结构
二、非选择题(共7题)
17.元素周期表是学习化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
(1)写出对应化学符号:① 镁离子_____;② 三个五氧化二磷分子______;
(2)请从上面右图中写一条关于硅元素的信息: ___________________________________
(3)研究表明:第二周期从3~9号元素的原子电子层数相同,随着核电荷数逐渐增大,原子核对核外电子的引力逐渐增大,故原子半径逐渐减小。请分析第三周期从11~17号元素原子半径变化规律是______________
18.图1是铝元素在元素周期表中的相关信息,图2是包含铝原子在内的几种粒子的结构示意图,据图仔细分析答题:
(1)铝元素属于____元素,铝的相对原子质量为____。在化学反应中,铝原子容易失去电子形成铝离子,铝离子的化学符号为____。
(2)图3四种粒子中,属于阴离子的是____(填字母,下同),属于同种元素的是____,与B化学性质相似的是____。
19.元素周期表是学习和研究化学的重要工具。下图为元素周期表的一角,A 是地壳中含量最多的元素,B 组成的单质是一种淡黄色的固体,E 的单质可用于填充气球,请回答问题。
(1)A 与C 形成物质的化学式是___________。
(2)B 组成的单质与A 组成的单质相互反应的符号表达式为___________________。
(3)E 的元素符号是_____________,原子序数 C_________________D(填“>”或“<”),C、B、D 在元素周期表中处于同一_________。
20.元素周期表中某一周期元素的原子结构示意图如图:
(1)图中具有相对稳定结构的是________(填元素符号).
(2)B的原子结构示意图中,x=________.
(3)镁原子的结构示意图如图,上图中与其化学性质相似的元素是________(填元素符号)
(4)图中元素从左至右排列所遵循的规律是________(写一条)
(5)根据图示信息,确定1个氧气分子中所含电子总数为________.
21.中国是核电大国。核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、铯、锶等原子和一些粒子及射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电。
(1)从物质的变化上看,核变化与化学变化的相同点是_________________________;
(2)从原子的变化上看,核变化与化学变化的不同点是________________________。
(3)下图为元素周期表中钚元素的相关信息,下列说法正确的是__________。
A.钚是非金属元素 B.钚原子核外有94个电子
C.钚元素的中子数94 D.钚的相对原子质量为244 g
22.如图所示是部分原子的结构示意图。请回答下列问题:
(1)原子序数为12的元素位于元素周期表中第____________周期,该原子的元素在元素分类中属于_____________(选填“金属”或“非金属”)元素。
(2)在化学反应中,原子序数为9的元素的原子易_____________(选填“得到”或“失去”)电子,形成的离子的符号是_____________。
(3)3-10号元素在元素周期表中处于同一周期的原因是它们原子结构中的____________相同。
(4)图2中A是某元素的原子结构示意图。标出该元素在图1中的位置:____________(选填“①”、“②”或“③”)。
(5)图2中B是镓元素的原子结构示意图,其中x的值为_________,它的化学性质和图1中的_____________(选填“①”、“②”或“③”)位置的元素相似。
23.在化学学习中运用适当的方法可以起到事半功倍的效果。请回答下列问题:
(1)下列是一些粒子结构示意图,请按照一定的标准将其平均分为两类。
其中的—个分类标准是①__________,包含微粒为②___________(填字母);
(2)将数据进行图表化总结,是化学学习中经常用到的方法。如图所示,三种方法各有优势:
图1 一些国家的人均水量 图2 地壳运动的元素含量 图3 生物细胞中的元素组成
请你模仿图1和图2,将图3表格所表示的内容在答题卡分别以柱状图和饼状图的形式大略地呈现出来_____________。
参考答案
1.D
【详解】
A、水变成水蒸气,没有新物质生成,属于物理变化,物质种类没有发生变化,A选项不正确,不符合题意;
B、水变成水蒸气,物质种类不变,元素种类也没变,B选项不正确,不符合题意;
C、水变成水蒸气,物质种类不变,分子本身没有发生改变,只是分子间的间隔发生了改变,C选项不正确,不符合题意;
D、水变成水蒸气,分子间间隔变大,D选项正确,符合题意。故选D。
2.B
【详解】
A、由信息图可知,锶元素的符号为Sr, 错误;
B、由信息图可知,锶元素的原子序数为38,正确;
C、由信息图可知,根据原子中,原子序数=质子数,因此锶原子的质子数为38, 错误;
D、由信息图可知,相对原子质量单位是1, 省略不写,不是克,错误;
故选B。
3.C
【详解】
地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙, 故选C。
4.A
【解析】
试题分析:食盐中加碘,这里的“碘”应理解为表示宏观概念的元素,而不是表示微观概念的粒子,更不是单质。故选A.
5.B
【详解】
宏观物质的组成,用宏观概念元素来表示;分子的构成,用微观粒子来表示;宏观概念元素只讲种类,不讲个数,高“钙”牛奶,这里的“钙”不能以单质、分子、原子形式存在,而是指元素。故选B。
6.D
【详解】
A、根据元素名称是钙,该元素属于金属元素,故选项说法正确;
B、根据元素周期表中的一格可知,左上角的数字为20,表示原子序数为20;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子的核电荷数为20,故选项说法正确;
C、根据元素周期表中的一格可知,左上角的数字为20,该元素的原子序数为20,故选项说法正确;
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为40.08,相对原子质量单位是“1”,不是“克”,故选项说法错误。故选D。
7.D
【详解】
市场上食用钙片、补铁酱油中的 “钙”、“铁”指的是这些食品中含有的钙元素、铁元素,不是指具体的某种分子、原子或单质。故选D。
8.C
【分析】
元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。
【详解】
A、由汉字结构可知,钪属于金属元素,错误;
B、钪的相对原子质量为44.96,错误;
C、原子中原子序数=质子数=核外电子数,故钪的核外电子数为21,正确;
D、没有信息能体现钪位于元素周期表第三周期,错误。
故选C。
9.C
【详解】
A.有些氢原子的原子核中没有中子,故错误;
B.同种元素的原子核内质子数和中子数不一定相等,如有些氢原子核中有1个质子,没有中子,故错误;
C.原子是化学变化中的最小粒子,故正确;
D.水由水分子构成,保持水化学性质的最小粒子是水分子,故错误。
故选C。
10.A
【详解】
A、根据镓原子结构示意图可知,镓原子的原子最外层电子数为3,少于4个,在化学反应中易失去3个电子而形成阳离子达到稳定结构,说法错误;
B、元素周期表格中,左上角的数字为31,表示原子序数为31,原子中,原子序数=核电荷数=质子数=核外电子数,则镓原子核中的质子数为31,说法正确;
C、弧线表示电子层数,根据镓原子结构示意图可知,镓原子核外有四个电子层,说法正确;
D、元素周期表中的一格可知:字母表示该元素的元素符号;镓的元素符号是 Ga,选说法正确。
故选:A。
11.B
【详解】
A、根据元素周期表中的一格可知,字母表示该元素的元素符号,该元素的元素符号为Og,元素符号的第1字母应该大写,错误;B、根据元素周期表中的一格可知,左上角的数字为118,该元素的原子序数为118,根据原子序数=核电荷数=质子数=核外电子数,原子核外电子数为118,正确;C、根据元素周期表中的一格可知,左上角的数字为118,表示原子序数为118;根据原子序数=核电荷数=质子数,原子的质子数为118,错误;D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为297,相对原子质量单位是“1”,不是“克”,故选项说法错误。故选B。
12.C
【详解】
A、元素周期表一格左上角为原子序数,为33,正确。
B、砷原子最外层电子数为5,大于4,容易得到电子。正确。
C、从元素周期表一格中无法看出原子的质量,错误。
D、砷是石字旁,是非金属元素。砷原子原子核外有4个电子层,在元素周期表中位于第四周期,正确。
故选C。
13.C
【解析】
A、四个小方格中表示的元素名称分别是钠、镁、铝、硅,硅属于非金属元素,错误;B、下方数字表示相对原子质量,故一个钠原子的相对原子质量为22.99,错误;C、镁元素的原子序数是l2,正确;D、铝原子核外最外层有3个电子,在化学反应中易失去3个电子而形成铝离子,符号为,错误。故选C。
14.B
【详解】
A、氧原子核外有8个电子,该选项说法不正确;
B、硫、氧均属于非金属元素,该选项说法正确;
C、硫原子的相对原子质量为32.06,该选项说法不正确;
D、硫原子最外层电子数是6,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为S2-,故选项说法错误;
故选B。
15.B
【详解】
A、除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁;钠元素是金属元素,说法错误,不符合题意;
B、一般情况下,最外层电子数小于4的,反应中容易失去电子,大于4的反应中容易得到电子,原子最外层电子数是1,反应中容易失去电子,钠原子失去电子变为Na+,Na+得到电子后变为钠原子,说法正确,符合题意;
C、相对原子质量≈质子数+中子数,单位不是g,说法错误,不符合题意;
D、原子中,核电荷数=核内质子数=核外电子数=原子序数,而质子数与中子数无必然关系,钠原子核内有11个质子,而中子数不一定是11个,说法错误,不符合题意。
故选B。
16.B
【详解】
A、质子数=原子序数,12号元素是镁元素,由“金”字旁可知,属于金属元素,10号元素是氖元素,属于稀有气体元素,故①属于金属元素,不符合题意;
B、①12号元素为镁元素,质子数大于核外电子数,表示镁离子;④8号元素为氧元素,质子数小于核外电子数,表示氧离子,故镁离子和氧离子可以形成化合物氧化镁,符合题意;
C、③质子数=核外电子数,表示原子;④质子数小于核外电子数,表示阴离子,不符合题意;
D、②最外层电子数为2,小于4,在化学反应中,容易失去电子,不是稳定结构;④最外层电子数为8,是稳定结构,不符合题意。
故选B。
17.Mg2+ 3P2O5 硅的相对原子质量是28.09 或硅的元素符号是Si 或Si的元素名称是硅 或硅的核电荷数(或原子序数、核内质子数)是14(其它合理答案也可) 由大变小(其它合理答案也可)
【详解】
试题分析∶由题中信息并结合元素周期表知,(1)化学符号:① 镁离子是Mg2+;② 三个五氧化二磷分子3P2O5;(2)请从上面右图中知硅元素的信息:硅的相对原子质量是28.09 ,硅的元素符号是Si ,Si的元素名称是硅,硅的核电荷数(或原子序数、核内质子数)是14。(2)同周期元素的原子电子层数相同,随着核电荷数逐渐增大,原子核对核外电子的引力逐渐增大,故原子半径逐渐减小。同主族元素的原子从上到下,最外层上电子数相同,随着核电荷数逐渐增大,电子层数随之增加,原子核对核外电子的引力逐渐减小,故原子半径逐渐减小。
18.金属 26.98 Al3+ A AB C
【详解】
(1)从汉字来看,铝元素属于金属元素,由图示可知铝的相对原子质量为26.89;铝原子最外层有三个电子,在化学变化中容易失去三个电子,形成带三个单位正电荷的铝离子Al3+;
(2) 阴离子中核外电子数大于核内质子数;图3四种粒子中,属于阴离子的是A;
元素是质子数相同的一类原子,属于同种元素的是AB;
元素的化学性质取决于最外层电子数,B的最外层有六个电子和C的最外层电子数相同,故与B化学性质相似的是C。
19.SiO2 S+O2SO2 He < 周期
【分析】
根据“A 是地壳中含量最多的元素,B 组成的单质是一种淡黄色的固体,E 的单质可用于填充气球”即可直接推出这三种元素,然后根据其余元素在元素周期表中的位置进行推断即可。
【详解】
A 是地壳中含量最多的元素,则A为O,B 组成的单质是一种淡黄色的固体,则B为S,E 的单质可用于填充气球,则E为He,由图中元素的位置可知,C为Si,D为Cl;
(1)O与Si能够形成二氧化硅,二氧化硅的化学式为SiO2;
(2)硫燃烧生成二氧化硫,该反应的符号表达式为S+O2SO2;
(3)E的元素符号为He,C与D位于同一周期,且C位于D的左边,因此原子序数:C20.Ne 5 Be 从左至右原子序数依次递增等 16
【详解】
(1)最外层电子数为8(一个电子层最外层是2)属于相对稳定结构,所以表中具有相对稳定结构的元素是氖元素;故填:Ne;
(2)原子中,质子数=核外电子数,x=2+3=5;故填:5;
(3)最外层电子数决定元素的化学性质,最外层电子数相同,化学性质相似,镁原子最外层有2个电子,铍原子最外层也是2个电子,化学性质相似;故填:Be;
(4)该周期的元素排列从左至右所遵循的规律是从左至右原子序数依次递增等.故答案为:从左至右原子序数依次递增等;
(5)在原子中,质子数=核电荷数=核外电子数.1个氧分子是由2个氧原子构成的.1个氧原子中有8个电子,故1个氧分子中含有16个电子;故填:16。
21.都产生新的物质 核变化中原子发生变化,化学变化中原子不变 B
【详解】
(1)从物质的变化上看,核变化与化学变化的相同点是都产生新的物质。(2)从原子的变化上看,核变化与化学变化的不同点是核变化中原子发生变化,化学变化中原子不变。 (3)A.钚是金属元素,错误;B.原子序数在数值上等于原子内的质子数,原子中质子数=核外电子数,钚原子核外有94个电子,正确;C.钚元素的质子数94,错误;D.钚的相对原子质量为244,错误。故选B。
22.
(1) 3三 金属
(2) 得到 F-
(3)电子层数
(4)③
(5) 31 ①
【分析】
(1)
根据部分原子的结构示意图可知:原子序数为12的元素是镁元素,镁元素原子的电子层数为3层,所以镁元素位于元素周期表中第三周期,镁的汉字偏旁带“钅”字旁,属于金属元素,故填:3(或三);金属。
(2)
在化学反应中,原子序数为9的元素的原子的最外层电子数是7,大于4,在化学反应中易得到一个电子达到8个电子的稳定结构,形成带一个单位负电荷的氟离子,表示为F-,故填:得到;F-。
(3)
原子的电子层数决定了元素的周期,3-10号元素在元素周期表中处于同一周期的原因是它们原子结构中的电子层数相同,故填:电子层数。
(4)
在原子中,核电荷数=质子数=原子序数,由A是某元素的原子结构示意图可知:粒子A的质子数为15,所以该元素在图1中的位置是③,故填:③。
(5)
在原子中,核电荷数=质子数=核外电子数,由图2中B是镓元素的原子结构示意图可得:x=2+8+18+3=31;该原子的最外层电子数是3,与图1中①原子的最外层电子数相同;②原子的最外层电子数是4;③原子的最外层电子数是5,元素原子的最外层电子数相同,在化学反应中元素的化学性质相似,所以该元素的化学性质和图1中的①位置的元素相似,故填:③;31;①。
23.化学性质相似(或元素周期表中同一纵行元素)的原子 b、c
【详解】
(1) 其中的—个分类标准是化学性质相似(或元素周期表中同一纵行元素)的原子,最外层电子数相同,元素的化学性质相似,故包含微粒为b、c;(2) 图3表格所表示的内容以柱状图和饼状图的形式大略地表示为:。
一、选择题(共16题)
1.水加热成水蒸气的过程中,发生变化的是( )
A.物质种类 B.元素种类 C.分子种类 D.分子间隔
2.2020年6月23日,我国成功发射北斗三号最后一颗卫星。锶等材料制成的原子钟被用于北斗三号卫星的精确计时,其精准度世界第一、锶在元素周期表中的信息如图所示,下列说法正确的是( )
A.元素符号为sR B.原子序数为38
C.原子的质子数为50 D.相对原子质量为87.62g
3.各种元素在地壳中的含量差别很大,按质量计,含量最多的元素是( )
A.铝 B.硅 C.氧 D.铁
4.为了预防碘缺乏疾病,主要防治措施是在食盐中加碘,这里的“碘”应理解为
A.元素 B.分子 C.单质 D.离子
5.小明同学今天在超市里买了“高钙牛奶”,这里的“钙”指的是( )
A.单质 B.元素 C.分子 D.原子
6.元素周期表是学习化学的重要工具。右下图是元素周期表中的一格,从中获取的信息错误的是( )
A.该元素属于金属元素 B.该元素原子的核电荷数为20
C.该元素的原子序数为20 D.该元素的原子的相对原子质量为40.08g
7.市场上食用钙片、补铁酱油中的 “钙”、“铁”指的是( )
A.分子 B.原子 C.单质 D.元素
8.2021年4月24日是第六个“中国航天日”,“航天日”的设立激发了全民族探索创新热情,旨在实现中国航天梦。在航天飞机和火箭上用到了稀罕的钪钛合金。钪(Sc)在元素周期表中的信息如图所示,关于钪的有关说法正确的是( )
A.钪属于非金属元素 B.钪的相对原子质量为44.96g
C.钪的核外电子数为21 D.钪位于元素周期表第三周期
9.下列有关分子原子、离子、元素的说法中,正确的是( )
A.原子都是由质子、中子和核外电子构成的
B.同种元素的原子核内质子数和中子数一定相等
C.原子是化学变化中的最小粒子
D.保持水的化学性质的最小粒子是氢原子和氧原子
10.化学家根据门捷列夫的预言,发现了镓在元素周期表中的位置以及原子结构示意图如图所示,下列说法错误的是( )
A.镓原子在化学反应中易得到电子 B.镓原子核中的质子数为 31
C.镓原子核外有四层电子层 D.镓的元素符号是 Ga
11.2017年5月,中科院、国家语委会和全国科技名词委正式为118号元素定名,其部分信息如图所示.则下列有关说法正确的是( )
A.元素符号为og B.原子核外电子数为118
C.原子的质子数为179 D.原子的相对原子质量为297 g
12.科学家利用“基因剪刀”技术降低了水稻中砷的含量。下图为砷元素在元素周期表中的单元格与砷原子的结构示意图,下列说法不正确的是( )
砷的原子序数为33
B.在化学反应中,砷原子容易得到电子
一个砷原子的质量为74.92g
D.砷属于非金属元素,在元素周期表中位于第四周期
13.表为元素周期表第三周期的局部.据此判断下列说法中正确的是( )
11 Na 钠 22.99 12 Mg 镁 24.31 13 Al 铝 26.98 14 Si 硅 28.09
A.它们都属于金属元素 B.1个钠原子的质量是22.99g
C.镁元素的原子序数是l2 D.铝离子的结构示意图是:
14.如图所示的是氧原子结构示意图和硫元素在元素周期表中的信息。下列说法正确的是( )
A.氧原子核外有6个电子
B.硫、氧均属于非金属元素
C.硫原子的相对原子质量为32.06 g
D.在化学反应中,硫原子易得电子形成S2+
15.下列说法正确的是( )
A.钠属于非金属元素
B.钠原子失去电子变为Na+,Na+得到电子后变为钠原子
C.钠的相对原子质量为23g
D.钠原子核内有11个质子,一定也有11个中子
16.下列关于微粒结构示意图的说法正确的是( )
A.①③属于金属元素
B.①④可以形成化合物
C.③④是阴离子
D.②④是稳定结构
二、非选择题(共7题)
17.元素周期表是学习化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
(1)写出对应化学符号:① 镁离子_____;② 三个五氧化二磷分子______;
(2)请从上面右图中写一条关于硅元素的信息: ___________________________________
(3)研究表明:第二周期从3~9号元素的原子电子层数相同,随着核电荷数逐渐增大,原子核对核外电子的引力逐渐增大,故原子半径逐渐减小。请分析第三周期从11~17号元素原子半径变化规律是______________
18.图1是铝元素在元素周期表中的相关信息,图2是包含铝原子在内的几种粒子的结构示意图,据图仔细分析答题:
(1)铝元素属于____元素,铝的相对原子质量为____。在化学反应中,铝原子容易失去电子形成铝离子,铝离子的化学符号为____。
(2)图3四种粒子中,属于阴离子的是____(填字母,下同),属于同种元素的是____,与B化学性质相似的是____。
19.元素周期表是学习和研究化学的重要工具。下图为元素周期表的一角,A 是地壳中含量最多的元素,B 组成的单质是一种淡黄色的固体,E 的单质可用于填充气球,请回答问题。
(1)A 与C 形成物质的化学式是___________。
(2)B 组成的单质与A 组成的单质相互反应的符号表达式为___________________。
(3)E 的元素符号是_____________,原子序数 C_________________D(填“>”或“<”),C、B、D 在元素周期表中处于同一_________。
20.元素周期表中某一周期元素的原子结构示意图如图:
(1)图中具有相对稳定结构的是________(填元素符号).
(2)B的原子结构示意图中,x=________.
(3)镁原子的结构示意图如图,上图中与其化学性质相似的元素是________(填元素符号)
(4)图中元素从左至右排列所遵循的规律是________(写一条)
(5)根据图示信息,确定1个氧气分子中所含电子总数为________.
21.中国是核电大国。核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生钡、氙、碘、铯、锶等原子和一些粒子及射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电。
(1)从物质的变化上看,核变化与化学变化的相同点是_________________________;
(2)从原子的变化上看,核变化与化学变化的不同点是________________________。
(3)下图为元素周期表中钚元素的相关信息,下列说法正确的是__________。
A.钚是非金属元素 B.钚原子核外有94个电子
C.钚元素的中子数94 D.钚的相对原子质量为244 g
22.如图所示是部分原子的结构示意图。请回答下列问题:
(1)原子序数为12的元素位于元素周期表中第____________周期,该原子的元素在元素分类中属于_____________(选填“金属”或“非金属”)元素。
(2)在化学反应中,原子序数为9的元素的原子易_____________(选填“得到”或“失去”)电子,形成的离子的符号是_____________。
(3)3-10号元素在元素周期表中处于同一周期的原因是它们原子结构中的____________相同。
(4)图2中A是某元素的原子结构示意图。标出该元素在图1中的位置:____________(选填“①”、“②”或“③”)。
(5)图2中B是镓元素的原子结构示意图,其中x的值为_________,它的化学性质和图1中的_____________(选填“①”、“②”或“③”)位置的元素相似。
23.在化学学习中运用适当的方法可以起到事半功倍的效果。请回答下列问题:
(1)下列是一些粒子结构示意图,请按照一定的标准将其平均分为两类。
其中的—个分类标准是①__________,包含微粒为②___________(填字母);
(2)将数据进行图表化总结,是化学学习中经常用到的方法。如图所示,三种方法各有优势:
图1 一些国家的人均水量 图2 地壳运动的元素含量 图3 生物细胞中的元素组成
请你模仿图1和图2,将图3表格所表示的内容在答题卡分别以柱状图和饼状图的形式大略地呈现出来_____________。
参考答案
1.D
【详解】
A、水变成水蒸气,没有新物质生成,属于物理变化,物质种类没有发生变化,A选项不正确,不符合题意;
B、水变成水蒸气,物质种类不变,元素种类也没变,B选项不正确,不符合题意;
C、水变成水蒸气,物质种类不变,分子本身没有发生改变,只是分子间的间隔发生了改变,C选项不正确,不符合题意;
D、水变成水蒸气,分子间间隔变大,D选项正确,符合题意。故选D。
2.B
【详解】
A、由信息图可知,锶元素的符号为Sr, 错误;
B、由信息图可知,锶元素的原子序数为38,正确;
C、由信息图可知,根据原子中,原子序数=质子数,因此锶原子的质子数为38, 错误;
D、由信息图可知,相对原子质量单位是1, 省略不写,不是克,错误;
故选B。
3.C
【详解】
地壳中元素的质量分数,由高到低的前五种元素分别是:氧、硅、铝、铁、钙, 故选C。
4.A
【解析】
试题分析:食盐中加碘,这里的“碘”应理解为表示宏观概念的元素,而不是表示微观概念的粒子,更不是单质。故选A.
5.B
【详解】
宏观物质的组成,用宏观概念元素来表示;分子的构成,用微观粒子来表示;宏观概念元素只讲种类,不讲个数,高“钙”牛奶,这里的“钙”不能以单质、分子、原子形式存在,而是指元素。故选B。
6.D
【详解】
A、根据元素名称是钙,该元素属于金属元素,故选项说法正确;
B、根据元素周期表中的一格可知,左上角的数字为20,表示原子序数为20;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子的核电荷数为20,故选项说法正确;
C、根据元素周期表中的一格可知,左上角的数字为20,该元素的原子序数为20,故选项说法正确;
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为40.08,相对原子质量单位是“1”,不是“克”,故选项说法错误。故选D。
7.D
【详解】
市场上食用钙片、补铁酱油中的 “钙”、“铁”指的是这些食品中含有的钙元素、铁元素,不是指具体的某种分子、原子或单质。故选D。
8.C
【分析】
元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。
【详解】
A、由汉字结构可知,钪属于金属元素,错误;
B、钪的相对原子质量为44.96,错误;
C、原子中原子序数=质子数=核外电子数,故钪的核外电子数为21,正确;
D、没有信息能体现钪位于元素周期表第三周期,错误。
故选C。
9.C
【详解】
A.有些氢原子的原子核中没有中子,故错误;
B.同种元素的原子核内质子数和中子数不一定相等,如有些氢原子核中有1个质子,没有中子,故错误;
C.原子是化学变化中的最小粒子,故正确;
D.水由水分子构成,保持水化学性质的最小粒子是水分子,故错误。
故选C。
10.A
【详解】
A、根据镓原子结构示意图可知,镓原子的原子最外层电子数为3,少于4个,在化学反应中易失去3个电子而形成阳离子达到稳定结构,说法错误;
B、元素周期表格中,左上角的数字为31,表示原子序数为31,原子中,原子序数=核电荷数=质子数=核外电子数,则镓原子核中的质子数为31,说法正确;
C、弧线表示电子层数,根据镓原子结构示意图可知,镓原子核外有四个电子层,说法正确;
D、元素周期表中的一格可知:字母表示该元素的元素符号;镓的元素符号是 Ga,选说法正确。
故选:A。
11.B
【详解】
A、根据元素周期表中的一格可知,字母表示该元素的元素符号,该元素的元素符号为Og,元素符号的第1字母应该大写,错误;B、根据元素周期表中的一格可知,左上角的数字为118,该元素的原子序数为118,根据原子序数=核电荷数=质子数=核外电子数,原子核外电子数为118,正确;C、根据元素周期表中的一格可知,左上角的数字为118,表示原子序数为118;根据原子序数=核电荷数=质子数,原子的质子数为118,错误;D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为297,相对原子质量单位是“1”,不是“克”,故选项说法错误。故选B。
12.C
【详解】
A、元素周期表一格左上角为原子序数,为33,正确。
B、砷原子最外层电子数为5,大于4,容易得到电子。正确。
C、从元素周期表一格中无法看出原子的质量,错误。
D、砷是石字旁,是非金属元素。砷原子原子核外有4个电子层,在元素周期表中位于第四周期,正确。
故选C。
13.C
【解析】
A、四个小方格中表示的元素名称分别是钠、镁、铝、硅,硅属于非金属元素,错误;B、下方数字表示相对原子质量,故一个钠原子的相对原子质量为22.99,错误;C、镁元素的原子序数是l2,正确;D、铝原子核外最外层有3个电子,在化学反应中易失去3个电子而形成铝离子,符号为,错误。故选C。
14.B
【详解】
A、氧原子核外有8个电子,该选项说法不正确;
B、硫、氧均属于非金属元素,该选项说法正确;
C、硫原子的相对原子质量为32.06,该选项说法不正确;
D、硫原子最外层电子数是6,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为S2-,故选项说法错误;
故选B。
15.B
【详解】
A、除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁;钠元素是金属元素,说法错误,不符合题意;
B、一般情况下,最外层电子数小于4的,反应中容易失去电子,大于4的反应中容易得到电子,原子最外层电子数是1,反应中容易失去电子,钠原子失去电子变为Na+,Na+得到电子后变为钠原子,说法正确,符合题意;
C、相对原子质量≈质子数+中子数,单位不是g,说法错误,不符合题意;
D、原子中,核电荷数=核内质子数=核外电子数=原子序数,而质子数与中子数无必然关系,钠原子核内有11个质子,而中子数不一定是11个,说法错误,不符合题意。
故选B。
16.B
【详解】
A、质子数=原子序数,12号元素是镁元素,由“金”字旁可知,属于金属元素,10号元素是氖元素,属于稀有气体元素,故①属于金属元素,不符合题意;
B、①12号元素为镁元素,质子数大于核外电子数,表示镁离子;④8号元素为氧元素,质子数小于核外电子数,表示氧离子,故镁离子和氧离子可以形成化合物氧化镁,符合题意;
C、③质子数=核外电子数,表示原子;④质子数小于核外电子数,表示阴离子,不符合题意;
D、②最外层电子数为2,小于4,在化学反应中,容易失去电子,不是稳定结构;④最外层电子数为8,是稳定结构,不符合题意。
故选B。
17.Mg2+ 3P2O5 硅的相对原子质量是28.09 或硅的元素符号是Si 或Si的元素名称是硅 或硅的核电荷数(或原子序数、核内质子数)是14(其它合理答案也可) 由大变小(其它合理答案也可)
【详解】
试题分析∶由题中信息并结合元素周期表知,(1)化学符号:① 镁离子是Mg2+;② 三个五氧化二磷分子3P2O5;(2)请从上面右图中知硅元素的信息:硅的相对原子质量是28.09 ,硅的元素符号是Si ,Si的元素名称是硅,硅的核电荷数(或原子序数、核内质子数)是14。(2)同周期元素的原子电子层数相同,随着核电荷数逐渐增大,原子核对核外电子的引力逐渐增大,故原子半径逐渐减小。同主族元素的原子从上到下,最外层上电子数相同,随着核电荷数逐渐增大,电子层数随之增加,原子核对核外电子的引力逐渐减小,故原子半径逐渐减小。
18.金属 26.98 Al3+ A AB C
【详解】
(1)从汉字来看,铝元素属于金属元素,由图示可知铝的相对原子质量为26.89;铝原子最外层有三个电子,在化学变化中容易失去三个电子,形成带三个单位正电荷的铝离子Al3+;
(2) 阴离子中核外电子数大于核内质子数;图3四种粒子中,属于阴离子的是A;
元素是质子数相同的一类原子,属于同种元素的是AB;
元素的化学性质取决于最外层电子数,B的最外层有六个电子和C的最外层电子数相同,故与B化学性质相似的是C。
19.SiO2 S+O2SO2 He < 周期
【分析】
根据“A 是地壳中含量最多的元素,B 组成的单质是一种淡黄色的固体,E 的单质可用于填充气球”即可直接推出这三种元素,然后根据其余元素在元素周期表中的位置进行推断即可。
【详解】
A 是地壳中含量最多的元素,则A为O,B 组成的单质是一种淡黄色的固体,则B为S,E 的单质可用于填充气球,则E为He,由图中元素的位置可知,C为Si,D为Cl;
(1)O与Si能够形成二氧化硅,二氧化硅的化学式为SiO2;
(2)硫燃烧生成二氧化硫,该反应的符号表达式为S+O2SO2;
(3)E的元素符号为He,C与D位于同一周期,且C位于D的左边,因此原子序数:C
【详解】
(1)最外层电子数为8(一个电子层最外层是2)属于相对稳定结构,所以表中具有相对稳定结构的元素是氖元素;故填:Ne;
(2)原子中,质子数=核外电子数,x=2+3=5;故填:5;
(3)最外层电子数决定元素的化学性质,最外层电子数相同,化学性质相似,镁原子最外层有2个电子,铍原子最外层也是2个电子,化学性质相似;故填:Be;
(4)该周期的元素排列从左至右所遵循的规律是从左至右原子序数依次递增等.故答案为:从左至右原子序数依次递增等;
(5)在原子中,质子数=核电荷数=核外电子数.1个氧分子是由2个氧原子构成的.1个氧原子中有8个电子,故1个氧分子中含有16个电子;故填:16。
21.都产生新的物质 核变化中原子发生变化,化学变化中原子不变 B
【详解】
(1)从物质的变化上看,核变化与化学变化的相同点是都产生新的物质。(2)从原子的变化上看,核变化与化学变化的不同点是核变化中原子发生变化,化学变化中原子不变。 (3)A.钚是金属元素,错误;B.原子序数在数值上等于原子内的质子数,原子中质子数=核外电子数,钚原子核外有94个电子,正确;C.钚元素的质子数94,错误;D.钚的相对原子质量为244,错误。故选B。
22.
(1) 3三 金属
(2) 得到 F-
(3)电子层数
(4)③
(5) 31 ①
【分析】
(1)
根据部分原子的结构示意图可知:原子序数为12的元素是镁元素,镁元素原子的电子层数为3层,所以镁元素位于元素周期表中第三周期,镁的汉字偏旁带“钅”字旁,属于金属元素,故填:3(或三);金属。
(2)
在化学反应中,原子序数为9的元素的原子的最外层电子数是7,大于4,在化学反应中易得到一个电子达到8个电子的稳定结构,形成带一个单位负电荷的氟离子,表示为F-,故填:得到;F-。
(3)
原子的电子层数决定了元素的周期,3-10号元素在元素周期表中处于同一周期的原因是它们原子结构中的电子层数相同,故填:电子层数。
(4)
在原子中,核电荷数=质子数=原子序数,由A是某元素的原子结构示意图可知:粒子A的质子数为15,所以该元素在图1中的位置是③,故填:③。
(5)
在原子中,核电荷数=质子数=核外电子数,由图2中B是镓元素的原子结构示意图可得:x=2+8+18+3=31;该原子的最外层电子数是3,与图1中①原子的最外层电子数相同;②原子的最外层电子数是4;③原子的最外层电子数是5,元素原子的最外层电子数相同,在化学反应中元素的化学性质相似,所以该元素的化学性质和图1中的①位置的元素相似,故填:③;31;①。
23.化学性质相似(或元素周期表中同一纵行元素)的原子 b、c
【详解】
(1) 其中的—个分类标准是化学性质相似(或元素周期表中同一纵行元素)的原子,最外层电子数相同,元素的化学性质相似,故包含微粒为b、c;(2) 图3表格所表示的内容以柱状图和饼状图的形式大略地表示为:。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
