9.3溶液的浓度同步练习-2021-2022学年九年级化学人教版下册(含解析)
文档属性
| 名称 | 9.3溶液的浓度同步练习-2021-2022学年九年级化学人教版下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 234.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-02 11:37:44 | ||
图片预览


文档简介
9.3溶液的浓度
一、选择题(共16题)
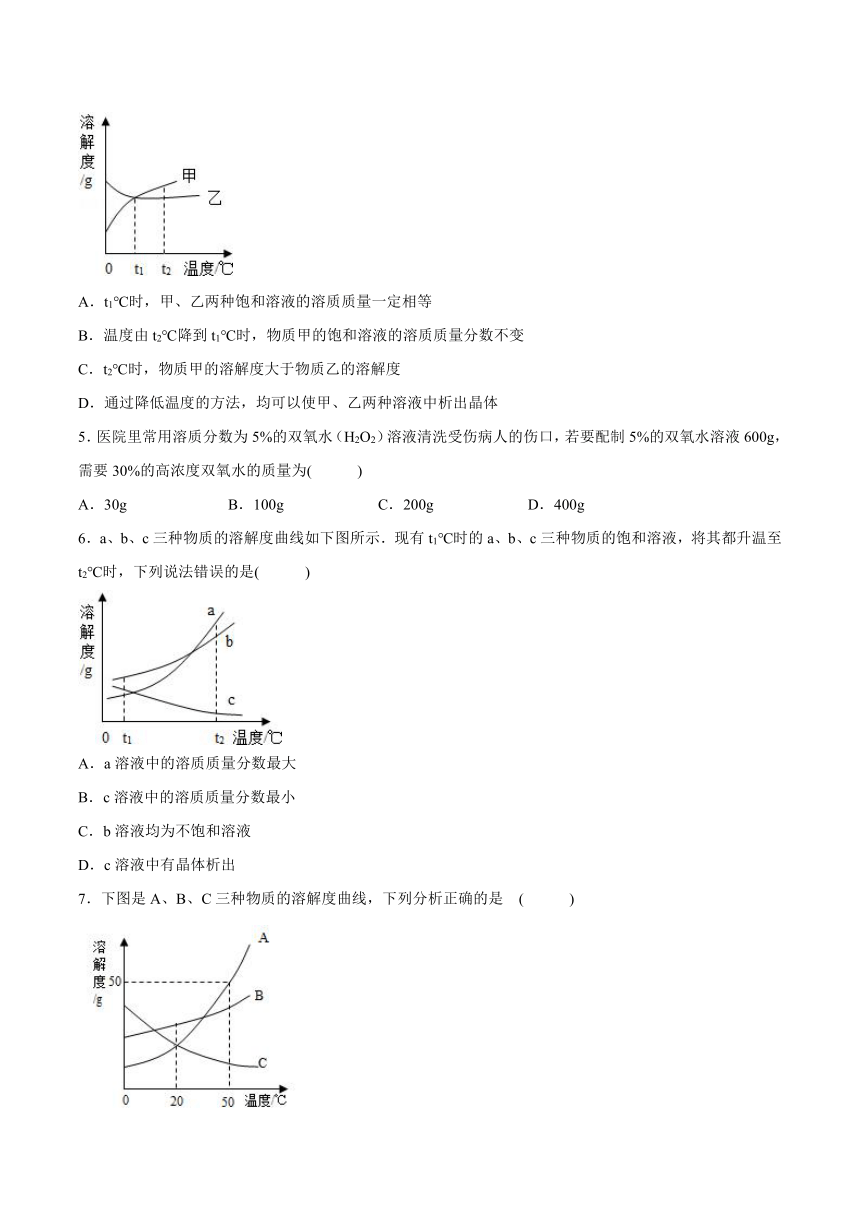
1.20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液一定是不饱和溶液
B.甲和乙烧杯中,硝酸钾溶液的溶质质量分数相等
C.丙烧杯中,硝酸钾溶液一定是不饱和溶液
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
2.欲配制19.6%的稀硫酸,需98%的浓硫酸和水的质量比为。( )
A.1:6 B. 1:5 C.1:4 D. 1:3
3.甲、乙两物质的溶解度曲线如右图所示。下列叙述中,正确的是( )
A.t1℃时,甲和乙的饱和溶液的质量分数均是30%
B.t2℃时,甲和乙的饱和溶液中溶质质量分数相等
C.从0℃至t1℃时,甲物质的溶解度大于乙物质的溶解度
D.t2℃时, 分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
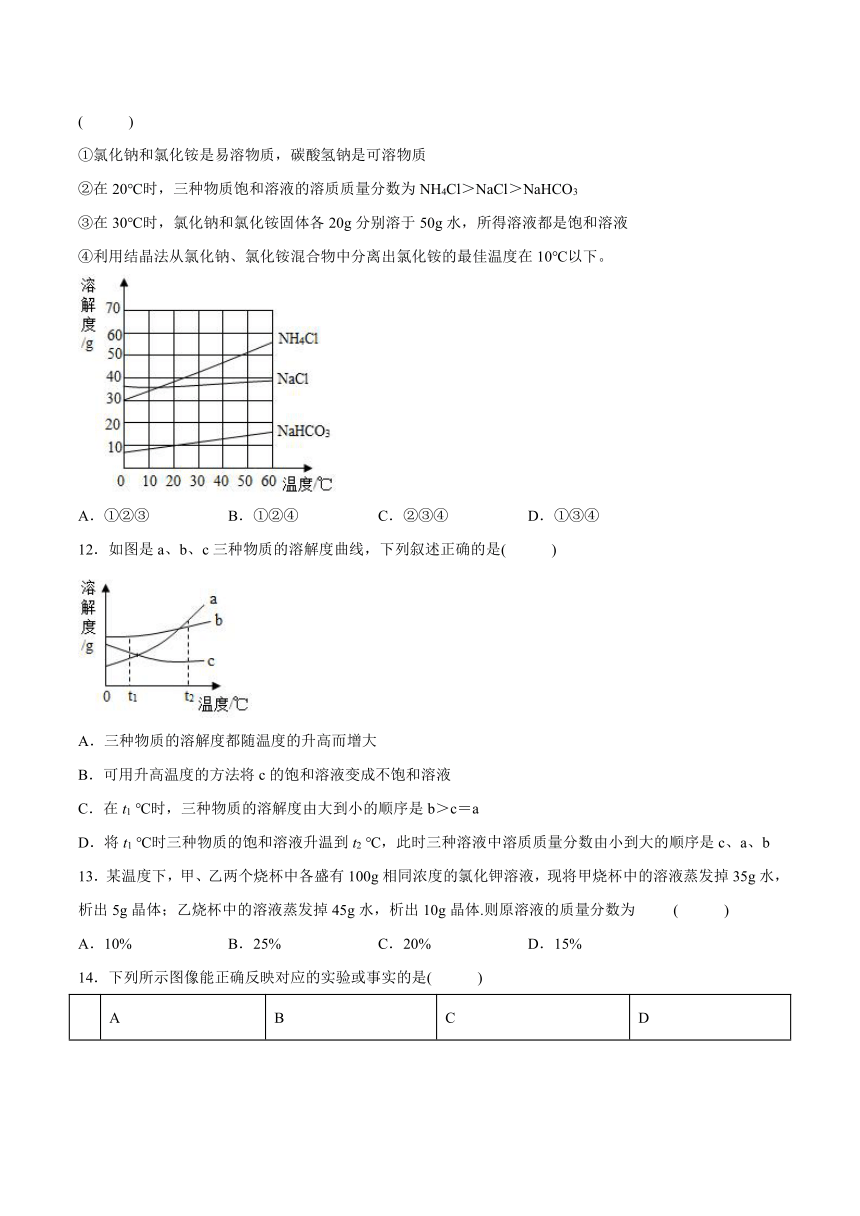
4.如图所示的是甲、乙两种固体物质的溶解度曲线.根据图中的相关信息判断下列说法正确的是( )
A.t1℃时,甲、乙两种饱和溶液的溶质质量一定相等
B.温度由t2℃降到t1℃时,物质甲的饱和溶液的溶质质量分数不变
C.t2℃时,物质甲的溶解度大于物质乙的溶解度
D.通过降低温度的方法,均可以使甲、乙两种溶液中析出晶体
5.医院里常用溶质分数为5%的双氧水(H2O2)溶液清洗受伤病人的伤口,若要配制5%的双氧水溶液600g,需要30%的高浓度双氧水的质量为( )
A.30g B.100g C.200g D.400g
6.a、b、c三种物质的溶解度曲线如下图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
A.a溶液中的溶质质量分数最大
B.c溶液中的溶质质量分数最小
C.b溶液均为不饱和溶液
D.c溶液中有晶体析出
7.下图是A、B、C三种物质的溶解度曲线,下列分析正确的是 ( )
A.A的溶解度比B大
B.50℃时把50gA放入100g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:2
C.将A的饱和溶液变为不饱和溶液,可采用升温的方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
8.下表为氯化铵和氯化钠在不同温度时的溶解度。下列说法正确的是( )
温度/℃ 0 10 20 30 40 50
NH4Cl溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4
NaCl溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0
A.20℃时,氯化钠饱和溶液的溶质质量分数为36%
B.由表中数据可知,溶解度受温度变化影响较大的物质是氯化钠
C.氯化钠与氯化铵溶解度相等的温度在10℃-20℃之间
D.50℃时,100g水中加入50.0g氯化铵配成溶液,再冷却到20℃,能够析出13.2g固体
9.小军同学需要快速配制一杯可口的白糖溶液,下列措施不能达到目的的是( )
A.用冰水溶解 B.用热水溶解
C.把白糖碾成粉末后溶解 D.溶解时用筷子搅拌
10.如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
A.将t2℃时甲、乙的饱和溶液均降温到t1℃,都有晶体析出
B.t2℃时,100g甲的饱和溶液中含甲的质量为30g
C.t1℃时,甲、乙的溶解度相等
D.t2℃时,甲溶液溶质的质量分数一定大于乙溶液溶质的质量分数
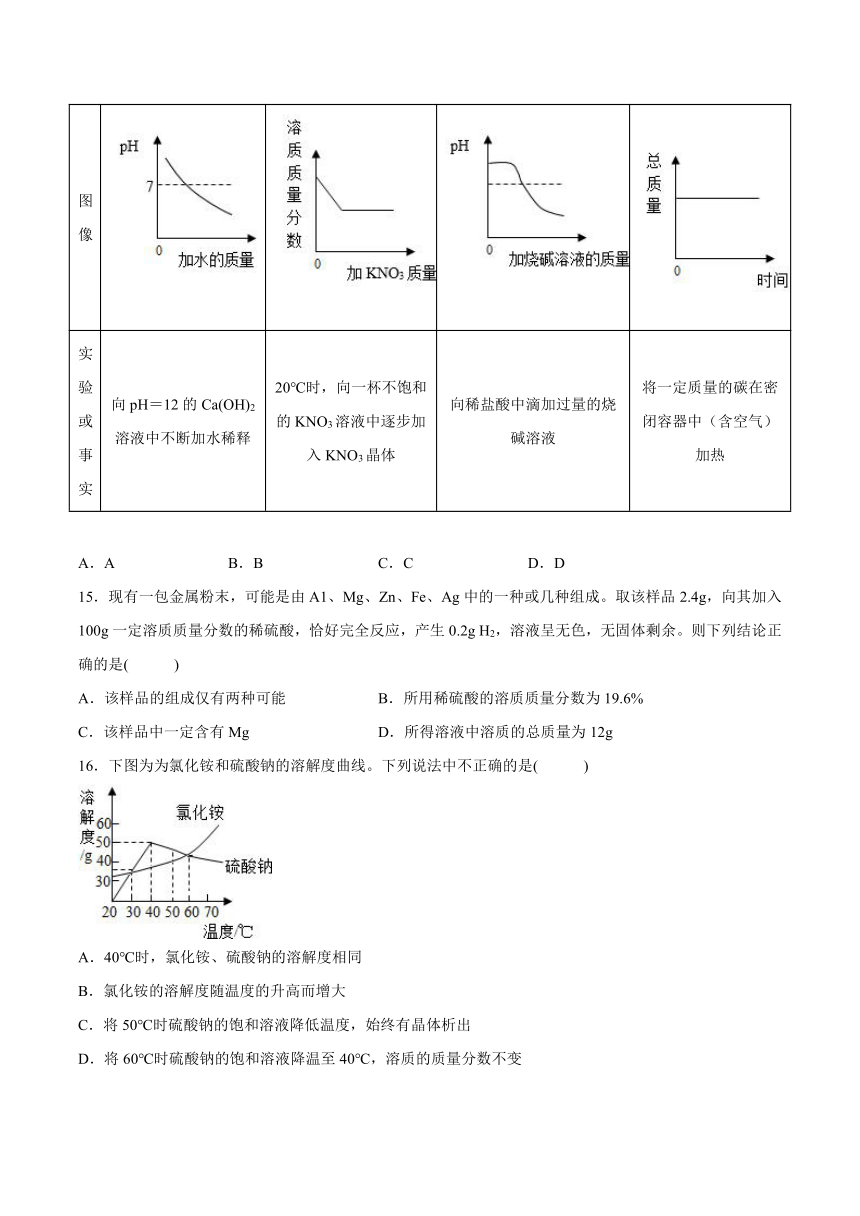
11.如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是( )
①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下。
A.①②③ B.①②④ C.②③④ D.①③④
12.如图是a、b、c三种物质的溶解度曲线,下列叙述正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.可用升高温度的方法将c的饱和溶液变成不饱和溶液
C.在t1 ℃时,三种物质的溶解度由大到小的顺序是b>c=a
D.将t1 ℃时三种物质的饱和溶液升温到t2 ℃,此时三种溶液中溶质质量分数由小到大的顺序是c、a、b
13.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
14.下列所示图像能正确反映对应的实验或事实的是( )
A B C D
图像
实验或事实 向pH=12的Ca(OH)2溶液中不断加水稀释 20℃时,向一杯不饱和的KNO3溶液中逐步加入KNO3晶体 向稀盐酸中滴加过量的烧碱溶液 将一定质量的碳在密闭容器中(含空气)加热
A.A B.B C.C D.D
15.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是( )
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
16.下图为为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是( )
A.40℃时,氯化铵、硫酸钠的溶解度相同
B.氯化铵的溶解度随温度的升高而增大
C.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出
D.将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
二、非选择题(共7题)
17.水是人类生产和生活中重要的物质,回答下列问题:
(1)电解水的实验中下列说法不正确的是_____(填字母)
A产生的氢气与氧气的体积之比约为 2:1
B氢原子和氧原子发生变化
C水是由氢元素和氧元素组成
D水分子发生了改变
E水分子是化学变化中最小的微粒
(2)如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,
①甲物质中混有少量乙物质,提纯甲物质应采用的方法是___________。
②t3℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体, 需蒸发掉较多水的是___________(填“甲”或“乙”)物质饱和溶液。
③ 以下说法正确的是_____________;
At2℃时,将 20g 丙物质溶于 50g 水中,得到 70g 溶液
B将t3℃时等质量甲、乙两物质的饱和溶液降温至t1℃,析出晶体的质量甲>乙
C将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t2℃所得溶液中溶质的质量分数为甲>丙>乙
D丙的溶解度小于甲和乙
18.如图是甲、乙、丙三种物质的溶解度曲线。
(1)40 ℃时,甲、乙、丙三种物质溶解度由小到大的顺序是__________。
(2)现有接近饱和的丙物质溶液,使其变成饱和溶液的方法有①加入丙物质;②__________;③升高温度。
(3)10 ℃时,把15 g乙物质放入200 g水中,充分搅拌后,再升高温度到50 ℃,则还需加入乙物质__________g,才能使溶液成为饱和溶液。
(4)50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时,析出晶体最多的是__________,所得溶液中溶质质量分数最小的是__________。
(5)30 ℃时,30克甲放入50克水中,所得溶液的质量分数为__________。
(6)如图所示,试管内为25 ℃饱和的甲物质溶液,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,可观察到的现象是__________。
19.海水是种宝贵资源。
(1)海上航行缺乏饮用水时可采用下图装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒若干小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_____g;
(2)海水中的硼酸(化学式为H3BO3)可用于玻璃工业,下表为硼酸的部分溶解度数据;
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 3 5 9 15 23
①若要将硼酸的不饱和溶液转变成饱和溶液,可采取的措施是加入硼酸、_____、_____;
②某同学设计如下实验探究“温度”及“固体溶质的形态”对溶解速率的影响:
Ⅰ、上述三个烧杯中,所得溶液浓度的大小关系是_____(用“①”、“②”、“③”表示);
Ⅱ、本实验能达到的目的是(______)
A探究固体颗粒大小对溶解速度的影响
B探究温度对溶解度的影响
C探究溶剂的量对溶解速度的影响
③若将230g硼酸饱和溶液从60℃降温至20℃,可析出固体(不含结晶水)_____g。
20.氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度及其溶解度曲线如下:
温度(℃) 10 20 40 60 80
溶解度(g) KNO3 20.9 31.6 63.9 110 169
NaCl 35.8 36.0 36.6 37.3 38.4
(1)图1中能表示KNO3溶解度曲线的是__________(填“甲"或“乙")。
(2)60℃时,将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是__________(填“饱和”或“不饱和”)溶液,其中溶质与溶剂的质量比为__________(填最简整数比)。
(3)20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加人100g水,充分溶解后,恢复至20℃,其结果如图2所示。下列有关说法中确的是__________(填字母)
A.烧杯①中溶解的是NaC1,烧杯2中溶解的是KNO3
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
21.在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售 的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、 锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实 验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;2Al+6HCl=2AlCl3+3H2↑)
(1)取少量“银粉”于试管中,滴加适量盐酸,观察到有________产生,说明“银粉”一定不是银。
(2)为了进一步确定“银粉”是铝还是锌,学习小 组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。
取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是________。计算实验中所用稀盐酸的溶质质量分数________。
22.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
23.海水是一种宝贵的资源。
(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含外还含有、等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是和
D.20°时向40g固体和40g固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为)可用于玻璃业,下表为硼酸的部分溶解度数据。
温度/℃ 0 20 40 60 80
溶解度/(g/100g水) 3 5 9 15 23
①由表可知,硼酸的溶解度随着温度的升高而_________(填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________(用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________(填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含,、)200g,向溶液中先滴加足量的_________,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________%(保留三位小数)。
参考答案
1.B
【详解】
A、甲烧杯中,硝酸钾有部分未溶解,所以一定是饱和溶液,错误。
B、甲和乙烧杯中都有硝酸钾剩余,都是硝酸钾的饱和溶液,因为温度相同,所以溶解度相同,则硝酸钾溶液的溶质质量分数相等。正确。
C、丙烧杯中,没有硝酸钾剩余。因乙有硝酸钾剩余,所以不能确定丙是否为不饱和溶液。错误。
D、丙→丁过程中,溶剂质量增加,溶质质量不变,所以溶质质量分数减小。错误。
故选B。
2.C
【详解】
根据溶液在稀释前后溶质质量不变的原则,设:需98%的浓硫酸的质量为a,水的质量为b。则,解得。故选C。
3.D
【详解】
A、t1℃时,甲和乙的溶解度相等,它们的饱和溶液的质量分数均是×100%<30%,错误;B、t2℃时,甲的溶解度大于乙的溶解度,甲、乙的饱和溶液中溶质质量分数不相等,错误;C、从0℃至t1℃时,甲物质的溶解度小于乙物质的溶解度,错误;D、由甲、乙两物质的溶解度曲线可知,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高而增大幅度不大。所以t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和,正确。故选D。
4.C
【详解】
A、t1℃时,没有说明溶液的质量,甲、乙两种饱和溶液的溶质质量不一定相等,此选项错误;
B、温度由t2℃降到t1℃时,物质甲的溶解度减小,其饱和溶液的溶质质量分数变小,此选项错误;
C、t2℃时,物质甲的溶解度大于物质乙的溶解度,此选项正确;
D、降低温度,乙物质的溶解度增大,不会有晶体析出,此选项错误。故选C。
5.B
【详解】
根据稀释前后过氧化氢的质量前后保持不变,设需要30%的高浓度双氧水的质量为x,依据计算公式可得:
600g×5%=x.30,
则 x=100g;
故选B.
6.A
【详解】
试题分析:由a、b、c三种物质的溶解度曲线图可知,a、b、c三种物质的饱和溶液,将其从t1℃升温至t2℃,可知:b溶液为不饱和溶液;b溶液中溶质的质量分数最大;a的溶解度最大等信息.
解:A、在t1℃时b的溶解度最大,所以将其从t1℃升温至t2℃,可知:b溶液为不饱和溶液;b溶液中溶质的质量分数最大,故A错误;
B、在t2℃时,c物质的溶解度最小,从t1℃升温至t2℃,c物质的饱和溶液中有晶体析出,c溶液中的溶质质量分数最小,故B正确;
C、b物质的溶解度随温度的升高而增大,所以从t1℃升温至t2℃可知:b溶液变为不饱和溶液,故C正确;
D、c物质的溶解度随温度的升高而减小,所以从t1℃升温至t2℃,c溶液中有晶体析,故D正确.
故选A.
7.C
【详解】
A. 比较溶解度大小,必须指明温度,错误;B. 50℃时,A的溶解度是50g,把50gA放入100g水中恰好得到A的饱和溶液,其中溶质与溶液的质量比为50g:(50g+100g)=1:3,错误;C. A的溶解度随温度的升高而增大,将A的饱和溶液变为不饱和溶液,可采用升温的方法,正确;D. 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,C的溶解度增大,溶质质量分数不变,A、B的溶解度减小,溶质质量分数减小,这三种溶液的溶质质量分数的大小关系是B>A>C,错误。故选C。
8.C
【解析】
试题分析:A、20℃时,氯化钠的溶解度是36g,错误;B、由表中数据可知,溶解度受温度变化影响较大的物质是氯化铵,错误;C、由表中数据可知,氯化钠与氯化铵溶解度相等的温度在10℃-20℃之间,正确;D、50℃时,100g水中加入50.0g氯化铵,50.0g氯化铵全部溶解,再冷却到20℃,100g水中最多溶解的氯化铵质量是37.2g,析出的质量是50.0g-37.2g=12.8g,错误。故选C。
9.A
【详解】
A、温度越低,分子的运动速度越慢,即蔗糖的溶解速度越慢,用冰水溶解不能达到目的,符合题意;B、温度越高,分子的运动速度越快,即蔗糖的溶解速度越快,用热水溶解能达到目的,不符合题意; C、白糖碾成粉末增加蔗糖与水的接触面积,能加快蔗糖的溶解速度,把白糖碾成粉末后溶解能达到目的,不符合题意;D、用筷子不断搅拌,能加快分子运动速度,能加快固体物质的溶解速度,溶解时用筷子搅拌能达到目的,不符合题意。故选A。
10.C
【详解】
A.根据溶解度曲线图可知,甲物质的溶解度随温度的升高而逐渐增大,故从t2℃降温至t1℃时,甲物质的溶液中会有溶质析出;但由于乙物质的溶解度随温度的升高而逐渐减小,故从t2℃降温到t1℃时,乙物质的饱和溶液会变为不饱和溶液,错误;
B.根据溶解度曲线图可知,t2℃时,甲物质的溶解度是30g,即t2℃时,每100g水中最多溶解30g甲物质而达到饱和状态,故t2℃时,100g甲的饱和溶液中含甲的质量<30g,错误;
C.根据溶解度曲线图可知,甲、乙两物质的溶解度曲线在t1℃时相交于一点,即说明此温度下,两种物质的溶解度相等,正确;
D.根据溶解度曲线图可知,t2℃时,甲物质的溶解度>乙物质的溶解度,当两物质均为饱和溶液时,根据饱和溶液的溶质质量分数=×100%,可知此时甲溶液溶质的质量分数大于乙溶液溶质的质量分数,但由于溶液是否饱和不确定,故甲溶液溶质的质量分数不一定大于乙溶液溶质的质量分数,错误.
故选C.
11.B
【详解】
试题分析:①在20℃时,氯化钠和氯化铵的溶解度大于10g,是易溶物质,碳酸氢钠的溶解度大于1小于10,是可溶物质,故正确;②在20℃时,三种物质的溶解度是为NH4Cl>NaCl>NaHCO3,由饱和溶液的溶质质量分数=100%,故三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3 ,故正确;③30℃时,氯化铵的溶解度大于40g,20g氯化铵能完全溶于50g水,所得溶液不是饱和溶液,氯化钠的溶解度小于40g,20g氯化钠不能全部溶解,所得溶液是饱和溶液,故错误;④由三种物质的溶解度变化规律可知:利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下,故正确。答案:B。
12.D
【详解】
由图中信息知,A、a、b种物质的溶解度都随温度的升高而增大,c种物质的溶解度随温度的升高而减少,故A错误;B、c种物质的溶解度随温度的升高而减少,可用降低温度的方法将c的饱和溶液变成不饱和溶液,故B错误;C、在t1 ℃时,三种物质的溶解度由大到小的顺序是b>c>a,故C错误;D、将t1 ℃时三种物质的饱和溶液升温到t2 ℃,此时三种溶液中溶质质量分数由小到大的顺序是c、a、b,故D正确。
13.B
【详解】
可以认为蒸发掉 45 g H2O是在蒸发掉 35 g H2O的基础上完成的,也就是说,在10g水中最多能溶解氯化钾5g,从而得出在此温度下氯化钾的溶解度为50g。这样100 g溶液中所含的氯化钾的质量为 +5g=25g,质量分数为×100%=25%。
故选:B。
14.D
【详解】
本题是一道图表题,既考查了学生对化学知识的掌握,又考查了学生对图表的理解。该题中A和C考查了溶液的PH值的变化情况.要使溶液的PH值发生变化,有两种方法,一是向该溶液中加水,该方法只能使酸溶液的PH值变大,但是不会≥7,能使碱溶液的PH值变小,但是不会≤7.另一种方法是向溶液中加酸或碱溶液。该题中B选项考查了溶质的质量分数,当溶液达到饱和时,其溶质的质量分数达到最大值,再加溶质其质量分数也不在变化。
A、向氢氧化钙溶液中不断加水其溶液的PH值只能无限的接近于7,不能小于7。故A不正确;
B、溶质的质量分数应该是先变大,溶液饱和后,质量分数不在发生变化。故B不正确;
C、PH值的变化应该是从<7,到═7,到>7,故C不正确;
D、化学反应前后,物质的总重量不变,故D正确。
故选D。
15.D
【分析】
设生成0.2g氢气,需要镁、锌和铝的质量分别为、、
【详解】
A、金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B、由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2g氢气,100g一定溶质质量分数的稀硫酸中氢元素的质量=0.2g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C、由A可知,该样品中不一定含有镁,说法错误;
D、反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4g,硫酸根的质量=,所得溶液中溶质的质量=9.6g+2.4g=12g;
答案:D。
16.C
【详解】
略
17.BE 降温结晶 乙 BC
【详解】
(1)A、产生的氢气与氧气的体积之比约为2:1,故A正确;
B、原子是化学变化中的最小微粒,所以氢原子和氢原子没有发生变化,故B错误;
C、水通电分解生成氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学反应中元素的种类不变,所以水是由氢元素和氧元素组成,故C正确;
D、水分子发生了改变,生成了氢分子和氧分子,故D正确;
E、该反应中氢原子、氧原子是化学变化中最小的微粒,故E错误。|故选:BE;
(2)①甲、乙两物质的溶解度都随温度的降低而减小,甲的溶解度受温度变化影响较大,所以甲中混有少量乙,提纯甲应采用的方法是降温结晶;
②t3℃时,甲的溶解度大于乙的溶解度,所以若从甲和乙两种物质的饱和溶液中析出等质量的固体,需蒸发掉较多水的是乙饱和溶液;
③A、t2℃时,丙的溶解度是25g,所以将20g丙溶于50g水中,只能溶解12.5g,得到62.5g溶液,故A错误;
B、将t3℃时,等质量甲、乙两物质的饱和溶液降温至t1℃,甲的溶解度受温度变化影响较大,所以析出晶体的质量甲>乙,故B正确;
C、将t3℃时甲、乙、丙三种物质的饱和溶液降温到t2℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t2℃时甲的溶解度大于t3℃时丙的溶解度,t3℃时丙的溶解度大于t2℃时乙溶解度,所以将3℃时甲、乙、丙三种物质的饱和溶液分别降温至t2℃时所得溶液中溶质的质量分数为甲>丙>乙,故C正确;
D、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故D错误。故选BC。
18.
(1)丙<乙=甲
(2)恒温蒸发水
(3)65
(4) 甲 丙
(5)23.1%
(6)烧杯内水温下降,试管中有晶体析出
【解析】
(1)
由溶解度曲线可知,40°C时,甲乙丙三种物质溶解度由小到大的顺序是:丙<甲=乙,故答案为:丙<甲=乙;
(2)
现有接近饱和的丙物质溶液,使其变成饱和溶液的方法有:①加入丙物质;②恒温蒸发溶剂;③升高温度,故答案为:恒温蒸发水;
(3)
10°C时,把15g乙物质放入200g水中,充分搅拌后,再升高温度到50°C,则还需加入乙物质的质量=80g-15g=65g,才能使溶液成为饱和溶液,故答案为:65;
(4)
50°C时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10°C时,析出晶体最多的是甲,因为甲的溶解度受温度的影响最大;所得溶液中溶质质量分数最小的是丙,因为降温后,丙的质量分数不变,溶质质量分数按50℃的溶解度计算,50℃丙的溶解度小于10℃时甲、乙的溶解度,故丙的溶质质量分数最小,故答案为:甲;丙;
(5)
30°C时,甲的溶解度为30g,则100g水最多溶解30g甲,50g水最多溶解15g甲,故30g甲放入50g水中,所得溶液的质量分数为:,故答案为:23. 1%;
(6)
如图2所示,试管内为25°C饱和的甲物质溶液,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是:析出固体甲,因为硝酸铵溶于水温度降低,甲的溶解度减小而析出,故答案为:烧杯内水温下降,试管中有晶体析出。
19.500 降温 蒸发溶剂 ①<②=③ B 20
【详解】
(1)设收集到的可饮用水为的质量为x,则2000g×3%=(2000g-x)×4%,解得:x=500g。
(2)①硼酸的溶解度随温度升高而增大,若要将硼酸的不饱和溶液转变成饱和溶液,可采取的措施是加入硼酸、降温、蒸发溶剂;
②Ⅰ、20℃时,硼酸的溶解度为5g,80℃时,硼酸的溶解度为23g,2g硼酸在①②③中均能全部溶解,根据溶剂关系,上述三个烧杯中,所得溶液浓度的大小关系是①<②=③;
Ⅱ、对比①②,对比①③,均有多个变量,对比②③只有温度不同,可探究温度对溶解速度的影响;
故填:B。
③60℃时,硼酸溶解度为15g,设230g硼酸饱和溶液中溶质质量为a,则 ,a=30g,20℃时硼酸溶解度为5g,若将230g硼酸饱和溶液从60℃降温至20℃,设可析出固体质量为b,则,b=20g。
20. 甲 饱和 11:10 B
【解析】(1)根据溶解度表知道,在温度较低时,硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道,甲表示的是硝酸钾的溶解度曲线。(2)60℃时,KNO3的溶解度是110g,则50g水中最多能溶解55g硝酸钾,所以将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是饱和溶液,其中溶质与溶剂的质量比为:55g:50g=11:10。(3)A.20℃时,NaCl的溶解度大于KNO3的溶解度,等质量的水中溶解的硝酸钾比氯化钠溶解的少,所以烧杯①中溶解的是硝酸钾,烧杯②中溶解的是氯化钠,错误;B.升高温度,硝酸钾的溶解度增大,所以升高温度或增加溶剂都有可能将烧杯①中固体全部溶解,正确;C.若将烧杯①中的溶液变为不饱和溶液,可以采用升高温度的方法,这样就会把不溶解的硝酸钾溶解,溶质质量分数会变大,错误。故选B。
21.银粉”表面有气泡产生 铝(或“Al”) 14.6%
【详解】
(1)银与盐酸不反应,若“银粉”表面有气泡产生,说明银粉一定不是银;(2)根据图表分析1.8g金属生成0.2g氢气,说明该金属是铝; 解:设实验中所用稀盐酸的溶质质量为x。
2Al+6HCl=2AlCl3+3H2↑
219 6
X 0.2g
X=7.3g
盐酸中溶质质量分数=
答: 实验中所用稀盐酸的溶质质量分数为14.6%。
22.CBA .C 100 小于 漏斗 4.5 500
【分析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】
(1)
①根据溶解度曲线可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A;
②根据溶解度曲线可知,A、B、C三种物质中,溶解度随温度升高而减小的是C;
③t2℃时,A的溶解度是ag,即t2℃时100g水中最多溶解A的质量为ag就达到饱和状态,则完全溶解ag A物质最少需要水的质量是100g;
④t2℃时,由于A物质的溶解度大于B,所以相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量小于B的饱和溶液中所含水的质量;
(2)过滤是把不溶于液体的固体与液体分离,过滤操作的实验仪器和用品有铁架台、烧杯、玻璃棒、漏斗、滤纸,则还需要的是漏斗;
(3)溶质质量=溶液质量×溶质质量分数,则需要氯化钠固体的质量=45g×10%=4.5g;根据溶液稀释过程中溶质质量不变,设得到的0.9%氯化钠的溶液质量为x,则45g×10%=0.9%x,x=500g。
23.C 500 增大 13 乙=丙>甲 B 溶液 1.775
【详解】
(1)A:,0℃时,三种物质的饱和溶液中,溶质质量分数最大的是氯化镁,选项错误;
B.氯化镁和氯化钠两种物质的溶解度都随温度升高而不断增大,硫酸镁的溶解度在温度高于一定数值时,溶解度随温度升高减小,选项错误;
C.将卤水加热到80℃以上蒸发水分,硫酸镁的溶解度随温度升高而减小,硫酸镁析出,氯化钠的溶解度受温度的影响很小,但水的量减少会导致氯化钠的溶解量降低而析出,逐渐析出的晶体是和,选项正确;
D. 20°时向40g固体的溶解度小于40g,溶液达到饱和, 固体的溶解度大于40g,加入100g水充分溶解后,溶液不能达到饱和状态,选项错误;
故选C;
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为的质量为x,蒸发过程中溶质的质量不变,2000g×3%= (2000g-x)×4%,x=500g;
(3)①由表可知,硼酸的溶解度随着温度的升高而增大;
②60℃时,硼酸的溶解度为15g,100g硼酸饱和溶液中含有硼酸y,
y≈13g;
③a.上述三个烧杯中,溶质都是2g,乙和丙的溶剂都是50g,甲的溶剂是100g,所得溶液浓度的大小关系是乙=丙>甲;
b.若要达到实验目的,根据控制变量原则,对照试验只有固体的形状不同,需改变实验甲中的一个条件是将水的体积改为50mL;
(4)某同学取模拟海水(含,、)200g,硫酸根离子与银离子生成的硫酸银十微溶物,影响氯离子的验证,向溶液中先滴加足量的溶液,充分反应后,使硫酸镁转化成硫酸钡沉淀,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,可知生成氯化银的质量是14.35g,则氯元素的质量为:14.35g× =3.55g,测得模拟海水中氯元素的质量分数为 。
一、选择题(共16题)
1.20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液一定是不饱和溶液
B.甲和乙烧杯中,硝酸钾溶液的溶质质量分数相等
C.丙烧杯中,硝酸钾溶液一定是不饱和溶液
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
2.欲配制19.6%的稀硫酸,需98%的浓硫酸和水的质量比为。( )
A.1:6 B. 1:5 C.1:4 D. 1:3
3.甲、乙两物质的溶解度曲线如右图所示。下列叙述中,正确的是( )
A.t1℃时,甲和乙的饱和溶液的质量分数均是30%
B.t2℃时,甲和乙的饱和溶液中溶质质量分数相等
C.从0℃至t1℃时,甲物质的溶解度大于乙物质的溶解度
D.t2℃时, 分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
4.如图所示的是甲、乙两种固体物质的溶解度曲线.根据图中的相关信息判断下列说法正确的是( )
A.t1℃时,甲、乙两种饱和溶液的溶质质量一定相等
B.温度由t2℃降到t1℃时,物质甲的饱和溶液的溶质质量分数不变
C.t2℃时,物质甲的溶解度大于物质乙的溶解度
D.通过降低温度的方法,均可以使甲、乙两种溶液中析出晶体
5.医院里常用溶质分数为5%的双氧水(H2O2)溶液清洗受伤病人的伤口,若要配制5%的双氧水溶液600g,需要30%的高浓度双氧水的质量为( )
A.30g B.100g C.200g D.400g
6.a、b、c三种物质的溶解度曲线如下图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
A.a溶液中的溶质质量分数最大
B.c溶液中的溶质质量分数最小
C.b溶液均为不饱和溶液
D.c溶液中有晶体析出
7.下图是A、B、C三种物质的溶解度曲线,下列分析正确的是 ( )
A.A的溶解度比B大
B.50℃时把50gA放入100g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:2
C.将A的饱和溶液变为不饱和溶液,可采用升温的方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
8.下表为氯化铵和氯化钠在不同温度时的溶解度。下列说法正确的是( )
温度/℃ 0 10 20 30 40 50
NH4Cl溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4
NaCl溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0
A.20℃时,氯化钠饱和溶液的溶质质量分数为36%
B.由表中数据可知,溶解度受温度变化影响较大的物质是氯化钠
C.氯化钠与氯化铵溶解度相等的温度在10℃-20℃之间
D.50℃时,100g水中加入50.0g氯化铵配成溶液,再冷却到20℃,能够析出13.2g固体
9.小军同学需要快速配制一杯可口的白糖溶液,下列措施不能达到目的的是( )
A.用冰水溶解 B.用热水溶解
C.把白糖碾成粉末后溶解 D.溶解时用筷子搅拌
10.如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
A.将t2℃时甲、乙的饱和溶液均降温到t1℃,都有晶体析出
B.t2℃时,100g甲的饱和溶液中含甲的质量为30g
C.t1℃时,甲、乙的溶解度相等
D.t2℃时,甲溶液溶质的质量分数一定大于乙溶液溶质的质量分数
11.如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,分析曲线得到的以下说法中,正确的是( )
①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质
②在20℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3
③在30℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下。
A.①②③ B.①②④ C.②③④ D.①③④
12.如图是a、b、c三种物质的溶解度曲线,下列叙述正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.可用升高温度的方法将c的饱和溶液变成不饱和溶液
C.在t1 ℃时,三种物质的溶解度由大到小的顺序是b>c=a
D.将t1 ℃时三种物质的饱和溶液升温到t2 ℃,此时三种溶液中溶质质量分数由小到大的顺序是c、a、b
13.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
14.下列所示图像能正确反映对应的实验或事实的是( )
A B C D
图像
实验或事实 向pH=12的Ca(OH)2溶液中不断加水稀释 20℃时,向一杯不饱和的KNO3溶液中逐步加入KNO3晶体 向稀盐酸中滴加过量的烧碱溶液 将一定质量的碳在密闭容器中(含空气)加热
A.A B.B C.C D.D
15.现有一包金属粉末,可能是由A1、Mg、Zn、Fe、Ag中的一种或几种组成。取该样品2.4g,向其加入100g一定溶质质量分数的稀硫酸,恰好完全反应,产生0.2g H2,溶液呈无色,无固体剩余。则下列结论正确的是( )
A.该样品的组成仅有两种可能 B.所用稀硫酸的溶质质量分数为19.6%
C.该样品中一定含有Mg D.所得溶液中溶质的总质量为12g
16.下图为为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是( )
A.40℃时,氯化铵、硫酸钠的溶解度相同
B.氯化铵的溶解度随温度的升高而增大
C.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出
D.将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
二、非选择题(共7题)
17.水是人类生产和生活中重要的物质,回答下列问题:
(1)电解水的实验中下列说法不正确的是_____(填字母)
A产生的氢气与氧气的体积之比约为 2:1
B氢原子和氧原子发生变化
C水是由氢元素和氧元素组成
D水分子发生了改变
E水分子是化学变化中最小的微粒
(2)如图是甲、乙、丙三种固体物质的溶解度曲线,请你结合所给曲线,
①甲物质中混有少量乙物质,提纯甲物质应采用的方法是___________。
②t3℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体, 需蒸发掉较多水的是___________(填“甲”或“乙”)物质饱和溶液。
③ 以下说法正确的是_____________;
At2℃时,将 20g 丙物质溶于 50g 水中,得到 70g 溶液
B将t3℃时等质量甲、乙两物质的饱和溶液降温至t1℃,析出晶体的质量甲>乙
C将t3℃时甲、乙、丙三种物质的饱和溶液分别降温至t2℃所得溶液中溶质的质量分数为甲>丙>乙
D丙的溶解度小于甲和乙
18.如图是甲、乙、丙三种物质的溶解度曲线。
(1)40 ℃时,甲、乙、丙三种物质溶解度由小到大的顺序是__________。
(2)现有接近饱和的丙物质溶液,使其变成饱和溶液的方法有①加入丙物质;②__________;③升高温度。
(3)10 ℃时,把15 g乙物质放入200 g水中,充分搅拌后,再升高温度到50 ℃,则还需加入乙物质__________g,才能使溶液成为饱和溶液。
(4)50 ℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10 ℃时,析出晶体最多的是__________,所得溶液中溶质质量分数最小的是__________。
(5)30 ℃时,30克甲放入50克水中,所得溶液的质量分数为__________。
(6)如图所示,试管内为25 ℃饱和的甲物质溶液,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,可观察到的现象是__________。
19.海水是种宝贵资源。
(1)海上航行缺乏饮用水时可采用下图装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒若干小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_____g;
(2)海水中的硼酸(化学式为H3BO3)可用于玻璃工业,下表为硼酸的部分溶解度数据;
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 3 5 9 15 23
①若要将硼酸的不饱和溶液转变成饱和溶液,可采取的措施是加入硼酸、_____、_____;
②某同学设计如下实验探究“温度”及“固体溶质的形态”对溶解速率的影响:
Ⅰ、上述三个烧杯中,所得溶液浓度的大小关系是_____(用“①”、“②”、“③”表示);
Ⅱ、本实验能达到的目的是(______)
A探究固体颗粒大小对溶解速度的影响
B探究温度对溶解度的影响
C探究溶剂的量对溶解速度的影响
③若将230g硼酸饱和溶液从60℃降温至20℃,可析出固体(不含结晶水)_____g。
20.氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度及其溶解度曲线如下:
温度(℃) 10 20 40 60 80
溶解度(g) KNO3 20.9 31.6 63.9 110 169
NaCl 35.8 36.0 36.6 37.3 38.4
(1)图1中能表示KNO3溶解度曲线的是__________(填“甲"或“乙")。
(2)60℃时,将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是__________(填“饱和”或“不饱和”)溶液,其中溶质与溶剂的质量比为__________(填最简整数比)。
(3)20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加人100g水,充分溶解后,恢复至20℃,其结果如图2所示。下列有关说法中确的是__________(填字母)
A.烧杯①中溶解的是NaC1,烧杯2中溶解的是KNO3
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
21.在学习了金属的化学性质后,科学老师布置了一项课外学习任务:调查化工颜料店出售 的涂料添加剂“银粉”是什么金属?某学习小组通过调查,分别获得了“银粉”是银粉、铝粉、 锌粉这三种不同结果。为了确定究竟是哪一种金属,学习小组同学将一小包“银粉”带回实 验室,进行了如下实验和分析。(相关反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;2Al+6HCl=2AlCl3+3H2↑)
(1)取少量“银粉”于试管中,滴加适量盐酸,观察到有________产生,说明“银粉”一定不是银。
(2)为了进一步确定“银粉”是铝还是锌,学习小 组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。
取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是________。计算实验中所用稀盐酸的溶质质量分数________。
22.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
23.海水是一种宝贵的资源。
(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含外还含有、等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是和
D.20°时向40g固体和40g固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为)可用于玻璃业,下表为硼酸的部分溶解度数据。
温度/℃ 0 20 40 60 80
溶解度/(g/100g水) 3 5 9 15 23
①由表可知,硼酸的溶解度随着温度的升高而_________(填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________(用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________(填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含,、)200g,向溶液中先滴加足量的_________,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________%(保留三位小数)。
参考答案
1.B
【详解】
A、甲烧杯中,硝酸钾有部分未溶解,所以一定是饱和溶液,错误。
B、甲和乙烧杯中都有硝酸钾剩余,都是硝酸钾的饱和溶液,因为温度相同,所以溶解度相同,则硝酸钾溶液的溶质质量分数相等。正确。
C、丙烧杯中,没有硝酸钾剩余。因乙有硝酸钾剩余,所以不能确定丙是否为不饱和溶液。错误。
D、丙→丁过程中,溶剂质量增加,溶质质量不变,所以溶质质量分数减小。错误。
故选B。
2.C
【详解】
根据溶液在稀释前后溶质质量不变的原则,设:需98%的浓硫酸的质量为a,水的质量为b。则,解得。故选C。
3.D
【详解】
A、t1℃时,甲和乙的溶解度相等,它们的饱和溶液的质量分数均是×100%<30%,错误;B、t2℃时,甲的溶解度大于乙的溶解度,甲、乙的饱和溶液中溶质质量分数不相等,错误;C、从0℃至t1℃时,甲物质的溶解度小于乙物质的溶解度,错误;D、由甲、乙两物质的溶解度曲线可知,甲物质的溶解度随温度的升高而明显增大,乙物质的溶解度随温度的升高而增大幅度不大。所以t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和,正确。故选D。
4.C
【详解】
A、t1℃时,没有说明溶液的质量,甲、乙两种饱和溶液的溶质质量不一定相等,此选项错误;
B、温度由t2℃降到t1℃时,物质甲的溶解度减小,其饱和溶液的溶质质量分数变小,此选项错误;
C、t2℃时,物质甲的溶解度大于物质乙的溶解度,此选项正确;
D、降低温度,乙物质的溶解度增大,不会有晶体析出,此选项错误。故选C。
5.B
【详解】
根据稀释前后过氧化氢的质量前后保持不变,设需要30%的高浓度双氧水的质量为x,依据计算公式可得:
600g×5%=x.30,
则 x=100g;
故选B.
6.A
【详解】
试题分析:由a、b、c三种物质的溶解度曲线图可知,a、b、c三种物质的饱和溶液,将其从t1℃升温至t2℃,可知:b溶液为不饱和溶液;b溶液中溶质的质量分数最大;a的溶解度最大等信息.
解:A、在t1℃时b的溶解度最大,所以将其从t1℃升温至t2℃,可知:b溶液为不饱和溶液;b溶液中溶质的质量分数最大,故A错误;
B、在t2℃时,c物质的溶解度最小,从t1℃升温至t2℃,c物质的饱和溶液中有晶体析出,c溶液中的溶质质量分数最小,故B正确;
C、b物质的溶解度随温度的升高而增大,所以从t1℃升温至t2℃可知:b溶液变为不饱和溶液,故C正确;
D、c物质的溶解度随温度的升高而减小,所以从t1℃升温至t2℃,c溶液中有晶体析,故D正确.
故选A.
7.C
【详解】
A. 比较溶解度大小,必须指明温度,错误;B. 50℃时,A的溶解度是50g,把50gA放入100g水中恰好得到A的饱和溶液,其中溶质与溶液的质量比为50g:(50g+100g)=1:3,错误;C. A的溶解度随温度的升高而增大,将A的饱和溶液变为不饱和溶液,可采用升温的方法,正确;D. 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,C的溶解度增大,溶质质量分数不变,A、B的溶解度减小,溶质质量分数减小,这三种溶液的溶质质量分数的大小关系是B>A>C,错误。故选C。
8.C
【解析】
试题分析:A、20℃时,氯化钠的溶解度是36g,错误;B、由表中数据可知,溶解度受温度变化影响较大的物质是氯化铵,错误;C、由表中数据可知,氯化钠与氯化铵溶解度相等的温度在10℃-20℃之间,正确;D、50℃时,100g水中加入50.0g氯化铵,50.0g氯化铵全部溶解,再冷却到20℃,100g水中最多溶解的氯化铵质量是37.2g,析出的质量是50.0g-37.2g=12.8g,错误。故选C。
9.A
【详解】
A、温度越低,分子的运动速度越慢,即蔗糖的溶解速度越慢,用冰水溶解不能达到目的,符合题意;B、温度越高,分子的运动速度越快,即蔗糖的溶解速度越快,用热水溶解能达到目的,不符合题意; C、白糖碾成粉末增加蔗糖与水的接触面积,能加快蔗糖的溶解速度,把白糖碾成粉末后溶解能达到目的,不符合题意;D、用筷子不断搅拌,能加快分子运动速度,能加快固体物质的溶解速度,溶解时用筷子搅拌能达到目的,不符合题意。故选A。
10.C
【详解】
A.根据溶解度曲线图可知,甲物质的溶解度随温度的升高而逐渐增大,故从t2℃降温至t1℃时,甲物质的溶液中会有溶质析出;但由于乙物质的溶解度随温度的升高而逐渐减小,故从t2℃降温到t1℃时,乙物质的饱和溶液会变为不饱和溶液,错误;
B.根据溶解度曲线图可知,t2℃时,甲物质的溶解度是30g,即t2℃时,每100g水中最多溶解30g甲物质而达到饱和状态,故t2℃时,100g甲的饱和溶液中含甲的质量<30g,错误;
C.根据溶解度曲线图可知,甲、乙两物质的溶解度曲线在t1℃时相交于一点,即说明此温度下,两种物质的溶解度相等,正确;
D.根据溶解度曲线图可知,t2℃时,甲物质的溶解度>乙物质的溶解度,当两物质均为饱和溶液时,根据饱和溶液的溶质质量分数=×100%,可知此时甲溶液溶质的质量分数大于乙溶液溶质的质量分数,但由于溶液是否饱和不确定,故甲溶液溶质的质量分数不一定大于乙溶液溶质的质量分数,错误.
故选C.
11.B
【详解】
试题分析:①在20℃时,氯化钠和氯化铵的溶解度大于10g,是易溶物质,碳酸氢钠的溶解度大于1小于10,是可溶物质,故正确;②在20℃时,三种物质的溶解度是为NH4Cl>NaCl>NaHCO3,由饱和溶液的溶质质量分数=100%,故三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3 ,故正确;③30℃时,氯化铵的溶解度大于40g,20g氯化铵能完全溶于50g水,所得溶液不是饱和溶液,氯化钠的溶解度小于40g,20g氯化钠不能全部溶解,所得溶液是饱和溶液,故错误;④由三种物质的溶解度变化规律可知:利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度在10℃以下,故正确。答案:B。
12.D
【详解】
由图中信息知,A、a、b种物质的溶解度都随温度的升高而增大,c种物质的溶解度随温度的升高而减少,故A错误;B、c种物质的溶解度随温度的升高而减少,可用降低温度的方法将c的饱和溶液变成不饱和溶液,故B错误;C、在t1 ℃时,三种物质的溶解度由大到小的顺序是b>c>a,故C错误;D、将t1 ℃时三种物质的饱和溶液升温到t2 ℃,此时三种溶液中溶质质量分数由小到大的顺序是c、a、b,故D正确。
13.B
【详解】
可以认为蒸发掉 45 g H2O是在蒸发掉 35 g H2O的基础上完成的,也就是说,在10g水中最多能溶解氯化钾5g,从而得出在此温度下氯化钾的溶解度为50g。这样100 g溶液中所含的氯化钾的质量为 +5g=25g,质量分数为×100%=25%。
故选:B。
14.D
【详解】
本题是一道图表题,既考查了学生对化学知识的掌握,又考查了学生对图表的理解。该题中A和C考查了溶液的PH值的变化情况.要使溶液的PH值发生变化,有两种方法,一是向该溶液中加水,该方法只能使酸溶液的PH值变大,但是不会≥7,能使碱溶液的PH值变小,但是不会≤7.另一种方法是向溶液中加酸或碱溶液。该题中B选项考查了溶质的质量分数,当溶液达到饱和时,其溶质的质量分数达到最大值,再加溶质其质量分数也不在变化。
A、向氢氧化钙溶液中不断加水其溶液的PH值只能无限的接近于7,不能小于7。故A不正确;
B、溶质的质量分数应该是先变大,溶液饱和后,质量分数不在发生变化。故B不正确;
C、PH值的变化应该是从<7,到═7,到>7,故C不正确;
D、化学反应前后,物质的总重量不变,故D正确。
故选D。
15.D
【分析】
设生成0.2g氢气,需要镁、锌和铝的质量分别为、、
【详解】
A、金属粉末与稀硫酸反应,得到无色溶液,固体无剩余,说明粉末中一定不包括铁和银,通过上面计算可知,金属粉末可能组成为镁、铝和锌、铝、镁和锌,组成有三种可能,说法错误;
B、由质量守恒定律可知:生成的氢气中氢元素都来源于硫酸中的氢元素,生成0.2g氢气,100g一定溶质质量分数的稀硫酸中氢元素的质量=0.2g,则硫酸溶液中硫酸的质量=,稀硫酸的溶质质量分数=,说法错误;
C、由A可知,该样品中不一定含有镁,说法错误;
D、反应后所得溶液中溶质的为金属硫酸盐,金属的质量=2.4g,硫酸根的质量=,所得溶液中溶质的质量=9.6g+2.4g=12g;
答案:D。
16.C
【详解】
略
17.BE 降温结晶 乙 BC
【详解】
(1)A、产生的氢气与氧气的体积之比约为2:1,故A正确;
B、原子是化学变化中的最小微粒,所以氢原子和氢原子没有发生变化,故B错误;
C、水通电分解生成氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学反应中元素的种类不变,所以水是由氢元素和氧元素组成,故C正确;
D、水分子发生了改变,生成了氢分子和氧分子,故D正确;
E、该反应中氢原子、氧原子是化学变化中最小的微粒,故E错误。|故选:BE;
(2)①甲、乙两物质的溶解度都随温度的降低而减小,甲的溶解度受温度变化影响较大,所以甲中混有少量乙,提纯甲应采用的方法是降温结晶;
②t3℃时,甲的溶解度大于乙的溶解度,所以若从甲和乙两种物质的饱和溶液中析出等质量的固体,需蒸发掉较多水的是乙饱和溶液;
③A、t2℃时,丙的溶解度是25g,所以将20g丙溶于50g水中,只能溶解12.5g,得到62.5g溶液,故A错误;
B、将t3℃时,等质量甲、乙两物质的饱和溶液降温至t1℃,甲的溶解度受温度变化影响较大,所以析出晶体的质量甲>乙,故B正确;
C、将t3℃时甲、乙、丙三种物质的饱和溶液降温到t2℃时,甲、乙的溶解度减小,丙的溶解度随温度的降低而增大,甲、乙有晶体析出,质量分数变小,溶液仍为饱和溶液,丙没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t2℃时甲的溶解度大于t3℃时丙的溶解度,t3℃时丙的溶解度大于t2℃时乙溶解度,所以将3℃时甲、乙、丙三种物质的饱和溶液分别降温至t2℃时所得溶液中溶质的质量分数为甲>丙>乙,故C正确;
D、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故D错误。故选BC。
18.
(1)丙<乙=甲
(2)恒温蒸发水
(3)65
(4) 甲 丙
(5)23.1%
(6)烧杯内水温下降,试管中有晶体析出
【解析】
(1)
由溶解度曲线可知,40°C时,甲乙丙三种物质溶解度由小到大的顺序是:丙<甲=乙,故答案为:丙<甲=乙;
(2)
现有接近饱和的丙物质溶液,使其变成饱和溶液的方法有:①加入丙物质;②恒温蒸发溶剂;③升高温度,故答案为:恒温蒸发水;
(3)
10°C时,把15g乙物质放入200g水中,充分搅拌后,再升高温度到50°C,则还需加入乙物质的质量=80g-15g=65g,才能使溶液成为饱和溶液,故答案为:65;
(4)
50°C时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10°C时,析出晶体最多的是甲,因为甲的溶解度受温度的影响最大;所得溶液中溶质质量分数最小的是丙,因为降温后,丙的质量分数不变,溶质质量分数按50℃的溶解度计算,50℃丙的溶解度小于10℃时甲、乙的溶解度,故丙的溶质质量分数最小,故答案为:甲;丙;
(5)
30°C时,甲的溶解度为30g,则100g水最多溶解30g甲,50g水最多溶解15g甲,故30g甲放入50g水中,所得溶液的质量分数为:,故答案为:23. 1%;
(6)
如图2所示,试管内为25°C饱和的甲物质溶液,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是:析出固体甲,因为硝酸铵溶于水温度降低,甲的溶解度减小而析出,故答案为:烧杯内水温下降,试管中有晶体析出。
19.500 降温 蒸发溶剂 ①<②=③ B 20
【详解】
(1)设收集到的可饮用水为的质量为x,则2000g×3%=(2000g-x)×4%,解得:x=500g。
(2)①硼酸的溶解度随温度升高而增大,若要将硼酸的不饱和溶液转变成饱和溶液,可采取的措施是加入硼酸、降温、蒸发溶剂;
②Ⅰ、20℃时,硼酸的溶解度为5g,80℃时,硼酸的溶解度为23g,2g硼酸在①②③中均能全部溶解,根据溶剂关系,上述三个烧杯中,所得溶液浓度的大小关系是①<②=③;
Ⅱ、对比①②,对比①③,均有多个变量,对比②③只有温度不同,可探究温度对溶解速度的影响;
故填:B。
③60℃时,硼酸溶解度为15g,设230g硼酸饱和溶液中溶质质量为a,则 ,a=30g,20℃时硼酸溶解度为5g,若将230g硼酸饱和溶液从60℃降温至20℃,设可析出固体质量为b,则,b=20g。
20. 甲 饱和 11:10 B
【解析】(1)根据溶解度表知道,在温度较低时,硝酸钾的溶解度较小,结合图中的两条溶解度曲线可以知道,甲表示的是硝酸钾的溶解度曲线。(2)60℃时,KNO3的溶解度是110g,则50g水中最多能溶解55g硝酸钾,所以将60gKNO3固体加入到50g水中,充分溶解后,所得溶液是饱和溶液,其中溶质与溶剂的质量比为:55g:50g=11:10。(3)A.20℃时,NaCl的溶解度大于KNO3的溶解度,等质量的水中溶解的硝酸钾比氯化钠溶解的少,所以烧杯①中溶解的是硝酸钾,烧杯②中溶解的是氯化钠,错误;B.升高温度,硝酸钾的溶解度增大,所以升高温度或增加溶剂都有可能将烧杯①中固体全部溶解,正确;C.若将烧杯①中的溶液变为不饱和溶液,可以采用升高温度的方法,这样就会把不溶解的硝酸钾溶解,溶质质量分数会变大,错误。故选B。
21.银粉”表面有气泡产生 铝(或“Al”) 14.6%
【详解】
(1)银与盐酸不反应,若“银粉”表面有气泡产生,说明银粉一定不是银;(2)根据图表分析1.8g金属生成0.2g氢气,说明该金属是铝; 解:设实验中所用稀盐酸的溶质质量为x。
2Al+6HCl=2AlCl3+3H2↑
219 6
X 0.2g
X=7.3g
盐酸中溶质质量分数=
答: 实验中所用稀盐酸的溶质质量分数为14.6%。
22.CBA .C 100 小于 漏斗 4.5 500
【分析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【详解】
(1)
①根据溶解度曲线可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A;
②根据溶解度曲线可知,A、B、C三种物质中,溶解度随温度升高而减小的是C;
③t2℃时,A的溶解度是ag,即t2℃时100g水中最多溶解A的质量为ag就达到饱和状态,则完全溶解ag A物质最少需要水的质量是100g;
④t2℃时,由于A物质的溶解度大于B,所以相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量小于B的饱和溶液中所含水的质量;
(2)过滤是把不溶于液体的固体与液体分离,过滤操作的实验仪器和用品有铁架台、烧杯、玻璃棒、漏斗、滤纸,则还需要的是漏斗;
(3)溶质质量=溶液质量×溶质质量分数,则需要氯化钠固体的质量=45g×10%=4.5g;根据溶液稀释过程中溶质质量不变,设得到的0.9%氯化钠的溶液质量为x,则45g×10%=0.9%x,x=500g。
23.C 500 增大 13 乙=丙>甲 B 溶液 1.775
【详解】
(1)A:,0℃时,三种物质的饱和溶液中,溶质质量分数最大的是氯化镁,选项错误;
B.氯化镁和氯化钠两种物质的溶解度都随温度升高而不断增大,硫酸镁的溶解度在温度高于一定数值时,溶解度随温度升高减小,选项错误;
C.将卤水加热到80℃以上蒸发水分,硫酸镁的溶解度随温度升高而减小,硫酸镁析出,氯化钠的溶解度受温度的影响很小,但水的量减少会导致氯化钠的溶解量降低而析出,逐渐析出的晶体是和,选项正确;
D. 20°时向40g固体的溶解度小于40g,溶液达到饱和, 固体的溶解度大于40g,加入100g水充分溶解后,溶液不能达到饱和状态,选项错误;
故选C;
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为的质量为x,蒸发过程中溶质的质量不变,2000g×3%= (2000g-x)×4%,x=500g;
(3)①由表可知,硼酸的溶解度随着温度的升高而增大;
②60℃时,硼酸的溶解度为15g,100g硼酸饱和溶液中含有硼酸y,
y≈13g;
③a.上述三个烧杯中,溶质都是2g,乙和丙的溶剂都是50g,甲的溶剂是100g,所得溶液浓度的大小关系是乙=丙>甲;
b.若要达到实验目的,根据控制变量原则,对照试验只有固体的形状不同,需改变实验甲中的一个条件是将水的体积改为50mL;
(4)某同学取模拟海水(含,、)200g,硫酸根离子与银离子生成的硫酸银十微溶物,影响氯离子的验证,向溶液中先滴加足量的溶液,充分反应后,使硫酸镁转化成硫酸钡沉淀,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,可知生成氯化银的质量是14.35g,则氯元素的质量为:14.35g× =3.55g,测得模拟海水中氯元素的质量分数为 。
同课章节目录
