湘赣粤名校2021-2022学年高一上学期12月大联考化学试题(Word版含答案)
文档属性
| 名称 | 湘赣粤名校2021-2022学年高一上学期12月大联考化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 577.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 21:12:08 | ||
图片预览


文档简介
湘赣粤名校2021级高一(12月)大联考
化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷草稿纸上作答无效.
3.本卷命题范围:新人教版必修一.
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5
一、选择题:本题共16小题,共44分.第1~10题,每小题2分;第11-16题,每小题4分,在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列我国古代的技术应用中,不涉及化学变化的是( )
A.火药使用 B.粮食酿酒 C.活字印刷 D.湿法炼铜
A.A B.B C.C D.D
2.下列关于铝的叙述正确的是
A.铝在常温下不会被氧气氧化 B.铝具有导热性,可用金属铝制成铝锅
C.铝具有良好的导电性,故可用于制铝箔 D.通常情况下,铝比铁更容易被腐蚀
3.2021年国庆节期间,国内多地绽放烟火,给人们带去节日问候和美好祝福.在制作烟火时需要加入发色剂,在烟火引燃后,会在天空中绽放出五彩缤纷的图案.在烟火发色剂中可能不会添加的元素是( )
A.锂 B.钙 C.铁 D.铜
4.下列化学用语正确的是( )
A.的结构式: B.的结构示意图:
C.氧化钠的电子式: D.钙离子的电子式:
5.下列有关金属或合金的说法中错误的是( )
A.生铁属于合金
B.合金的化学性质与其成分金属的化学性质不同
C.一般合金的熔点比各成分金属的低
D.改变原料的配比、改变生成合金的条件,可以得到具有不同性能的合金
6.下列发生的变化属于氧化还原反应的是( )
A.铁杵磨成针 B.明月松间照 C.雪融成水水成冰 D.战火曾烧赤壁山
7.由一种阳离子与两种酸根离子组成的盐称为混盐.向混盐中加入足量浓硫酸,可发生反应:.下列说法错误的是(设表示阿伏加德罗常数的值)( )
A.混盐中既含离子键又含共价键 B.每产生氯气,转移的电子数为
C.混盐中含有的离子数为 D.反应中浓硫酸体现了氧化性与酸性
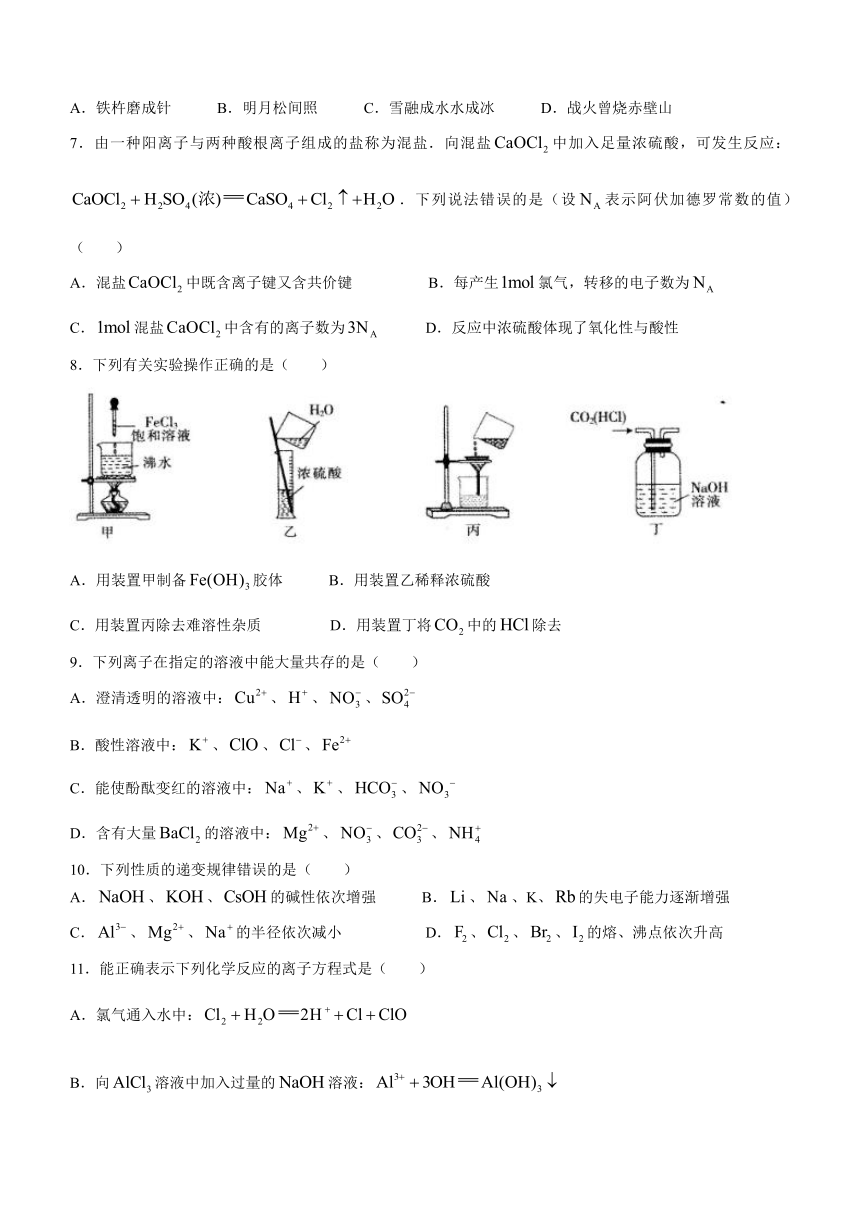
8.下列有关实验操作正确的是( )
A.用装置甲制备胶体 B.用装置乙稀释浓硫酸
C.用装置丙除去难溶性杂质 D.用装置丁将中的除去
9.下列离子在指定的溶液中能大量共存的是( )
A.澄清透明的溶液中:、、、
B.酸性溶液中:、、、
C.能使酚酞变红的溶液中:、、、
D.含有大量的溶液中:、、、
10.下列性质的递变规律错误的是( )
A.、、的碱性依次增强 B.、、K、的失电子能力逐渐增强
C.、、的半径依次减小 D.、、、的熔、沸点依次升高
11.能正确表示下列化学反应的离子方程式是( )
A.氯气通入水中:
B.向溶液中加入过量的溶液:
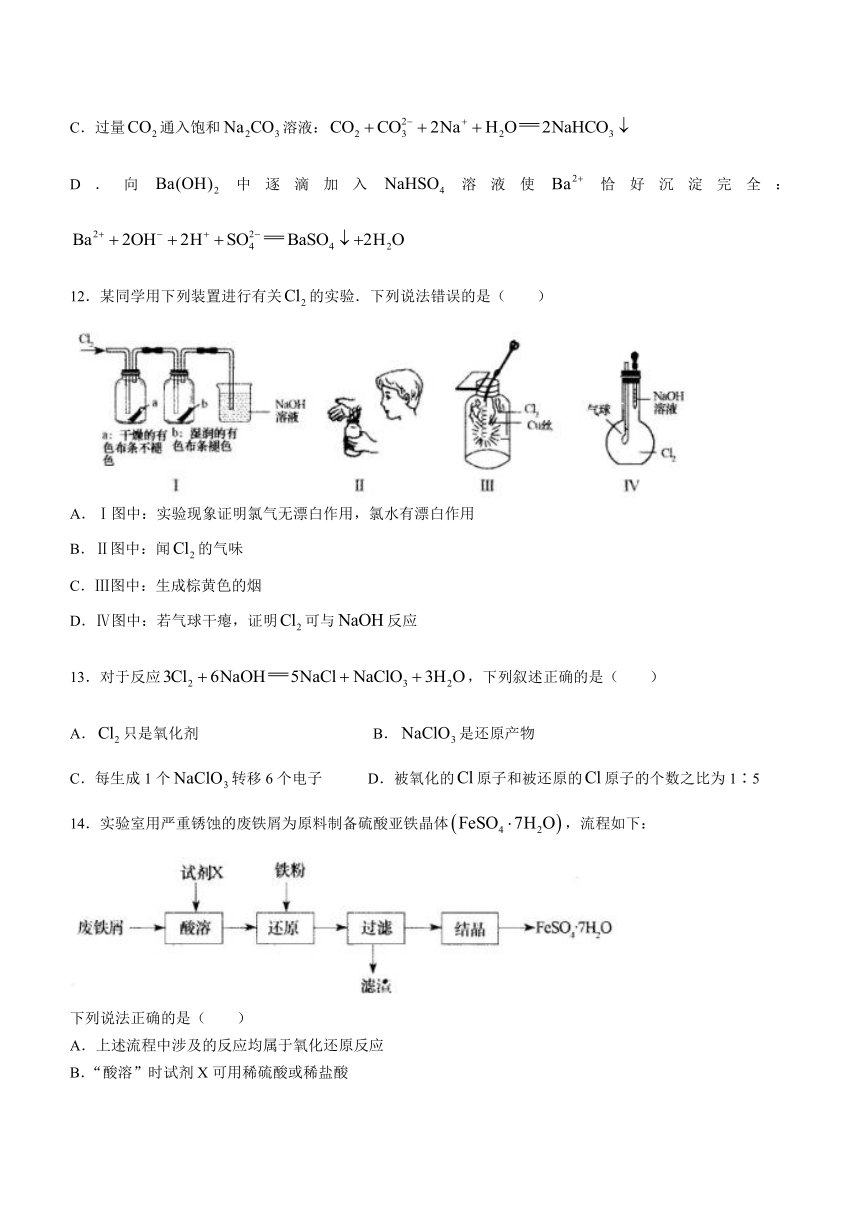
C.过量通入饱和溶液:
D.向中逐滴加入溶液使恰好沉淀完全:
12.某同学用下列装置进行有关的实验.下列说法错误的是( )
A.Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.Ⅱ图中:闻的气味
C.Ⅲ图中:生成棕黄色的烟
D.Ⅳ图中:若气球干瘪,证明可与反应
13.对于反应,下列叙述正确的是( )
A.只是氧化剂 B.是还原产物
C.每生成1个转移6个电子 D.被氧化的原子和被还原的原子的个数之比为1∶5
14.实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体,流程如下:
下列说法正确的是( )
A.上述流程中涉及的反应均属于氧化还原反应
B.“酸溶”时试剂X可用稀硫酸或稀盐酸
C.“还原”时发生反应的离子方程式为
D.“结晶”采用的方式是蒸发浓缩、冷却结晶
15.科技文献记载:与,在合成了无色气体,其反应可用如图表示:,其中元素W、X、Y、Z的原子序数依次增大,W与X同周期,X与Y同主族,Z的原子半径在第四周期中最大.下列有关说法正确的是( )
A.Z与W、X、Y均可形成离子化合物 B.Y的氧化物的水化物均为强酸
C.原子半径: D.四种元素的最高正化合价均与其主族序数相等
16.在学习了氯元素相关化合物的知识后,某学生绘制了如下含氯物质价类二维图,下列叙述正确的是( )
A.f具有消毒功能是因为和空气接触生成d,f本身无氧化性
B.a的酸性比d强,d的酸性比碳酸强
C.c的漂白能力和消毒能力比b强
D.以f为有效成分的消毒剂可以消毒有色衣物、织物、瓷砖、地板等
二、非选择题:本题共4小题,共56分.
17.(14分)有如下物质:①铁丝;②溶液;③固体;④;⑤酒精;⑥蒸馏水;⑦;⑧熔融的;⑨红褐色的氢氧化铁胶体.回答下列问题:
(1)以上物质中,属于电解质的是_________(填序号,下同),属于非电解质的是_______.
(2)已知蒸馏水有非常微弱的导电性,上述物质除⑥外,能导电的是_______.
(3)分离⑤与⑥的混合液所用的方法是__________;分离⑥与⑦的混合液所用的方法是_____________.
(4)物质③溶于水的电离方程式为____________.
(5)向⑨的溶液中逐渐滴加③的溶液,看到的现象是__________.
18.(12分)次氯酸溶液是常用的消毒剂和漂白剂.某学习小组根据需要欲用如图装置制备某浓度的次氯酸溶液.经查阅资料知:
①极易溶于.
②常温常压下,为棕黄色气体,沸点为,以上会分解生成和,易溶于水并与水立即反应生成.
③将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应:(反应过程放出热量),用水吸收(不含)制得次氯酸溶液.
回答下列问题:
(1)各装置的连接顺序为_________→_________→_________→_________→E.
(2)装置A中反应的离子方程式是_______________________.
(3)实验中控制氯气与空气体积比的方法是_______________________.
(4)反应过程中,装置B需放在冷水中,其目的是_________________________.
(5)装置E采用棕色圆底烧瓶是因为________________________.
19.(14分)化学方法在文物保护中有巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物:
主要成分的化学式
铁器在具有、________等环境中容易被腐蚀.
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环.
①转化为.
②在自然环境中形成,该物质中铁元素的化合价为_________.
③和反应形成致密的保护层.在该过程中的作用是____________(填标号).
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
①保护层被氧化为,如此往复腐蚀.写出该过程的化学方程式:__________________.
(3)研究发现,对铁的腐蚀会造成严重影响.化学修复:脱氯、还原,形成保护层.
方法如下:将铁器浸没在盛有的、的溶液的容器中,缓慢加热至,一段时间后,取出器物,用溶液洗涤至无.
①配平还原形成的离子方程式:
②脱氯反应:.离子反应的本质是离子浓度的减小,则溶解度: _______(填“>”“<”或“=”).
③检测器物已洗涤干净的方法是_________________________________.
20.(16分)元素周期表与元素周期律在学习、研究中有很重要的作用.下表所示为某5种元素的相关信息,已知W、X都位于第三周期.
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
回答下列问题:
(1)W在元素周期表中的位置为____________________,X的最高价氧化物对应的水化物的化学式为____________.
(2)Y的单质与水反应的离子方程式是_____________________________________.
(3)用电子式表示的形成过程:______________________________________.
(4)金属性:Y___________(填“>”或“<”)X,用原子结构解释原因:______________________________________________.
(5)下列对于Z及其化合物的推断中正确的是________(填标号).
A.Z的化合价中有和
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z元素单质的氧化性强于W元素单质的氧化性
(6)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入硫酸亚铁溶液中,主要的反应现象是_________________________________.
2021~2022学年度上学期高一年级期末考试·化学
参考答案、提示及评分细则
1.C 火药爆炸,属于剧烈的氧化还原反应,属于化学变化,故A不选;粮食酿酒,有新物质酒精生成,属于化学变化,故B不选;活字印刷,没有新物质生成,属于物理变化,故C符合题意;湿法炼铜,是铁置换岀铜,有新物质生成,属于化学变化,故D不选.
2.B
3.C 焰色试验指某些金属元素在灼烧时会使火焰产生不同的颜色,属于物理变化.在进行焰色试验时可以用洁净的铁丝蘸取样品在火焰上灼烧,说眀铁不能使火焰产生特殊的颜色,故在烟火发色剂中应该不会添加铁元素.
4.D 属于共价化合物,其结构式为,A项错误;氯离子的核电荷数为17,核外电子总数为18,其结构示意图为,B项错误;氧化钠是离子化合物,其电子式为,C项错误;钙离子为简单阳离子,其电子式为,D项正确.
5.B
6.D 铁杵磨成针,属于物理变化,A错误;明月松间照是光的折射现象,属于光学性质,不涉及氧化还原反应,B错误;雪融成水水成冰没有新物质生成,属于物理变化,C错误;燃烧是可燃物和助燃剂发生发光放热、剧烈的化学反应,燃烧涉及了氧化还原反应,D正确.
7.D 的化学式可以写为,则中含有离子键,也含有共价键,A项正确;反应中,部分元素的化合价从降低到0,部分元素的化合价从升高到0,每产生氯气,转移的电子数为,B项正确;的化学式可以写为,则混盐中含有的离子数为,C项正确;反应中S的化合价没有发生变化,浓硫酸只表现酸性,D项错误.
8.A 量筒不能用来稀释浓硫酸,且稀释浓硫酸时应将浓硫酸注λ水中,B错误;过滤时应用玻璃棒引流,C错误;溶液也可以与反应,D错误.
9.A
10.C 金属性:,则、、的碱性依次增强,A项正确;金属性:,则、、K、的失电子能力逐渐增强,B项正确;、、都含有2个电子层,核电荷数越大,离子半径越小,则、、的半径依次增大,C项错误;由卤素单质的物理性质可知,、、、的熔、沸点依次升高,D项正确.
11.C 次氯酸为弱酸,应保留化学式,离子方程式为,A错误;向溶液中加入过量的溶液生成偏铝酸钠,离子方程式为,B错误;过量通入饱和溶液生成,的溶解度小于,故会产生沉淀,离子方程式为,C正确;向中逐滴加入溶液使恰好沉淀完全,两者应该1∶1反应,离子方程式为,D错误.
12.D Ⅰ图中:干燥的有色布条不褪色,湿润的有色布条褪色,证明氯气无漂白作用,氯气溶于水产生的氯水具有漂白作用,A正确;是有毒气体,为达到闻气体气味同时又避免中毒的目的,应该采用Ⅱ图中所示的扇闻的方法闻的气味,B正确;将灼热的丝伸入到盛有的集气瓶中,会看到铜丝在中着火燃烧,同时看到有棕黄色的烟,C正确;与发生反应:,反应发生使烧瓶中的气体压强减小,通过导气管与外界大气相通的气球就会鼓起胀大,而不是干瘪,D错误.
13.D
14.D 严重锈蚀的废铁屑用硫酸酸浸,溶液中含和,加铁粉将还原成,过滤除去不溶杂质,得硫酸亚铁溶液,蒸发浓缩、冷却结晶,制取硫酸亚铁晶体.与硫酸的反应不是氧化还原反应,A错误;“酸溶”时不能用盐酸,会引入,B错误;所给的离子方程式电荷不守恒,“还原”时发生反应的离子方程式为,C错误;晶体带结晶水,一般采用蒸发浓缩、冷却结晶的方法提取,“结晶”采用的方式是蒸发浓缩、冷却结晶,D正确.
15.A W、X、Y、Z的原子序数依次增大,且Z在第四周期中原子半径最大,则Z为钾元素,根据结构和化合价可推知W、Ⅹ、Y分别为氧、氟、氯.钾与氧、氟、氯均可形成离子化合物,A正确;次氯酸不是强酸,B错误;原子半径:,C错误;氟无正化合价,氧的最高正化合价小于其主族序数(如中氧为价,不存在),D错误.
16.C f中,元素显价且为盐,则其为等,不管是还是,都具有消毒功能,A错误;a为盐酸,d为次氯酸,盐酸的酸性比次氯酸强,但次氯酸的酸性比碳酸弱,B错误;c为,b为,的漂白能力和消毒能力都比强,C正确;f为等盐,以等为有效成分的消毒剂具有强氧化性,消毒时易损坏有色衣物、织物等,D错误.
17.(1)③⑥⑧ ④⑤⑦(各2分)
(2)①②⑧⑨(2分)
(3)蒸馏 分液(各2分)
(4)(2分)
(5)先生成红褐色沉淀,后沉淀溶解,溶液呈黄色(2分)
18.(1)A D B C(各1分)
(2)(2分)
(3)通过观察D中产生气泡的速率调节流速(2分)
(4)防止反应放热后温度过高导致分解(2分)
(5)见光易分解(2分)
19.(1)(或潮湿)(2分)
(2)②(2分) ③c(2分) ④(2分)
(3)①1,6,1,2,3(2分) ②>(2分)
③取少量最后一次洗涤液于试管中,加亼稀硝酸和硝酸银的混合液,若无白色沉淀产生,说明器物已洗涤干净(2分)
20.(1)第三周期第ⅦA族 (各2分)
(2)(2分)
(3)(2分)
(4)>(2分) K和位于同一主族,电子层数K大于,原子半径K大于,原子核对核外电子的吸引力K小于,失电子能力K大于则金属性K强于(2分)
(5)AB(2分)
(6)有气泡产生,并生成红褐色沉淀(2分)
化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷草稿纸上作答无效.
3.本卷命题范围:新人教版必修一.
可能用到的相对原子质量:H 1 C 12 O 16 Cl 35.5
一、选择题:本题共16小题,共44分.第1~10题,每小题2分;第11-16题,每小题4分,在每小题给出的四个选项中,只有一项是符合题目要求的.
1.下列我国古代的技术应用中,不涉及化学变化的是( )
A.火药使用 B.粮食酿酒 C.活字印刷 D.湿法炼铜
A.A B.B C.C D.D
2.下列关于铝的叙述正确的是
A.铝在常温下不会被氧气氧化 B.铝具有导热性,可用金属铝制成铝锅
C.铝具有良好的导电性,故可用于制铝箔 D.通常情况下,铝比铁更容易被腐蚀
3.2021年国庆节期间,国内多地绽放烟火,给人们带去节日问候和美好祝福.在制作烟火时需要加入发色剂,在烟火引燃后,会在天空中绽放出五彩缤纷的图案.在烟火发色剂中可能不会添加的元素是( )
A.锂 B.钙 C.铁 D.铜
4.下列化学用语正确的是( )
A.的结构式: B.的结构示意图:
C.氧化钠的电子式: D.钙离子的电子式:
5.下列有关金属或合金的说法中错误的是( )
A.生铁属于合金
B.合金的化学性质与其成分金属的化学性质不同
C.一般合金的熔点比各成分金属的低
D.改变原料的配比、改变生成合金的条件,可以得到具有不同性能的合金
6.下列发生的变化属于氧化还原反应的是( )
A.铁杵磨成针 B.明月松间照 C.雪融成水水成冰 D.战火曾烧赤壁山
7.由一种阳离子与两种酸根离子组成的盐称为混盐.向混盐中加入足量浓硫酸,可发生反应:.下列说法错误的是(设表示阿伏加德罗常数的值)( )
A.混盐中既含离子键又含共价键 B.每产生氯气,转移的电子数为
C.混盐中含有的离子数为 D.反应中浓硫酸体现了氧化性与酸性
8.下列有关实验操作正确的是( )
A.用装置甲制备胶体 B.用装置乙稀释浓硫酸
C.用装置丙除去难溶性杂质 D.用装置丁将中的除去
9.下列离子在指定的溶液中能大量共存的是( )
A.澄清透明的溶液中:、、、
B.酸性溶液中:、、、
C.能使酚酞变红的溶液中:、、、
D.含有大量的溶液中:、、、
10.下列性质的递变规律错误的是( )
A.、、的碱性依次增强 B.、、K、的失电子能力逐渐增强
C.、、的半径依次减小 D.、、、的熔、沸点依次升高
11.能正确表示下列化学反应的离子方程式是( )
A.氯气通入水中:
B.向溶液中加入过量的溶液:
C.过量通入饱和溶液:
D.向中逐滴加入溶液使恰好沉淀完全:
12.某同学用下列装置进行有关的实验.下列说法错误的是( )
A.Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.Ⅱ图中:闻的气味
C.Ⅲ图中:生成棕黄色的烟
D.Ⅳ图中:若气球干瘪,证明可与反应
13.对于反应,下列叙述正确的是( )
A.只是氧化剂 B.是还原产物
C.每生成1个转移6个电子 D.被氧化的原子和被还原的原子的个数之比为1∶5
14.实验室用严重锈蚀的废铁屑为原料制备硫酸亚铁晶体,流程如下:
下列说法正确的是( )
A.上述流程中涉及的反应均属于氧化还原反应
B.“酸溶”时试剂X可用稀硫酸或稀盐酸
C.“还原”时发生反应的离子方程式为
D.“结晶”采用的方式是蒸发浓缩、冷却结晶
15.科技文献记载:与,在合成了无色气体,其反应可用如图表示:,其中元素W、X、Y、Z的原子序数依次增大,W与X同周期,X与Y同主族,Z的原子半径在第四周期中最大.下列有关说法正确的是( )
A.Z与W、X、Y均可形成离子化合物 B.Y的氧化物的水化物均为强酸
C.原子半径: D.四种元素的最高正化合价均与其主族序数相等
16.在学习了氯元素相关化合物的知识后,某学生绘制了如下含氯物质价类二维图,下列叙述正确的是( )
A.f具有消毒功能是因为和空气接触生成d,f本身无氧化性
B.a的酸性比d强,d的酸性比碳酸强
C.c的漂白能力和消毒能力比b强
D.以f为有效成分的消毒剂可以消毒有色衣物、织物、瓷砖、地板等
二、非选择题:本题共4小题,共56分.
17.(14分)有如下物质:①铁丝;②溶液;③固体;④;⑤酒精;⑥蒸馏水;⑦;⑧熔融的;⑨红褐色的氢氧化铁胶体.回答下列问题:
(1)以上物质中,属于电解质的是_________(填序号,下同),属于非电解质的是_______.
(2)已知蒸馏水有非常微弱的导电性,上述物质除⑥外,能导电的是_______.
(3)分离⑤与⑥的混合液所用的方法是__________;分离⑥与⑦的混合液所用的方法是_____________.
(4)物质③溶于水的电离方程式为____________.
(5)向⑨的溶液中逐渐滴加③的溶液,看到的现象是__________.
18.(12分)次氯酸溶液是常用的消毒剂和漂白剂.某学习小组根据需要欲用如图装置制备某浓度的次氯酸溶液.经查阅资料知:
①极易溶于.
②常温常压下,为棕黄色气体,沸点为,以上会分解生成和,易溶于水并与水立即反应生成.
③将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应:(反应过程放出热量),用水吸收(不含)制得次氯酸溶液.
回答下列问题:
(1)各装置的连接顺序为_________→_________→_________→_________→E.
(2)装置A中反应的离子方程式是_______________________.
(3)实验中控制氯气与空气体积比的方法是_______________________.
(4)反应过程中,装置B需放在冷水中,其目的是_________________________.
(5)装置E采用棕色圆底烧瓶是因为________________________.
19.(14分)化学方法在文物保护中有巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物:
主要成分的化学式
铁器在具有、________等环境中容易被腐蚀.
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环.
①转化为.
②在自然环境中形成,该物质中铁元素的化合价为_________.
③和反应形成致密的保护层.在该过程中的作用是____________(填标号).
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
①保护层被氧化为,如此往复腐蚀.写出该过程的化学方程式:__________________.
(3)研究发现,对铁的腐蚀会造成严重影响.化学修复:脱氯、还原,形成保护层.
方法如下:将铁器浸没在盛有的、的溶液的容器中,缓慢加热至,一段时间后,取出器物,用溶液洗涤至无.
①配平还原形成的离子方程式:
②脱氯反应:.离子反应的本质是离子浓度的减小,则溶解度: _______(填“>”“<”或“=”).
③检测器物已洗涤干净的方法是_________________________________.
20.(16分)元素周期表与元素周期律在学习、研究中有很重要的作用.下表所示为某5种元素的相关信息,已知W、X都位于第三周期.
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
回答下列问题:
(1)W在元素周期表中的位置为____________________,X的最高价氧化物对应的水化物的化学式为____________.
(2)Y的单质与水反应的离子方程式是_____________________________________.
(3)用电子式表示的形成过程:______________________________________.
(4)金属性:Y___________(填“>”或“<”)X,用原子结构解释原因:______________________________________________.
(5)下列对于Z及其化合物的推断中正确的是________(填标号).
A.Z的化合价中有和
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z元素单质的氧化性强于W元素单质的氧化性
(6)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入硫酸亚铁溶液中,主要的反应现象是_________________________________.
2021~2022学年度上学期高一年级期末考试·化学
参考答案、提示及评分细则
1.C 火药爆炸,属于剧烈的氧化还原反应,属于化学变化,故A不选;粮食酿酒,有新物质酒精生成,属于化学变化,故B不选;活字印刷,没有新物质生成,属于物理变化,故C符合题意;湿法炼铜,是铁置换岀铜,有新物质生成,属于化学变化,故D不选.
2.B
3.C 焰色试验指某些金属元素在灼烧时会使火焰产生不同的颜色,属于物理变化.在进行焰色试验时可以用洁净的铁丝蘸取样品在火焰上灼烧,说眀铁不能使火焰产生特殊的颜色,故在烟火发色剂中应该不会添加铁元素.
4.D 属于共价化合物,其结构式为,A项错误;氯离子的核电荷数为17,核外电子总数为18,其结构示意图为,B项错误;氧化钠是离子化合物,其电子式为,C项错误;钙离子为简单阳离子,其电子式为,D项正确.
5.B
6.D 铁杵磨成针,属于物理变化,A错误;明月松间照是光的折射现象,属于光学性质,不涉及氧化还原反应,B错误;雪融成水水成冰没有新物质生成,属于物理变化,C错误;燃烧是可燃物和助燃剂发生发光放热、剧烈的化学反应,燃烧涉及了氧化还原反应,D正确.
7.D 的化学式可以写为,则中含有离子键,也含有共价键,A项正确;反应中,部分元素的化合价从降低到0,部分元素的化合价从升高到0,每产生氯气,转移的电子数为,B项正确;的化学式可以写为,则混盐中含有的离子数为,C项正确;反应中S的化合价没有发生变化,浓硫酸只表现酸性,D项错误.
8.A 量筒不能用来稀释浓硫酸,且稀释浓硫酸时应将浓硫酸注λ水中,B错误;过滤时应用玻璃棒引流,C错误;溶液也可以与反应,D错误.
9.A
10.C 金属性:,则、、的碱性依次增强,A项正确;金属性:,则、、K、的失电子能力逐渐增强,B项正确;、、都含有2个电子层,核电荷数越大,离子半径越小,则、、的半径依次增大,C项错误;由卤素单质的物理性质可知,、、、的熔、沸点依次升高,D项正确.
11.C 次氯酸为弱酸,应保留化学式,离子方程式为,A错误;向溶液中加入过量的溶液生成偏铝酸钠,离子方程式为,B错误;过量通入饱和溶液生成,的溶解度小于,故会产生沉淀,离子方程式为,C正确;向中逐滴加入溶液使恰好沉淀完全,两者应该1∶1反应,离子方程式为,D错误.
12.D Ⅰ图中:干燥的有色布条不褪色,湿润的有色布条褪色,证明氯气无漂白作用,氯气溶于水产生的氯水具有漂白作用,A正确;是有毒气体,为达到闻气体气味同时又避免中毒的目的,应该采用Ⅱ图中所示的扇闻的方法闻的气味,B正确;将灼热的丝伸入到盛有的集气瓶中,会看到铜丝在中着火燃烧,同时看到有棕黄色的烟,C正确;与发生反应:,反应发生使烧瓶中的气体压强减小,通过导气管与外界大气相通的气球就会鼓起胀大,而不是干瘪,D错误.
13.D
14.D 严重锈蚀的废铁屑用硫酸酸浸,溶液中含和,加铁粉将还原成,过滤除去不溶杂质,得硫酸亚铁溶液,蒸发浓缩、冷却结晶,制取硫酸亚铁晶体.与硫酸的反应不是氧化还原反应,A错误;“酸溶”时不能用盐酸,会引入,B错误;所给的离子方程式电荷不守恒,“还原”时发生反应的离子方程式为,C错误;晶体带结晶水,一般采用蒸发浓缩、冷却结晶的方法提取,“结晶”采用的方式是蒸发浓缩、冷却结晶,D正确.
15.A W、X、Y、Z的原子序数依次增大,且Z在第四周期中原子半径最大,则Z为钾元素,根据结构和化合价可推知W、Ⅹ、Y分别为氧、氟、氯.钾与氧、氟、氯均可形成离子化合物,A正确;次氯酸不是强酸,B错误;原子半径:,C错误;氟无正化合价,氧的最高正化合价小于其主族序数(如中氧为价,不存在),D错误.
16.C f中,元素显价且为盐,则其为等,不管是还是,都具有消毒功能,A错误;a为盐酸,d为次氯酸,盐酸的酸性比次氯酸强,但次氯酸的酸性比碳酸弱,B错误;c为,b为,的漂白能力和消毒能力都比强,C正确;f为等盐,以等为有效成分的消毒剂具有强氧化性,消毒时易损坏有色衣物、织物等,D错误.
17.(1)③⑥⑧ ④⑤⑦(各2分)
(2)①②⑧⑨(2分)
(3)蒸馏 分液(各2分)
(4)(2分)
(5)先生成红褐色沉淀,后沉淀溶解,溶液呈黄色(2分)
18.(1)A D B C(各1分)
(2)(2分)
(3)通过观察D中产生气泡的速率调节流速(2分)
(4)防止反应放热后温度过高导致分解(2分)
(5)见光易分解(2分)
19.(1)(或潮湿)(2分)
(2)②(2分) ③c(2分) ④(2分)
(3)①1,6,1,2,3(2分) ②>(2分)
③取少量最后一次洗涤液于试管中,加亼稀硝酸和硝酸银的混合液,若无白色沉淀产生,说明器物已洗涤干净(2分)
20.(1)第三周期第ⅦA族 (各2分)
(2)(2分)
(3)(2分)
(4)>(2分) K和位于同一主族,电子层数K大于,原子半径K大于,原子核对核外电子的吸引力K小于,失电子能力K大于则金属性K强于(2分)
(5)AB(2分)
(6)有气泡产生,并生成红褐色沉淀(2分)
同课章节目录
