河南省南阳地区2021-2022学年高二上学期12月阶段检测化学试题(Word版含答案)
文档属性
| 名称 | 河南省南阳地区2021-2022学年高二上学期12月阶段检测化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 248.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 21:15:54 | ||
图片预览



文档简介
南阳地区2021~2022年度高二年级12月阶段检测考试卷
化 学
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分。考试时间90分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H1 C12 O16 Na23 Cl 35.5
第I卷(选择题共48分)
一、 选择题:本题共16小题, 每小题3分,共48分。每小题只有一个选项符合题目要求。
1.化学与生产、生活密切相关,下列说法正确的是
A.明矾可用于饮用水的杀菌消毒
B.一氧化碳的燃烧是将热能转化为化学能
C.金属铁在潮湿的空气中生锈,主要发生化学腐蚀
D.可依据碳酸氢钠溶液和硫酸铝溶液反应的原理来制备泡沫灭火器
2.对于可逆反应8NH3(g) +3Cl2(g) 6NH4Cl(s) +N2(g),下列能正确表示该反应的平衡常数表达式的是
A. B.
C. D.
3.室温下,将0.1 mol· L-1的HClO溶液加水稀释至0.01 mol·L-1的过程中,下列各项始终保持减小的是
A. Ka(HClO) B. C. D.
4.在一恒容密闭容器中,充入一定物质的量的NO和Cl2,发生反应2NO(g) +Cl2(g) 2NOCl(g)△H。平衡时某反应物的平衡转化率与氮氯比及温度的关系如图所示,下列说法正确的是
A.该反应的反应物的总能量小于生成物的总能量
B.a、b、c三点平衡常数大小关系为Ka>Kb>Kc
C.加入合适的催化剂,反应物的平衡转化率和△H的大小均保持不变
D.当混合气体的密度不再随时间改变时,该反应达到平衡
5.下列说法正确的是
A.室温下,某溶液中的c(H+ )=1.0 ×10-12 mol·L-1,该溶液可能为酸溶液
B. pH<7的溶液也可能是中性溶液
C. pH=3的HNO3与pH=11的KOH溶液等体积混合的溶液中:c(H+ )D.室温下,0.1 mol·L-1的NH3·H2O溶液中:c(OH- )>c(H+ )>c(NH3·H2O)
6.已知25 °C时有关弱酸的电离平衡常数如表所示。
弱酸 HClO HF CH3COOH HNO2
电离常数 3.0 ×10-8 6.8 ×10-4 1.6 ×10-5 6.4 ×10-6
下列说法错误的是
A.酸性:HF> CH3COOH> HNO2> HClO
B.反应2HF +Ca(ClO)2 =2HClO+CaF2↓可以发生
C.相同物质的量浓度的四种溶液中由水电离出的c(H+):HClO溶液>HNO2溶液>CH3COOH溶液>HF溶液
D.ClO-与H+的结合能力弱于F-与H+的结合能力
7.利用CH4可消除NO2的污染,反应原理为CH4(g) + 2NO2(g) N2(g) +CO2(g) +2H2O(g),向两个容积完全相同的恒容密闭容器中均充入0.50 mol CH4和1.20 mol NO2,测得不同温度下n(CH4,)随时间变化的有关实验数据如表所示:
容器 时间/min n(CH4)/ mol 温度/K 0 10 20 40 50
① T1 0.50 0.35 0.25 0.10 0.10
② T2 0.50 0.30 0.18 0.15 0.15
下列说法错误的是
A.容器①中反应达到平衡状态时的平衡常数K①=6.4
B. T1C.容器①与容器②中NO2的平衡转化率之比为8: 7
D.反应达到平衡后,容器①与容器②中CO2的物质的量分数:w①> >w ②
8.室温下,甲酸( HCOOH)为一元弱酸。下列说法错误的是
A.0.2 mol·L-1的HCOOH溶液中各离子浓度由大到小的关系为c(H+ )>c(HCOO- )>c(OH- )
B.将0.1 mol·L-1的HCOOH溶液加水稀释到0.01 mol·L-1的过程中,的值增大
C. HCOONa溶液中,c(Na+ )>c(HCOO- )
D.升高温度,Ka(HCOOH)将增大
9.向某一恒容密闭容器中充入一定量的X(g)、Y(g),发生反应X(g)+ Y(g) 2Z(g) ΔH<0,下列说法正确的是
A.反应达到平衡后,仅升高温度,该反应的平衡常数增大
B.加入合适的催化剂,可提高Z的产率
C.仅增大Y的物质的量浓度,X的平衡转化率增大
D.当n(X) : n(Y) : n(Z)=1: 1 : 2时,该反应一定达到平衡
10.室温下,下列有关HNO2及其盐的说法正确的是
A.浓度均为0.1 mol·L-1的NaNO2和HNO2混合溶液可能显酸性
B.将0.1 mol·L-1的NaNO2溶液从20 °C升温至30 °C ,其水解程度减小
C.0.1 mol·L-1的HNO2溶液的pH=1
D.将0.1 mol·L-1的NaNO2溶液蒸干后最终产物为NaOH
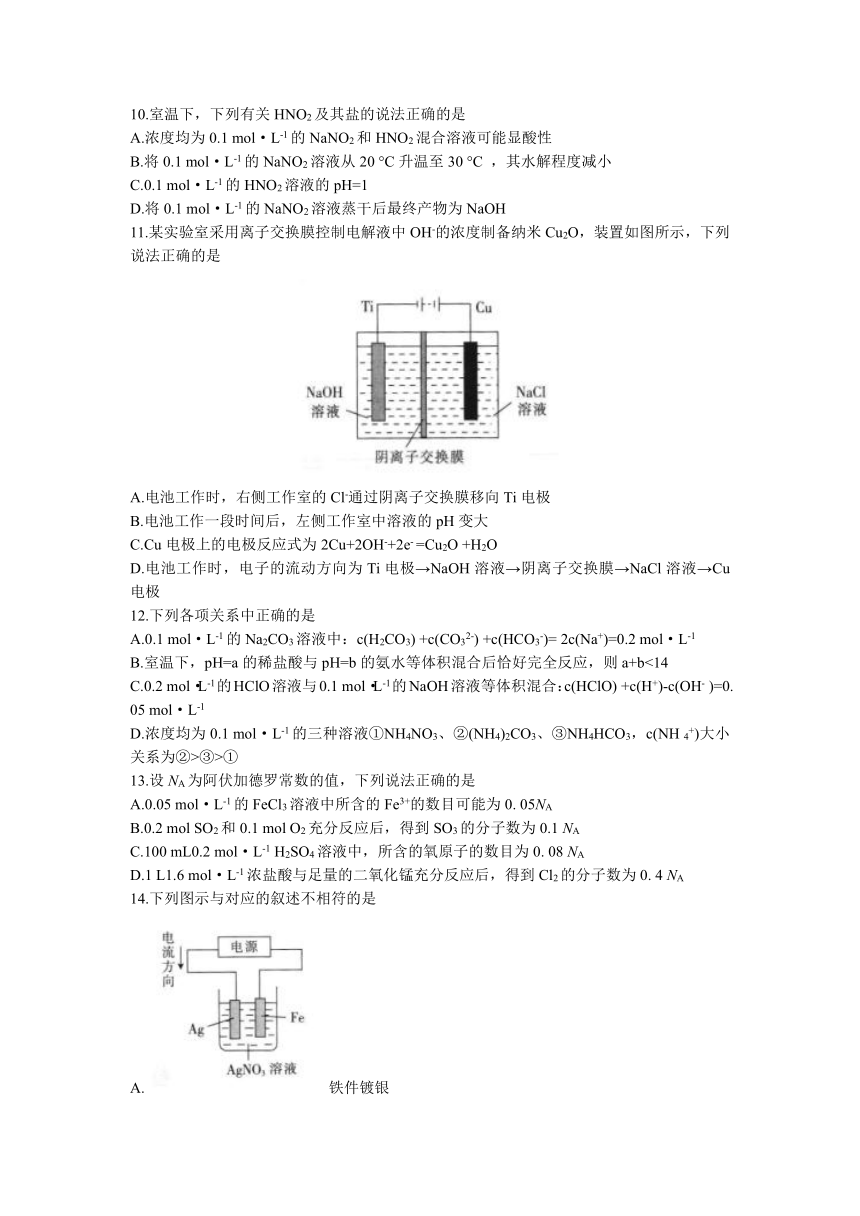
11.某实验室采用离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,装置如图所示,下列说法正确的是
A.电池工作时,右侧工作室的Cl-通过阴离子交换膜移向Ti电极
B.电池工作一段时间后,左侧工作室中溶液的pH变大
C.Cu电极上的电极反应式为2Cu+2OH-+2e- =Cu2O +H2O
D.电池工作时,电子的流动方向为Ti电极→NaOH溶液→阴离子交换膜→NaCl溶液→Cu电极
12.下列各项关系中正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(H2CO3) +c(CO32-) +c(HCO3-)= 2c(Na+)=0.2 mol·L-1
B.室温下,pH=a的稀盐酸与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2 mol·L-1的HClO溶液与0.1 mol·L-1的NaOH溶液等体积混合:c(HClO) +c(H+)-c(OH- )=0. 05 mol·L-1
D.浓度均为0.1 mol·L-1的三种溶液①NH4NO3、②(NH4)2CO3、③NH4HCO3,c(NH 4+)大小关系为②>③>①
13.设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.05 mol·L-1的FeCl3溶液中所含的Fe3+的数目可能为0. 05NA
B.0.2 mol SO2和0.1 mol O2充分反应后,得到SO3的分子数为0.1 NA
C.100 mL0.2 mol·L-1 H2SO4溶液中,所含的氧原子的数目为0. 08 NA
D.1 L1.6 mol·L-1浓盐酸与足量的二氧化锰充分反应后,得到Cl2的分子数为0. 4 NA
14.下列图示与对应的叙述不相符的是
A.铁件镀银
B. 由褪色快慢研究反应物浓度对反应速率的影响
C. 氮气与氧气反应生成一氧化氮的能量变化
D. 蒸干硫酸铝溶液制无水硫酸铝固体
15.某温度下,向容积为10 L的恒容密闭容器中充入2 mol M和4 molN,发生反应M(g)十2N(g) P(g)+xR(g) ΔH =-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
A.该反应中,化学计量数x=3
B.反应达到平衡后,仅增大压强,平衡常数也增大
C.8 min时,该反应的平衡常数K=2.5
D.10min时,仅将容器容积扩大至原来的两倍,则气体N的物质的量浓度的变化曲线为a
16.室温下,用0.1 mol·L-1的NaOH溶液滴定25 mL0.1 mol·L-1 H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5× 10-2 ,Ka2(H2C2O4)=2 ×10-4,忽略溶液混合时体积和温度的变化,lg2 =0.3,lg3=0. 5,电离度= ×100%]。下列说法正确的是
A.a点溶液中,0.1 mol·L-1的H2C2O4溶液的电离度为50% .
B.b点溶液中各离子浓度大小关系为c(Na+ )>c(HC2O4-)>c(OH- )>c(H+ )>c(C2O42- )
C.c点溶液中一定存在c(OH- )- c(H+ )D.d的值为8. 9
第II卷(非选择题共52分)
二、非选择题:本题共5小题,共52分。
17. (9分)原电池反应一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子,电子通过外电路输送到正极上,氧化剂在正极上得电子,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
(1)甲醇燃料电池结构简单、能量转化率高,工作原理如图1所示。加入的a是______ (填名称),该电极的名称是______ (填“ 正”或“负”)极,其电极反应式为 。
(2)我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,其原理如图2所示。
①该电池的电流方向:由______ (填 “左”或“右”,下同)侧电极经过负载流向 侧电极。
②当1 mol O2参与电极反应时,从左侧穿过质子交换膜进入右侧的H+数目为_ NA。
18. (9分)生活中常用一定浓度的过氧乙酸(CH3COOOH)溶液作消毒液。某化学小组对过氧乙酸的制备和性质进行如下探究(夹持、加热及搅拌装置均未画出)。
I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30 °C。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为 。
(2)仪器a与分液漏斗相比,其优点是_ _。
(3)控制温度在20~30 °C的目的是_ 。
II.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0 mol·L-1时,发生如下反应:①CH3COOOH+2I- +2H+=CH3COOH+I2+H2O;
②H2O2+2I- +2H+=I2 +2H2O;
③2S2O32- +I2=2I- +S4O62-。
i .取V0mL该样品并用硫酸酸化,恰好与V1 mL c1 mol·L-1 KMnO4溶液完全反应。
ii.另取V2 mL(V2≠V0)该样品,加入过量的KI溶液,并用硫酸酸化,恰好与V3 mLc2 mol·L-1Na2S2O3溶液完全反应。
(4) i中发生反应的离子方程式为 , 过氧乙酸的浓度c0 mol·L-1= _ mol·L-1 (用含V0、c1、V1、c2、V2、V3的代数式表示)。
19. (10分)铝氢化钠(NaAIH4)是有机合成的重要还原剂,工业上常用铝土矿(主要成分为Al2O3,含有Fe2O3杂质)为原料制备铝氢化钠,其制备工艺流程如图:
已知:AlO2- + HCO3-+ H2O=Al(OH)3↓+CO32-。
回答下列问题: .
(1)“碱浸”前“粉碎”的目的是 。
(2)“碱浸”时发生反应的离子方程式为 。
(3)“滤渣”的主要成分为_ ____(填化学式), 过滤时用到的主要玻璃仪器有 。
(4)“反应III”中每生成0.1 mol NaAlH4,生成另一种产物的质量为 g。
20. (11分)硫及其化合物在生产、生活中具有广泛的用途,根据所学知识,回答下列问题。
已知:常温下K(NH3·H2O)=1.6 ×10-5,lg2=0. 3。
(1)(NH4)2SO4溶液可用来除铁锈,其原因是
(用离子方程式表示)。
(2)常温下,0.1 mol·L-1的(NH4)2SO4溶液的pH= , 由水电离出的c(H+ )=_ mol·L-1。
(3)常温下,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,得到溶液的pH与NaOH溶液的体积的关系如图所示(忽略溶液混合时体积的变化)。
①a点时,溶液中各离子的浓度由大到小的顺序为__ ___(用离子符号表示)。
②c点时,c(NH4+ )+c(Na+)_____ (填“> ”“<”或“=”)c(SO42- )。
③d点时,= 。
21. (13分)苯硫酚(C6H5 -SH)是一种用途广泛的有机合成中间体。工业上常用氯苯(C6H5-Cl)和硫化氢(H2S)反应制备苯硫酚,该反应常伴有副产物苯(C6H6)生成,发生如下反应:
①主反应:C6H5- Cl(g)+H2S(g) C6H5- SH(g)+ HCl(g) ΔH1= -16.8kJ· mol-1;
②副反应:C6H5- Cl(g) +H2S(g) C6H6(g)+HCl(g)+ S8(g) ΔH2;
查阅相关资料可知,C6H5- SH(g) C6H6(g)+ S8(g) ΔH3=-29.0 kJ·mol-1。
回答下列问题:
(1)在副反应中,反应物的键能总和 (填“>”、“<”或“=”)生成物的键能总和。
(2)为了提高C6H5- Cl (g)的转化率,可采取的措施有__ __(填一种即可)。
(3)在一定温度下,往容积为5 L的恒容密闭容器中,充入2 mol C6H5- Cl (g)和2 molH2S(g),发生上述反应,2min时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为,C6H5- SH(g)的物质的量分数为25%。
①0~2 min内,v(C6H5-Cl)= mol·L-1·min-1。
②2 min时,c( HCl)=______mol· L-1,H2S(g)的转化率为 _%。
③该温度下,主反应的平衡常数K=____ _ (写 出计算式即可)。
④下列叙述能用来判断上述反应已达到平衡状态的是 _(填标号)。
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
南阳地区2021~2022 年度高二年级12月阶段检测考试卷
化学参考答案
1.D 2.B 3.D 4.C 5.B 6.D 7.A 8.B 9.C 10.A 11.B 12.C 13.A 14.B 15.C 16. A
17. (1)甲醇(2分);负(1分);CH3OH+ H2O-6e- =CO2↑+6H+ (2分)
(2)①右(1分);左(1分)
②4(2分)
18. (1)三颈烧瓶(1分)
(2)维持气压稳定,使液体顺利滴下(2分) .
(3)防止H2O2分解和冰醋酸挥发(只答防止H2O2分解也给分,2分) .
(4)6H+ +5H2O2 +2MnO4-=2Mn2+ +8H2O+5O2↑(2分); (2分)
19. (1)增大接触面积,加快碱浸速率(2分)
(2)Al2O3+ 2OH-=2AlO2- +H2O(2分)
(3)Fe2O3(2分);烧杯、玻璃棒和漏斗(2分)
(4)17. 55(2分)
20. (1)NH4+ +H2O NH3·H2O+H+(2分)
(2)4. 95(2分);1.0 ×10-4.95(2分)
(3)①c(H+ )>c(SO42- )>c(NH4+ )>c(OH- )(2分)
②>(1分)
③2: 5(2分)
21.(1)<(1分)
(2)及时移除部分HCl(g)(或其他合理答案,2分)
(3)①0.10825(2分)
②0.2165(2分);54.125(2分)
③(或,2分)
④BD(2分)
化 学
考生注意:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分。考试时间90分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H1 C12 O16 Na23 Cl 35.5
第I卷(选择题共48分)
一、 选择题:本题共16小题, 每小题3分,共48分。每小题只有一个选项符合题目要求。
1.化学与生产、生活密切相关,下列说法正确的是
A.明矾可用于饮用水的杀菌消毒
B.一氧化碳的燃烧是将热能转化为化学能
C.金属铁在潮湿的空气中生锈,主要发生化学腐蚀
D.可依据碳酸氢钠溶液和硫酸铝溶液反应的原理来制备泡沫灭火器
2.对于可逆反应8NH3(g) +3Cl2(g) 6NH4Cl(s) +N2(g),下列能正确表示该反应的平衡常数表达式的是
A. B.
C. D.
3.室温下,将0.1 mol· L-1的HClO溶液加水稀释至0.01 mol·L-1的过程中,下列各项始终保持减小的是
A. Ka(HClO) B. C. D.
4.在一恒容密闭容器中,充入一定物质的量的NO和Cl2,发生反应2NO(g) +Cl2(g) 2NOCl(g)△H。平衡时某反应物的平衡转化率与氮氯比及温度的关系如图所示,下列说法正确的是
A.该反应的反应物的总能量小于生成物的总能量
B.a、b、c三点平衡常数大小关系为Ka>Kb>Kc
C.加入合适的催化剂,反应物的平衡转化率和△H的大小均保持不变
D.当混合气体的密度不再随时间改变时,该反应达到平衡
5.下列说法正确的是
A.室温下,某溶液中的c(H+ )=1.0 ×10-12 mol·L-1,该溶液可能为酸溶液
B. pH<7的溶液也可能是中性溶液
C. pH=3的HNO3与pH=11的KOH溶液等体积混合的溶液中:c(H+ )
6.已知25 °C时有关弱酸的电离平衡常数如表所示。
弱酸 HClO HF CH3COOH HNO2
电离常数 3.0 ×10-8 6.8 ×10-4 1.6 ×10-5 6.4 ×10-6
下列说法错误的是
A.酸性:HF> CH3COOH> HNO2> HClO
B.反应2HF +Ca(ClO)2 =2HClO+CaF2↓可以发生
C.相同物质的量浓度的四种溶液中由水电离出的c(H+):HClO溶液>HNO2溶液>CH3COOH溶液>HF溶液
D.ClO-与H+的结合能力弱于F-与H+的结合能力
7.利用CH4可消除NO2的污染,反应原理为CH4(g) + 2NO2(g) N2(g) +CO2(g) +2H2O(g),向两个容积完全相同的恒容密闭容器中均充入0.50 mol CH4和1.20 mol NO2,测得不同温度下n(CH4,)随时间变化的有关实验数据如表所示:
容器 时间/min n(CH4)/ mol 温度/K 0 10 20 40 50
① T1 0.50 0.35 0.25 0.10 0.10
② T2 0.50 0.30 0.18 0.15 0.15
下列说法错误的是
A.容器①中反应达到平衡状态时的平衡常数K①=6.4
B. T1
D.反应达到平衡后,容器①与容器②中CO2的物质的量分数:w①> >w ②
8.室温下,甲酸( HCOOH)为一元弱酸。下列说法错误的是
A.0.2 mol·L-1的HCOOH溶液中各离子浓度由大到小的关系为c(H+ )>c(HCOO- )>c(OH- )
B.将0.1 mol·L-1的HCOOH溶液加水稀释到0.01 mol·L-1的过程中,的值增大
C. HCOONa溶液中,c(Na+ )>c(HCOO- )
D.升高温度,Ka(HCOOH)将增大
9.向某一恒容密闭容器中充入一定量的X(g)、Y(g),发生反应X(g)+ Y(g) 2Z(g) ΔH<0,下列说法正确的是
A.反应达到平衡后,仅升高温度,该反应的平衡常数增大
B.加入合适的催化剂,可提高Z的产率
C.仅增大Y的物质的量浓度,X的平衡转化率增大
D.当n(X) : n(Y) : n(Z)=1: 1 : 2时,该反应一定达到平衡
10.室温下,下列有关HNO2及其盐的说法正确的是
A.浓度均为0.1 mol·L-1的NaNO2和HNO2混合溶液可能显酸性
B.将0.1 mol·L-1的NaNO2溶液从20 °C升温至30 °C ,其水解程度减小
C.0.1 mol·L-1的HNO2溶液的pH=1
D.将0.1 mol·L-1的NaNO2溶液蒸干后最终产物为NaOH
11.某实验室采用离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,装置如图所示,下列说法正确的是
A.电池工作时,右侧工作室的Cl-通过阴离子交换膜移向Ti电极
B.电池工作一段时间后,左侧工作室中溶液的pH变大
C.Cu电极上的电极反应式为2Cu+2OH-+2e- =Cu2O +H2O
D.电池工作时,电子的流动方向为Ti电极→NaOH溶液→阴离子交换膜→NaCl溶液→Cu电极
12.下列各项关系中正确的是
A.0.1 mol·L-1的Na2CO3溶液中:c(H2CO3) +c(CO32-) +c(HCO3-)= 2c(Na+)=0.2 mol·L-1
B.室温下,pH=a的稀盐酸与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2 mol·L-1的HClO溶液与0.1 mol·L-1的NaOH溶液等体积混合:c(HClO) +c(H+)-c(OH- )=0. 05 mol·L-1
D.浓度均为0.1 mol·L-1的三种溶液①NH4NO3、②(NH4)2CO3、③NH4HCO3,c(NH 4+)大小关系为②>③>①
13.设NA为阿伏加德罗常数的值,下列说法正确的是
A.0.05 mol·L-1的FeCl3溶液中所含的Fe3+的数目可能为0. 05NA
B.0.2 mol SO2和0.1 mol O2充分反应后,得到SO3的分子数为0.1 NA
C.100 mL0.2 mol·L-1 H2SO4溶液中,所含的氧原子的数目为0. 08 NA
D.1 L1.6 mol·L-1浓盐酸与足量的二氧化锰充分反应后,得到Cl2的分子数为0. 4 NA
14.下列图示与对应的叙述不相符的是
A.铁件镀银
B. 由褪色快慢研究反应物浓度对反应速率的影响
C. 氮气与氧气反应生成一氧化氮的能量变化
D. 蒸干硫酸铝溶液制无水硫酸铝固体
15.某温度下,向容积为10 L的恒容密闭容器中充入2 mol M和4 molN,发生反应M(g)十2N(g) P(g)+xR(g) ΔH =-akJ·mol-1(a>0)。反应过程中测得气体N的物质的量浓度变化如图所示。已知反应进行到8min时达到平衡状态,若平衡后降低温度,混合气体的平均相对分子质量将增大(x为正整数),下列说法正确的是
A.该反应中,化学计量数x=3
B.反应达到平衡后,仅增大压强,平衡常数也增大
C.8 min时,该反应的平衡常数K=2.5
D.10min时,仅将容器容积扩大至原来的两倍,则气体N的物质的量浓度的变化曲线为a
16.室温下,用0.1 mol·L-1的NaOH溶液滴定25 mL0.1 mol·L-1 H2C2O4(草酸)溶液的滴定曲线如图所示[已知:Ka1(H2C2O4)=5× 10-2 ,Ka2(H2C2O4)=2 ×10-4,忽略溶液混合时体积和温度的变化,lg2 =0.3,lg3=0. 5,电离度= ×100%]。下列说法正确的是
A.a点溶液中,0.1 mol·L-1的H2C2O4溶液的电离度为50% .
B.b点溶液中各离子浓度大小关系为c(Na+ )>c(HC2O4-)>c(OH- )>c(H+ )>c(C2O42- )
C.c点溶液中一定存在c(OH- )- c(H+ )
第II卷(非选择题共52分)
二、非选择题:本题共5小题,共52分。
17. (9分)原电池反应一般是氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子,电子通过外电路输送到正极上,氧化剂在正极上得电子,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
(1)甲醇燃料电池结构简单、能量转化率高,工作原理如图1所示。加入的a是______ (填名称),该电极的名称是______ (填“ 正”或“负”)极,其电极反应式为 。
(2)我国科学工作者从环境污染物中分离出一株假单胞菌,该菌株能够在分解有机物的同时产生电能,其原理如图2所示。
①该电池的电流方向:由______ (填 “左”或“右”,下同)侧电极经过负载流向 侧电极。
②当1 mol O2参与电极反应时,从左侧穿过质子交换膜进入右侧的H+数目为_ NA。
18. (9分)生活中常用一定浓度的过氧乙酸(CH3COOOH)溶液作消毒液。某化学小组对过氧乙酸的制备和性质进行如下探究(夹持、加热及搅拌装置均未画出)。
I.在磁力搅拌作用下,向仪器b中加入一定量的冰醋酸和浓硫酸,打开开关K,缓缓滴入适量30%的H2O2溶液,控制温度在20~30 °C。
已知:过氧乙酸的氧化性强于高锰酸钾的。
(1)仪器b的名称为 。
(2)仪器a与分液漏斗相比,其优点是_ _。
(3)控制温度在20~30 °C的目的是_ 。
II.过氧乙酸样品中常含有残留的H2O2。样品中过氧乙酸的浓度为c0 mol·L-1时,发生如下反应:①CH3COOOH+2I- +2H+=CH3COOH+I2+H2O;
②H2O2+2I- +2H+=I2 +2H2O;
③2S2O32- +I2=2I- +S4O62-。
i .取V0mL该样品并用硫酸酸化,恰好与V1 mL c1 mol·L-1 KMnO4溶液完全反应。
ii.另取V2 mL(V2≠V0)该样品,加入过量的KI溶液,并用硫酸酸化,恰好与V3 mLc2 mol·L-1Na2S2O3溶液完全反应。
(4) i中发生反应的离子方程式为 , 过氧乙酸的浓度c0 mol·L-1= _ mol·L-1 (用含V0、c1、V1、c2、V2、V3的代数式表示)。
19. (10分)铝氢化钠(NaAIH4)是有机合成的重要还原剂,工业上常用铝土矿(主要成分为Al2O3,含有Fe2O3杂质)为原料制备铝氢化钠,其制备工艺流程如图:
已知:AlO2- + HCO3-+ H2O=Al(OH)3↓+CO32-。
回答下列问题: .
(1)“碱浸”前“粉碎”的目的是 。
(2)“碱浸”时发生反应的离子方程式为 。
(3)“滤渣”的主要成分为_ ____(填化学式), 过滤时用到的主要玻璃仪器有 。
(4)“反应III”中每生成0.1 mol NaAlH4,生成另一种产物的质量为 g。
20. (11分)硫及其化合物在生产、生活中具有广泛的用途,根据所学知识,回答下列问题。
已知:常温下K(NH3·H2O)=1.6 ×10-5,lg2=0. 3。
(1)(NH4)2SO4溶液可用来除铁锈,其原因是
(用离子方程式表示)。
(2)常温下,0.1 mol·L-1的(NH4)2SO4溶液的pH= , 由水电离出的c(H+ )=_ mol·L-1。
(3)常温下,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,得到溶液的pH与NaOH溶液的体积的关系如图所示(忽略溶液混合时体积的变化)。
①a点时,溶液中各离子的浓度由大到小的顺序为__ ___(用离子符号表示)。
②c点时,c(NH4+ )+c(Na+)_____ (填“> ”“<”或“=”)c(SO42- )。
③d点时,= 。
21. (13分)苯硫酚(C6H5 -SH)是一种用途广泛的有机合成中间体。工业上常用氯苯(C6H5-Cl)和硫化氢(H2S)反应制备苯硫酚,该反应常伴有副产物苯(C6H6)生成,发生如下反应:
①主反应:C6H5- Cl(g)+H2S(g) C6H5- SH(g)+ HCl(g) ΔH1= -16.8kJ· mol-1;
②副反应:C6H5- Cl(g) +H2S(g) C6H6(g)+HCl(g)+ S8(g) ΔH2;
查阅相关资料可知,C6H5- SH(g) C6H6(g)+ S8(g) ΔH3=-29.0 kJ·mol-1。
回答下列问题:
(1)在副反应中,反应物的键能总和 (填“>”、“<”或“=”)生成物的键能总和。
(2)为了提高C6H5- Cl (g)的转化率,可采取的措施有__ __(填一种即可)。
(3)在一定温度下,往容积为5 L的恒容密闭容器中,充入2 mol C6H5- Cl (g)和2 molH2S(g),发生上述反应,2min时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为,C6H5- SH(g)的物质的量分数为25%。
①0~2 min内,v(C6H5-Cl)= mol·L-1·min-1。
②2 min时,c( HCl)=______mol· L-1,H2S(g)的转化率为 _%。
③该温度下,主反应的平衡常数K=____ _ (写 出计算式即可)。
④下列叙述能用来判断上述反应已达到平衡状态的是 _(填标号)。
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
南阳地区2021~2022 年度高二年级12月阶段检测考试卷
化学参考答案
1.D 2.B 3.D 4.C 5.B 6.D 7.A 8.B 9.C 10.A 11.B 12.C 13.A 14.B 15.C 16. A
17. (1)甲醇(2分);负(1分);CH3OH+ H2O-6e- =CO2↑+6H+ (2分)
(2)①右(1分);左(1分)
②4(2分)
18. (1)三颈烧瓶(1分)
(2)维持气压稳定,使液体顺利滴下(2分) .
(3)防止H2O2分解和冰醋酸挥发(只答防止H2O2分解也给分,2分) .
(4)6H+ +5H2O2 +2MnO4-=2Mn2+ +8H2O+5O2↑(2分); (2分)
19. (1)增大接触面积,加快碱浸速率(2分)
(2)Al2O3+ 2OH-=2AlO2- +H2O(2分)
(3)Fe2O3(2分);烧杯、玻璃棒和漏斗(2分)
(4)17. 55(2分)
20. (1)NH4+ +H2O NH3·H2O+H+(2分)
(2)4. 95(2分);1.0 ×10-4.95(2分)
(3)①c(H+ )>c(SO42- )>c(NH4+ )>c(OH- )(2分)
②>(1分)
③2: 5(2分)
21.(1)<(1分)
(2)及时移除部分HCl(g)(或其他合理答案,2分)
(3)①0.10825(2分)
②0.2165(2分);54.125(2分)
③(或,2分)
④BD(2分)
同课章节目录
