9.2 溶解度同步练习—2021-2022学年九年级化学人教版下册(word版 含解析)
文档属性
| 名称 | 9.2 溶解度同步练习—2021-2022学年九年级化学人教版下册(word版 含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 200.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-03 15:15:53 | ||
图片预览

文档简介
9.2、溶解度
一、选择题(共16题)
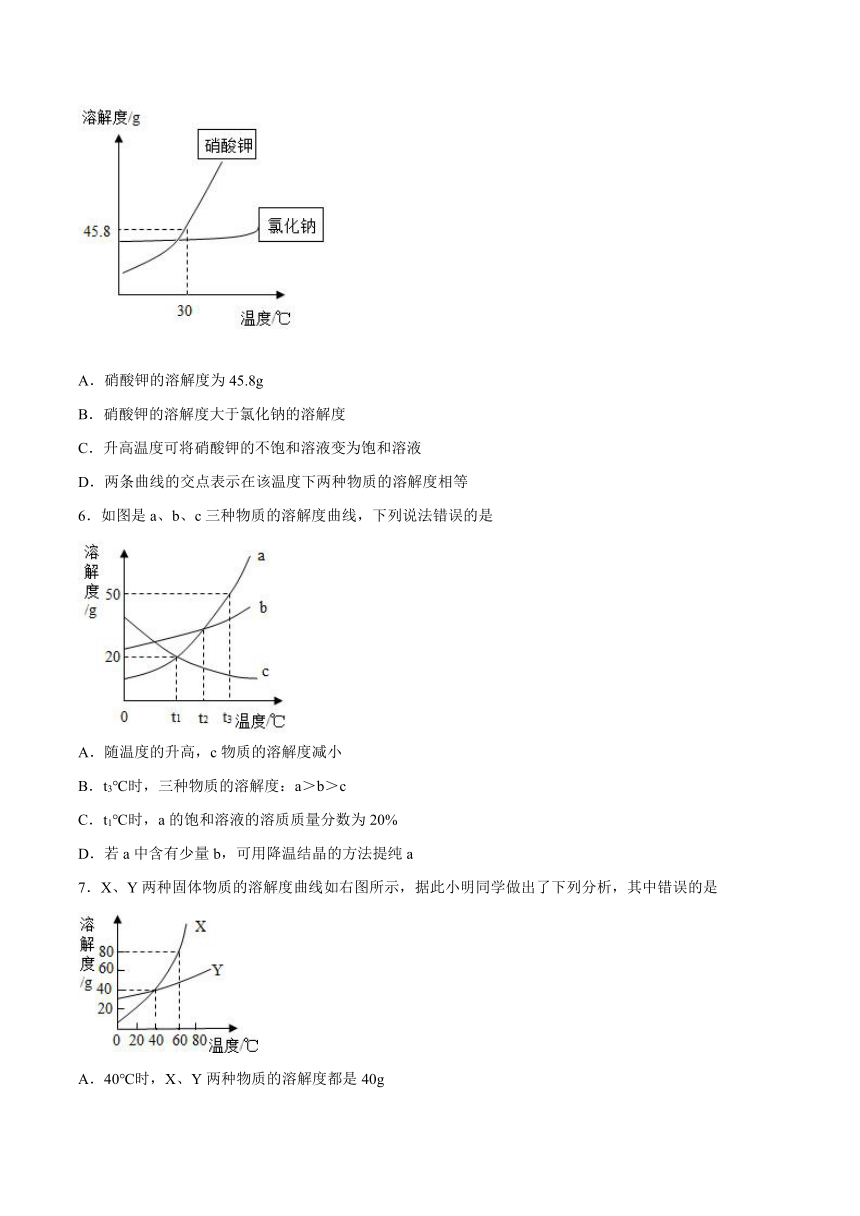
1.A B C三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.t2℃时,A和C的溶解度相等
B.A B C三种物质的溶解度都随温度的升高而增大
C.将B的饱和溶液变为不饱和溶液可采用升高温度的方法
D.t1℃时,三种物质的溶解度由大到小的顺序是A>B>C
2.下列因素与固体物质的溶解度有关的是
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质 ⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
3.下列方法能增加气体物质的溶解度的是
A.升高温度 B.增加溶质
C.加大压强 D.减小压强
4.在一定温度下,往一瓶硝酸钾饱和溶液中加入一些硝酸钾固体并充分搅拌,下列说法中正确的是
A.固体质量减少
B.固体质量增加
C.溶液的质量不变
D.溶液质量增加
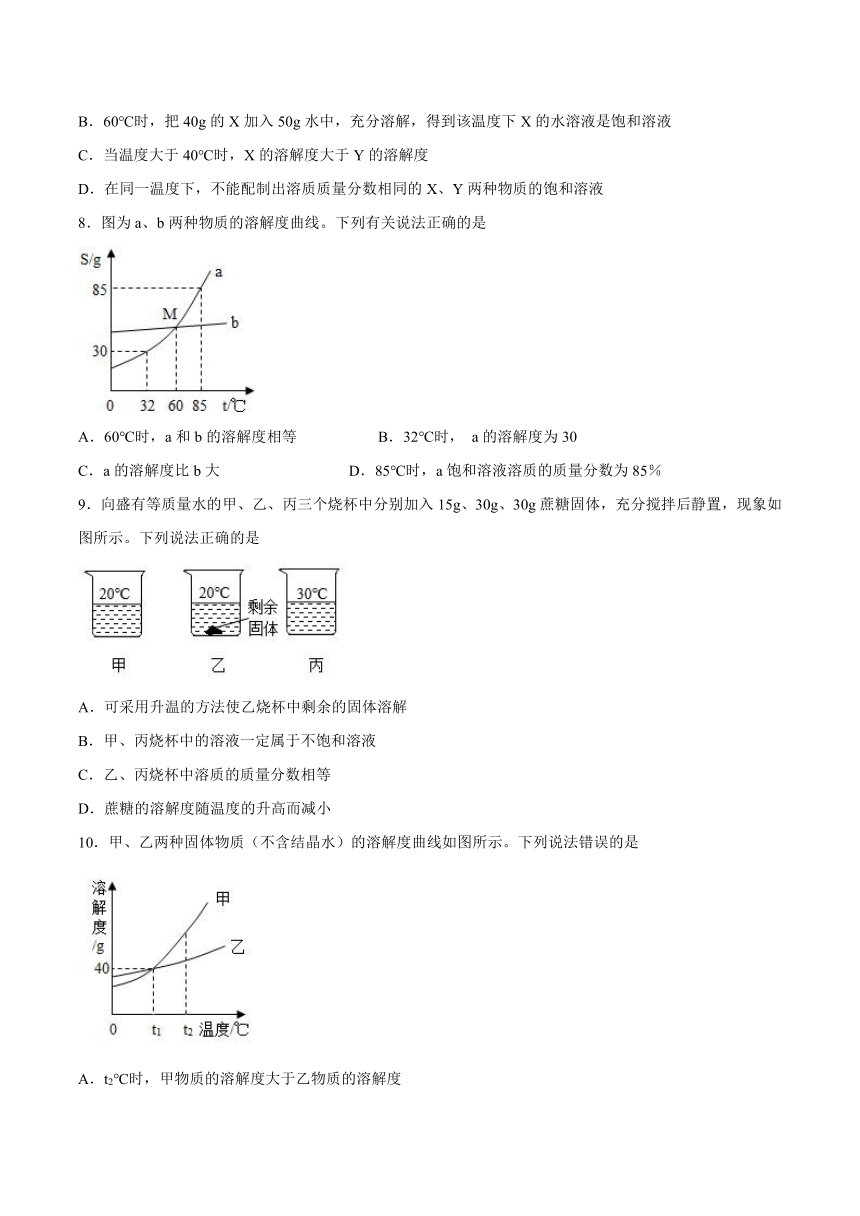
5.结合如图判断,下列说法正确的是
A.硝酸钾的溶解度为45.8g
B.硝酸钾的溶解度大于氯化钠的溶解度
C.升高温度可将硝酸钾的不饱和溶液变为饱和溶液
D.两条曲线的交点表示在该温度下两种物质的溶解度相等
6.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.随温度的升高,c物质的溶解度减小
B.t3℃时,三种物质的溶解度:a>b>c
C.t1℃时,a的饱和溶液的溶质质量分数为20%
D.若a中含有少量b,可用降温结晶的方法提纯a
7.X、Y两种固体物质的溶解度曲线如右图所示,据此小明同学做出了下列分析,其中错误的是
A.40℃时,X、Y两种物质的溶解度都是40g
B.60℃时,把40g的X加入50g水中,充分溶解,得到该温度下X的水溶液是饱和溶液
C.当温度大于40℃时,X的溶解度大于Y的溶解度
D.在同一温度下,不能配制出溶质质量分数相同的X、Y两种物质的饱和溶液
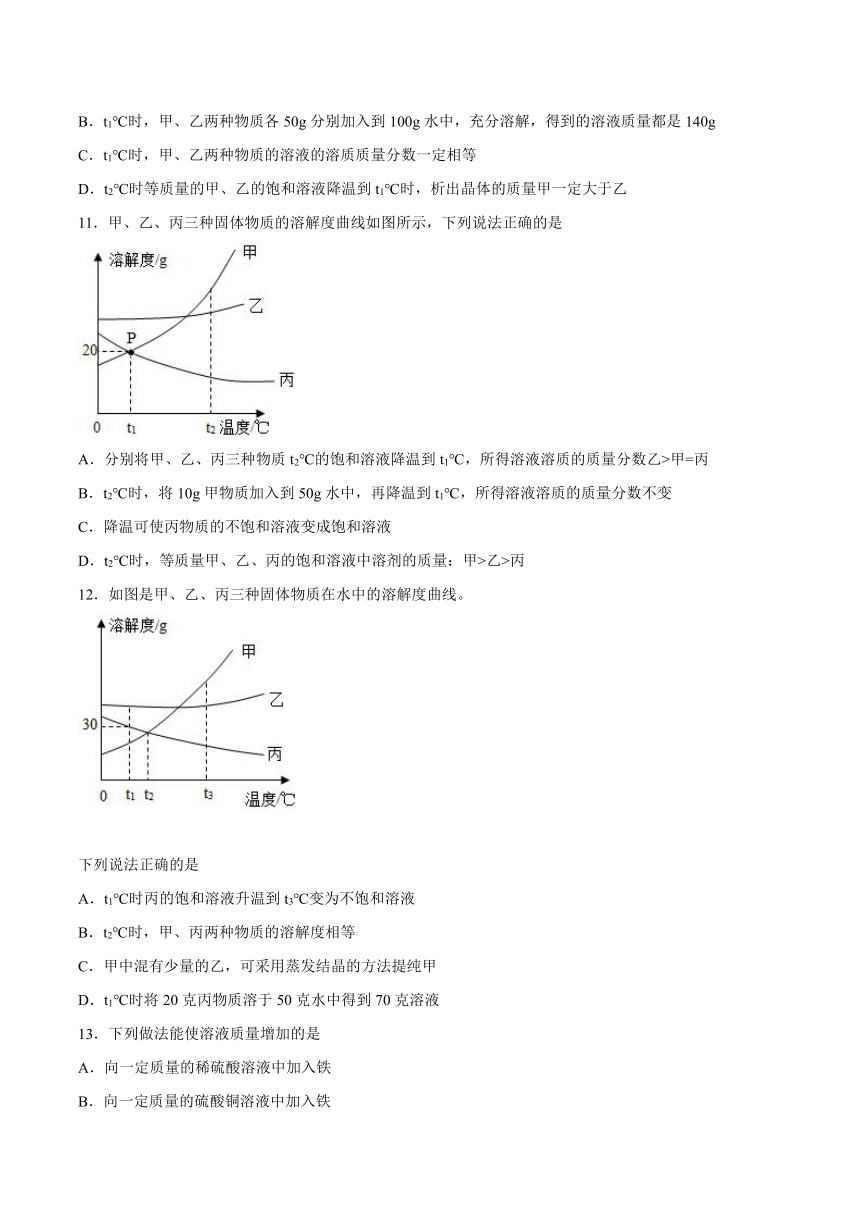
8.图为a、b两种物质的溶解度曲线。下列有关说法正确的是
A.60℃时,a和b的溶解度相等 B.32℃时, a的溶解度为30
C.a的溶解度比b大 D.85℃时,a饱和溶液溶质的质量分数为85%
9.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
10.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法错误的是
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g
C.t1℃时,甲、乙两种物质的溶液的溶质质量分数一定相等
D.t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
11.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数乙>甲=丙
B.t2℃时,将10g甲物质加入到50g水中,再降温到t1℃,所得溶液溶质的质量分数不变
C.降温可使丙物质的不饱和溶液变成饱和溶液
D.t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲>乙>丙
12.如图是甲、乙、丙三种固体物质在水中的溶解度曲线。
下列说法正确的是
A.t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液
B.t2℃时,甲、丙两种物质的溶解度相等
C.甲中混有少量的乙,可采用蒸发结晶的方法提纯甲
D.t1℃时将20克丙物质溶于50克水中得到70克溶液
13.下列做法能使溶液质量增加的是
A.向一定质量的稀硫酸溶液中加入铁
B.向一定质量的硫酸铜溶液中加入铁
C.向一定质量的澄清石灰水溶液中通入二氧化碳
D.向20℃氯化钠的饱和溶液中逐渐加入氯化钠固体
14.下列说法中叙述正确的是
A.汽油洗衣服上的油污是利用了乳化作用
B.将CO2气体通入紫色石蕊试液中,紫色石蕊试液变成红色,说明CO2气体显酸性
C.取等量瓶装矿泉水和某处的井水,分别加入等量、相同浓度的肥皂水,井水中形成大量浮渣,泡沫较少;瓶装矿泉水中没有浮渣,泡沫较多,说明此处井水是硬水,瓶装矿泉水是软水
D.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
15.下列关于溶液的说法正确的是
A.溶液具有均一性和稳定性,所以均一、稳定的液体都是溶液
B.溶质可以是固体,也可以是气体或液体
C.饱和溶液就是不能再溶解任何物质的溶液
D.在相同温度下,饱和溶液一定比不饱和溶液浓
16.现有一瓶接近饱和的硝酸钾溶液,逐渐加入硝酸钾晶体,下图中符合溶液中溶质质量变化的是
A. B. C. D.
二、非选择题(共8题)
17.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)t2℃时,物质a的溶解度与物质___________的相等。
(2)t3℃时,把30g物质a加入到50g水中充分溶解、静置,形成溶液的质量为___________g。
(3)将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b、c溶液中溶质的质量分数由大到小的顺序是:___________。
18.如图是甲、乙两种固体物质的溶解度曲线。
(1)M点的意义为______;
(2)t2℃,将18克甲加入到50克水中,充分溶解后溶液质量为______;
(3)欲使t2℃时乙物质的饱和溶液变为该温度下的不饱和溶液,可采取的方法______。
19.图1所示为甲、乙两种固体物质的溶解度曲线。回答下列问题∶
(1)图1中溶解度随温度升高而减小的物质是___________(填"甲"或"乙")。
(2)图中 P点表示的乙溶液为___________(填"饱和"或"不饱和")溶液。
(3)若甲中混有少量的乙,可采取___________的方法提纯甲物质。
(4)某同学进行了如图2 所示实验,得到相应的溶液 A、B、C,则溶液C 的质量为___________g。
20.水和溶液在生命活动和生活中起着十分重要的作用。K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃
20
30
50
60
80
溶解度/g
K2CO3
110
114
121
126
139
KNO3
31.6
45.8
85.5
110
169
(1)图中能表示KNO3溶解度曲线的是_____(填“甲”或“乙”);
(2)溶解度曲线上M点的含义是____________________________________;
(3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示。下列有关说法中,正确的是_____(填字母序号)。
A.烧杯②中溶液一定是不饱和溶液
B.若使烧杯①中固体全部溶解,溶液中溶质质量分数一定增大
C.将烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能增大
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数可能增大
21.水和溶液是生活中常见的物质。
(1)图B中发生反应的化学方程式为__________, 图 C 中活性炭的作用的是_____。
(2)从微观角度解释图A与图B中所发生的变化的本质不同是___________________。
(3)甲乙两种不含结晶水的固体物质的溶解度曲线如图所示。
①t2℃时,甲、乙两种物质的溶解度比较:甲___________乙(填“>”“<”或“=”)。
②t1℃,将50 g水加入25 g甲物质中,充分搅拌, 可得到_________g 溶液。
③要使接近饱和的乙溶液转化为饱和溶液,可采用__________方法。
22.溶解度可表示物质溶解性的大小
①如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线
Ⅰ.20℃时,甲的溶解度_____(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙_____(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表。
烧杯中的溶质 烧杯中固体的变化
甲 _____
乙 固体逐渐减少至全部溶解
丙 _____
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的_____(填序号)。
A 乙、丙都是饱和溶液 B 所含溶剂质量:乙<丙
C 溶液质量:乙>丙 D 溶质质量分数:乙>丙
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越_____.为增大CO2的溶解度,可采用的一种方法是_____。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度_____(填编号)。
a 小于40℃ b 大于40℃ c 无法确定
23.如图是A、B、C三种常见固体物质的溶解度曲线,请回答下列问题。
(1)在_______℃时,A、C两种物质的溶解度相等。
(2)A、B、C三种物质,溶解度受温度影响最小的是_______。
(3)t1℃时A物质饱和溶液的溶质质量分数为_______。
(4)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是_______(填“升高”或“降低”)温度。
24.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
参考答案
1.A
【详解】
A、t2℃时,A和C的溶解度相等正确,因为该温度下它们有交点,故选项正确;
B、A、B、C三种物质的溶解度都随温度的升高而增大错误,因为B的溶解度随温度的升高而减少,故选项错误;
C、将B的饱和溶液变为不饱和溶液可采用升高温度的方法错误,因为B的溶解度随温度的升高而减少,故选项错误;
D、根据溶解度曲线可知,t1℃时,三种物质的溶解度由大到小的顺序是B>C>A,故选项错误。
故选A。
2.B
【分析】
固体物质的溶解度受温度、溶质种类、溶解种类影响;
【详解】
由分析可知:①溶质的多少、③溶剂的多少、⑤溶液是否饱和、 ⑥是否搅拌不会影响溶解度;
②溶质的性质、④溶剂的性质、⑦温度会影响物质的溶解度;
故选B。
3.C
【详解】
气体物质溶解度的影响因素与温度和压强有关:温度越高,气体的溶解度越小,压强越高,气体的溶解度越大,能增加气体物质的溶解度的是减小压强或者降低温度,故选:C。
4.C
【详解】
在一定温度下,饱和溶液不会再溶解该种溶质,即溶质和溶剂质量都不变,则溶液质量也不会变。
答案:C
5.D
【详解】
A、应该是30℃硝酸钾的溶解度为45.8g,该选项未指明温度,故A错;
B、比较溶解度必须指明温度,故B错;
C、升高温度,硝酸钾的溶解度随温度升高而增大,升高温度不饱和溶液会变得更加不饱和,故C错;
D、两条曲线的交点的含义就是表示在该温度下两种物质的溶解度相等,故D对。
故选D。
6.C
【详解】
A、由图可知,随着温度的升高,c物质的溶解度减小,不符合题意;
B、由图可知,t3℃时,三种物质的溶解度:a>b>c,不符合题意;
C、由图可知,t1℃时,a的溶解度是20g,故该温度下,a的饱和溶液的溶质质量分数为:,符合题意;
D、由图可知,a、b的溶解度随温度的升高而增加,a的溶解度受温度影响较大,b的溶解度受温度影响较小,故若a中含有少量b,可用降温结晶的方法提纯a,不符合题意。
故选C。
7.D
【详解】
A、通过分析溶解度曲线可知,40℃时,X、Y两种物质的溶解度都是40g,故A正确;
B、60℃时,X物质的溶解度是80g,所以把40g的X加入50g水中,充分溶解,得到该温度下X的水溶液是饱和溶液,故B正确;
C、当温度大于40℃时,X的溶解度大于Y的溶解度,故C正确;
D、在40℃时,两种物质的溶解度相等,可以配制出溶质质量分数相同的X、Y两种物质的饱和溶液,故D错误。
故选D。
8.A
【详解】
A、60℃时,a和b的溶解度曲线交于一点,故它们的溶解度相等,故A说法正确;
B、32℃时,a的溶解度为30g,故B说法错误;
C、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于60℃时,a的溶解度大于b的溶解度,故C说法错误;
D、85℃时,a的溶解度为85g,故其饱和溶液溶质的质量分数为85g/(85g+100g)×100%<85%,故D说法错误;
故选A.
9.A
【详解】
A、对比乙丙图可知,升温固体溶解,可采用升温的方法使乙烧杯中剩余的固体溶解,A正确。
B、溶液中没有固体不溶解,可能刚好饱和,也可能不饱和,B错误。
C、乙、丙烧杯中溶剂质量相等,乙部分溶解,丙全部溶解,溶质的质量分数不相等,C错误。
D、对比乙丙图可知,升温固体溶解,蔗糖的溶解度随温度的升高而增大,D错误。
故选:A。
10.C
【详解】
A、由溶解度曲线可知:t2℃时,甲的溶解度大于乙的溶解度,正确;B、t1℃时,甲、乙两种物质的溶解度都是40g,即100g水中最多溶解40g的物质;所以各50g分别加入到100g水中,充分溶解,最多溶解40g,得到的溶液质量都是140g,正确;C、t1℃时,甲、乙两种物质的溶解度都是40g,但溶液是否饱和不确定,无法判断溶质的质量分数,错误;D、t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,甲的溶解度受温度影响比乙大,则析出晶体的质量甲一定大于乙,正确。故选C。
11.B
【详解】
A、分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数乙>甲>丙,乙>甲=丙错误,因为降温后乙的溶解度大于甲,丙的质量分数不变,还是最小,说法错误;
B、t2℃时,将10g甲物质加入到50g水中,再降温到t1℃,所得溶液溶质的质量分数不变正确,因为溶液是中溶质和溶剂都不变,说法正确;
C、降温可使丙物质的不饱和溶液变成饱和溶液错误,因为丙的溶解度随温度的升高而减少,说法错误;
D、t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲<乙<丙,甲>乙>丙错误,说法错误;
故选:B。
12.B
【详解】
A、丙溶解度随着温度升高而减小,t1℃时丙的饱和溶液升温到t3℃仍然是饱和溶液,故选项错误;
B、t2℃时,甲、丙两种物质的溶解度相等,故选项正确;
C、甲溶解度受温度变化影响较大,乙溶解度受温度变化影响较小,甲中混有少量的乙,可采用降温结晶的方法提纯甲,故选项错误;
D、t1℃时丙溶解度是30g,将20g丙物质溶于50g水中,最多能够溶解15g,得到65g溶液,故选项错误。故选B。
13.A
【详解】
A、稀硫酸和铁反应,生成氢气,反应的化学方程式为:Fe + H2SO4 = FeSO4 + H2↑,根据该化学方程式可知,每56份质量的铁可生成2份质量的氢气,逸出气体的质量<铁的质量,所以溶液质量比反应前的溶液质量增加,符合题意;
B、向一定质量的硫酸铜溶液中加入铁,铁与硫酸铜反应,生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4,根据该化学方程式可知,每56份质量的铁可生成64份质量的铜,所以置换出的铜的质量>参与反应铁的质量,故溶液的质量会减少,不符合题意;
C、向一定质量的澄清石灰水溶液中通入二氧化碳,生成碳酸钙沉淀和水,反应的化学方程式为:CO2 +Ca(OH)2 =CaCO3↓+ H2O,根据该化学方程式可知,每44份质量的二氧化碳可生成100份质量的碳酸钙,溶液的质量会减少,不符合题意;
D、向20℃氯化钠的饱和溶液中逐渐加入氯化钠固体,不再溶解,故溶液质量不变,不符合题意。故选A。
14.C
【详解】
A、汽油清洗油污是利用了溶解功能,故错误;
B、CO2气体通入紫色石蕊试液中,紫色石蕊试液变成红色是由于二氧化碳与水反应生成碳酸,碳酸显酸性,石蕊变红,而二氧化碳不显酸性,故错误;
C、检验软硬水用肥皂水,方法是向水中加入肥皂水,如泡沫多浮渣少是软水,反之是硬水,故正确;
D、当将溶液恒温蒸发时,有晶体析出,得到同温下的饱和溶液,溶液的质量分数不变,故错误。故选C。
15.B
【详解】
A、溶液具有均一、稳定的特征,但均一、稳定的物质不一定是溶液,如水是均一的、稳定的液体,但不是混合物,不是溶液,故说法错误。
B、溶质可以是固体,也可以是气体或液体,故说法正确。
C、饱和溶液就是在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,定义中指出的只是这种溶质,并没有限制不能再溶解其他的溶质,故说法错误。
D、对于同一溶质的溶液,在同一温度时,其饱和溶液一定比其不饱和溶液浓,故说法错误。
故选:B。
16.B
【详解】
一定溶质质量分数的不饱和溶液中不断加入硝酸钾固体,硝酸钾会逐渐地被溶解直至溶液达到饱和,溶液中溶质的质量会逐渐的增大至不再发生变化,接近饱和的硝酸钾溶液中原有一部分溶质,故ACD错误;D正确。故选B。
17.b 75 b>a>c
【详解】
(1)由溶解度曲线可知,交点表示在该温度下,两种物质的溶解度相等,所以t2℃时,物质a的溶解度与物质b的溶解度相等;
(2)t3℃时,物质a的溶解度是50g,所以在该温度下,100g水中最多溶解50g,50g水中最多溶解25g,t3℃时,把30g物质a加入到50g水中充分溶解、静置,形成溶液的质量为25g+50g=75g;
(3)将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b的溶解度变小,析出晶体,溶液仍然是饱和溶液,降温后溶质的质量分数大小,取决于t1℃时,a、b的溶解度大小,所以b>a,c物质降温后,溶解度变大,溶液变为不饱和溶液,溶质质量分数不变,因为t1℃时,a的溶解度大于t3℃时c物质的溶解度,所以将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b、c溶液中溶质的质量分数由大到小的顺序是:b>a>c。
18.在t1℃时,甲和乙的溶解度相等 65g 增加溶剂
【详解】
点的意义为:在时,甲和乙的溶解度相等。故答案为:在时,甲和乙的溶解度相等;
,甲的溶解度是30g,则50克水中最多能溶解15g甲,将18克甲加入到50克水中,充分溶解后溶液质量。故答案为:65g;
温度不变,物质的溶解度不变,欲使时乙物质的饱和溶液变为该温度下的不饱和溶液,可采取的方法是增加溶剂。故答案为:增加溶剂。
19.乙 饱和 降温结晶 70
【详解】
(1)根据溶解度曲线图可以得出, 图1中溶解度随温度升高而减小的物是乙;
(2)P点在乙的溶解度曲线的上方,因此表示的乙溶液为饱和溶液;
(3)甲物质的溶解度随温度的升高而增大且受温度影响较大,乙物质的溶解度曲线随温度的升高而减小,若甲中混有少量的乙,可采取降温结晶的方法提纯甲物质;
(4)由图可知,t2℃时,甲物质的溶解度为40g,50g水中最多溶解20g,则形成溶液的质量为50g+20g=70g。
20.甲 t1℃时,碳酸钾和硝酸钾的溶解度相等 D
【详解】
(1)根据表中的溶解度,可知KNO3的溶解度随温度的升高而变化较大,所以图中能表示KNO3溶解度曲线的是甲
(2)M点是交点,表示的含义是:t1℃时,碳酸钾和硝酸钾的溶解度相等
(3)A、烧杯②溶液中没有未溶解的物质,所以可能是不饱和溶液,也可能是饱和溶液,错误;
B、若使烧杯①中固体全部溶解,由于是相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,溶液中溶质质量和溶剂质量都相等,所以溶质质量分数也相等,错误;
C、将烧杯②中溶液降温至20℃时,溶液有可能会析出晶体,也有可能没有晶体析出,所以溶液中溶质质量分数可能变小,也可能不变,错误;
D、将烧杯①中的溶液变为不饱和溶液,可以升温,此时溶液中溶质质量分数增大,也可以加水,此时溶液中溶质质量分数变小,所以溶液中溶质质量分数可能增大,正确,故选D。
21.2H2O 2H2↑+O2↑ 吸附作用 A只是分子间距离增大分子没有改变,B是原子重新组合形成新的分子 = 60 加入少量的固体乙物质或蒸发掉少量的水
【详解】
本题考查了本考点考查了水的通电实验、活性炭的吸附作用、溶解度曲线及其应用。
(1)图B中发生的是水通电时生成氢气和氧气,反应的化学方程式为2H2O 2H2↑+O2↑ ; 图C中活性炭的作用的是吸附作用;
(2)从微观角度解释图A与图B中所发生的变化的本质不同是A只是分子间距离增大分子没有改变,B是原子重新组合形成新的分子;
(3)①t2℃时,甲、乙两种物质的溶解度比较:甲=乙;
②t1℃,甲的溶解度是20g,将50 g水加入25 g甲中最多溶解10g的甲,充分搅拌, 可得到60g 溶液;
③要使接近饱和的乙溶液转化为饱和溶液,可采用加入少量的固体乙物质或蒸发掉少量的水方法。
22.< 能 固体逐渐减少,至全部溶解 固体逐渐增加 B、D 小 降温(或加压) b
【详解】
①
Ⅰ.20℃时,甲的溶解度小于乙的溶解度;故答案为<。
Ⅱ.40℃时,乙和丙能形成溶质质量分数相同的饱和溶液,因为该温度下乙和丙的溶解度相等;故答案为能。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃时,甲中固体逐渐减少,至全部溶解;乙中固体逐渐减少至全部溶解,丙中固体逐渐增加,因为甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;故填:
烧杯中的溶质 烧杯中固体的变化
甲 固体逐渐减少,至全部溶解
乙 固体逐渐减少至全部溶解
丙 固体逐渐增加
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的是:所含溶剂质量:乙<丙;溶质质量分数:乙>丙;故填:BD。
②
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越小。为增大CO2的溶解度,可采用的一种方法是降温(或加压);故填:小,降温(或加压)。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度是大于40℃;故填:b。
23.t1 B 37.5% 降低
【分析】
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液和不饱和溶液相互转化的方法。
【详解】
(1)通过分析溶解度曲线可知,在t1℃时,A、C两种物质的溶解度相等.
(2)A、B、C三种物质,B物质的溶解度曲线最平缓,所以溶解度受温度影响最小的是B;
(3)t1℃时,A物质的溶解度是60g,所以饱和溶液的溶质质量分数为=37.5%;
(4)A物质的溶解度随温度的降低而减小,所以要使A物质的不饱和溶液变为饱和溶液,可采用的方法是降低温度。
故答案为:(1)t1;(2)B;(3)37.5%;(4)降低。
24.有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
【详解】
①甲方案:电解水生成氢气和氧气,玻璃管内的现象是有大量气泡,液面下降;b管内产生的气体较多是氢气,a管内产生的气体较少时氧气;检验a管内产生气体的方法是将带火星的木条伸到尖嘴导管处,余烬木条复燃。生成气体的体积比是V(H2):V (O2)=2:1,根据质量守恒定律可以得出水是由氢、氧元素组成的结论;Ⅰ、16g氧气的物质的量为,设参加反应的水的物质的量为mol,
2H2O2H2↑+O2↑
2 1
0.5mol
,解得=1mol;Ⅱ、设电解前氢氧化钠溶液的质量为yg,根据反应前后溶质的质量不变得,解得y=180g;乙方案:该方案的实验目的是用化合的方法测定水的组成,氢气在氧气中剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠,反应的化学方程式是:2H2+O22H2O;该实验不能达到实验目的,因为用排水法收集氧气,会带有大量水分;②Ⅰ、从表中数据可知,以上两种物质溶解度的变化受温度影响较小的是氯化钠;Ⅱ、40℃时,KNO3溶解度为64.0g,故在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是32g+50g=82g,60℃时,KNO3溶解度为110.0g,升温至60℃,形成的溶液为不饱和溶液,该溶液的溶质质量分数为;Ⅲ、根据表中数据,设此时100g水中最多能溶解硝酸钾的质量为,,解得=110.0g,所以60.0g水能够溶解66.0g KNO3的温度范围是:t≥60℃;Ⅳ、由于硝酸钾的溶解度受温度的影响比较大,氯化钠的溶解度随温度的影响不大,可以采用冷却热饱和溶液的方法进行提纯,所以固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为:溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干;Ⅴ、气体的溶解度随着压强的增大而增大,随着温度的升高而降低,所以P1
一、选择题(共16题)
1.A B C三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.t2℃时,A和C的溶解度相等
B.A B C三种物质的溶解度都随温度的升高而增大
C.将B的饱和溶液变为不饱和溶液可采用升高温度的方法
D.t1℃时,三种物质的溶解度由大到小的顺序是A>B>C
2.下列因素与固体物质的溶解度有关的是
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质 ⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
3.下列方法能增加气体物质的溶解度的是
A.升高温度 B.增加溶质
C.加大压强 D.减小压强
4.在一定温度下,往一瓶硝酸钾饱和溶液中加入一些硝酸钾固体并充分搅拌,下列说法中正确的是
A.固体质量减少
B.固体质量增加
C.溶液的质量不变
D.溶液质量增加
5.结合如图判断,下列说法正确的是
A.硝酸钾的溶解度为45.8g
B.硝酸钾的溶解度大于氯化钠的溶解度
C.升高温度可将硝酸钾的不饱和溶液变为饱和溶液
D.两条曲线的交点表示在该温度下两种物质的溶解度相等
6.如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
A.随温度的升高,c物质的溶解度减小
B.t3℃时,三种物质的溶解度:a>b>c
C.t1℃时,a的饱和溶液的溶质质量分数为20%
D.若a中含有少量b,可用降温结晶的方法提纯a
7.X、Y两种固体物质的溶解度曲线如右图所示,据此小明同学做出了下列分析,其中错误的是
A.40℃时,X、Y两种物质的溶解度都是40g
B.60℃时,把40g的X加入50g水中,充分溶解,得到该温度下X的水溶液是饱和溶液
C.当温度大于40℃时,X的溶解度大于Y的溶解度
D.在同一温度下,不能配制出溶质质量分数相同的X、Y两种物质的饱和溶液
8.图为a、b两种物质的溶解度曲线。下列有关说法正确的是
A.60℃时,a和b的溶解度相等 B.32℃时, a的溶解度为30
C.a的溶解度比b大 D.85℃时,a饱和溶液溶质的质量分数为85%
9.向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
10.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法错误的是
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g
C.t1℃时,甲、乙两种物质的溶液的溶质质量分数一定相等
D.t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
11.甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是
A.分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数乙>甲=丙
B.t2℃时,将10g甲物质加入到50g水中,再降温到t1℃,所得溶液溶质的质量分数不变
C.降温可使丙物质的不饱和溶液变成饱和溶液
D.t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲>乙>丙
12.如图是甲、乙、丙三种固体物质在水中的溶解度曲线。
下列说法正确的是
A.t1℃时丙的饱和溶液升温到t3℃变为不饱和溶液
B.t2℃时,甲、丙两种物质的溶解度相等
C.甲中混有少量的乙,可采用蒸发结晶的方法提纯甲
D.t1℃时将20克丙物质溶于50克水中得到70克溶液
13.下列做法能使溶液质量增加的是
A.向一定质量的稀硫酸溶液中加入铁
B.向一定质量的硫酸铜溶液中加入铁
C.向一定质量的澄清石灰水溶液中通入二氧化碳
D.向20℃氯化钠的饱和溶液中逐渐加入氯化钠固体
14.下列说法中叙述正确的是
A.汽油洗衣服上的油污是利用了乳化作用
B.将CO2气体通入紫色石蕊试液中,紫色石蕊试液变成红色,说明CO2气体显酸性
C.取等量瓶装矿泉水和某处的井水,分别加入等量、相同浓度的肥皂水,井水中形成大量浮渣,泡沫较少;瓶装矿泉水中没有浮渣,泡沫较多,说明此处井水是硬水,瓶装矿泉水是软水
D.溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小
15.下列关于溶液的说法正确的是
A.溶液具有均一性和稳定性,所以均一、稳定的液体都是溶液
B.溶质可以是固体,也可以是气体或液体
C.饱和溶液就是不能再溶解任何物质的溶液
D.在相同温度下,饱和溶液一定比不饱和溶液浓
16.现有一瓶接近饱和的硝酸钾溶液,逐渐加入硝酸钾晶体,下图中符合溶液中溶质质量变化的是
A. B. C. D.
二、非选择题(共8题)
17.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)t2℃时,物质a的溶解度与物质___________的相等。
(2)t3℃时,把30g物质a加入到50g水中充分溶解、静置,形成溶液的质量为___________g。
(3)将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b、c溶液中溶质的质量分数由大到小的顺序是:___________。
18.如图是甲、乙两种固体物质的溶解度曲线。
(1)M点的意义为______;
(2)t2℃,将18克甲加入到50克水中,充分溶解后溶液质量为______;
(3)欲使t2℃时乙物质的饱和溶液变为该温度下的不饱和溶液,可采取的方法______。
19.图1所示为甲、乙两种固体物质的溶解度曲线。回答下列问题∶
(1)图1中溶解度随温度升高而减小的物质是___________(填"甲"或"乙")。
(2)图中 P点表示的乙溶液为___________(填"饱和"或"不饱和")溶液。
(3)若甲中混有少量的乙,可采取___________的方法提纯甲物质。
(4)某同学进行了如图2 所示实验,得到相应的溶液 A、B、C,则溶液C 的质量为___________g。
20.水和溶液在生命活动和生活中起着十分重要的作用。K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃
20
30
50
60
80
溶解度/g
K2CO3
110
114
121
126
139
KNO3
31.6
45.8
85.5
110
169
(1)图中能表示KNO3溶解度曲线的是_____(填“甲”或“乙”);
(2)溶解度曲线上M点的含义是____________________________________;
(3)40℃时,向两个分别盛有相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,充分溶解后,恢复至40℃,其结果如图2所示。下列有关说法中,正确的是_____(填字母序号)。
A.烧杯②中溶液一定是不饱和溶液
B.若使烧杯①中固体全部溶解,溶液中溶质质量分数一定增大
C.将烧杯②中溶液降温至20℃时,溶液中溶质质量分数可能增大
D.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数可能增大
21.水和溶液是生活中常见的物质。
(1)图B中发生反应的化学方程式为__________, 图 C 中活性炭的作用的是_____。
(2)从微观角度解释图A与图B中所发生的变化的本质不同是___________________。
(3)甲乙两种不含结晶水的固体物质的溶解度曲线如图所示。
①t2℃时,甲、乙两种物质的溶解度比较:甲___________乙(填“>”“<”或“=”)。
②t1℃,将50 g水加入25 g甲物质中,充分搅拌, 可得到_________g 溶液。
③要使接近饱和的乙溶液转化为饱和溶液,可采用__________方法。
22.溶解度可表示物质溶解性的大小
①如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线
Ⅰ.20℃时,甲的溶解度_____(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙_____(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表。
烧杯中的溶质 烧杯中固体的变化
甲 _____
乙 固体逐渐减少至全部溶解
丙 _____
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的_____(填序号)。
A 乙、丙都是饱和溶液 B 所含溶剂质量:乙<丙
C 溶液质量:乙>丙 D 溶质质量分数:乙>丙
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越_____.为增大CO2的溶解度,可采用的一种方法是_____。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度_____(填编号)。
a 小于40℃ b 大于40℃ c 无法确定
23.如图是A、B、C三种常见固体物质的溶解度曲线,请回答下列问题。
(1)在_______℃时,A、C两种物质的溶解度相等。
(2)A、B、C三种物质,溶解度受温度影响最小的是_______。
(3)t1℃时A物质饱和溶液的溶质质量分数为_______。
(4)要使A物质的不饱和溶液变为饱和溶液,可采用的方法是_______(填“升高”或“降低”)温度。
24.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是____________;b管内生成的气体是______________;检验a管内产生气体的方法是___________。生成气体的体积比是___________,该实验说明水是由氢、氧元素组成的理论依据是__________;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量____________mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为________________g。
乙方案:该方案的实验目的是____________________,氢气在氧气中燃烧,反应的化学方程式是_________________,现象__________;该实验能否达到实验目的,并阐述理由___________。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是___________。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是_______g。若升温至60℃,形成的溶液为________(填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为_______。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是___________。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为________。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是________。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
参考答案
1.A
【详解】
A、t2℃时,A和C的溶解度相等正确,因为该温度下它们有交点,故选项正确;
B、A、B、C三种物质的溶解度都随温度的升高而增大错误,因为B的溶解度随温度的升高而减少,故选项错误;
C、将B的饱和溶液变为不饱和溶液可采用升高温度的方法错误,因为B的溶解度随温度的升高而减少,故选项错误;
D、根据溶解度曲线可知,t1℃时,三种物质的溶解度由大到小的顺序是B>C>A,故选项错误。
故选A。
2.B
【分析】
固体物质的溶解度受温度、溶质种类、溶解种类影响;
【详解】
由分析可知:①溶质的多少、③溶剂的多少、⑤溶液是否饱和、 ⑥是否搅拌不会影响溶解度;
②溶质的性质、④溶剂的性质、⑦温度会影响物质的溶解度;
故选B。
3.C
【详解】
气体物质溶解度的影响因素与温度和压强有关:温度越高,气体的溶解度越小,压强越高,气体的溶解度越大,能增加气体物质的溶解度的是减小压强或者降低温度,故选:C。
4.C
【详解】
在一定温度下,饱和溶液不会再溶解该种溶质,即溶质和溶剂质量都不变,则溶液质量也不会变。
答案:C
5.D
【详解】
A、应该是30℃硝酸钾的溶解度为45.8g,该选项未指明温度,故A错;
B、比较溶解度必须指明温度,故B错;
C、升高温度,硝酸钾的溶解度随温度升高而增大,升高温度不饱和溶液会变得更加不饱和,故C错;
D、两条曲线的交点的含义就是表示在该温度下两种物质的溶解度相等,故D对。
故选D。
6.C
【详解】
A、由图可知,随着温度的升高,c物质的溶解度减小,不符合题意;
B、由图可知,t3℃时,三种物质的溶解度:a>b>c,不符合题意;
C、由图可知,t1℃时,a的溶解度是20g,故该温度下,a的饱和溶液的溶质质量分数为:,符合题意;
D、由图可知,a、b的溶解度随温度的升高而增加,a的溶解度受温度影响较大,b的溶解度受温度影响较小,故若a中含有少量b,可用降温结晶的方法提纯a,不符合题意。
故选C。
7.D
【详解】
A、通过分析溶解度曲线可知,40℃时,X、Y两种物质的溶解度都是40g,故A正确;
B、60℃时,X物质的溶解度是80g,所以把40g的X加入50g水中,充分溶解,得到该温度下X的水溶液是饱和溶液,故B正确;
C、当温度大于40℃时,X的溶解度大于Y的溶解度,故C正确;
D、在40℃时,两种物质的溶解度相等,可以配制出溶质质量分数相同的X、Y两种物质的饱和溶液,故D错误。
故选D。
8.A
【详解】
A、60℃时,a和b的溶解度曲线交于一点,故它们的溶解度相等,故A说法正确;
B、32℃时,a的溶解度为30g,故B说法错误;
C、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于60℃时,a的溶解度大于b的溶解度,故C说法错误;
D、85℃时,a的溶解度为85g,故其饱和溶液溶质的质量分数为85g/(85g+100g)×100%<85%,故D说法错误;
故选A.
9.A
【详解】
A、对比乙丙图可知,升温固体溶解,可采用升温的方法使乙烧杯中剩余的固体溶解,A正确。
B、溶液中没有固体不溶解,可能刚好饱和,也可能不饱和,B错误。
C、乙、丙烧杯中溶剂质量相等,乙部分溶解,丙全部溶解,溶质的质量分数不相等,C错误。
D、对比乙丙图可知,升温固体溶解,蔗糖的溶解度随温度的升高而增大,D错误。
故选:A。
10.C
【详解】
A、由溶解度曲线可知:t2℃时,甲的溶解度大于乙的溶解度,正确;B、t1℃时,甲、乙两种物质的溶解度都是40g,即100g水中最多溶解40g的物质;所以各50g分别加入到100g水中,充分溶解,最多溶解40g,得到的溶液质量都是140g,正确;C、t1℃时,甲、乙两种物质的溶解度都是40g,但溶液是否饱和不确定,无法判断溶质的质量分数,错误;D、t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,甲的溶解度受温度影响比乙大,则析出晶体的质量甲一定大于乙,正确。故选C。
11.B
【详解】
A、分别将甲、乙、丙三种物质t2℃的饱和溶液降温到t1℃,所得溶液溶质的质量分数乙>甲>丙,乙>甲=丙错误,因为降温后乙的溶解度大于甲,丙的质量分数不变,还是最小,说法错误;
B、t2℃时,将10g甲物质加入到50g水中,再降温到t1℃,所得溶液溶质的质量分数不变正确,因为溶液是中溶质和溶剂都不变,说法正确;
C、降温可使丙物质的不饱和溶液变成饱和溶液错误,因为丙的溶解度随温度的升高而减少,说法错误;
D、t2℃时,等质量甲、乙、丙的饱和溶液中溶剂的质量:甲<乙<丙,甲>乙>丙错误,说法错误;
故选:B。
12.B
【详解】
A、丙溶解度随着温度升高而减小,t1℃时丙的饱和溶液升温到t3℃仍然是饱和溶液,故选项错误;
B、t2℃时,甲、丙两种物质的溶解度相等,故选项正确;
C、甲溶解度受温度变化影响较大,乙溶解度受温度变化影响较小,甲中混有少量的乙,可采用降温结晶的方法提纯甲,故选项错误;
D、t1℃时丙溶解度是30g,将20g丙物质溶于50g水中,最多能够溶解15g,得到65g溶液,故选项错误。故选B。
13.A
【详解】
A、稀硫酸和铁反应,生成氢气,反应的化学方程式为:Fe + H2SO4 = FeSO4 + H2↑,根据该化学方程式可知,每56份质量的铁可生成2份质量的氢气,逸出气体的质量<铁的质量,所以溶液质量比反应前的溶液质量增加,符合题意;
B、向一定质量的硫酸铜溶液中加入铁,铁与硫酸铜反应,生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4,根据该化学方程式可知,每56份质量的铁可生成64份质量的铜,所以置换出的铜的质量>参与反应铁的质量,故溶液的质量会减少,不符合题意;
C、向一定质量的澄清石灰水溶液中通入二氧化碳,生成碳酸钙沉淀和水,反应的化学方程式为:CO2 +Ca(OH)2 =CaCO3↓+ H2O,根据该化学方程式可知,每44份质量的二氧化碳可生成100份质量的碳酸钙,溶液的质量会减少,不符合题意;
D、向20℃氯化钠的饱和溶液中逐渐加入氯化钠固体,不再溶解,故溶液质量不变,不符合题意。故选A。
14.C
【详解】
A、汽油清洗油污是利用了溶解功能,故错误;
B、CO2气体通入紫色石蕊试液中,紫色石蕊试液变成红色是由于二氧化碳与水反应生成碳酸,碳酸显酸性,石蕊变红,而二氧化碳不显酸性,故错误;
C、检验软硬水用肥皂水,方法是向水中加入肥皂水,如泡沫多浮渣少是软水,反之是硬水,故正确;
D、当将溶液恒温蒸发时,有晶体析出,得到同温下的饱和溶液,溶液的质量分数不变,故错误。故选C。
15.B
【详解】
A、溶液具有均一、稳定的特征,但均一、稳定的物质不一定是溶液,如水是均一的、稳定的液体,但不是混合物,不是溶液,故说法错误。
B、溶质可以是固体,也可以是气体或液体,故说法正确。
C、饱和溶液就是在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,定义中指出的只是这种溶质,并没有限制不能再溶解其他的溶质,故说法错误。
D、对于同一溶质的溶液,在同一温度时,其饱和溶液一定比其不饱和溶液浓,故说法错误。
故选:B。
16.B
【详解】
一定溶质质量分数的不饱和溶液中不断加入硝酸钾固体,硝酸钾会逐渐地被溶解直至溶液达到饱和,溶液中溶质的质量会逐渐的增大至不再发生变化,接近饱和的硝酸钾溶液中原有一部分溶质,故ACD错误;D正确。故选B。
17.b 75 b>a>c
【详解】
(1)由溶解度曲线可知,交点表示在该温度下,两种物质的溶解度相等,所以t2℃时,物质a的溶解度与物质b的溶解度相等;
(2)t3℃时,物质a的溶解度是50g,所以在该温度下,100g水中最多溶解50g,50g水中最多溶解25g,t3℃时,把30g物质a加入到50g水中充分溶解、静置,形成溶液的质量为25g+50g=75g;
(3)将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b的溶解度变小,析出晶体,溶液仍然是饱和溶液,降温后溶质的质量分数大小,取决于t1℃时,a、b的溶解度大小,所以b>a,c物质降温后,溶解度变大,溶液变为不饱和溶液,溶质质量分数不变,因为t1℃时,a的溶解度大于t3℃时c物质的溶解度,所以将t3℃时a、b、c的饱和溶液降温到t1℃时,a、b、c溶液中溶质的质量分数由大到小的顺序是:b>a>c。
18.在t1℃时,甲和乙的溶解度相等 65g 增加溶剂
【详解】
点的意义为:在时,甲和乙的溶解度相等。故答案为:在时,甲和乙的溶解度相等;
,甲的溶解度是30g,则50克水中最多能溶解15g甲,将18克甲加入到50克水中,充分溶解后溶液质量。故答案为:65g;
温度不变,物质的溶解度不变,欲使时乙物质的饱和溶液变为该温度下的不饱和溶液,可采取的方法是增加溶剂。故答案为:增加溶剂。
19.乙 饱和 降温结晶 70
【详解】
(1)根据溶解度曲线图可以得出, 图1中溶解度随温度升高而减小的物是乙;
(2)P点在乙的溶解度曲线的上方,因此表示的乙溶液为饱和溶液;
(3)甲物质的溶解度随温度的升高而增大且受温度影响较大,乙物质的溶解度曲线随温度的升高而减小,若甲中混有少量的乙,可采取降温结晶的方法提纯甲物质;
(4)由图可知,t2℃时,甲物质的溶解度为40g,50g水中最多溶解20g,则形成溶液的质量为50g+20g=70g。
20.甲 t1℃时,碳酸钾和硝酸钾的溶解度相等 D
【详解】
(1)根据表中的溶解度,可知KNO3的溶解度随温度的升高而变化较大,所以图中能表示KNO3溶解度曲线的是甲
(2)M点是交点,表示的含义是:t1℃时,碳酸钾和硝酸钾的溶解度相等
(3)A、烧杯②溶液中没有未溶解的物质,所以可能是不饱和溶液,也可能是饱和溶液,错误;
B、若使烧杯①中固体全部溶解,由于是相同质量的硝酸钾和碳酸钾的烧杯中,各加入100g水,溶液中溶质质量和溶剂质量都相等,所以溶质质量分数也相等,错误;
C、将烧杯②中溶液降温至20℃时,溶液有可能会析出晶体,也有可能没有晶体析出,所以溶液中溶质质量分数可能变小,也可能不变,错误;
D、将烧杯①中的溶液变为不饱和溶液,可以升温,此时溶液中溶质质量分数增大,也可以加水,此时溶液中溶质质量分数变小,所以溶液中溶质质量分数可能增大,正确,故选D。
21.2H2O 2H2↑+O2↑ 吸附作用 A只是分子间距离增大分子没有改变,B是原子重新组合形成新的分子 = 60 加入少量的固体乙物质或蒸发掉少量的水
【详解】
本题考查了本考点考查了水的通电实验、活性炭的吸附作用、溶解度曲线及其应用。
(1)图B中发生的是水通电时生成氢气和氧气,反应的化学方程式为2H2O 2H2↑+O2↑ ; 图C中活性炭的作用的是吸附作用;
(2)从微观角度解释图A与图B中所发生的变化的本质不同是A只是分子间距离增大分子没有改变,B是原子重新组合形成新的分子;
(3)①t2℃时,甲、乙两种物质的溶解度比较:甲=乙;
②t1℃,甲的溶解度是20g,将50 g水加入25 g甲中最多溶解10g的甲,充分搅拌, 可得到60g 溶液;
③要使接近饱和的乙溶液转化为饱和溶液,可采用加入少量的固体乙物质或蒸发掉少量的水方法。
22.< 能 固体逐渐减少,至全部溶解 固体逐渐增加 B、D 小 降温(或加压) b
【详解】
①
Ⅰ.20℃时,甲的溶解度小于乙的溶解度;故答案为<。
Ⅱ.40℃时,乙和丙能形成溶质质量分数相同的饱和溶液,因为该温度下乙和丙的溶解度相等;故答案为能。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃时,甲中固体逐渐减少,至全部溶解;乙中固体逐渐减少至全部溶解,丙中固体逐渐增加,因为甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;故填:
烧杯中的溶质 烧杯中固体的变化
甲 固体逐渐减少,至全部溶解
乙 固体逐渐减少至全部溶解
丙 固体逐渐增加
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的是:所含溶剂质量:乙<丙;溶质质量分数:乙>丙;故填:BD。
②
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越小。为增大CO2的溶解度,可采用的一种方法是降温(或加压);故填:小,降温(或加压)。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度是大于40℃;故填:b。
23.t1 B 37.5% 降低
【分析】
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断饱和溶液和不饱和溶液相互转化的方法。
【详解】
(1)通过分析溶解度曲线可知,在t1℃时,A、C两种物质的溶解度相等.
(2)A、B、C三种物质,B物质的溶解度曲线最平缓,所以溶解度受温度影响最小的是B;
(3)t1℃时,A物质的溶解度是60g,所以饱和溶液的溶质质量分数为=37.5%;
(4)A物质的溶解度随温度的降低而减小,所以要使A物质的不饱和溶液变为饱和溶液,可采用的方法是降低温度。
故答案为:(1)t1;(2)B;(3)37.5%;(4)降低。
24.有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
【详解】
①甲方案:电解水生成氢气和氧气,玻璃管内的现象是有大量气泡,液面下降;b管内产生的气体较多是氢气,a管内产生的气体较少时氧气;检验a管内产生气体的方法是将带火星的木条伸到尖嘴导管处,余烬木条复燃。生成气体的体积比是V(H2):V (O2)=2:1,根据质量守恒定律可以得出水是由氢、氧元素组成的结论;Ⅰ、16g氧气的物质的量为,设参加反应的水的物质的量为mol,
2H2O2H2↑+O2↑
2 1
0.5mol
,解得=1mol;Ⅱ、设电解前氢氧化钠溶液的质量为yg,根据反应前后溶质的质量不变得,解得y=180g;乙方案:该方案的实验目的是用化合的方法测定水的组成,氢气在氧气中剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠,反应的化学方程式是:2H2+O22H2O;该实验不能达到实验目的,因为用排水法收集氧气,会带有大量水分;②Ⅰ、从表中数据可知,以上两种物质溶解度的变化受温度影响较小的是氯化钠;Ⅱ、40℃时,KNO3溶解度为64.0g,故在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是32g+50g=82g,60℃时,KNO3溶解度为110.0g,升温至60℃,形成的溶液为不饱和溶液,该溶液的溶质质量分数为;Ⅲ、根据表中数据,设此时100g水中最多能溶解硝酸钾的质量为,,解得=110.0g,所以60.0g水能够溶解66.0g KNO3的温度范围是:t≥60℃;Ⅳ、由于硝酸钾的溶解度受温度的影响比较大,氯化钠的溶解度随温度的影响不大,可以采用冷却热饱和溶液的方法进行提纯,所以固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为:溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干;Ⅴ、气体的溶解度随着压强的增大而增大,随着温度的升高而降低,所以P1
同课章节目录
