人教版化学九年级下册 第八单元金属及金属材料 单元精讲课件(24张PPT)
文档属性
| 名称 | 人教版化学九年级下册 第八单元金属及金属材料 单元精讲课件(24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-05 10:30:49 | ||
图片预览








文档简介
(共24张PPT)
第八单元金属及金属材料
单元复习
人教版 九年级下
第八单元 金属及金属材料
单元复习
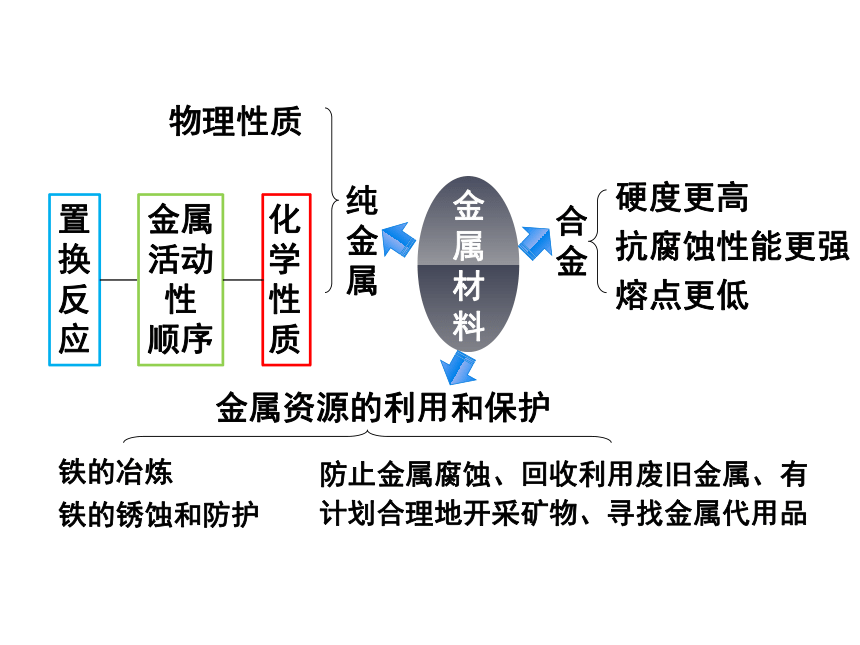
纯
金
属
物理性质
化学
性质
金属
活动性
顺序
合金
硬度更高
抗腐蚀性能更强
熔点更低
金属资源的利用和保护
铁的冶炼
防止金属腐蚀、回收利用废旧金属、有计划合理地开采矿物、寻找金属代用品
金
属
材
料
置换
反应
铁的锈蚀和防护
1.金属的物理性质
金属材料:包括 及 。
纯金属
合金
(1)常温下一般为 ( 是液态)
固态
汞
(2)大多数呈银白色(铜为 ,金为 )
紫红
黄色
(3)有良好的 、 、 。
导电性
导热性
延展性
2.产量最高,使用最广的金属是 ,铝抗腐蚀性
好的原因是: 。
铁
铝的表面有一层致密的氧化膜
考点一 金属材料及其用途
考点一 金属材料及其用途
2.合金
(1)定义:在金属中加热熔合某些金属或非金属形成的具有____________的物质。
金属特征
合金的特点:是一种 物,合金中至少
含 种金属,也可以含非金属)
合金的用途比纯金属广泛。
注意
混合
1
合金的优势
硬度比其组分金属大 (纯铁较软―→生铁、锰钢)
抗腐蚀性能比其组分金属好 (铁易生锈―→不锈钢)
熔点比其组分金属低 (焊锡以及保险丝:武德合金)
(2)生铁和钢都是 合金,生铁的含碳量为
,钢的含碳量 。
铁
2%~4.3%
0.03%~2%
(3)钛合金与人体有很好的“相容性”,因此可用
来制造人造骨。
金属的性质在很大程度上决定了金属的用途,但这不是唯一决定的因素,还需考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
3.金属的用途
1、下面是金属的用途和性质,请把用途和性质相对应的连接起来:
金属铜用来作电线 延展性
铁用来作铁锅 导电性
铝制成铝薄作食品包装 导热性
金属活动性顺序
K Ca Na Fe Sn Pb (H) Pt Au
Mg
Al
Zn
Cu
Hg
Ag
金属活动性由强到弱
考点二 金属的化学性质
氢前可换氢 前金换后金
(1)金属位置越前,活动性越 。
强
(2)位于前面的金属能置换出盐酸、硫酸中的
(注:酸指的是稀盐酸和稀硫酸)
氢
(3)位于 的金属能把位于 的金属
从它们的盐溶液中置换出来(钾钙钠除外)
前面
后面
许多金属都能与氧气反应,但反应的难易和剧烈程度度不同。
(1)镁、铝在常温下就能与氧气反应;
(2)铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
(3)金在高温下也不与氧气反应(真金不怕火炼)。
1.金属与氧气反应
4Al+3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
金属+氧气→金属氧化物
金属+酸→盐+氢气 (都是 反应)
锌和稀盐酸:_____________________________
Zn+2HCI ZnCI2+H2
镁和稀硫酸:_____________________________
铁和稀硫酸:_____________________________
铝和稀盐酸:_____________________________
置换
反应条件:
①排在 前面的金属;
②用稀盐酸或稀硫酸
氢
Mg+H2SO4 MgSO4 + H2
Fe+ H2SO4 FeSO4 + H2
2AI+6HCI 2AICI3+3H2
(氢前可换氢)
2.金属与酸反应
Fe2+
浅绿色
金属+盐溶液 → 新金属+新盐(都是 反应)
(1)铁和硫酸铜溶液:_________________________
Fe+CuSO4 FeSO4 +Cu
(用铁制容器不能盛装波尔多液农药)
置换
现象:铁钉表面有 出现,溶液由
变为 。
红色固体
浅绿色
蓝色
3.金属与其他金属化合物溶液的反应(“前金”换“后金”)
(1)在初中阶段,金属活动性顺序的应用不涉及K、Ca、Na
(2)Fe在这两类置换反应中,都变成亚铁离子(Fe2+)
注意
(2)铝和硫酸铜溶液:____________________________
2AI+3CuSO4 AI2(SO4) 3 +3Cu
现象:铝丝表面有 出现,溶液由
色变为 色。
红色固体
蓝
无
(3)铜和硝酸银溶液:____________________________
Cu+2AgNO3 Cu(NO3)2+2Ag
现象:铜丝表面有 出现,溶液由
色变为 色。
银白色固体
无
蓝
写出下列除杂的反应方程式
Cu粉(Fe粉)______________________________
Fe+2HCI FeCI2+H2
FeCl2溶液(CuCl2)___________________________
Fe+CuCI2 FeCI2+Cu
考点三 铁的冶炼
1.一氧化碳还原氧化铁
(1)实验装置(如图)
(2)实验步骤
一氧化碳
酒精喷灯
早出
早退
迟到
晚归
(3)实验现象:红棕色粉末逐渐变为______色,澄清石灰水变________,尾气燃烧产生_______火焰。
黑
浑浊
蓝色
防爆炸
防氧化
防倒吸
点燃或收集
【注意】①先通CO(早出)
②实验完毕后要先撤掉酒精喷灯,继续通入CO(晚归)
③CO有毒,要进行尾气处理
3CO+Fe2O3 2Fe+3CO2
高温
2.工业炼铁
原料 铁矿石(磁铁矿的主要成分是 )、(赤铁矿的主要成分是 )、焦炭、石灰石、空气。
反应原理 用一氧化碳把铁从赤铁矿里还原出来,请写出两道对应的方程式:
设备 炼铁高炉
3CO+Fe2O3 2Fe+3CO2
高温
Fe3O4
Fe2O3
产品 (Fe和C的合金,含碳量为2%~4.3%)
各物质的作用 焦炭的作用是:
①_________________________
②_________________________
石灰石的作用是:______________________________
生铁
提高热量
提供还原剂CO
把矿石中的SiO2转化为炉渣
结论:对比A和B,说明铁生锈需要 ,对比
A和C,说明铁生锈需要 。
1.铁生锈的探究实验
现象:一段时间后,试管 中的铁钉生锈,试管
和 中的铁钉无明显变化。
A
水
氧气
B
C
控制变量法
考点四 金属资源保护
注意:铁锈的主要成分为: (颜
色 ,疏松多孔,要及时除去)。
铁生锈的条件是: 。
铁与氧气和水同时接触
2.食品“双吸剂”中含有铁粉,就是利用铁生锈,
消耗 和 的原理,从而保鲜
食品。
Fe2O3·xH2O
3.铜生锈是铜与 接触生成了铜
绿,铜绿的主要成份为碱式碳酸铜,化学式为:
Cu2(OH)2CO3。
红棕色
H2O
O2
H2O、CO2、O2
(2)常用的防锈方法:
等。
4.钢铁的防护
涂油、刷漆、电镀、烤蓝、制成不锈钢
(1)一般钢铁的防锈原理:保持钢铁制品表面的洁
净和干燥,使钢铁制品与 隔绝。
O2和H2O
不锈钢的防锈原理是 。
改变金属的内部结构
1、防止金属腐蚀
2、金属回收利用
3、有计划、合理开采矿物
4、寻找金属代用品
5.保护金属资源的有效途径
感谢聆听
https://www.21cnjy.com/help/help_extract.php
第八单元金属及金属材料
单元复习
人教版 九年级下
第八单元 金属及金属材料
单元复习
纯
金
属
物理性质
化学
性质
金属
活动性
顺序
合金
硬度更高
抗腐蚀性能更强
熔点更低
金属资源的利用和保护
铁的冶炼
防止金属腐蚀、回收利用废旧金属、有计划合理地开采矿物、寻找金属代用品
金
属
材
料
置换
反应
铁的锈蚀和防护
1.金属的物理性质
金属材料:包括 及 。
纯金属
合金
(1)常温下一般为 ( 是液态)
固态
汞
(2)大多数呈银白色(铜为 ,金为 )
紫红
黄色
(3)有良好的 、 、 。
导电性
导热性
延展性
2.产量最高,使用最广的金属是 ,铝抗腐蚀性
好的原因是: 。
铁
铝的表面有一层致密的氧化膜
考点一 金属材料及其用途
考点一 金属材料及其用途
2.合金
(1)定义:在金属中加热熔合某些金属或非金属形成的具有____________的物质。
金属特征
合金的特点:是一种 物,合金中至少
含 种金属,也可以含非金属)
合金的用途比纯金属广泛。
注意
混合
1
合金的优势
硬度比其组分金属大 (纯铁较软―→生铁、锰钢)
抗腐蚀性能比其组分金属好 (铁易生锈―→不锈钢)
熔点比其组分金属低 (焊锡以及保险丝:武德合金)
(2)生铁和钢都是 合金,生铁的含碳量为
,钢的含碳量 。
铁
2%~4.3%
0.03%~2%
(3)钛合金与人体有很好的“相容性”,因此可用
来制造人造骨。
金属的性质在很大程度上决定了金属的用途,但这不是唯一决定的因素,还需考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
3.金属的用途
1、下面是金属的用途和性质,请把用途和性质相对应的连接起来:
金属铜用来作电线 延展性
铁用来作铁锅 导电性
铝制成铝薄作食品包装 导热性
金属活动性顺序
K Ca Na Fe Sn Pb (H) Pt Au
Mg
Al
Zn
Cu
Hg
Ag
金属活动性由强到弱
考点二 金属的化学性质
氢前可换氢 前金换后金
(1)金属位置越前,活动性越 。
强
(2)位于前面的金属能置换出盐酸、硫酸中的
(注:酸指的是稀盐酸和稀硫酸)
氢
(3)位于 的金属能把位于 的金属
从它们的盐溶液中置换出来(钾钙钠除外)
前面
后面
许多金属都能与氧气反应,但反应的难易和剧烈程度度不同。
(1)镁、铝在常温下就能与氧气反应;
(2)铁、铜在常温下几乎不与氧气反应,但在点燃或加热时能与氧气反应;
(3)金在高温下也不与氧气反应(真金不怕火炼)。
1.金属与氧气反应
4Al+3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
金属+氧气→金属氧化物
金属+酸→盐+氢气 (都是 反应)
锌和稀盐酸:_____________________________
Zn+2HCI ZnCI2+H2
镁和稀硫酸:_____________________________
铁和稀硫酸:_____________________________
铝和稀盐酸:_____________________________
置换
反应条件:
①排在 前面的金属;
②用稀盐酸或稀硫酸
氢
Mg+H2SO4 MgSO4 + H2
Fe+ H2SO4 FeSO4 + H2
2AI+6HCI 2AICI3+3H2
(氢前可换氢)
2.金属与酸反应
Fe2+
浅绿色
金属+盐溶液 → 新金属+新盐(都是 反应)
(1)铁和硫酸铜溶液:_________________________
Fe+CuSO4 FeSO4 +Cu
(用铁制容器不能盛装波尔多液农药)
置换
现象:铁钉表面有 出现,溶液由
变为 。
红色固体
浅绿色
蓝色
3.金属与其他金属化合物溶液的反应(“前金”换“后金”)
(1)在初中阶段,金属活动性顺序的应用不涉及K、Ca、Na
(2)Fe在这两类置换反应中,都变成亚铁离子(Fe2+)
注意
(2)铝和硫酸铜溶液:____________________________
2AI+3CuSO4 AI2(SO4) 3 +3Cu
现象:铝丝表面有 出现,溶液由
色变为 色。
红色固体
蓝
无
(3)铜和硝酸银溶液:____________________________
Cu+2AgNO3 Cu(NO3)2+2Ag
现象:铜丝表面有 出现,溶液由
色变为 色。
银白色固体
无
蓝
写出下列除杂的反应方程式
Cu粉(Fe粉)______________________________
Fe+2HCI FeCI2+H2
FeCl2溶液(CuCl2)___________________________
Fe+CuCI2 FeCI2+Cu
考点三 铁的冶炼
1.一氧化碳还原氧化铁
(1)实验装置(如图)
(2)实验步骤
一氧化碳
酒精喷灯
早出
早退
迟到
晚归
(3)实验现象:红棕色粉末逐渐变为______色,澄清石灰水变________,尾气燃烧产生_______火焰。
黑
浑浊
蓝色
防爆炸
防氧化
防倒吸
点燃或收集
【注意】①先通CO(早出)
②实验完毕后要先撤掉酒精喷灯,继续通入CO(晚归)
③CO有毒,要进行尾气处理
3CO+Fe2O3 2Fe+3CO2
高温
2.工业炼铁
原料 铁矿石(磁铁矿的主要成分是 )、(赤铁矿的主要成分是 )、焦炭、石灰石、空气。
反应原理 用一氧化碳把铁从赤铁矿里还原出来,请写出两道对应的方程式:
设备 炼铁高炉
3CO+Fe2O3 2Fe+3CO2
高温
Fe3O4
Fe2O3
产品 (Fe和C的合金,含碳量为2%~4.3%)
各物质的作用 焦炭的作用是:
①_________________________
②_________________________
石灰石的作用是:______________________________
生铁
提高热量
提供还原剂CO
把矿石中的SiO2转化为炉渣
结论:对比A和B,说明铁生锈需要 ,对比
A和C,说明铁生锈需要 。
1.铁生锈的探究实验
现象:一段时间后,试管 中的铁钉生锈,试管
和 中的铁钉无明显变化。
A
水
氧气
B
C
控制变量法
考点四 金属资源保护
注意:铁锈的主要成分为: (颜
色 ,疏松多孔,要及时除去)。
铁生锈的条件是: 。
铁与氧气和水同时接触
2.食品“双吸剂”中含有铁粉,就是利用铁生锈,
消耗 和 的原理,从而保鲜
食品。
Fe2O3·xH2O
3.铜生锈是铜与 接触生成了铜
绿,铜绿的主要成份为碱式碳酸铜,化学式为:
Cu2(OH)2CO3。
红棕色
H2O
O2
H2O、CO2、O2
(2)常用的防锈方法:
等。
4.钢铁的防护
涂油、刷漆、电镀、烤蓝、制成不锈钢
(1)一般钢铁的防锈原理:保持钢铁制品表面的洁
净和干燥,使钢铁制品与 隔绝。
O2和H2O
不锈钢的防锈原理是 。
改变金属的内部结构
1、防止金属腐蚀
2、金属回收利用
3、有计划、合理开采矿物
4、寻找金属代用品
5.保护金属资源的有效途径
感谢聆听
https://www.21cnjy.com/help/help_extract.php
同课章节目录
