第三单元物质构成的奥秘练习-2021-2022学年九年级化学人教版上册(含解析)
文档属性
| 名称 | 第三单元物质构成的奥秘练习-2021-2022学年九年级化学人教版上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 72.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-05 14:32:59 | ||
图片预览



文档简介
第三单元《物质构成的奥秘》测试卷
一、单选题(共15小题)
1.某气态物质变成液态的主要原因是( )
A. 微粒的性质发生了改变
B. 微粒的大小发生了改变
C. 微粒的质量发生了改变
D. 微粒间的间隔发生了改变
2.下列元素名称与其对应的元素符号完全正确的是( )
A. 氯cl
B. 氖 Na
C. 镁Mg
D. 铜Ca
3.下图是元素周期表中的一部分,下列有关说法中正确的是( )
A. 锂原子的原子序数为3
B. 氢元素的相对原子质量1.008g
C. 锂元素和氢元素都属于金属元素
D. 锂元素和氢元素属于同周期元素
4.关于氧分子和氧原子的说法,错误的是( )
A. 在化学变化中,氧分子能再分,氧原子不能
B. 氧分子大,氧原子小
C. 氧气的化学性质由氧分子保持
D. 氧气由氧分子构成,也由氧原子构成
5.地球是人类的家园。地壳里各种元素的含量差别很大,按质量计,含量最多的元素是( )
A. 铝
B. 硅
C. 氧
D. 铁
6.下列有关原子结构的说法中正确的是( )
A. 氢、碳、氧的原子核都由质子和中子构成
B. “毒大米”中含有金属铬(Cr),铬原子序数为24,则质子数和中子数都为24
C. 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(Cl-)
D. 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
7.下列现象中,能充分说明“分子在不停地运动”的是( )
A. 春天,冰雪开始融化
B. 气体热胀冷缩
C. 真金不怕火烧
D. 墙内开花墙外香
8.央视《焦点访谈》报道了苏泊尔四大类产品锰超出国标近4倍。这里的“锰”是指( )
A. 单质
B. 元素
C. 离子
D. 分子
9.原子的构成示意图如下,下列叙述正确的是( )
A. 原子是实心球体
B. 质子、中子、电子均匀分布在原子中
C. 质子与电子质量相等
D. 整个原子的质量主要集中在原子核上
10.下列说法正确的是
A.气态水分子、液态水分子是运动的,固态水分子是不运动的
B.原子通过得失电子变成离子,但离子不能变成原子
C.原子、分子、离子都是构成物质的基本微粒
D.原子的质量几乎都集中在原子核外的电子上
11.从分子的角度分析并解释下列现象,不正确的是
A.八月桂花飘香﹣﹣分子在不停地运动
B.液氧受热变为气体,所占体积变大﹣﹣气体分子变大
C.晴天湿衣服比阴天干得快﹣﹣晴天气温高,分子运动速率快
D.6000L 氧气加压后可装入容积为 40L 的钢瓶中﹣﹣分子间有间隔
12.化学学习,要学会对数据进行分析和处理,从而得出正确的结论。下表是课本中几种原子的构成,分析表中的信息,下列说法正确的是
原子 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 X
A.原子核内质子数等于中子数
B.原子核都由质子和中子构成
C.原子只由质子和电子构成
D.表中X=11
13.如图是金元素在元素周期表中的信息,下列有关金的说法正确的是( )
A.属于非金属元素
B.元素符号为Au
C.中子数为79
D.相对原子质量为197.0g
14.下列有关物质的组成、结构和性质关系归纳错误的是( )
A.具有相同质子数的粒子不一定是同种元素
B.元素的化学性质与原子最外层电子数关系密切
C.由同种元素组成的物质是单质
D.同一种元素的原子和离子质量相差不大
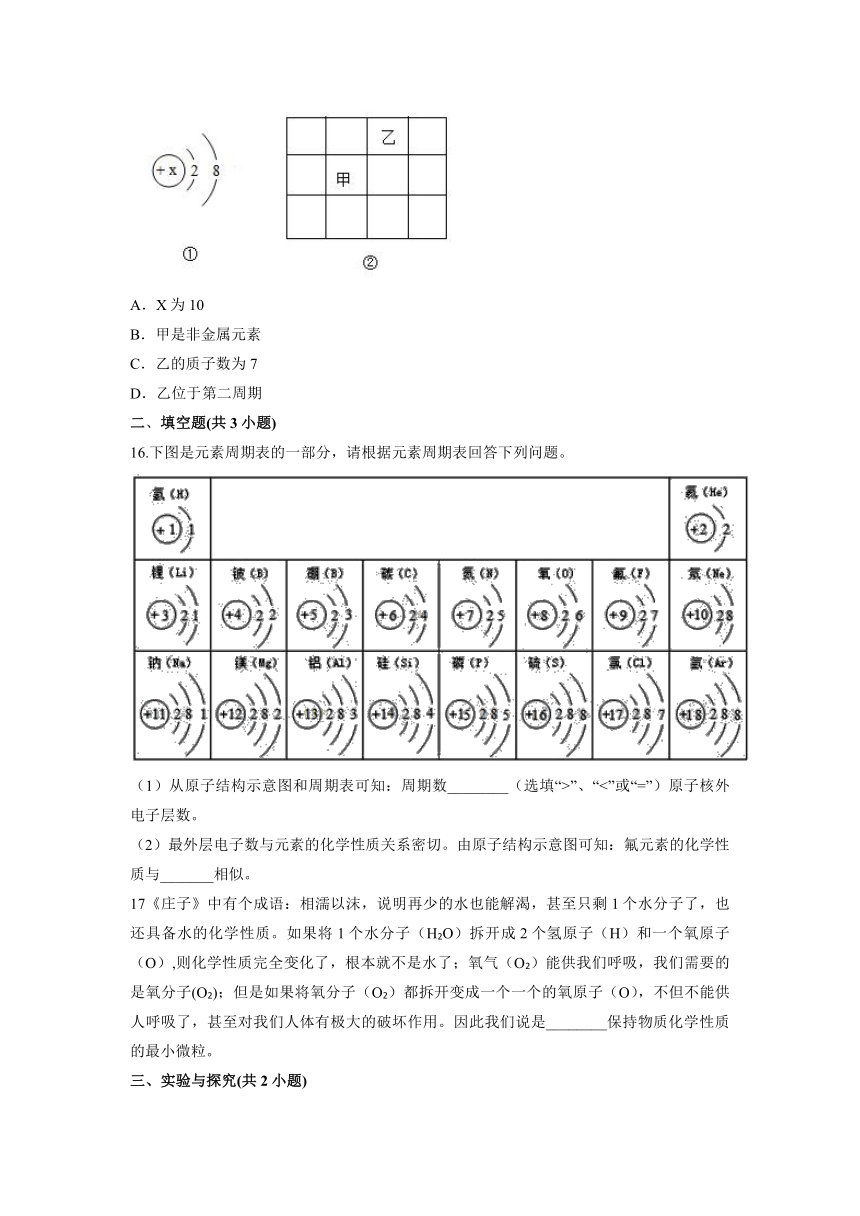
15.2019年被定为“国际化学元素周期表年”。已知甲元素在化合物中显+3价,图①是甲的微粒结构示意图,图②是元素周期表的一部分,则下列叙述正确的是( )
A.X为10
B.甲是非金属元素
C.乙的质子数为7
D.乙位于第二周期
二、填空题(共3小题)
16.下图是元素周期表的一部分,请根据元素周期表回答下列问题。
(1)从原子结构示意图和周期表可知:周期数________(选填“>”、“<”或“=”)原子核外电子层数。
(2)最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素的化学性质与_______相似。
17《庄子》中有个成语:相濡以沫,说明再少的水也能解渴,甚至只剩1个水分子了,也还具备水的化学性质。如果将1个水分子(H2O)拆开成2个氢原子(H)和一个氧原子(O),则化学性质完全变化了,根本就不是水了;氧气(O2)能供我们呼吸,我们需要的是氧分子(O2);但是如果将氧分子(O2)都拆开变成一个一个的氧原子(O),不但不能供人呼吸了,甚至对我们人体有极大的破坏作用。因此我们说是________保持物质化学性质的最小微粒。
三、实验与探究(共2小题)
18.实验探究:某化学兴趣小组同学为了研究影响分子运动速率的因素,如下图所示,玻璃管左、右两端分别放有脱脂棉,注射器中分别装有浓盐酸和浓氨水。浓氨水挥发出来的氨气(NH3)和浓盐酸挥发出来的氯化氢气体(HCl)能发生反应生成白色的氯化铵固体。两个注射器同时向脱脂棉靠近里边的部位注入等体积的液体,过一会,先在A处产生大量白烟,然后白烟逐渐充满整个试管。
根据现象回答问题:
(1)A处形成白烟是因为分子在___________________________;
(2)有同学认为先在A处产生白烟是因为氯化氢分子比氨气分子运动速度__________,已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成__________比。(填正或反)
19.实验探究
(1)实验方法:如图所示:在A烧杯中盛有浓氨水,在盛有20mL水的B烧杯中加入5~6滴酚酞溶液,从B烧杯中取少量溶液置于试管中,向其中滴加浓氨水,用一个大烧杯罩住AB两个小烧杯。
(2)实验现象:①过一会儿,观察到的现象:试管中的现象_________________________,
②AB烧杯中的现象__________________________________。
(3)你的猜想:_________________________________________________。
(4)讨论交流:与小组同学交流你的看法:往装有酚酞溶液的试管中加浓氨水这样操作的
目的_________________________________________________。
答案解析
1.【答案】D
【解析】某气态物质变为液态,其中的微粒本身没有发生任何变化,改变的是微粒间的间隔。故选D。
2.【答案】C
【解析】氯元素符号为Cl,氖元素符号为Ne,镁元素符号为Mg,铜元素符号为Cu,故选C。
3.【答案】A
【解析】从图中元素周期表的一部分,可知锂原子的原子序数为3;氢元素的相对原子质量1.008;锂元素属于金属元素,氢元素属于非金属元素;元素周期表中位于同一横行的元素是同一周期的元素,锂元素和氢元素不属于同周期元素。故选A。
4.【答案】D
【解析】氧气是由氧分子构成,不是由氧原子构成,而氧分子由氧原子构成,故选D。
5.【答案】C
【解析】地壳中含量最多的元素为氧元素,故选C。
6.【答案】C
【解析】A.氢的原子核中没有中子,错误;B.“毒大米”中含有金属铬(Cr),铬原子序数为24,但质子数不等于中子数,它的中子数为28,错误;C.氯原子的最外层电子数为7,所以在反应中若得到一个电子即变成氯离子(Cl-),正确;D.质子和中子的相对质量都约等于1,每个质子都带1个单位正电荷,而中子不带电,错误。故答案应选C。
7.【答案】D
【解析】春天,冰雪开始融化,是物质状态的改变,是由于水分子之间的间隔发生了改变;气体热胀冷缩是由于构成气体的分子之间的间隔发生改变的结果;真金不怕火烧说明了金的化学性质不活泼,很难和氧气发生化学反应;墙内开花墙外香是由于分子在不停运动的结果。所以答案选D。
8.【答案】B
【解析】元素在地壳、生物体内、空气中以及各种食品、药品、保健品都有广泛的分布,故选B。
9.【答案】D
【解析】原子内有大部分的空间;原子不是实心球体;原子由原子核和电子构成,原子核又由质子和中子构成,电子在原子很大的空间内运动,质子、中子和电子在原子中的分布并不均匀;整个原子的质量主要集中在原子核上并且质子的质量远远大于电子的质量。故答案应选D。
10.C
【详解】
A、分子总是在不停地运动,固态水分子也是运动的,A错误;
B、原子通过得失电子变成离子,但离子也能通过得失电子变成原子,B错误;
C、原子、分子、离子都是构成物质的基本微粒,C正确;
D、一个电子的质量是一个质子的,可以忽略不计,故原子的质量几乎都集中在原子核上,D错误;
故选C。
11.B
【详解】
A、八月桂花飘香,说明分子在不停地运动,故 A 正确;
B、由于分子间有间隔,液氧受热变为气体,所占体积变大,是分子间的间隔变 大,分子的体积没有变化,故B错误;
C、由于分子是运动的,温度升高运动的速率加快,晴天比阴天温度高,所以晴天湿衣服比阴天干得快,故C正确;
D、由于分子间有间隔,加压时间隔变小,所以6000L 氧气加压后可装入容积40L 的钢瓶中,故 D 正确。
故选:B。
12.D
【详解】
A、原子核内质子数不一定等于中子数,如氢、钠原子核中质子数与中子数不相等。错误。
B、原子核中不一定含有中子,如氢原子核不含中子。错误。
C、大部分原子由质子、中子、电子构成,错误。
D、原子中,质子数=电子数,所以X=11。正确。
故选D。
13.B
【详解】
A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是金,属于金属元素,故选项说法错误。
B、根据元素周期表中的一格可知,元素符号为Au,故选项说法正确。
C、根据元素周期表中的一格可知,左上角的数字为79,表示原子序数为79;根据原子序数=核电荷数=质子数,则该元素的核内质子数为79;该元素原子的相对原子质量为197,相对原子质量=质子数+中子数,则中子数为197-79=118,故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197,相对原子质量单位是“1”,不是“克”,故选项说法错误。
故选:B。
14.C
【详解】
试题分析:我们把具有相同核电荷数(质子数)的一类原子的总称叫做同种元素,如果含有相同质子数的粒子(原子和分子或者分子和离子)不一定是同种元素,A正确;.原子最外层电子数决定元素的化学性质,B正确;由同种元素组成的纯净物是单质,由同种元素组成的物质可能是单质或混合物,C错误;核外电子的质量很小,常不计,同一种元素的原子和离子质量相差不大,D正确。
15.D
【详解】
A、甲元素在化合物中显+3价,甲的微粒结构示意图为图①,由此可得,甲的微粒是原子失去3个电子得到的,该原子的质子数即核电荷数为13,在微粒结构示意图中,圆圈内的数字为质子数,因此,X为13,选项说法错误,故不符合题意;
B、根据质子数=核电荷数=核外电子数=原子序数可知,甲的原子序数为13,在元素周期表中排第13位,为铝元素,元素名称中带有“金”子旁,属于金属元素,选项说法错误,故不符合题意;
C、由图②可知,甲元素的右上角为乙元素,甲元素的正上方元素与甲元素属于同一族元素,甲元素的周期数比其正上方元素的周期数大1,即其正上方元素的原子的核外电子数为13-8=5,根据质子数=核电荷数=核外电子数=原子序数可知,其原子序数为5,在元素周期表中,元素是按原子序数递增的顺序排列的,因此,原子序数为5的元素后面的乙元素原子序数为6,即乙的质子数为6,选项说法错误,故不符合题意;
D、由详解可知,乙的质子数为6,即核外电子数也为6,核外电子排布为2,4,有两个电子层,根据原子的核外电子层数=元素周期数可得,乙位于第二周期,选项说法正确,符合题意。
故选D。
16.【答案】(1)=(2)氯
【解析】从原子结构示意图和周期表可知:周期数等于原子核外电子层数,最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素与氯元素的最外电子数相等,因此它们的化学性质相似。
17.【答案】分子
【解析】分子是保持物质化学性质最小的微粒,而原子是化学变化中最小的微粒。
18.【答案】(1)不停地运动(2)慢 反
【解析】由于浓盐酸中的氯化氢分子和浓氨水中的氨气分子都在不停地运动,所以会在A处形成白烟。形成的白烟在A处,离浓盐酸较近,离浓氨水较远,这是因为氯化氢分子运动速度比氨气分子运动速度慢。已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成反比。
19.【答案】(2)①液体变为红色 ;②A无明显变化,B烧杯中酚酞变红;
(3)分子在不断地运动;
(4)说明浓氨水能使酚酞变红
【解析】浓氨水显碱性能够使无色酚酞变红色,A烧杯中浓氨水中的氨气分子是不断运动着的,氨气分子运动到B烧杯中,能够使B烧杯中的无色酚酞变红,所以可以观察到B烧杯中酚酞变红,这一现象从而也证明了分子是不断运动的。往装有酚酞溶液的试管中加浓氨水这样操作的目的正是说明浓氨水能使酚酞变红。
一、单选题(共15小题)
1.某气态物质变成液态的主要原因是( )
A. 微粒的性质发生了改变
B. 微粒的大小发生了改变
C. 微粒的质量发生了改变
D. 微粒间的间隔发生了改变
2.下列元素名称与其对应的元素符号完全正确的是( )
A. 氯cl
B. 氖 Na
C. 镁Mg
D. 铜Ca
3.下图是元素周期表中的一部分,下列有关说法中正确的是( )
A. 锂原子的原子序数为3
B. 氢元素的相对原子质量1.008g
C. 锂元素和氢元素都属于金属元素
D. 锂元素和氢元素属于同周期元素
4.关于氧分子和氧原子的说法,错误的是( )
A. 在化学变化中,氧分子能再分,氧原子不能
B. 氧分子大,氧原子小
C. 氧气的化学性质由氧分子保持
D. 氧气由氧分子构成,也由氧原子构成
5.地球是人类的家园。地壳里各种元素的含量差别很大,按质量计,含量最多的元素是( )
A. 铝
B. 硅
C. 氧
D. 铁
6.下列有关原子结构的说法中正确的是( )
A. 氢、碳、氧的原子核都由质子和中子构成
B. “毒大米”中含有金属铬(Cr),铬原子序数为24,则质子数和中子数都为24
C. 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(Cl-)
D. 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
7.下列现象中,能充分说明“分子在不停地运动”的是( )
A. 春天,冰雪开始融化
B. 气体热胀冷缩
C. 真金不怕火烧
D. 墙内开花墙外香
8.央视《焦点访谈》报道了苏泊尔四大类产品锰超出国标近4倍。这里的“锰”是指( )
A. 单质
B. 元素
C. 离子
D. 分子
9.原子的构成示意图如下,下列叙述正确的是( )
A. 原子是实心球体
B. 质子、中子、电子均匀分布在原子中
C. 质子与电子质量相等
D. 整个原子的质量主要集中在原子核上
10.下列说法正确的是
A.气态水分子、液态水分子是运动的,固态水分子是不运动的
B.原子通过得失电子变成离子,但离子不能变成原子
C.原子、分子、离子都是构成物质的基本微粒
D.原子的质量几乎都集中在原子核外的电子上
11.从分子的角度分析并解释下列现象,不正确的是
A.八月桂花飘香﹣﹣分子在不停地运动
B.液氧受热变为气体,所占体积变大﹣﹣气体分子变大
C.晴天湿衣服比阴天干得快﹣﹣晴天气温高,分子运动速率快
D.6000L 氧气加压后可装入容积为 40L 的钢瓶中﹣﹣分子间有间隔
12.化学学习,要学会对数据进行分析和处理,从而得出正确的结论。下表是课本中几种原子的构成,分析表中的信息,下列说法正确的是
原子 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 X
A.原子核内质子数等于中子数
B.原子核都由质子和中子构成
C.原子只由质子和电子构成
D.表中X=11
13.如图是金元素在元素周期表中的信息,下列有关金的说法正确的是( )
A.属于非金属元素
B.元素符号为Au
C.中子数为79
D.相对原子质量为197.0g
14.下列有关物质的组成、结构和性质关系归纳错误的是( )
A.具有相同质子数的粒子不一定是同种元素
B.元素的化学性质与原子最外层电子数关系密切
C.由同种元素组成的物质是单质
D.同一种元素的原子和离子质量相差不大
15.2019年被定为“国际化学元素周期表年”。已知甲元素在化合物中显+3价,图①是甲的微粒结构示意图,图②是元素周期表的一部分,则下列叙述正确的是( )
A.X为10
B.甲是非金属元素
C.乙的质子数为7
D.乙位于第二周期
二、填空题(共3小题)
16.下图是元素周期表的一部分,请根据元素周期表回答下列问题。
(1)从原子结构示意图和周期表可知:周期数________(选填“>”、“<”或“=”)原子核外电子层数。
(2)最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素的化学性质与_______相似。
17《庄子》中有个成语:相濡以沫,说明再少的水也能解渴,甚至只剩1个水分子了,也还具备水的化学性质。如果将1个水分子(H2O)拆开成2个氢原子(H)和一个氧原子(O),则化学性质完全变化了,根本就不是水了;氧气(O2)能供我们呼吸,我们需要的是氧分子(O2);但是如果将氧分子(O2)都拆开变成一个一个的氧原子(O),不但不能供人呼吸了,甚至对我们人体有极大的破坏作用。因此我们说是________保持物质化学性质的最小微粒。
三、实验与探究(共2小题)
18.实验探究:某化学兴趣小组同学为了研究影响分子运动速率的因素,如下图所示,玻璃管左、右两端分别放有脱脂棉,注射器中分别装有浓盐酸和浓氨水。浓氨水挥发出来的氨气(NH3)和浓盐酸挥发出来的氯化氢气体(HCl)能发生反应生成白色的氯化铵固体。两个注射器同时向脱脂棉靠近里边的部位注入等体积的液体,过一会,先在A处产生大量白烟,然后白烟逐渐充满整个试管。
根据现象回答问题:
(1)A处形成白烟是因为分子在___________________________;
(2)有同学认为先在A处产生白烟是因为氯化氢分子比氨气分子运动速度__________,已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成__________比。(填正或反)
19.实验探究
(1)实验方法:如图所示:在A烧杯中盛有浓氨水,在盛有20mL水的B烧杯中加入5~6滴酚酞溶液,从B烧杯中取少量溶液置于试管中,向其中滴加浓氨水,用一个大烧杯罩住AB两个小烧杯。
(2)实验现象:①过一会儿,观察到的现象:试管中的现象_________________________,
②AB烧杯中的现象__________________________________。
(3)你的猜想:_________________________________________________。
(4)讨论交流:与小组同学交流你的看法:往装有酚酞溶液的试管中加浓氨水这样操作的
目的_________________________________________________。
答案解析
1.【答案】D
【解析】某气态物质变为液态,其中的微粒本身没有发生任何变化,改变的是微粒间的间隔。故选D。
2.【答案】C
【解析】氯元素符号为Cl,氖元素符号为Ne,镁元素符号为Mg,铜元素符号为Cu,故选C。
3.【答案】A
【解析】从图中元素周期表的一部分,可知锂原子的原子序数为3;氢元素的相对原子质量1.008;锂元素属于金属元素,氢元素属于非金属元素;元素周期表中位于同一横行的元素是同一周期的元素,锂元素和氢元素不属于同周期元素。故选A。
4.【答案】D
【解析】氧气是由氧分子构成,不是由氧原子构成,而氧分子由氧原子构成,故选D。
5.【答案】C
【解析】地壳中含量最多的元素为氧元素,故选C。
6.【答案】C
【解析】A.氢的原子核中没有中子,错误;B.“毒大米”中含有金属铬(Cr),铬原子序数为24,但质子数不等于中子数,它的中子数为28,错误;C.氯原子的最外层电子数为7,所以在反应中若得到一个电子即变成氯离子(Cl-),正确;D.质子和中子的相对质量都约等于1,每个质子都带1个单位正电荷,而中子不带电,错误。故答案应选C。
7.【答案】D
【解析】春天,冰雪开始融化,是物质状态的改变,是由于水分子之间的间隔发生了改变;气体热胀冷缩是由于构成气体的分子之间的间隔发生改变的结果;真金不怕火烧说明了金的化学性质不活泼,很难和氧气发生化学反应;墙内开花墙外香是由于分子在不停运动的结果。所以答案选D。
8.【答案】B
【解析】元素在地壳、生物体内、空气中以及各种食品、药品、保健品都有广泛的分布,故选B。
9.【答案】D
【解析】原子内有大部分的空间;原子不是实心球体;原子由原子核和电子构成,原子核又由质子和中子构成,电子在原子很大的空间内运动,质子、中子和电子在原子中的分布并不均匀;整个原子的质量主要集中在原子核上并且质子的质量远远大于电子的质量。故答案应选D。
10.C
【详解】
A、分子总是在不停地运动,固态水分子也是运动的,A错误;
B、原子通过得失电子变成离子,但离子也能通过得失电子变成原子,B错误;
C、原子、分子、离子都是构成物质的基本微粒,C正确;
D、一个电子的质量是一个质子的,可以忽略不计,故原子的质量几乎都集中在原子核上,D错误;
故选C。
11.B
【详解】
A、八月桂花飘香,说明分子在不停地运动,故 A 正确;
B、由于分子间有间隔,液氧受热变为气体,所占体积变大,是分子间的间隔变 大,分子的体积没有变化,故B错误;
C、由于分子是运动的,温度升高运动的速率加快,晴天比阴天温度高,所以晴天湿衣服比阴天干得快,故C正确;
D、由于分子间有间隔,加压时间隔变小,所以6000L 氧气加压后可装入容积40L 的钢瓶中,故 D 正确。
故选:B。
12.D
【详解】
A、原子核内质子数不一定等于中子数,如氢、钠原子核中质子数与中子数不相等。错误。
B、原子核中不一定含有中子,如氢原子核不含中子。错误。
C、大部分原子由质子、中子、电子构成,错误。
D、原子中,质子数=电子数,所以X=11。正确。
故选D。
13.B
【详解】
A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是金,属于金属元素,故选项说法错误。
B、根据元素周期表中的一格可知,元素符号为Au,故选项说法正确。
C、根据元素周期表中的一格可知,左上角的数字为79,表示原子序数为79;根据原子序数=核电荷数=质子数,则该元素的核内质子数为79;该元素原子的相对原子质量为197,相对原子质量=质子数+中子数,则中子数为197-79=118,故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为197,相对原子质量单位是“1”,不是“克”,故选项说法错误。
故选:B。
14.C
【详解】
试题分析:我们把具有相同核电荷数(质子数)的一类原子的总称叫做同种元素,如果含有相同质子数的粒子(原子和分子或者分子和离子)不一定是同种元素,A正确;.原子最外层电子数决定元素的化学性质,B正确;由同种元素组成的纯净物是单质,由同种元素组成的物质可能是单质或混合物,C错误;核外电子的质量很小,常不计,同一种元素的原子和离子质量相差不大,D正确。
15.D
【详解】
A、甲元素在化合物中显+3价,甲的微粒结构示意图为图①,由此可得,甲的微粒是原子失去3个电子得到的,该原子的质子数即核电荷数为13,在微粒结构示意图中,圆圈内的数字为质子数,因此,X为13,选项说法错误,故不符合题意;
B、根据质子数=核电荷数=核外电子数=原子序数可知,甲的原子序数为13,在元素周期表中排第13位,为铝元素,元素名称中带有“金”子旁,属于金属元素,选项说法错误,故不符合题意;
C、由图②可知,甲元素的右上角为乙元素,甲元素的正上方元素与甲元素属于同一族元素,甲元素的周期数比其正上方元素的周期数大1,即其正上方元素的原子的核外电子数为13-8=5,根据质子数=核电荷数=核外电子数=原子序数可知,其原子序数为5,在元素周期表中,元素是按原子序数递增的顺序排列的,因此,原子序数为5的元素后面的乙元素原子序数为6,即乙的质子数为6,选项说法错误,故不符合题意;
D、由详解可知,乙的质子数为6,即核外电子数也为6,核外电子排布为2,4,有两个电子层,根据原子的核外电子层数=元素周期数可得,乙位于第二周期,选项说法正确,符合题意。
故选D。
16.【答案】(1)=(2)氯
【解析】从原子结构示意图和周期表可知:周期数等于原子核外电子层数,最外层电子数与元素的化学性质关系密切。由原子结构示意图可知:氟元素与氯元素的最外电子数相等,因此它们的化学性质相似。
17.【答案】分子
【解析】分子是保持物质化学性质最小的微粒,而原子是化学变化中最小的微粒。
18.【答案】(1)不停地运动(2)慢 反
【解析】由于浓盐酸中的氯化氢分子和浓氨水中的氨气分子都在不停地运动,所以会在A处形成白烟。形成的白烟在A处,离浓盐酸较近,离浓氨水较远,这是因为氯化氢分子运动速度比氨气分子运动速度慢。已知一个氯化氢分子的质量要大于一个氨气分子的质量,所以可以说分子的运动速度与其质量成反比。
19.【答案】(2)①液体变为红色 ;②A无明显变化,B烧杯中酚酞变红;
(3)分子在不断地运动;
(4)说明浓氨水能使酚酞变红
【解析】浓氨水显碱性能够使无色酚酞变红色,A烧杯中浓氨水中的氨气分子是不断运动着的,氨气分子运动到B烧杯中,能够使B烧杯中的无色酚酞变红,所以可以观察到B烧杯中酚酞变红,这一现象从而也证明了分子是不断运动的。往装有酚酞溶液的试管中加浓氨水这样操作的目的正是说明浓氨水能使酚酞变红。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
