11.1对酸碱的初步认识-2021-2022学年九年级化学京改版(2013)下册(word版 含解析)
文档属性
| 名称 | 11.1对酸碱的初步认识-2021-2022学年九年级化学京改版(2013)下册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 192.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-06 17:18:43 | ||
图片预览


文档简介
11.1对酸碱的初步认识
一、选择题(共16题)
1.测定生活中一些物质的pH,结果如下:
参照以上图示,下列说法正确的是
A.肥皂水是中性物质 B.草木灰可改良碱性土壤
C.吃松花蛋一般添加食醋去除涩味 D.橘子汁能使酚酞试液变红
2.下列实验操作正确的是
A.CO2验满 B.测溶液pH
C.加热液体 D.量筒读数
3.下列是人体中几种体液的正常pH,碱性最强的是
A.血浆(7.35~7.45) B.胰液(7.5~8.0)
C.胃液(0.9~1.5) D.唾液(6.6~7.1)
4.下列各组混合物中加入无色酚酞溶液后,一定有明显现象是
A.氢氧化钙溶液、硫酸铜溶液
B.稀盐酸、氯化钠溶液
C.水、氧化钙
D.氢氧化钠溶液、稀硫酸
5.一些食物的pH范围如下,其中呈碱性的是
A.柠檬汁(2.0-3.0)
B.牛奶(6.3-6.6)
C.番茄汁(4.0-4.4)
D.鸡蛋清(7.6-8.0)
6.一些食物的近似pH如下,其中碱性最强的是
A.柠檬汁2.2~2.4 B.苹果汁2.9~3.3
C.番茄汁4.0~4.4 D.鸡蛋清7.6~8.0
7.下列食物中,酸性最强的是
A.牛奶(pH=6.4) B.草莓(pH=3.0)
C.木瓜(pH=5.5) D.西红柿(pH=4.3)
8.下列食品和日用品的pH,其中碱性最强的是
A.苹果汁:3.0 B.西红柿汁:4.4 C.鸡蛋清:7.8 D.肥皂水:9.5
9.测定生活中一些物质的pH,结果如下:
参照以上图示判断,下列说法正确的是
A.牙膏是中性物质 B.草木灰可改良碱性土壤
C.胃酸过多的人不宜多吃橘子 D.食醋能使无色酚酞变红
10.生活中常见的三种物质:①白醋,②肥皂水,③食盐水。白醋显酸性,肥皂水能使酚酞溶液变红色,食盐水显中性。它们的pH由大到小排列,正确的是
A.①②③
B.③②①
C.②③①
D.①③②
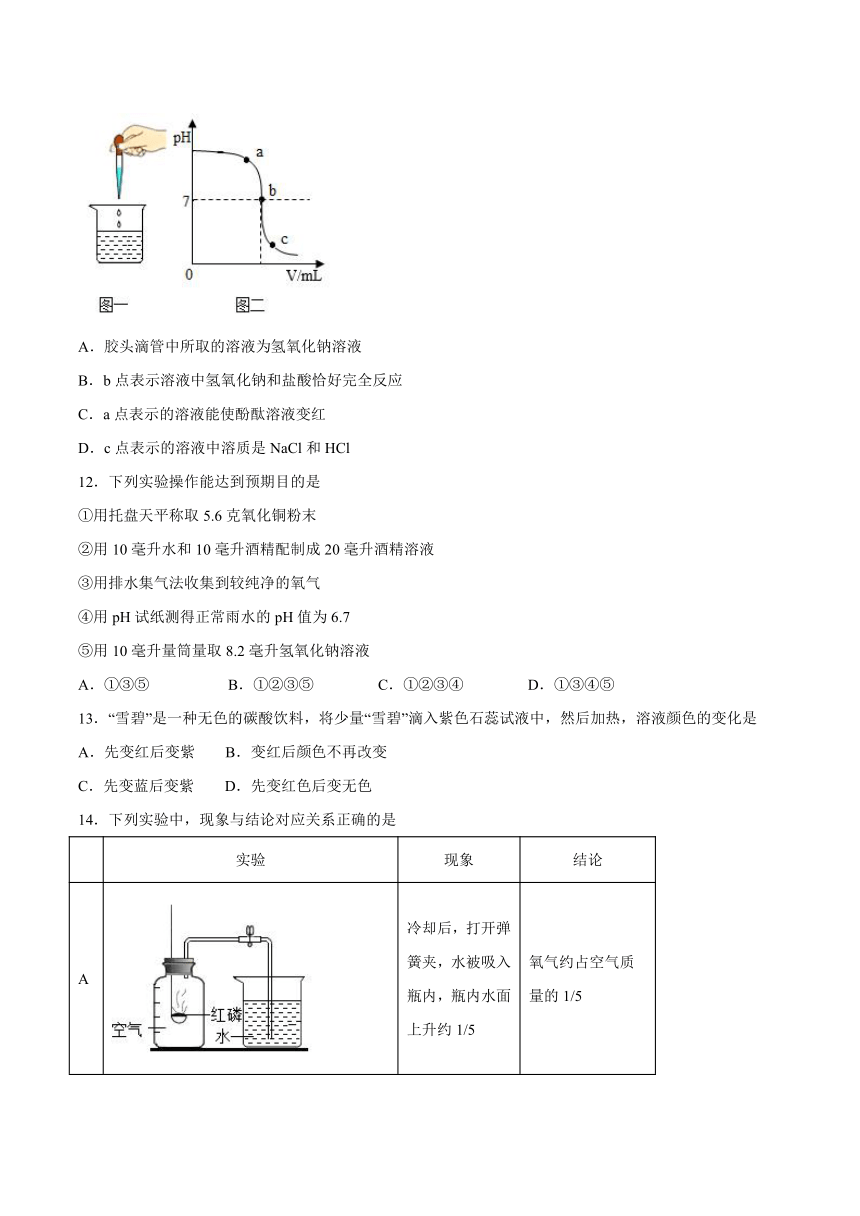
11.如图一所示为稀盐酸和氢氧化钠溶液反应的实验操作,图二为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是
A.胶头滴管中所取的溶液为氢氧化钠溶液
B.b点表示溶液中氢氧化钠和盐酸恰好完全反应
C.a点表示的溶液能使酚酞溶液变红
D.c点表示的溶液中溶质是NaCl和HCl
12.下列实验操作能达到预期目的是
①用托盘天平称取5.6克氧化铜粉末
②用10毫升水和10毫升酒精配制成20毫升酒精溶液
③用排水集气法收集到较纯净的氧气
④用pH试纸测得正常雨水的pH值为6.7
⑤用10毫升量筒量取8.2毫升氢氧化钠溶液
A.①③⑤ B.①②③⑤ C.①②③④ D.①③④⑤
13.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后加热,溶液颜色的变化是
A.先变红后变紫 B.变红后颜色不再改变
C.先变蓝后变紫 D.先变红色后变无色
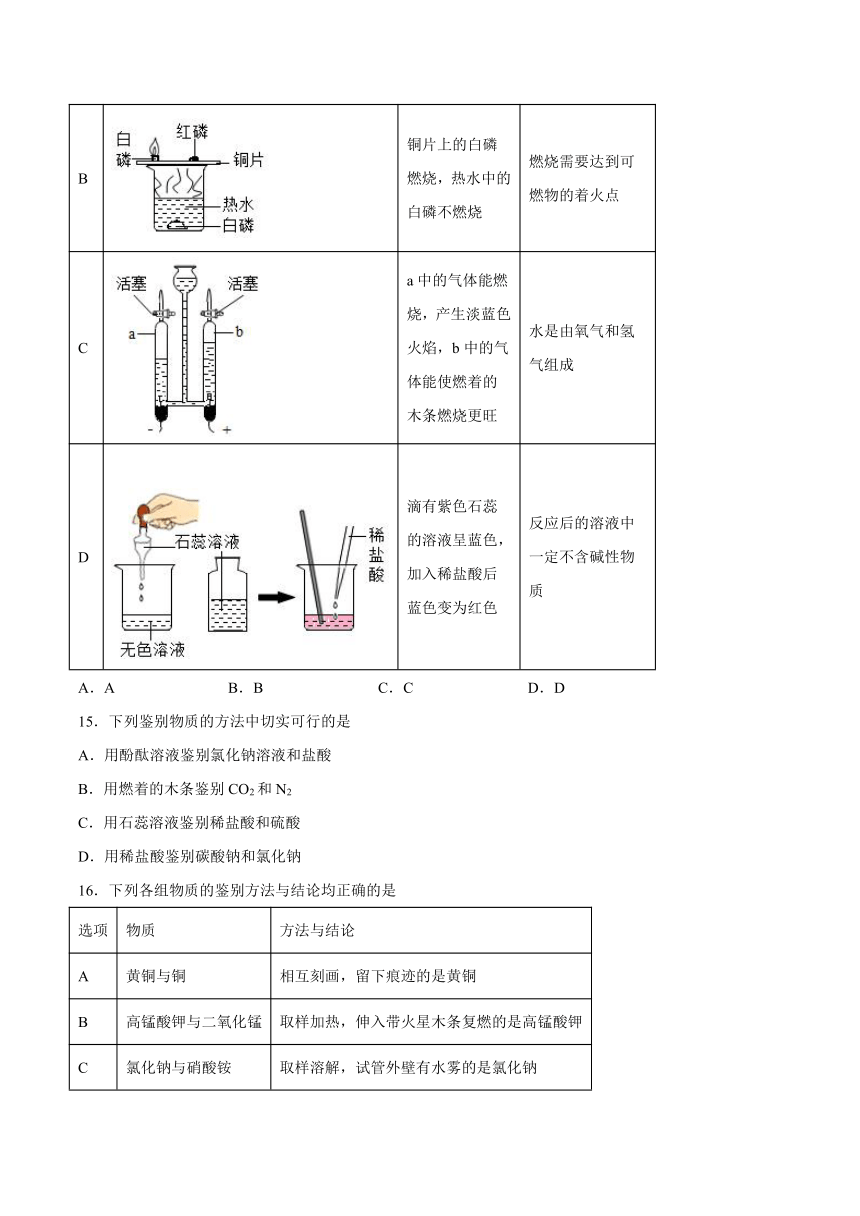
14.下列实验中,现象与结论对应关系正确的是
实验 现象 结论
A 冷却后,打开弹簧夹,水被吸入瓶内,瓶内水面上升约1/5 氧气约占空气质量的1/5
B 铜片上的白磷燃烧,热水中的白磷不燃烧 燃烧需要达到可燃物的着火点
C a中的气体能燃烧,产生淡蓝色火焰,b中的气体能使燃着的木条燃烧更旺 水是由氧气和氢气组成
D 滴有紫色石蕊的溶液呈蓝色,加入稀盐酸后蓝色变为红色 反应后的溶液中一定不含碱性物质
A.A B.B C.C D.D
15.下列鉴别物质的方法中切实可行的是
A.用酚酞溶液鉴别氯化钠溶液和盐酸
B.用燃着的木条鉴别CO2和N2
C.用石蕊溶液鉴别稀盐酸和硫酸
D.用稀盐酸鉴别碳酸钠和氯化钠
16.下列各组物质的鉴别方法与结论均正确的是
选项 物质 方法与结论
A 黄铜与铜 相互刻画,留下痕迹的是黄铜
B 高锰酸钾与二氧化锰 取样加热,伸入带火星木条复燃的是高锰酸钾
C 氯化钠与硝酸铵 取样溶解,试管外壁有水雾的是氯化钠
D 稀盐酸与稀硫酸 取样测pH,pH大的是稀盐酸
A.A B.B C.C D.D
二、综合题(共8题)
17.如图所示装置中观察到无色酚酞变红。
(1)物质A是__________(选填序号)。
a.浓氨水 b.稀盐酸 c.食盐水
(2)该实验现象说明构成物质的微粒是____________。
18.分类、类比是学习化学常用的方法。
(1)初中化学有很多实验分类方法,请根据实验方法进行分类,可将_____(填字母)分为一类,分类的依据为_____。
(2)在金属活动性顺序中,(H)前金属单质都可与盐酸和稀硫酸反应生成氢气,但为什么没有加上“硝酸”呢?因为硝酸和金属单质的反应的生成物并不遵循上述规律!例如:镁和稀硝酸反应会生成硝酸镁、一氧化氮和水,镁和浓硝酸反应时生成的气体是一种红棕色的二氧化氮,这说明金属单质和硝酸的反应的气体产物和硝酸的_____有关系,请写出镁和浓硝酸反应的化学方程式_____。
19.在化学晚会上,小华用玻璃棒蘸取一种液体在白纸上画上花,再蘸取另一种液体画上叶,将白纸挂在墙上,又用一种液体向纸上的叶、花喷洒,立即展现出“‘雨’落叶出红花开”的趣味景象。请你想一想,小华先后所用的液体可能是________ ,其化学原理是____________ 。
20.SO2气体不是酸,但能与水反应生成酸。请仿照CO2的性质实验,设计实验予以证明。________________
21.化学在改善人类生存环境,提高生活质量方面起着重要作用。
(改善环境)温室效应和酸雨会威胁珊瑚礁生存。我国开展了南海珊瑚礁生态修复工作。
(1)我们把pH_____5.6(填“>”或“<”或“=”或“≥”或“≤”)的降雨称为酸雨。
(2)为改善生存环境,倡导“低碳”生活。建议使用清洁能源。写出一种常见的清洁能源_____。
(探测资源)近几年,我国向月球背面成功发射新中国通信卫星,助力探测月球资源。
(1)月球上有丰富的核能原料He-3。He的原子结构示意图为_____(填字每序号)。
A
B
C
(2)月球土壤中有天然的铁、铝、银等金属颗粒。根据铁锈蚀的条件分析,铁在月球上不易锈蚀的原因可能是________。
(研发材料)中国芯彰显中国“智”造。芯片的基材主要是高纯硅。
(1)硅元素在元素周期表中的信息如图所示,据图可得到的信息是_____(填字母序号)。
A、硅元素是非金属元素
B、硅元素的元素符号为Si
C、硅元素在地壳里的含量排第二位
(2)下图是某种制备高纯硅的工艺流程图:
①反应I的化学方程式:_______________,该反应属于_____(填基本反应类型)。
②反应II要在无氧环境中进行,原因是___________(答出一种即可)。
③操作I的名称是_____,在实验室,进行该操作中玻璃棒的作用是_____。若滤液 仍浑浊,下列可能的原因有_____(填编号)
a、漏斗下端没有紧靠烧杯内壁
b、过滤器中的液面超过滤纸边缘
c、滤纸没有紧贴漏斗内壁
d、玻璃棒没有靠在三层滤纸处,且将滤纸捅破
④操作I后所得粗硅应充分洗涤,以除去表面可能含有的_____(填化学式)。
⑤上述已知生产流程中,可以循环利用的物质是_____(填化学式)。
22.根据下列装置图回答问题。
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 _______________________ 。
(2)二氧化碳通入紫色石蕊试液,试液变 _______ 色。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置如图)。
①其中二氧化锰的作用是 ___________________________ ;
②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为 _____________ ;KClO3的相对分子质量为 _____ 。计算完全反应后产生氧气的质量为 _________ g。
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是 _________ 。(任写一种情况)
23.草酸(H2C2O4)是一种酸,易溶于水。
(一)草酸的化学性质
(1)草酸溶液的pH______7选填“>”“<”或“=”。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为_________。
(二)CaC2O4热分解探究:部分资料:①CaC2O4CaCO3+CO②草酸钙分解能产生CO2
兴趣小组称一定量的CaC2O4固体,在老师的指导下用如图装置进行实验。
实验一:先通入N2,再加热相应固体,一段时间后停止加热,缓缓通入N2至试管冷却。
(1)装置B增重6.6g,装置B中发生反应的化学方程式为________。
(2)装置C中观察到_______的现象,说明反应生成CO。
实验二:取出实验一后装置A试管中的剩余固体,按图进行①-③实验。
(3)②中温度升高,则剩余固体中含有______,(填化学式)③中产生2.2g气体。
(4)将③中溶液蒸发得CaCl2固体22.2g。结论:取用的CaC2O4固体的质量为______g。
24.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
参考答案
1.C
【详解】
A、肥皂水的pH大于7,显碱性,故A错误;
B、草木灰的pH大于7,显碱性,可改良酸性土壤,故B错误;
C、松花蛋显碱性,而食醋pH小于7,显酸性,因此吃松花蛋时,可以添加食醋去除涩味,故C正确;
D、橘子汁的pH小于7,显酸性,不能使酚酞试液变色,故D错误。
故选C。
2.D
【详解】
A、二氧化碳的验满方法:将燃着的木条放在集气瓶口,不能伸入集气瓶中,故A错;
B、测溶液的pH值,不能将pH试纸伸入溶液中,用玻璃棒蘸取,故B错;
C、给试管内液体加热时,试管内液体量不能超过试管容积的三分之一,要用酒精灯的外焰加热,故C错;
D、量筒读数时,视线应与凹液面的最低处保持水平,故D正确;
故选D。
3.B
【详解】
A、血浆的pH为7.35~7.45,大于7,显碱性。
B、胰液的pH为7.5~8.0,大于7,显碱性。
C、胃液的pH为0.9~1.5,小于7,显酸性。
D、唾液的pH为6.6~7.1,显酸性、中性或碱性。
根据当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,胰液的pH最大,碱性最强。故选B。
4.C
【详解】
A、氢氧化钙和硫酸铜反应生成硫酸钙和氢氧化铜沉淀,当恰好完全反应时,溶液显中性,滴加酚酞不变色,不符合题意;
B、稀盐酸和氯化钠混合溶液现酸性,滴加酚酞不变色,不符合题意;
C、水和氧化钙混合生成氢氧化钙,溶液显碱性,滴加酚酞,溶液变红色,符合题意;
D、氢氧化钠和稀硫酸恰好完全反应,溶液显中性,滴加酚酞不变色,不符合题意。
故选:C。
5.D
【详解】
A、柠檬汁的pH为2.0~3.0,小于7,显酸性,故选项错误;
B、牛奶的pH为6.3~6.6,小于7,显酸性,故选项错误;
C、番茄汁的pH为4.0~4.4,小于7,显酸性,故选项错误
D、鸡蛋清的pH为7.6~8.0,大于7,显碱性,故选项正确。
故选D。
6.D
【详解】
pH>7,显碱性,pH值越大,碱性越强。
故选D。
7.B
【详解】
pH越小,酸性越强,观察选项,草莓的pH=3.0,所以草莓的pH最小,故草莓的酸性最强。故选:B。
8.D
【详解】
pH>7,溶液呈碱性;pH<7,溶液呈酸性;pH=7,溶液呈中性。中碱性最强的是肥皂水。故选D。
9.C
【详解】
试题分析:当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性。酚酞试液遇酸性溶液不变色,遇碱性溶液变红,遇中性溶液不变色。A、牙膏是碱性物质,故选项错误;B、草木灰显碱性,可改良酸性土壤,故选项错误;C、橘子显酸性,胃酸过多的人不宜多吃橘子,故选项正确;D、食醋显酸性,不能使酚酞试液变色,故选项错误,故选C。
10.C
【详解】
酚酞试液遇碱性溶液变红,肥皂水能使酚酞溶液变红色,则肥皂水显碱性,pH>7;白醋显酸性,pH<7;食盐水显中性,pH=7,白醋、肥皂水、食盐水的pH由大到小排列顺序为肥皂水、食盐水、白醋,故选C。
11.A
【详解】
A、由图像可知,开始溶液显碱性,故胶头滴管中所取的溶液为盐酸溶液,滴加到烧杯中的氢氧化钠溶液中,错误;
B、b点pH=7显中性,表示溶液中氢氧化钠和盐酸恰好完全反应,正确;
C、a点pH>7显碱性,表示的溶液显碱性,能使酚酞溶液变红,正确;
D、c点pH<7显酸性,说明盐酸过量,表示的溶液中溶质是生成的NaCl和过量的HCl,正确。
故选A。
12.A
【详解】
托盘天平的精确度为0.1g,所以能用托盘天平称取5.6克氧化铜粉末,故①能达到预期目的;由于分子之间有间隔,用10毫升水和10毫升酒精混合得到的酒精溶液的体积小于20毫升,故②不能达到预期目的;收集氧气的方法有排水法和向上排空气法,由于氧气的密度与空气的密度相差不大,所以用排空气法收集到的氧气纯度没有排水法收集到的氧气纯度高,故③能达到预期目的;用 pH试纸测得的数值只能准确到整数,故④不能达到预期目的;在实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒,所以量取8.2毫升氢氧化钠溶液时应选用量程为10毫升的量筒,故⑤能达到预期目的。
故选A。
13.A
【详解】
“雪碧”是一种无色的碳酸饮料,紫色石蕊试液遇酸变红,所以雪碧遇紫色石蕊试液遇酸变红,碳酸不稳定,受热易分解,生成二氧化碳和水,红色消失,故选A。
14.D
【详解】
A、红磷燃烧,冷却后,打开弹簧夹,水被吸入瓶内,瓶内水面上升约,说明氧气约占空气体积的,而不是质量,故错误;
B、铜片上的白磷与空气中的氧气接触,同时达到了白磷的着火点,所以铜片上的白磷燃烧。热水中的白磷虽然达到了白磷的着火点,但没有与氧气接触,所以热水中的白磷不燃烧,说明燃烧需要氧气,故错误;
C、电解水产生氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,说明水是由氧元素和氢元素组成,故错误;
D、滴有石蕊的溶液呈蓝色,说明溶液为碱性,加入稀盐酸后蓝色变为红色,说明碱性消失变为酸性,所以反应后的溶液中一定不含碱性物质,故正确。故选D。
15.D
【详解】
A、氯化钠溶液呈中性,盐酸呈酸性,酚酞在酸性和中性溶液中为无色,现象相同,无法鉴别,故A错误;
B、二氧化碳和氮气都不支持燃烧,所以它们都能使燃着的木条熄灭,无法鉴别,故B错误;
C、稀盐酸和硫酸都呈酸性,石蕊试液在酸性溶液中为红色,现象相同,无法鉴别,故C错误;
D、稀盐酸与碳酸钠反应有二氧化碳气体生成,与氯化钠不反应,现象不同,可以鉴别,故D正确;
故选:D.
16.B
【详解】
A、合金比组成金属的硬度大,故留下痕迹的是铜,故错误;
B、高锰酸钾加热 可生成氧气,可以使带火星的木条复燃,而二氧化锰不能,故正确;
C、氯化钠溶于水温度几乎不变,而硝酸铵溶于水温度降低,故试管外壁有水珠出现, 故错误;
D、溶液的pH的大小与溶液中含有氢离子的浓度有关,通过测量pH不能确定溶液是稀硫酸还是稀盐酸,故错误。故选B。
17.a 微粒在不断的运动
【详解】
物质A是浓氨水,因为浓氨水具有碱性,能够将无色酚酞变红,该实验现象说明构成物质的微粒是微粒在不断的运动。
18.AC(或BD) 定量实验法(或定性实验法)(两个答案一一对应) 浓度(溶质质量分数) Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
【详解】
(1)A探究空气中氧气含量,B探究了碳的化学性质,C探究了水的组成,D探究了氢氧化钠的性质,根据实验方法进行分类,可将AC分为一类,分类的依据为定量实验法,BD是定性实验法;
(2)镁和稀硝酸反应会生成硝酸镁、一氧化氮和水,镁和浓硝酸反应时生成的气体是一种红棕色的二氧化氮,这说明金属单质和硝酸的反应的气体产物和硝酸的浓度有关系,镁和浓硝酸反应生成硝酸镁、水和二氧化氮,反应的化学方程式Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O 。
19. 稀疏酸、氢氧化钠溶液、紫色石蕊试液 石蕊遇酸显红色,遇碱显蓝色
【详解】
根据紫色石蕊试液的特性可知,紫色石蕊试液遇酸变红;紫色石蕊试液遇碱变蓝,所以应蘸取酸性溶液画上花,碱性溶液画上叶,然后向白纸上喷洒石蕊即可.
故答案为: 稀疏酸、氢氧化钠溶液、紫色石蕊试液,石蕊遇酸显红色,遇碱显蓝色
20.
实验操作 现象
将干燥的紫色石蕊纸花放入装有SO2 的集气瓶中 纸花颜色不变
将湿润的紫色石蕊纸花放入装有SO2 的集气瓶中 纸花变红
【详解】
由题,变量为水的有无,然后可以用酸碱指示剂来判断是否有酸生成。
21.< 太阳能、风能、水能等 B 月球上缺少氧气和水,故铁不易生锈 A、B 置换 防止爆炸(或防止生成的硅被氧化) 过滤 引流 bd MgCl2 HCl
【详解】
(1)酸雨是雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化合物等物质,形成了pH低于5.6的酸性降水,pH<5.6的降雨称为酸雨;
(2)清洁能源,即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和“可再生能源”,太阳能、风能、水能等属于清洁能源;
探测资源:
(1)He的原子序数为2,原子结构示意图为,答案选B;
(2)铁在潮湿的空气中容易生锈,月球上缺少氧气和水,故铁不易生锈;
研发材料:
(1)从图中可以看出硅的元素符号,元素名称,原子序数,相对原子质量等;
A、从图中可以看出硅元素是非金属元素,故A正确;
B、从图中可以看出硅元素的元素符号为Si,故B正确;
C、硅元素在地壳里的含量排第二位,但是从图中无法得出,故C错误;
答案选AB。
(2)①反应I是二氧化硅和镁在高温下反应制得氧化镁和硅,化学方程式为:,该反应是单质和化合物生成另一种单质和化合物的反应,属于置换反应;
②反应II是四氯化硅和氢气在高温下经得到高纯硅和氯化氢,反应物中有氢气,若含有氧气会引起爆炸;生成的是高纯度的硅,容易被氧气氧化,要在无氧环境中进行;
③操作I是氯化镁和粗硅分开,名称是过滤,进行该操作中玻璃棒的作用是引流;
a、漏斗下端没有紧靠烧杯内壁,会使液体飞溅,滤液不会浑浊,故a不符合题意;
b、过滤器中的液面超过滤纸边缘,会使溶液从滤纸和漏斗之间留下,滤液会浑浊,故b符合题意;
c、滤纸没有紧贴漏斗内壁,会使过滤速率过慢,滤液不会浑浊,故c不符合题意;
d、玻璃棒没有靠在三层滤纸处,且将滤纸捅破,会使滤液过滤不干净,滤液会浑浊,故d符合题意;
答案选bd;
④过滤后所得溶液为氯化镁溶液,粗硅应充分洗涤,以除去表面可能含有的MgCl2;
⑤上述已知生产流程中,盐酸加入流程中,最后又生成了氯化氢气体,故可以循环利用的物质是HCl。
22.CaCO3+2HCl=CaCl2+H2O+CO2↑ 红色 做催化剂 2KClO32KCl + 3O2 ↑; 122.5 4.8 一加热就马上收集气体。
【详解】
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;(2)二氧化碳通入紫色石蕊试液,试液变红色;因为二氧化碳溶于水生成碳酸;(3)①其中二氧化锰的作用是做催化剂;②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为2KClO3 2KCl + 3O2 ↑,KClO3的相对分子质量为122.5,反应后产生氧气的质量为X,
2KClO3 2KCl + 3O2 ↑
245 96
122.5 X
245/96=122.5/X
X=4.8g
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确)的原因可能是一加热就马上收集气体。
23.< H2C2O4+Ca(OH)2=CaC2O4+2H2O 2NaOH+CO2=Na2CO3+H2O 黑色固体变红色 CaO 25.6
【详解】
(一)草酸的化学性质
(1)草酸是一种酸,其溶液的pH<7。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为:H2C2O4+Ca(OH)2=CaC2O4+2H2O。
(二)(1)装置B增重6.6g,装置B中发生反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。
(2)CO具有还原性,在加热条件下,能与氧化铜反应生成铜和二氧化碳,如果装置C中观察到黑色固体变红色的现象,说明反应生成CO。
(4)根据质量守恒定律,CaCl2与CaC2O4的对应关系为:CaCl2~CaC2O4,设将③中溶液蒸发得CaCl2固体22.2g,取用的CaC2O4固体的质量为x。
,x=25.6g
24.SO2有一定的毒性 紫 20 是
【详解】
(1)SO2对人体有一定的毒性,所以SO2作为食品添加剂须严格控制用量,故填SO2有一定的毒性。
(2)①由步骤1、2可知,H2O2溶液将葡萄酒中的SO2完全转化成硫酸,且指示剂在pH<7的溶液中显紫色,所以步骤2中,滴入指示剂后溶液呈紫色,故填紫。
②设加入水的质量为x,10g×30%=(10g+x)×10%,x=20g,故填20。
③解:设100mL该葡萄酒中的SO2的质量为x
64:98=x:14.7mg
x=9.6mg
1L该葡萄酒中的SO2的质量为9.6mg/100mL×1000mL=96mg<250mg,所以该葡萄酒中SO2的含量符合国家标准,故填是。
一、选择题(共16题)
1.测定生活中一些物质的pH,结果如下:
参照以上图示,下列说法正确的是
A.肥皂水是中性物质 B.草木灰可改良碱性土壤
C.吃松花蛋一般添加食醋去除涩味 D.橘子汁能使酚酞试液变红
2.下列实验操作正确的是
A.CO2验满 B.测溶液pH
C.加热液体 D.量筒读数
3.下列是人体中几种体液的正常pH,碱性最强的是
A.血浆(7.35~7.45) B.胰液(7.5~8.0)
C.胃液(0.9~1.5) D.唾液(6.6~7.1)
4.下列各组混合物中加入无色酚酞溶液后,一定有明显现象是
A.氢氧化钙溶液、硫酸铜溶液
B.稀盐酸、氯化钠溶液
C.水、氧化钙
D.氢氧化钠溶液、稀硫酸
5.一些食物的pH范围如下,其中呈碱性的是
A.柠檬汁(2.0-3.0)
B.牛奶(6.3-6.6)
C.番茄汁(4.0-4.4)
D.鸡蛋清(7.6-8.0)
6.一些食物的近似pH如下,其中碱性最强的是
A.柠檬汁2.2~2.4 B.苹果汁2.9~3.3
C.番茄汁4.0~4.4 D.鸡蛋清7.6~8.0
7.下列食物中,酸性最强的是
A.牛奶(pH=6.4) B.草莓(pH=3.0)
C.木瓜(pH=5.5) D.西红柿(pH=4.3)
8.下列食品和日用品的pH,其中碱性最强的是
A.苹果汁:3.0 B.西红柿汁:4.4 C.鸡蛋清:7.8 D.肥皂水:9.5
9.测定生活中一些物质的pH,结果如下:
参照以上图示判断,下列说法正确的是
A.牙膏是中性物质 B.草木灰可改良碱性土壤
C.胃酸过多的人不宜多吃橘子 D.食醋能使无色酚酞变红
10.生活中常见的三种物质:①白醋,②肥皂水,③食盐水。白醋显酸性,肥皂水能使酚酞溶液变红色,食盐水显中性。它们的pH由大到小排列,正确的是
A.①②③
B.③②①
C.②③①
D.①③②
11.如图一所示为稀盐酸和氢氧化钠溶液反应的实验操作,图二为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是
A.胶头滴管中所取的溶液为氢氧化钠溶液
B.b点表示溶液中氢氧化钠和盐酸恰好完全反应
C.a点表示的溶液能使酚酞溶液变红
D.c点表示的溶液中溶质是NaCl和HCl
12.下列实验操作能达到预期目的是
①用托盘天平称取5.6克氧化铜粉末
②用10毫升水和10毫升酒精配制成20毫升酒精溶液
③用排水集气法收集到较纯净的氧气
④用pH试纸测得正常雨水的pH值为6.7
⑤用10毫升量筒量取8.2毫升氢氧化钠溶液
A.①③⑤ B.①②③⑤ C.①②③④ D.①③④⑤
13.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后加热,溶液颜色的变化是
A.先变红后变紫 B.变红后颜色不再改变
C.先变蓝后变紫 D.先变红色后变无色
14.下列实验中,现象与结论对应关系正确的是
实验 现象 结论
A 冷却后,打开弹簧夹,水被吸入瓶内,瓶内水面上升约1/5 氧气约占空气质量的1/5
B 铜片上的白磷燃烧,热水中的白磷不燃烧 燃烧需要达到可燃物的着火点
C a中的气体能燃烧,产生淡蓝色火焰,b中的气体能使燃着的木条燃烧更旺 水是由氧气和氢气组成
D 滴有紫色石蕊的溶液呈蓝色,加入稀盐酸后蓝色变为红色 反应后的溶液中一定不含碱性物质
A.A B.B C.C D.D
15.下列鉴别物质的方法中切实可行的是
A.用酚酞溶液鉴别氯化钠溶液和盐酸
B.用燃着的木条鉴别CO2和N2
C.用石蕊溶液鉴别稀盐酸和硫酸
D.用稀盐酸鉴别碳酸钠和氯化钠
16.下列各组物质的鉴别方法与结论均正确的是
选项 物质 方法与结论
A 黄铜与铜 相互刻画,留下痕迹的是黄铜
B 高锰酸钾与二氧化锰 取样加热,伸入带火星木条复燃的是高锰酸钾
C 氯化钠与硝酸铵 取样溶解,试管外壁有水雾的是氯化钠
D 稀盐酸与稀硫酸 取样测pH,pH大的是稀盐酸
A.A B.B C.C D.D
二、综合题(共8题)
17.如图所示装置中观察到无色酚酞变红。
(1)物质A是__________(选填序号)。
a.浓氨水 b.稀盐酸 c.食盐水
(2)该实验现象说明构成物质的微粒是____________。
18.分类、类比是学习化学常用的方法。
(1)初中化学有很多实验分类方法,请根据实验方法进行分类,可将_____(填字母)分为一类,分类的依据为_____。
(2)在金属活动性顺序中,(H)前金属单质都可与盐酸和稀硫酸反应生成氢气,但为什么没有加上“硝酸”呢?因为硝酸和金属单质的反应的生成物并不遵循上述规律!例如:镁和稀硝酸反应会生成硝酸镁、一氧化氮和水,镁和浓硝酸反应时生成的气体是一种红棕色的二氧化氮,这说明金属单质和硝酸的反应的气体产物和硝酸的_____有关系,请写出镁和浓硝酸反应的化学方程式_____。
19.在化学晚会上,小华用玻璃棒蘸取一种液体在白纸上画上花,再蘸取另一种液体画上叶,将白纸挂在墙上,又用一种液体向纸上的叶、花喷洒,立即展现出“‘雨’落叶出红花开”的趣味景象。请你想一想,小华先后所用的液体可能是________ ,其化学原理是____________ 。
20.SO2气体不是酸,但能与水反应生成酸。请仿照CO2的性质实验,设计实验予以证明。________________
21.化学在改善人类生存环境,提高生活质量方面起着重要作用。
(改善环境)温室效应和酸雨会威胁珊瑚礁生存。我国开展了南海珊瑚礁生态修复工作。
(1)我们把pH_____5.6(填“>”或“<”或“=”或“≥”或“≤”)的降雨称为酸雨。
(2)为改善生存环境,倡导“低碳”生活。建议使用清洁能源。写出一种常见的清洁能源_____。
(探测资源)近几年,我国向月球背面成功发射新中国通信卫星,助力探测月球资源。
(1)月球上有丰富的核能原料He-3。He的原子结构示意图为_____(填字每序号)。
A
B
C
(2)月球土壤中有天然的铁、铝、银等金属颗粒。根据铁锈蚀的条件分析,铁在月球上不易锈蚀的原因可能是________。
(研发材料)中国芯彰显中国“智”造。芯片的基材主要是高纯硅。
(1)硅元素在元素周期表中的信息如图所示,据图可得到的信息是_____(填字母序号)。
A、硅元素是非金属元素
B、硅元素的元素符号为Si
C、硅元素在地壳里的含量排第二位
(2)下图是某种制备高纯硅的工艺流程图:
①反应I的化学方程式:_______________,该反应属于_____(填基本反应类型)。
②反应II要在无氧环境中进行,原因是___________(答出一种即可)。
③操作I的名称是_____,在实验室,进行该操作中玻璃棒的作用是_____。若滤液 仍浑浊,下列可能的原因有_____(填编号)
a、漏斗下端没有紧靠烧杯内壁
b、过滤器中的液面超过滤纸边缘
c、滤纸没有紧贴漏斗内壁
d、玻璃棒没有靠在三层滤纸处,且将滤纸捅破
④操作I后所得粗硅应充分洗涤,以除去表面可能含有的_____(填化学式)。
⑤上述已知生产流程中,可以循环利用的物质是_____(填化学式)。
22.根据下列装置图回答问题。
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 _______________________ 。
(2)二氧化碳通入紫色石蕊试液,试液变 _______ 色。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置如图)。
①其中二氧化锰的作用是 ___________________________ ;
②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为 _____________ ;KClO3的相对分子质量为 _____ 。计算完全反应后产生氧气的质量为 _________ g。
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是 _________ 。(任写一种情况)
23.草酸(H2C2O4)是一种酸,易溶于水。
(一)草酸的化学性质
(1)草酸溶液的pH______7选填“>”“<”或“=”。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为_________。
(二)CaC2O4热分解探究:部分资料:①CaC2O4CaCO3+CO②草酸钙分解能产生CO2
兴趣小组称一定量的CaC2O4固体,在老师的指导下用如图装置进行实验。
实验一:先通入N2,再加热相应固体,一段时间后停止加热,缓缓通入N2至试管冷却。
(1)装置B增重6.6g,装置B中发生反应的化学方程式为________。
(2)装置C中观察到_______的现象,说明反应生成CO。
实验二:取出实验一后装置A试管中的剩余固体,按图进行①-③实验。
(3)②中温度升高,则剩余固体中含有______,(填化学式)③中产生2.2g气体。
(4)将③中溶液蒸发得CaCl2固体22.2g。结论:取用的CaC2O4固体的质量为______g。
24.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
参考答案
1.C
【详解】
A、肥皂水的pH大于7,显碱性,故A错误;
B、草木灰的pH大于7,显碱性,可改良酸性土壤,故B错误;
C、松花蛋显碱性,而食醋pH小于7,显酸性,因此吃松花蛋时,可以添加食醋去除涩味,故C正确;
D、橘子汁的pH小于7,显酸性,不能使酚酞试液变色,故D错误。
故选C。
2.D
【详解】
A、二氧化碳的验满方法:将燃着的木条放在集气瓶口,不能伸入集气瓶中,故A错;
B、测溶液的pH值,不能将pH试纸伸入溶液中,用玻璃棒蘸取,故B错;
C、给试管内液体加热时,试管内液体量不能超过试管容积的三分之一,要用酒精灯的外焰加热,故C错;
D、量筒读数时,视线应与凹液面的最低处保持水平,故D正确;
故选D。
3.B
【详解】
A、血浆的pH为7.35~7.45,大于7,显碱性。
B、胰液的pH为7.5~8.0,大于7,显碱性。
C、胃液的pH为0.9~1.5,小于7,显酸性。
D、唾液的pH为6.6~7.1,显酸性、中性或碱性。
根据当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,胰液的pH最大,碱性最强。故选B。
4.C
【详解】
A、氢氧化钙和硫酸铜反应生成硫酸钙和氢氧化铜沉淀,当恰好完全反应时,溶液显中性,滴加酚酞不变色,不符合题意;
B、稀盐酸和氯化钠混合溶液现酸性,滴加酚酞不变色,不符合题意;
C、水和氧化钙混合生成氢氧化钙,溶液显碱性,滴加酚酞,溶液变红色,符合题意;
D、氢氧化钠和稀硫酸恰好完全反应,溶液显中性,滴加酚酞不变色,不符合题意。
故选:C。
5.D
【详解】
A、柠檬汁的pH为2.0~3.0,小于7,显酸性,故选项错误;
B、牛奶的pH为6.3~6.6,小于7,显酸性,故选项错误;
C、番茄汁的pH为4.0~4.4,小于7,显酸性,故选项错误
D、鸡蛋清的pH为7.6~8.0,大于7,显碱性,故选项正确。
故选D。
6.D
【详解】
pH>7,显碱性,pH值越大,碱性越强。
故选D。
7.B
【详解】
pH越小,酸性越强,观察选项,草莓的pH=3.0,所以草莓的pH最小,故草莓的酸性最强。故选:B。
8.D
【详解】
pH>7,溶液呈碱性;pH<7,溶液呈酸性;pH=7,溶液呈中性。中碱性最强的是肥皂水。故选D。
9.C
【详解】
试题分析:当溶液的pH等于7时,呈中性.当溶液的pH大于7时,呈碱性.当溶液的pH小于7时,呈酸性。酚酞试液遇酸性溶液不变色,遇碱性溶液变红,遇中性溶液不变色。A、牙膏是碱性物质,故选项错误;B、草木灰显碱性,可改良酸性土壤,故选项错误;C、橘子显酸性,胃酸过多的人不宜多吃橘子,故选项正确;D、食醋显酸性,不能使酚酞试液变色,故选项错误,故选C。
10.C
【详解】
酚酞试液遇碱性溶液变红,肥皂水能使酚酞溶液变红色,则肥皂水显碱性,pH>7;白醋显酸性,pH<7;食盐水显中性,pH=7,白醋、肥皂水、食盐水的pH由大到小排列顺序为肥皂水、食盐水、白醋,故选C。
11.A
【详解】
A、由图像可知,开始溶液显碱性,故胶头滴管中所取的溶液为盐酸溶液,滴加到烧杯中的氢氧化钠溶液中,错误;
B、b点pH=7显中性,表示溶液中氢氧化钠和盐酸恰好完全反应,正确;
C、a点pH>7显碱性,表示的溶液显碱性,能使酚酞溶液变红,正确;
D、c点pH<7显酸性,说明盐酸过量,表示的溶液中溶质是生成的NaCl和过量的HCl,正确。
故选A。
12.A
【详解】
托盘天平的精确度为0.1g,所以能用托盘天平称取5.6克氧化铜粉末,故①能达到预期目的;由于分子之间有间隔,用10毫升水和10毫升酒精混合得到的酒精溶液的体积小于20毫升,故②不能达到预期目的;收集氧气的方法有排水法和向上排空气法,由于氧气的密度与空气的密度相差不大,所以用排空气法收集到的氧气纯度没有排水法收集到的氧气纯度高,故③能达到预期目的;用 pH试纸测得的数值只能准确到整数,故④不能达到预期目的;在实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒,所以量取8.2毫升氢氧化钠溶液时应选用量程为10毫升的量筒,故⑤能达到预期目的。
故选A。
13.A
【详解】
“雪碧”是一种无色的碳酸饮料,紫色石蕊试液遇酸变红,所以雪碧遇紫色石蕊试液遇酸变红,碳酸不稳定,受热易分解,生成二氧化碳和水,红色消失,故选A。
14.D
【详解】
A、红磷燃烧,冷却后,打开弹簧夹,水被吸入瓶内,瓶内水面上升约,说明氧气约占空气体积的,而不是质量,故错误;
B、铜片上的白磷与空气中的氧气接触,同时达到了白磷的着火点,所以铜片上的白磷燃烧。热水中的白磷虽然达到了白磷的着火点,但没有与氧气接触,所以热水中的白磷不燃烧,说明燃烧需要氧气,故错误;
C、电解水产生氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,说明水是由氧元素和氢元素组成,故错误;
D、滴有石蕊的溶液呈蓝色,说明溶液为碱性,加入稀盐酸后蓝色变为红色,说明碱性消失变为酸性,所以反应后的溶液中一定不含碱性物质,故正确。故选D。
15.D
【详解】
A、氯化钠溶液呈中性,盐酸呈酸性,酚酞在酸性和中性溶液中为无色,现象相同,无法鉴别,故A错误;
B、二氧化碳和氮气都不支持燃烧,所以它们都能使燃着的木条熄灭,无法鉴别,故B错误;
C、稀盐酸和硫酸都呈酸性,石蕊试液在酸性溶液中为红色,现象相同,无法鉴别,故C错误;
D、稀盐酸与碳酸钠反应有二氧化碳气体生成,与氯化钠不反应,现象不同,可以鉴别,故D正确;
故选:D.
16.B
【详解】
A、合金比组成金属的硬度大,故留下痕迹的是铜,故错误;
B、高锰酸钾加热 可生成氧气,可以使带火星的木条复燃,而二氧化锰不能,故正确;
C、氯化钠溶于水温度几乎不变,而硝酸铵溶于水温度降低,故试管外壁有水珠出现, 故错误;
D、溶液的pH的大小与溶液中含有氢离子的浓度有关,通过测量pH不能确定溶液是稀硫酸还是稀盐酸,故错误。故选B。
17.a 微粒在不断的运动
【详解】
物质A是浓氨水,因为浓氨水具有碱性,能够将无色酚酞变红,该实验现象说明构成物质的微粒是微粒在不断的运动。
18.AC(或BD) 定量实验法(或定性实验法)(两个答案一一对应) 浓度(溶质质量分数) Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O
【详解】
(1)A探究空气中氧气含量,B探究了碳的化学性质,C探究了水的组成,D探究了氢氧化钠的性质,根据实验方法进行分类,可将AC分为一类,分类的依据为定量实验法,BD是定性实验法;
(2)镁和稀硝酸反应会生成硝酸镁、一氧化氮和水,镁和浓硝酸反应时生成的气体是一种红棕色的二氧化氮,这说明金属单质和硝酸的反应的气体产物和硝酸的浓度有关系,镁和浓硝酸反应生成硝酸镁、水和二氧化氮,反应的化学方程式Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O 。
19. 稀疏酸、氢氧化钠溶液、紫色石蕊试液 石蕊遇酸显红色,遇碱显蓝色
【详解】
根据紫色石蕊试液的特性可知,紫色石蕊试液遇酸变红;紫色石蕊试液遇碱变蓝,所以应蘸取酸性溶液画上花,碱性溶液画上叶,然后向白纸上喷洒石蕊即可.
故答案为: 稀疏酸、氢氧化钠溶液、紫色石蕊试液,石蕊遇酸显红色,遇碱显蓝色
20.
实验操作 现象
将干燥的紫色石蕊纸花放入装有SO2 的集气瓶中 纸花颜色不变
将湿润的紫色石蕊纸花放入装有SO2 的集气瓶中 纸花变红
【详解】
由题,变量为水的有无,然后可以用酸碱指示剂来判断是否有酸生成。
21.< 太阳能、风能、水能等 B 月球上缺少氧气和水,故铁不易生锈 A、B 置换 防止爆炸(或防止生成的硅被氧化) 过滤 引流 bd MgCl2 HCl
【详解】
(1)酸雨是雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化合物等物质,形成了pH低于5.6的酸性降水,pH<5.6的降雨称为酸雨;
(2)清洁能源,即绿色能源,是指不排放污染物、能够直接用于生产生活的能源,它包括核能和“可再生能源”,太阳能、风能、水能等属于清洁能源;
探测资源:
(1)He的原子序数为2,原子结构示意图为,答案选B;
(2)铁在潮湿的空气中容易生锈,月球上缺少氧气和水,故铁不易生锈;
研发材料:
(1)从图中可以看出硅的元素符号,元素名称,原子序数,相对原子质量等;
A、从图中可以看出硅元素是非金属元素,故A正确;
B、从图中可以看出硅元素的元素符号为Si,故B正确;
C、硅元素在地壳里的含量排第二位,但是从图中无法得出,故C错误;
答案选AB。
(2)①反应I是二氧化硅和镁在高温下反应制得氧化镁和硅,化学方程式为:,该反应是单质和化合物生成另一种单质和化合物的反应,属于置换反应;
②反应II是四氯化硅和氢气在高温下经得到高纯硅和氯化氢,反应物中有氢气,若含有氧气会引起爆炸;生成的是高纯度的硅,容易被氧气氧化,要在无氧环境中进行;
③操作I是氯化镁和粗硅分开,名称是过滤,进行该操作中玻璃棒的作用是引流;
a、漏斗下端没有紧靠烧杯内壁,会使液体飞溅,滤液不会浑浊,故a不符合题意;
b、过滤器中的液面超过滤纸边缘,会使溶液从滤纸和漏斗之间留下,滤液会浑浊,故b符合题意;
c、滤纸没有紧贴漏斗内壁,会使过滤速率过慢,滤液不会浑浊,故c不符合题意;
d、玻璃棒没有靠在三层滤纸处,且将滤纸捅破,会使滤液过滤不干净,滤液会浑浊,故d符合题意;
答案选bd;
④过滤后所得溶液为氯化镁溶液,粗硅应充分洗涤,以除去表面可能含有的MgCl2;
⑤上述已知生产流程中,盐酸加入流程中,最后又生成了氯化氢气体,故可以循环利用的物质是HCl。
22.CaCO3+2HCl=CaCl2+H2O+CO2↑ 红色 做催化剂 2KClO32KCl + 3O2 ↑; 122.5 4.8 一加热就马上收集气体。
【详解】
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;(2)二氧化碳通入紫色石蕊试液,试液变红色;因为二氧化碳溶于水生成碳酸;(3)①其中二氧化锰的作用是做催化剂;②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为2KClO3 2KCl + 3O2 ↑,KClO3的相对分子质量为122.5,反应后产生氧气的质量为X,
2KClO3 2KCl + 3O2 ↑
245 96
122.5 X
245/96=122.5/X
X=4.8g
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确)的原因可能是一加热就马上收集气体。
23.< H2C2O4+Ca(OH)2=CaC2O4+2H2O 2NaOH+CO2=Na2CO3+H2O 黑色固体变红色 CaO 25.6
【详解】
(一)草酸的化学性质
(1)草酸是一种酸,其溶液的pH<7。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为:H2C2O4+Ca(OH)2=CaC2O4+2H2O。
(二)(1)装置B增重6.6g,装置B中发生反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O。
(2)CO具有还原性,在加热条件下,能与氧化铜反应生成铜和二氧化碳,如果装置C中观察到黑色固体变红色的现象,说明反应生成CO。
(4)根据质量守恒定律,CaCl2与CaC2O4的对应关系为:CaCl2~CaC2O4,设将③中溶液蒸发得CaCl2固体22.2g,取用的CaC2O4固体的质量为x。
,x=25.6g
24.SO2有一定的毒性 紫 20 是
【详解】
(1)SO2对人体有一定的毒性,所以SO2作为食品添加剂须严格控制用量,故填SO2有一定的毒性。
(2)①由步骤1、2可知,H2O2溶液将葡萄酒中的SO2完全转化成硫酸,且指示剂在pH<7的溶液中显紫色,所以步骤2中,滴入指示剂后溶液呈紫色,故填紫。
②设加入水的质量为x,10g×30%=(10g+x)×10%,x=20g,故填20。
③解:设100mL该葡萄酒中的SO2的质量为x
64:98=x:14.7mg
x=9.6mg
1L该葡萄酒中的SO2的质量为9.6mg/100mL×1000mL=96mg<250mg,所以该葡萄酒中SO2的含量符合国家标准,故填是。
