化学九年级-第8单元【复习课程】金属和金属材料(21张PPT)
文档属性
| 名称 | 化学九年级-第8单元【复习课程】金属和金属材料(21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-05 16:27:20 | ||
图片预览







文档简介
(共21张PPT)
【复习课程】金属和金属材料
初三 化学
扫码获取更多
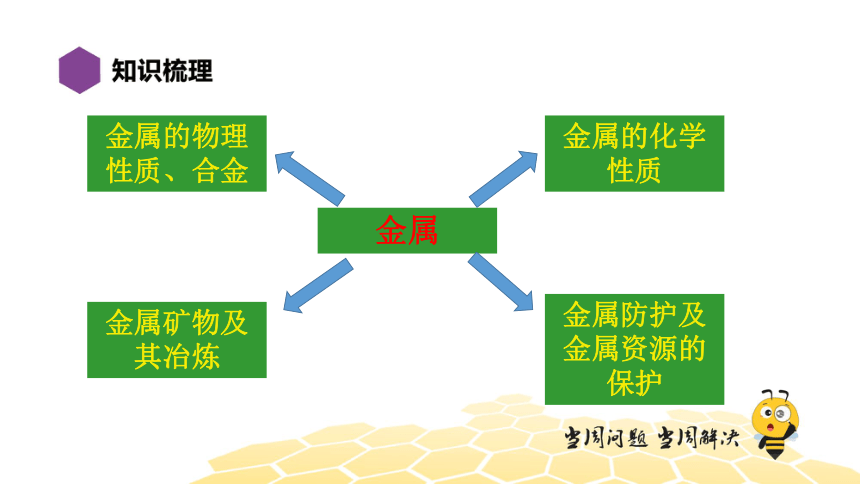
金属
金属的化学性质
金属的物理性质、合金
金属矿物及其冶炼
金属防护及金属资源的保护
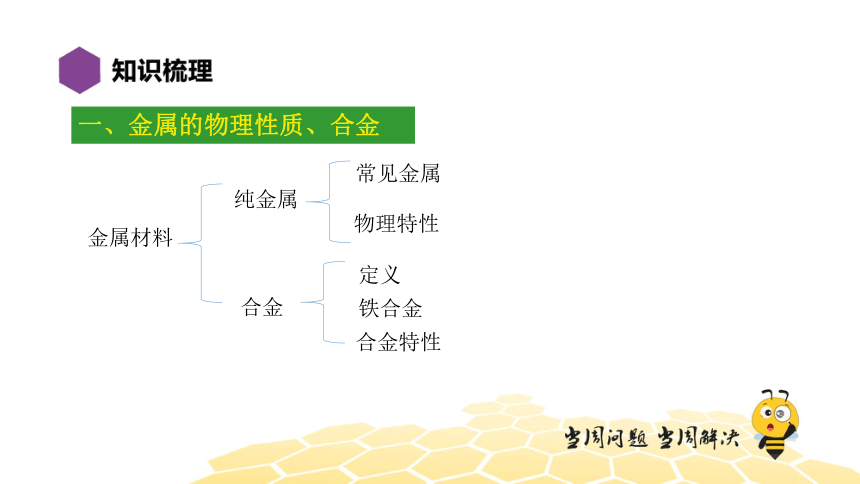
一、金属的物理性质、合金
金属材料
纯金属
合金
常见金属
物理特性
定义
铁合金
合金特性
二、金属的化学性质
1、大多数金属能与氧气反应
2Mg + O2 = 2MgO
点燃
点燃
3Fe + 2O2 = Fe3O4
4Al + 3O2 = 2Al2O3
2Cu + O2 = 2CuO
2、活泼金属(排在氢前)能与稀酸反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2
Fe + H2SO4 = FeSO4 + H2
Mg + H2SO4 = MgSO4 + H2
↑
↑
↑
镁
铁
锌
铜
应用:实验室制取氢气的原理
3、金属与金属化合物溶液反应(强换弱)
Fe + CuSO4 = FeSO4 + Cu
湿法冶金术的先驱
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
1.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
2.在金属活动性顺序中,活动性强的金属能把活动性弱的金属从它们化合物的溶液里置换出来
金属活动性顺序的应用
金属活动性 强 弱
三、金属矿物及其冶炼
1、常见的金属矿物
2、工业炼铁
原料:铁矿石、焦炭、热空气、石灰石
设备:高炉
原理:
Fe2O3 + 3CO = 2Fe + 3CO2
高温
Fe3O4 + 4CO = 3Fe + 4CO2
高温
四、金属防护及金属资源的保护
1、铁生锈的条件:铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化。
2、防止铁生锈的方法
(1)改善腐蚀环境
(2)形成保护层
(3)改变金属的内部结构
3、保护金属资源的措施:
①防止金属的腐蚀;
②废旧金属的回收与利用;
③有计划、合理地开采矿物,严禁不顾国家利益的乱采矿;
④寻找金属的代用品。
下列关于金属的说法正确的是( )
A. 人类使用金属铝的年代早于铜、铁
B. “真金不怕火炼”表明金(Au)在高温条件下也很难与氧气反应
C. 通过高炉炼得的铁为纯铁
D. 铁是地壳中含量最多的金属元素
答案:B
右图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断错误的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
答案:B
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所用的试剂如下,其中你认为不可行的是( )
A.Fe、Ag、CuSO4溶液
B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液
D.Cu、Ag、Fe、稀盐酸
答案:D
早在春秋战国时期,我国就开始生产和使用铁器。下列说法正确的是( )
A.铁和铁合金都容易被腐蚀
B.高炉炼铁是利用还原剂在高温下把铁从铁矿石中还原出来
C.配制波尔多液的原料是硫酸铜溶液,可用铁桶配制
D.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁
答案:B
铁是应用最广泛的金属。
(1)为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。一段时间后,甲中铁丝发生锈蚀且试管中液面上升,乙和丙中均无明显变化。由此得出铁丝锈蚀的过程,实际上是铁丝与 、 发生化学反应的过程。
(2)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,而“金龙纹手镯”光彩夺目,完好无损。这说明铁的金属活动性比金的 (填“强”或“弱”)
答案:氧气、水;强
【复习课程】金属和金属材料
初三 化学
扫码获取更多
金属
金属的化学性质
金属的物理性质、合金
金属矿物及其冶炼
金属防护及金属资源的保护
一、金属的物理性质、合金
金属材料
纯金属
合金
常见金属
物理特性
定义
铁合金
合金特性
二、金属的化学性质
1、大多数金属能与氧气反应
2Mg + O2 = 2MgO
点燃
点燃
3Fe + 2O2 = Fe3O4
4Al + 3O2 = 2Al2O3
2Cu + O2 = 2CuO
2、活泼金属(排在氢前)能与稀酸反应
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2
Fe + H2SO4 = FeSO4 + H2
Mg + H2SO4 = MgSO4 + H2
↑
↑
↑
镁
铁
锌
铜
应用:实验室制取氢气的原理
3、金属与金属化合物溶液反应(强换弱)
Fe + CuSO4 = FeSO4 + Cu
湿法冶金术的先驱
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
1.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
2.在金属活动性顺序中,活动性强的金属能把活动性弱的金属从它们化合物的溶液里置换出来
金属活动性顺序的应用
金属活动性 强 弱
三、金属矿物及其冶炼
1、常见的金属矿物
2、工业炼铁
原料:铁矿石、焦炭、热空气、石灰石
设备:高炉
原理:
Fe2O3 + 3CO = 2Fe + 3CO2
高温
Fe3O4 + 4CO = 3Fe + 4CO2
高温
四、金属防护及金属资源的保护
1、铁生锈的条件:铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化。
2、防止铁生锈的方法
(1)改善腐蚀环境
(2)形成保护层
(3)改变金属的内部结构
3、保护金属资源的措施:
①防止金属的腐蚀;
②废旧金属的回收与利用;
③有计划、合理地开采矿物,严禁不顾国家利益的乱采矿;
④寻找金属的代用品。
下列关于金属的说法正确的是( )
A. 人类使用金属铝的年代早于铜、铁
B. “真金不怕火炼”表明金(Au)在高温条件下也很难与氧气反应
C. 通过高炉炼得的铁为纯铁
D. 铁是地壳中含量最多的金属元素
答案:B
右图是探究铁锈蚀条件的装置。调节L端与R端的液面高度一致,塞紧木塞,一周后观察。下列推断错误的是( )
A.b管中铁钉不会锈蚀
B.L端与R端液面高度仍然保持一致
C.该实验说明铁锈蚀与空气、水有关
D.若将a管中的水改为食盐水能加快铁的锈蚀
答案:B
某化学兴趣小组为测定Fe、Cu、Ag三种金属的活动性顺序设计了四种方案,每种方案所用的试剂如下,其中你认为不可行的是( )
A.Fe、Ag、CuSO4溶液
B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液
D.Cu、Ag、Fe、稀盐酸
答案:D
早在春秋战国时期,我国就开始生产和使用铁器。下列说法正确的是( )
A.铁和铁合金都容易被腐蚀
B.高炉炼铁是利用还原剂在高温下把铁从铁矿石中还原出来
C.配制波尔多液的原料是硫酸铜溶液,可用铁桶配制
D.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁
答案:B
铁是应用最广泛的金属。
(1)为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。一段时间后,甲中铁丝发生锈蚀且试管中液面上升,乙和丙中均无明显变化。由此得出铁丝锈蚀的过程,实际上是铁丝与 、 发生化学反应的过程。
(2)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,而“金龙纹手镯”光彩夺目,完好无损。这说明铁的金属活动性比金的 (填“强”或“弱”)
答案:氧气、水;强
同课章节目录
