高二化学 酸碱中和滴定
图片预览




文档简介
课件17张PPT。酸碱中和滴定
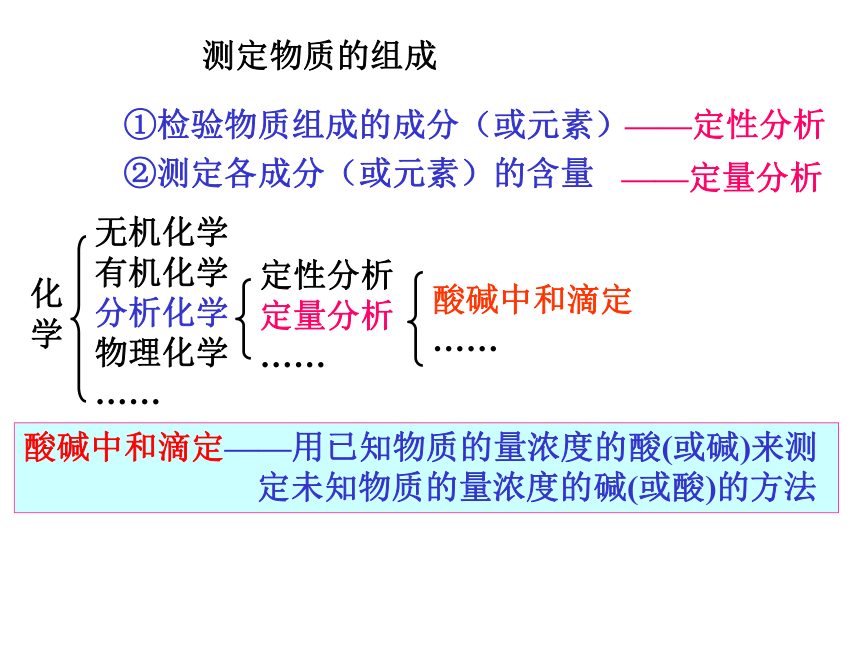
(一)测定物质的组成①检验物质组成的成分(或元素)
②测定各成分(或元素)的含量——定性分析化学无机化学 有机化学 分析化学 物理化学 ……定性分析 定量分析 ……酸碱中和滴定 ……酸碱中和滴定——用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法——定量分析一、酸碱中和滴定原理1、酸碱中和反应的实质H++OH-=H2O该离子方程式代表的意义是:强酸与强碱中和反应生成可溶性的盐和水。2、酸碱中和反应时量的关系1)酸碱完全中和时
A、溶液呈中性
B、酸碱物质的量相等
C、酸溶液中的H+与碱溶液中的OH-的物质的量相等
D、酸可提供的H+与碱可提供的OH-的物质的量相等 酸可提供的H+与碱可提供的OH-的物质的量相等
比较: 完全中和时消耗NaOH的量多少
①相同体积和物质的量浓度的盐酸和醋酸;
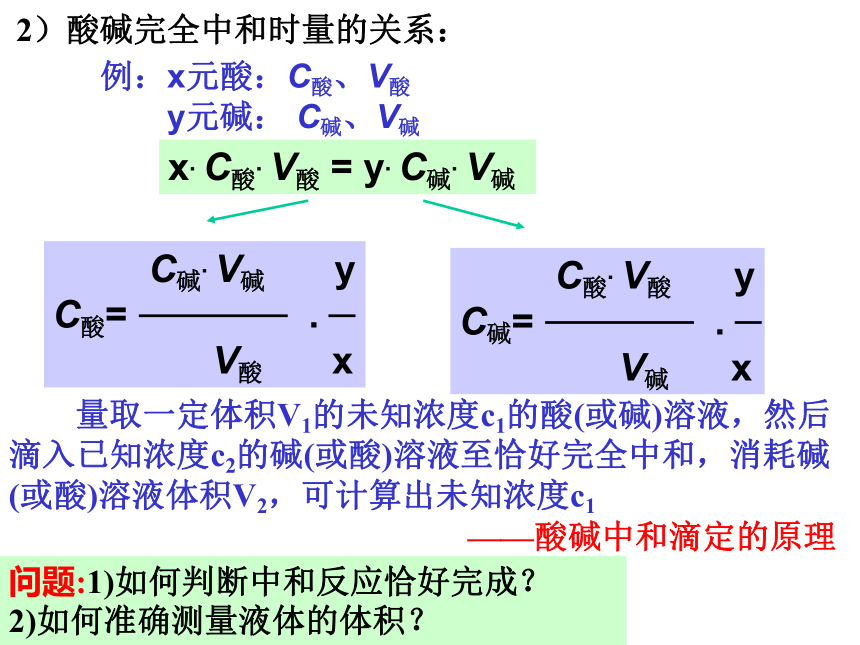
②相同体积和pH值的盐酸和醋酸。注意:溶液中的H+与能提供反应的H+的区别。比较:相同V、c的盐酸、硫酸、磷酸完全中和需NaOH的物质的量之比:_____________1:2:32)酸碱完全中和时量的关系:例:x元酸:C酸、V酸
y元碱: C碱、V碱 x. C酸. V酸 = y. C碱. V碱 C碱. V碱 y
C酸= .
V酸 x C酸. V酸 y
C碱= .
V碱 x 量取一定体积V1的未知浓度c1的酸(或碱)溶液,然后滴入已知浓度c2的碱(或酸)溶液至恰好完全中和,消耗碱(或酸)溶液体积V2,可计算出未知浓度c1——酸碱中和滴定的原理问题:1)如何判断中和反应恰好完成? 2)如何准确测量液体的体积?二、酸碱中和滴定终点的确定①酸碱指示剂的变色原理(P74)
②常用指示剂的变色范围甲基橙 石 蕊 酚 酞——— 3.1 ——— 4.4 ———酸色 中间色 碱色红色 橙色——— 5.0 ——— 8.0 —————— 8.2 ——— 10.0 ———红色 紫色 蓝色粉红色无色红色黄色③指示剂的选择原则
A、指示剂的PH变色范围尽可能接近中和时的PH
B、颜色变化明显。④常用中和滴定指示剂石蕊颜色变化不明显,一般不选用。甲基橙 酚 酞④常用中和滴定指示剂甲基橙 酚 酞——— 3.1 ——— 4.4 —————— 8.2 ——— 10.0 ———红色 橙色粉红色无色红色黄色中和滴定终点:当指示剂颜色发生变化,且在半分中 内不发生新的变化,即说明达到终点。终点颜色变化强碱滴 强酸酚酞
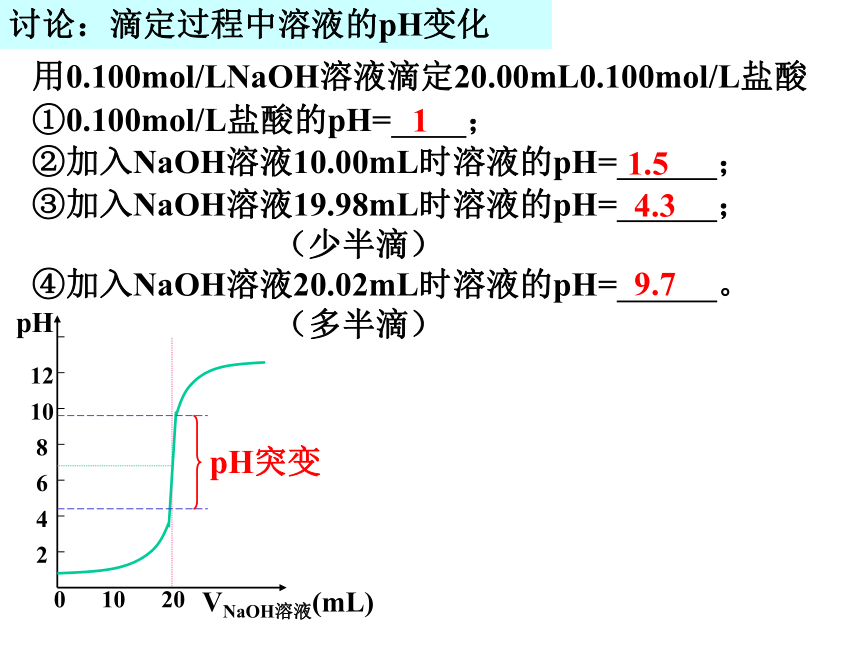
甲基橙无色粉红色 橙色红色讨论:滴定过程中溶液的pH变化用0.100mol/LNaOH溶液滴定20.00mL0.100mol/L盐酸①0.100mol/L盐酸的pH= ;
②加入NaOH溶液10.00mL时溶液的pH= ;
③加入NaOH溶液19.98mL时溶液的pH= ; (少半滴) ④加入NaOH溶液20.02mL时溶液的pH= 。 (多半滴)11.54.39.7pH12
10
8
6
4
20 10 20VNaOH溶液(mL)pH突变
强酸滴弱碱
弱酸滴强碱
应分别选用什么指示剂?想一想酸碱中和滴定
(二)一、酸碱中和滴定原理 量取一定体积V1的未知浓度的酸(或碱)溶液,然后滴入已知浓度c2的碱(或酸)溶液至恰好完全中和,消耗体积V2,可计算出未知浓度。甲基橙、酚酞等甲基橙酚酞强酸滴 强碱强碱滴 强酸酚酞
甲基橙酚酞
甲基橙 橙色黄色无色粉红色无色 橙色红色终点颜色变化红色【思考】有一支25mL酸式滴定管内盛有溶液,液面在 10.00mL刻度处,当管内溶液全部排出时,所得溶液 的体积是 。三、中和滴定的仪器例:用0.10mol/L的盐酸滴定未知浓度的NaOH溶液15.00mL1.滴定管②刻度酸式滴定管 碱式滴定管A、 “0”点在上端,从上向下增大。
B、每小格为0.1mL。
C、两端无刻度。>15.00mL①构造③标记(1)构造特点例:25mL、200C(2)滴定管的使用方法① 检查:活塞、是否漏水
② 洗涤:洗液洗、自来水洗、蒸馏水洗、润洗。
润洗(2~3次)的目的是什么?
③ 装液、把溶液注入滴定管中,使液面位于“0”以上 固定、2cm~3cm处,再把滴定管固定在滴定管夹上, 排气、在滴定管下放一个烧杯,调节活塞使滴定管 调零:的尖嘴部分充满溶液(不留气泡),并使液 面处在“0”或“0”以下某一刻度处,记下准确 读数。
④ 读数:a、滴定管要垂直,
b、装液或放液后静置一会儿,
c、视线与凹液面最低处保持水平,
d、估读到0.01mL。为什么?2.锥形瓶:(一般)盛放待测液3.滴定管夹四、中和滴定操作2.滴定①左手握滴定管活塞,右手拿锥形瓶并不断振荡。
②眼睛注视锥形瓶内溶液颜色的变化。
③终点判断:当滴入最后一滴,溶液颜色变化且在半 分钟内不褪色。
④读取滴定管刻度并记录。为保证测定的准确性,上述滴定重复2-3次。1.滴定前工作① 检查② 洗涤(润洗)③ 装液、固定、排气、调零、并记录读数④取液:用事先已用待测液润洗的碱式滴定管准确量
取一定体积的待测液,注入锥形瓶中。并加入2-3滴
指示剂。五、中和滴定的数据处理和误差分析1.中和滴定的数据处理标准
盐酸
浓度待测
碱液
体积
mL15.5215.5015.512)滴定误差分析 在盐酸滴定NaOH溶液的实验中,下列操作对实验结果有何影响?(偏高 、偏低 、无影响 ) ①酸式滴定管洗净后就装入标准盐酸进行滴定 ②碱式滴定管洗净后就装入NaOH溶液,再将一定量的溶液 注入锥形瓶中作滴定用 ③滴定前,酸式滴定管尖嘴部分有气泡,滴定后气泡消失 ④滴定至终点时,滴定管尖嘴外挂有液滴 ⑤向锥形瓶内注入待测液时,不小心洒到锥形瓶外 ⑥锥形瓶洗净后,先用待测液润洗,然后量入待测液进行滴定 ⑦因待测液浓度较大,移入锥形瓶后用蒸馏水稀释再滴定 ⑧滴定前平视,滴后俯视读取酸式滴定管的刻度 高低无影响高高高低低
(一)测定物质的组成①检验物质组成的成分(或元素)
②测定各成分(或元素)的含量——定性分析化学无机化学 有机化学 分析化学 物理化学 ……定性分析 定量分析 ……酸碱中和滴定 ……酸碱中和滴定——用已知物质的量浓度的酸(或碱)来测 定未知物质的量浓度的碱(或酸)的方法——定量分析一、酸碱中和滴定原理1、酸碱中和反应的实质H++OH-=H2O该离子方程式代表的意义是:强酸与强碱中和反应生成可溶性的盐和水。2、酸碱中和反应时量的关系1)酸碱完全中和时
A、溶液呈中性
B、酸碱物质的量相等
C、酸溶液中的H+与碱溶液中的OH-的物质的量相等
D、酸可提供的H+与碱可提供的OH-的物质的量相等 酸可提供的H+与碱可提供的OH-的物质的量相等
比较: 完全中和时消耗NaOH的量多少
①相同体积和物质的量浓度的盐酸和醋酸;
②相同体积和pH值的盐酸和醋酸。注意:溶液中的H+与能提供反应的H+的区别。比较:相同V、c的盐酸、硫酸、磷酸完全中和需NaOH的物质的量之比:_____________1:2:32)酸碱完全中和时量的关系:例:x元酸:C酸、V酸
y元碱: C碱、V碱 x. C酸. V酸 = y. C碱. V碱 C碱. V碱 y
C酸= .
V酸 x C酸. V酸 y
C碱= .
V碱 x 量取一定体积V1的未知浓度c1的酸(或碱)溶液,然后滴入已知浓度c2的碱(或酸)溶液至恰好完全中和,消耗碱(或酸)溶液体积V2,可计算出未知浓度c1——酸碱中和滴定的原理问题:1)如何判断中和反应恰好完成? 2)如何准确测量液体的体积?二、酸碱中和滴定终点的确定①酸碱指示剂的变色原理(P74)
②常用指示剂的变色范围甲基橙 石 蕊 酚 酞——— 3.1 ——— 4.4 ———酸色 中间色 碱色红色 橙色——— 5.0 ——— 8.0 —————— 8.2 ——— 10.0 ———红色 紫色 蓝色粉红色无色红色黄色③指示剂的选择原则
A、指示剂的PH变色范围尽可能接近中和时的PH
B、颜色变化明显。④常用中和滴定指示剂石蕊颜色变化不明显,一般不选用。甲基橙 酚 酞④常用中和滴定指示剂甲基橙 酚 酞——— 3.1 ——— 4.4 —————— 8.2 ——— 10.0 ———红色 橙色粉红色无色红色黄色中和滴定终点:当指示剂颜色发生变化,且在半分中 内不发生新的变化,即说明达到终点。终点颜色变化强碱滴 强酸酚酞
甲基橙无色粉红色 橙色红色讨论:滴定过程中溶液的pH变化用0.100mol/LNaOH溶液滴定20.00mL0.100mol/L盐酸①0.100mol/L盐酸的pH= ;
②加入NaOH溶液10.00mL时溶液的pH= ;
③加入NaOH溶液19.98mL时溶液的pH= ; (少半滴) ④加入NaOH溶液20.02mL时溶液的pH= 。 (多半滴)11.54.39.7pH12
10
8
6
4
20 10 20VNaOH溶液(mL)pH突变
强酸滴弱碱
弱酸滴强碱
应分别选用什么指示剂?想一想酸碱中和滴定
(二)一、酸碱中和滴定原理 量取一定体积V1的未知浓度的酸(或碱)溶液,然后滴入已知浓度c2的碱(或酸)溶液至恰好完全中和,消耗体积V2,可计算出未知浓度。甲基橙、酚酞等甲基橙酚酞强酸滴 强碱强碱滴 强酸酚酞
甲基橙酚酞
甲基橙 橙色黄色无色粉红色无色 橙色红色终点颜色变化红色【思考】有一支25mL酸式滴定管内盛有溶液,液面在 10.00mL刻度处,当管内溶液全部排出时,所得溶液 的体积是 。三、中和滴定的仪器例:用0.10mol/L的盐酸滴定未知浓度的NaOH溶液15.00mL1.滴定管②刻度酸式滴定管 碱式滴定管A、 “0”点在上端,从上向下增大。
B、每小格为0.1mL。
C、两端无刻度。>15.00mL①构造③标记(1)构造特点例:25mL、200C(2)滴定管的使用方法① 检查:活塞、是否漏水
② 洗涤:洗液洗、自来水洗、蒸馏水洗、润洗。
润洗(2~3次)的目的是什么?
③ 装液、把溶液注入滴定管中,使液面位于“0”以上 固定、2cm~3cm处,再把滴定管固定在滴定管夹上, 排气、在滴定管下放一个烧杯,调节活塞使滴定管 调零:的尖嘴部分充满溶液(不留气泡),并使液 面处在“0”或“0”以下某一刻度处,记下准确 读数。
④ 读数:a、滴定管要垂直,
b、装液或放液后静置一会儿,
c、视线与凹液面最低处保持水平,
d、估读到0.01mL。为什么?2.锥形瓶:(一般)盛放待测液3.滴定管夹四、中和滴定操作2.滴定①左手握滴定管活塞,右手拿锥形瓶并不断振荡。
②眼睛注视锥形瓶内溶液颜色的变化。
③终点判断:当滴入最后一滴,溶液颜色变化且在半 分钟内不褪色。
④读取滴定管刻度并记录。为保证测定的准确性,上述滴定重复2-3次。1.滴定前工作① 检查② 洗涤(润洗)③ 装液、固定、排气、调零、并记录读数④取液:用事先已用待测液润洗的碱式滴定管准确量
取一定体积的待测液,注入锥形瓶中。并加入2-3滴
指示剂。五、中和滴定的数据处理和误差分析1.中和滴定的数据处理标准
盐酸
浓度待测
碱液
体积
mL15.5215.5015.512)滴定误差分析 在盐酸滴定NaOH溶液的实验中,下列操作对实验结果有何影响?(偏高 、偏低 、无影响 ) ①酸式滴定管洗净后就装入标准盐酸进行滴定 ②碱式滴定管洗净后就装入NaOH溶液,再将一定量的溶液 注入锥形瓶中作滴定用 ③滴定前,酸式滴定管尖嘴部分有气泡,滴定后气泡消失 ④滴定至终点时,滴定管尖嘴外挂有液滴 ⑤向锥形瓶内注入待测液时,不小心洒到锥形瓶外 ⑥锥形瓶洗净后,先用待测液润洗,然后量入待测液进行滴定 ⑦因待测液浓度较大,移入锥形瓶后用蒸馏水稀释再滴定 ⑧滴定前平视,滴后俯视读取酸式滴定管的刻度 高低无影响高高高低低
