高二化学 电解质溶液和电离平衡
文档属性
| 名称 | 高二化学 电解质溶液和电离平衡 |  | |
| 格式 | zip | ||
| 文件大小 | 753.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-07 12:43:20 | ||
图片预览











文档简介
课件83张PPT。电解质溶液和电离平衡化学会IChO培训讲座-第七章22019/2/7所谓“溶液”通常是指电解质溶液。
通过对溶液及电离平衡的研究,可以对溶解、水解以及分布等概念有一个正确的理解,有利于对其他知识的深入学习。化学会IChO培训讲座-第七章32019/2/7§7 -1弱酸、弱碱的电离平衡 Ionization equilibrium weak acids and weak base任何一种电解质在相应的溶剂中都有一定的解离,只是程度有不同。
强电离质在水溶液中完全电离
HCl = H+ (aq) + Cl- (aq)
弱电解质的解离程度较小,在水溶液中只有小部分电离,未电离的分子与离子之间形成平衡:
HAc = H+ + Ac-
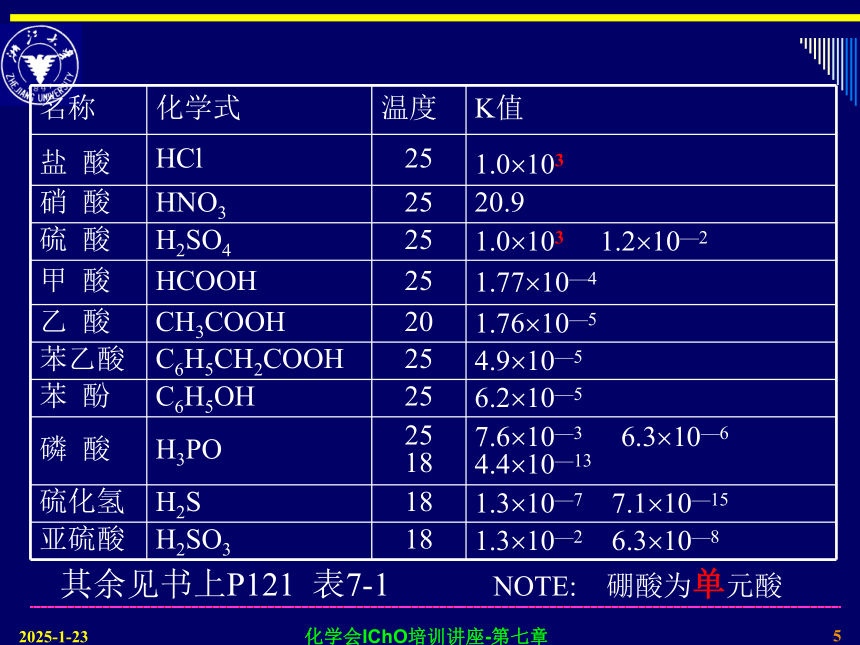
NH3.H2O = OH- + NH+4化学会IChO培训讲座-第七章42019/2/7—、电离平衡常数弱电解质在溶液中是部分电离:在此平衡中,不论物质的起始浓度如何,只要温度恒定,其电离平衡常数就是一个定值,且与各组分的平衡浓度有如下关系:化学会IChO培训讲座-第七章52019/2/7其余见书上P121 表7-1NOTE: 硼酸为单元酸化学会IChO培训讲座-第七章62019/2/7不同电解质的电离平衡常数相差越大,转化程度越大。Ka值相近时则可互相转化。强电解质能促进弱电解质的生成相当于“强酸置换弱酸”化学会IChO培训讲座-第七章72019/2/7有几个概念是必须搞清楚的:
酸碱的强度——酸碱给出或得到质子能力的大小,以解离常数ka、kb表示;
酸碱的浓度——溶质的分析浓度,即总浓度,以 C 表示;
溶液的酸度——溶液中H+的活度,即H+的平衡浓度,以pH表示。
弱酸(碱)的电离度——溶液中弱电解质电离的难易程度,用?表示。二、弱酸弱碱水溶液的pH值计算化学会IChO培训讲座-第七章82019/2/71.一元酸碱溶液的pH计算A)对强酸 [H+] = C(HA)
如果强酸的浓度很小时,那也不相同,可按下式计算:
[H+]2 -C [H+] - Kw = 0Q: 如果是强碱又如何?化学会IChO培训讲座-第七章92019/2/7Discussion:CHCl > 10-6, [H+] = C
CNaOH > 10-6 , [OH-] = C
CHCl < 10-8 , pH = 7;
CNaOH < 10-8 , pOH = 7
3. 10-6 > C > 10-8 , 需考虑水的电离.化学会IChO培训讲座-第七章102019/2/7B) 对一元弱酸化学会IChO培训讲座-第七章112019/2/7 很显然:
1) Ka、c、α三者中只要已知任何两个,便可得第三个数。
2) 已知任何一个,可知其他两个的比值。
3) c 和α成反比,是为稀释定律
根据分析化学的误差理论,只要α≤5%,便可视 1-α = 1。(相差20倍以上时可忽略小的一项),
此时,当c/Ka?400时α≤5%。化学会IChO培训讲座-第七章122019/2/7据此:
只要c/Ka?400,便可得:严格而论,还应有 cKa≥20Kw成立,方可有上式成立。化学会IChO培训讲座-第七章132019/2/7多元酸只考虑第一级解离。
通常,因第二级解离受到第一级解离的抑制(同离子效应),此时可按一元弱酸处理:2.多元酸碱溶液的pH计算但严格而论,只有满足2 Ka2 / [H+]<0.05时才能忽略第二级的解离。
一元弱碱和多元弱碱均可照此办理。化学会IChO培训讲座-第七章142019/2/7例:求0.01和 0.001 mol/L氨水溶液的pH. (见P122 例7-1)分析:两条件时的Ckb均大于20Kw,但 C/kb分别为555.6和55.6,可直接用最简式进行计算,而后者则必须用近似式解方程求得。
处理:1、2、化学会IChO培训讲座-第七章152019/2/7再讨论3.溶液浓度与存在形态的关系这是具有普遍意义的结论,即对任何弱酸都适用。在?=50%时:可求得化学会IChO培训讲座-第七章162019/2/7换一种表示方法:对一元弱碱的处理完全相似。化学会IChO培训讲座-第七章172019/2/74.溶液中各存在形态的分布情况解离的难易还可从各存在形态的分布中看出。
可以像P123例7-2那样计算而求得四种存在形式的浓度,但这样计算实在太麻烦。
以一元弱酸为例进行讨论:化学会IChO培训讲座-第七章182019/2/7有三种方法:
不简化假定: 每个可能存在组分都列出方程,解联立方程组得出。方程数多而复杂,不易求得
图解法:方法简单直观,但一图专用,浓度变化后即需换图
利用分布系数: 溶液中某组分的平衡浓度占该物质总浓度的分数 主要介绍多组分体系中相关组分间有如下关系存在: CA =[A]+[HA]+[H2A]+[H3A] (物料平衡) 往往需要了解在一定条件下各型体的平衡浓度化学会IChO培训讲座-第七章192019/2/7对一元弱酸HA,其离解平衡为:
根据定义:化学会IChO培训讲座-第七章202019/2/7即:由此可知任一酸度下的平衡浓度
[HA]=?HA·C总同理可得:化学会IChO培训讲座-第七章212019/2/7由图可知,在pH > pKa 时,以[Ac—]为主;
在 pH < pKa 时,以 [HAc]为主。
在 ?HA = ?A = 0.5时,[HA]= [A—],pH = pKa 化学会IChO培训讲座-第七章222019/2/7一元弱酸(碱)溶液一元弱酸HA,在水溶液中有HA和A-两种物种。设它们的总浓度为c,即c = c(HA) + c(A-)。 化学会IChO培训讲座-第七章232019/2/7例4-17 计算pH = 4.00时,浓度为0.10mol.L-1 HAc溶液中,HAc和Ac-的分布分数和平衡浓度。
解:
一元弱酸(碱)溶液化学会IChO培训讲座-第七章242019/2/7二元弱酸H2A在水溶液中有H2A,HA-和A2-三种物种,它们的总浓度为c,即c = c(H2A) + c(HA-) + c(A2-)。则有多元弱酸溶液化学会IChO培训讲座-第七章252019/2/7化学会IChO培训讲座-第七章262019/2/7 酒石酸的p = 3.04,p = 4.37, pH<p 以H2A占优势;pH>p ,A2-物种为主;当p <pH<p 时,则主要是HA-物种。p 与p 值相差越小,HA-占优势的区域越窄。多元弱酸溶液化学会IChO培训讲座-第七章272019/2/7三元酸体系:化学会IChO培训讲座-第七章282019/2/7磷酸(H3A)的型体分布图 (p135)化学会IChO培训讲座-第七章292019/2/7三、缓冲溶液 Buffers缓冲溶液是分析化学实验或其他化学实验中经常使用的重要试液之一,通常所指的缓冲溶液是一种能够抵抗加入少量强酸或强碱或稀释而能保持溶液pH值基本不变的溶液,一般由弱酸(碱)以及其共轭碱(酸)所组成,能控制氢离子浓度。化学会IChO培训讲座-第七章302019/2/7 血液中存在着许多缓冲剂,如H2CO3-HCO3-,HPO42-,蛋白质、血红蛋白和含氧血红蛋白等,这些缓冲体系可使血液的pH稳定在7.40左右。
土壤中一般含有H2CO3-HCO3-、腐殖酸及其共轭碱组成的缓冲体系,因此,土壤溶液是很好的缓冲溶液.大多数植物在pH<3.5和pH>9的土壤中都不能生长。不同的植物所需要的pH值也不同,如水稻生长适宜的pH为6~7。化学会IChO培训讲座-第七章312019/2/7缓冲作用原理缓冲溶液是由一种酸和它的共轭碱组成的混合体系。
HB + H2O H3O+ + B-
大量 少 大量
抗酸的作用:
当加入少量强酸时,H3O+浓度增加,平衡向左移动,B-浓度略有减少,HB浓度略有增加,H3O+浓度基本未变,即溶液pH值基本保持不变。化学会IChO培训讲座-第七章322019/2/7抗碱的作用:
当加入少量碱时,OH-浓度增加,H3O+浓度略有减少,平衡向右移动,HB和H2O作用产生H3O+以补充其减少的H3O+。而H3O+浓度几乎未变,pH基本保持不变。
缓冲作用原理化学会IChO培训讲座-第七章332019/2/71L浓度为0. 1mol/L的HAC-NaAc缓冲溶液体系可见,缓冲作用十分明显。化学会IChO培训讲座-第七章342019/2/7缓冲体系应具备的条件:
1. 具有既能抗碱(弱酸)又能抗酸(共轭碱)的组分;
2. 弱酸及其共轭碱保证足够大的浓度和适当的浓度比。
常见缓冲体系:
HAc-Ac-、HPO42-、NH4+-NH3和HCO3--CO32-等。缓冲作用原理化学会IChO培训讲座-第七章352019/2/7缓冲溶液pH值的计算以弱酸HB及其共轭碱NaB组成的缓冲溶液为例,设其浓度分别为ca和cb。
HB + H2O H3O+ + B-
(4-17)
可写成下面的形式:
(4-18)
弱碱与其共轭酸组成缓冲溶液,则:
(4-19)化学会IChO培训讲座-第七章362019/2/71、缓冲作用 缓冲溶液的缓冲作用主要依靠弱酸(碱)的弱电离平衡。当它与其共轭碱(酸)共存时,其pH值取决于下列关系:即溶液的pH或pOH 值除由组成缓冲溶液的弱酸(碱)的固有性质pKa或pKb所决定外,还受缓冲溶液中弱酸(碱)及其共轭就(酸)的浓度比的影响。化学会IChO培训讲座-第七章372019/2/72、缓冲容量缓冲容量是指缓冲溶液抵御外来强酸强碱的能力,它以缓冲指数β的大小来衡量。 缓冲容量与pH的关系任何一种缓冲溶液都有一定的缓冲容量,即外加的酸或碱过多,将使缓冲溶液失效。化学会IChO培训讲座-第七章382019/2/7由图可知:
强酸强碱只有在浓度大时才有较大缓冲指数,且不能抵御稀释作用,故不属于缓冲溶液.
弱酸及其共扼碱浓度为1︰1时β有最大值,即有最大的缓冲容量。 缓冲容量与pH的关系化学会IChO培训讲座-第七章392019/2/7综上所述,可得如下结论:
1)、β? C
2)、[HA]=[A—]时,β有极大值
3)、[HA]与[A—]相差越大β越小。(相差为10倍时, )
4)、公式中的C为总浓度,即弱酸和其共轭碱的总浓度。化学会IChO培训讲座-第七章402019/2/73、缓冲范围一元弱酸(碱)缓冲溶液:pKa土1 pH单位或 pKb土1 pOH单位。
在此范围以外,因Buffer的一组分浓度很低,缓冲容量很小,效果很差。
对二元弱酸(碱)及其共轭碱(酸)组成的缓冲溶液的缓冲范围较为复杂。根据pKa1和pKa2的差值,可以组成分段的和连续的两类缓冲溶液。化学会IChO培训讲座-第七章412019/2/74、缓冲溶液的有关计算A. 缓冲溶液的pH值
例: 0.1 mol/L的HAc150mL和0.2 mol/L的NaAc 100mL混合后的pH值是多少?
分析: 两溶液非等摩尔混合, pH值不会是4.74。因是碱多,会大于4.74。
解: 化学会IChO培训讲座-第七章422019/2/7缓冲溶液计算实例例 对于HAc-NaAc,HCOOH-HCOONa和H3BO3-NaH2BO3的缓冲体系,若要配制pH=4.8的酸碱缓冲溶液。①应选择何种体系为好?②现有c(HAc)=6.0 mol.L-1HAc溶液12mL配成250mL的酸碱缓冲溶液,应取固体NaAc.H2O多少克?
解: 已知: p (HCOOH)=3.75,p (HAc)=4.75,
p ( H3BO3)=9.24
如择HAc-NaAc体系,则
lg = pH-p =4.8-4.75=0.05;
=1.12≈1 浓度比值接近1,缓冲能力强;
ca=c(HAc)=12×6.0/250=0.288 mol.L-1,
cb=c(NaAc)=1.12×0.288=0.322 mol.L-1,
m(NaAc.H2O)=0.322×136×250/1000=11(g)化学会IChO培训讲座-第七章432019/2/7§7 -2 盐类的水解 The Hydrolysis of salts一、盐的种类和基本性质
定义:盐是酸分子中的氢原子被金属原子置换(取代)而成的化合物。
种类:有正盐、酸式盐、碱式盐、复盐、络盐等。
基本性质:常温下一般为晶体,绝大多数为强电解质。溶解度随物质不同有很大差别。化学会IChO培训讲座-第七章442019/2/7二、各类盐的水解定义:物质加水所引起的分解作用。
通常是指无机盐的水解。
常规的盐是酸和碱的产物,溶于水中后必然有重新生成相应的酸和碱的趋势。根据生成的酸或碱的强度不同,将使溶液的酸碱性有本质的区别。
有机物也会水解,如蛋白质水解成水解蛋白。此处不讨论有机物水解。
溶于水后溶液的pH值则以相应酸碱的强弱决定。化学会IChO培训讲座-第七章452019/2/7二、各类盐的水解规律:
1、强酸和强碱在水中都立即全部电离,相应盐解离后产生的Na+或Cl-不会引起体系酸碱度的变化。
2、弱酸和弱碱在水中只能部分电离,相应盐溶于水后产生的酸根或碱性阳离子有较强的生成相应酸或碱的倾向,将消耗水中H+或OH-而引起体系酸碱度的变化。
3、酸(或碱)越弱,水解后引起体系中H+(或OH- )的降低值越大,引起pH值额度变化值也越大。化学会IChO培训讲座-第七章462019/2/71、强酸强碱盐如规律 2 所言,强酸强碱盐(NaCl等)溶于水后不改变溶液酸碱度,因而,也就认为“不水解”。
化学会IChO培训讲座-第七章472019/2/72、弱酸强碱盐现象:弱酸强碱盐溶于水后因有生成弱酸趋势而消耗水中的H+,从而使溶液呈碱性。
原因:总反应:化学会IChO培训讲座-第七章482019/2/7水解平衡常数Kh只要该酸不太弱,且其浓度不太稀,则可用最简式计算其pH值。化学会IChO培训讲座-第七章492019/2/73、强酸弱碱盐其处理程序与强碱弱酸盐完全相同,只是将其中的酸与碱位置互换而已。因而不用多言而直接给出结论即可。 (以NH4Cl为例)化学会IChO培训讲座-第七章502019/2/7应用实例例: 0.1mol/LNaAc溶液的pH值。
解:NaAc水解而生成HAc和OH-,由于KaC>20Kw,且C/Ka>400,可直接用最简式进行计算。 如果按书上P129例7-6方法计算,结果相同。化学会IChO培训讲座-第七章512019/2/74、弱酸弱碱盐分析:弱酸弱碱盐因其酸碱两部分都会水解,都对体系pH值的改变有 “贡献” 。溶液的pH值具体数据则要视两者的相对强弱而定。
判断:酸碱性越弱的,其水解趋势越大,引起pH值的改变量也越大,因而体系的酸碱性由它决定,具体数据由两者的比例决定。化学会IChO培训讲座-第七章522019/2/70.1 mol/L NH4F的pH值化学会IChO培训讲座-第七章532019/2/70.1 mol/L NH4F的pH值然后可依据C’(HF)=9. 6?10-5或C’(NH3H2O) )=9. 6?10-5,从酸式或碱式分别计算体系的pH值。水解掉的组分的量为:化学会IChO培训讲座-第七章542019/2/7化学会IChO培训讲座-第七章552019/2/7其实,还有另一算法:前提是KaC>20Kw, 且 C>20Ka, C>20Kb Ka>Kb 时溶液呈酸性,Ka< Kb溶液呈碱性。化学会IChO培训讲座-第七章562019/2/75、多元酸根多元酸根同时具有酸式解离和碱式解离的趋势,溶液的酸碱度要视两种趋势的相对大小而定。
以HCO3-为例,其酸式解离的趋势由Kb2 决定,而其碱式解离则由Ka2决定。由于大多数酸式盐的Kb2和Ka2都不大,因而溶液的pH值可直接用下式进行计算:化学会IChO培训讲座-第七章572019/2/7三、影响水解的因素温度:K是温度的函数,升温有利于水解
浓度:稀释有利于水解的进行
体系pH值:对强酸弱碱盐或强碱弱酸盐,增加其“弱”的部分能促进水解化学会IChO培训讲座-第七章582019/2/7§7 -3 难溶物的溶度积 The solubility product of insoluble compounds任何一种化合物在水中都有一定的溶解趋向,所差就是溶解度大小而已,就如NaCl能完全溶解而AgCl只能部分溶解。
难溶化合物微量溶解后成为饱和溶液,大部分难溶化合物的溶解部分几乎能全部电离。
在一定温度下,溶解速率和沉淀速率相等时达到沉淀-溶解平衡。化学会IChO培训讲座-第七章592019/2/7一、溶度积常数(Ksp)1.溶度积 (积分以AgCl为例)
对于AgCl Ag+ + Cl- , K = [Ag+][Cl-]/[AgCl]
由于是饱和溶液,其[Ag+][Cl-]的乘积为常数。
一般形式AnBm中:
同类型沉淀,KSP大的溶解度大。化学会IChO培训讲座-第七章602019/2/72、溶度积和溶解度溶解度:一定温度下每升饱和溶液中所含溶质的物质的量。 (过去的单位为 g/100mL水)
从理论上讲,溶解度和溶度积都反映了难溶电解质的溶解能力,但由于实际上可能发生许多不可预料的副反应和其他情况,除少数几种化合物外,很多难溶电解质的溶解度和溶度积不能直接互算。
以可以互算的物质为例。化学会IChO培训讲座-第七章612019/2/7例7-8:298K时Ag2CrO4在水中溶解度为4.3mg,求其KSP分析: Ag2CrO4溶解后即解离,两离子水解趋势小符合互算条件。
解:
单位变换:4.3mg/100mL = 1.3?10-4 mol/L
浓度计算:[Ag+] = 2[CrO-4] = 2.6?10-4 mol/L
KSP计算: KSP = [Ag+]2[CrO-4] = 8.8 ?10-12 化学会IChO培训讲座-第七章622019/2/7说明:凡溶解后形成的构晶离子有明显副反应的(如水解、分步解离、形成配合物等)不能简单通过溶解度计算KSP值。
任何情况下,KSP值与构晶离子浓度的关系是确定的。 如 KSP(CaCO3) = [Ca2+][CO32-] 化学会IChO培训讲座-第七章632019/2/73、溶度积规则溶度积与离子积是不同的概念。
溶度积与离子积有紧密的关系。化学会IChO培训讲座-第七章642019/2/7二、沉淀-溶解平衡的移动主要考虑同离子效应和盐效应
同离子效应——往难溶强电解质饱和溶液中加入与该电解质相同的离子,从而使沉淀溶解度降低的效应
盐效应——由于有过量强电解质存在而使沉淀溶解度增大并随电解质的增加而增加的现象化学会IChO培训讲座-第七章652019/2/71、同离子效应 例7-9纯水中BaSO4的溶解度为:在0.01 mol/L Na2SO4溶液中BaSO4的溶解度为:差别是十分明显的。化学会IChO培训讲座-第七章662019/2/72、盐效应盐效应作用的根本原因是大量的强电解质增加了体系的离子强度,降低了离子的活动性,使其活度系数减小,亦即降低构晶离子的“有效浓度”,进而使平衡
向右移动,增加了沉淀的溶解度。
盐效应的计算十分复杂,一般由实验测得。化学会IChO培训讲座-第七章672019/2/73、沉淀的生成和溶解增大或减小构晶离子的浓度是促使沉淀生成或溶解的唯一条件。
离子沉淀完全的标准: 10-5 mol/L
合理调控实验条件可控制沉淀的生成或溶解。化学会IChO培训讲座-第七章682019/2/7 沉淀生成的方法加沉淀剂:控制沉淀剂量,即要保证沉淀完全,也要避免出现盐效应。
例:要使SO42-沉淀完全,需把体系中Ba2+量控制在什么浓度?
解:控制Ba2+量使其在溶液的过量部分为1.1?10-5即可,实际操作时过量部分要更多些。化学会IChO培训讲座-第七章692019/2/7控制酸碱度:控制合适pH值可使共存的不同金属离子分别沉淀,进而实现分离的目标。从表中可知,控制不同pH值可以分别沉淀Fe3+和Fe2+。同时也可知道,若仅仅是要除去铁的影响,将Fe2+氧化成Fe3+后再沉淀除去更为有利,此时对其他共存离子的影响最小。化学会IChO培训讲座-第七章702019/2/7例5-6 要使0.1molFeS完全溶于1L盐酸中,求所需盐 酸的最低浓度。 解:当0.1molFeS完全溶于1L盐酸时,
c(Fe2+) = 0.1mol·L-1, c(H2S) = 0.1mol·L-1
K?SP (FeS)=c(Fe2+)·c(S2-)
根据
化学会IChO培训讲座-第七章712019/2/7
生成H2S时消耗掉0.2mol盐酸,故所需的盐酸的最
初浓度为0.03+0.2=0.23mol·L-1。
化学会IChO培训讲座-第七章722019/2/7考察:什么pH时可使CdS沉淀完全而ZnS不沉淀。化学会IChO培训讲座-第七章732019/2/7控制[H+]在0.21~0.34即可实现完全沉淀CdS而ZnS不沉淀的目标,实际操作时在饱和H2S溶液中控制HCl为0.3 mol/L。 P132例7-11请自学.化学会IChO培训讲座-第七章742019/2/7 沉淀溶解的方法根据 MA ====M+ + A- 只要设法减小[M+]或[A-]即可使沉淀趋于溶解。
降低离子浓度的方法主要有:
生成弱电解质 —— 主要是减少[A-]
生成配合物 —— 主要是减少[M+]
改变离子价态 —— 对[M+]和[A-]都有影响
多因素联用 —— 效果更好,条件也更苛刻化学会IChO培训讲座-第七章752019/2/7 1、生成弱电解质 由于加入H+使OH-和H+结合成弱电解质水,溶液中的OH-离子的浓度降低使平衡向着溶解方向移动。从而使沉淀溶解。化学会IChO培训讲座-第七章762019/2/72. 通过氧化还原反应使沉淀溶解 如CuS(K?SP为1.27×10-36)溶于硝酸。
CuS(s) = Cu2+ + S2-
+
HNO3 S↓ + NO↑ + H2O
HgS (K?SP为6.44×10-53)需用王水来溶解。
3HgS + 2HNO3 + 12HCl 3H2[HgCl4] + 3S +
2NO + 4H2O 化学会IChO培训讲座-第七章772019/2/73. 生成配合物使沉淀溶解 例如AgCl不溶于酸,但可溶于NH3溶液。
AgCl(s) = Ag+ + Cl-
+
2NH3
‖
[Ag(NH3)2]+
使Qi<K?SP ,则固体AgCl开始溶解。
化学会IChO培训讲座-第七章782019/2/74、沉淀的转化有时,因所研究化合物沉淀的组成、存在形式、表面性质等多种因素对将要进行的研究会产生影响,需要对沉淀进行转化后继续研究。
如:为免外加阴离子影响,将BaSO4沉淀转化为BaCO3沉淀,分离后酸化即消除了SO42-的影响。
又如:CuI↓强烈吸附 I2,进行碘量法测铜时,近终点处需加入KSCN使CuI↓转化为CuSCN↓,释放出吸附的I2,从而使滴定反应顺利进行。化学会IChO培训讲座-第七章792019/2/7将BaSO4沉淀转化为BaCO3沉淀的平衡常数计算书上以列出,其数值较小,将使转化不完全,但加大浓度并多次转化后还是可以实现的。化学会IChO培训讲座-第七章802019/2/7§7 -4 离子方程式的书写和配平基本原则:
反应前后原子个数相等
氧化剂的电子总数与还原剂失电子总数相等化学反应方程式的正确书写和配平是理解、处理化学反应过程的重要步骤,尤其是氧化-还原反应。必须给予重视。化学会IChO培训讲座-第七章812019/2/7§7 -4 离子方程式的书写和配平具体过程:
根据实验事实写出反应产物
分解而列出两个半反应式
先配平除H、O外的原子数,然后以H2O、H+、OH-来配平H、O的原子数。
调整两半反应间的化学计量数,使得失电子的总数相等。
最后配上异电荷离子。
以P135例题所用竖式相加法较为合适。化学会IChO培训讲座-第七章822019/2/7离子式的其他注意事项:
只适合于溶液中或熔化状态
仅将强酸、强碱、可溶性盐写成离子,其余为化学式
微溶物的情况有特殊要求
氨水的书写需视情况而定化学会IChO培训讲座-第七章832019/2/7谢谢大家!
通过对溶液及电离平衡的研究,可以对溶解、水解以及分布等概念有一个正确的理解,有利于对其他知识的深入学习。化学会IChO培训讲座-第七章32019/2/7§7 -1弱酸、弱碱的电离平衡 Ionization equilibrium weak acids and weak base任何一种电解质在相应的溶剂中都有一定的解离,只是程度有不同。
强电离质在水溶液中完全电离
HCl = H+ (aq) + Cl- (aq)
弱电解质的解离程度较小,在水溶液中只有小部分电离,未电离的分子与离子之间形成平衡:
HAc = H+ + Ac-
NH3.H2O = OH- + NH+4化学会IChO培训讲座-第七章42019/2/7—、电离平衡常数弱电解质在溶液中是部分电离:在此平衡中,不论物质的起始浓度如何,只要温度恒定,其电离平衡常数就是一个定值,且与各组分的平衡浓度有如下关系:化学会IChO培训讲座-第七章52019/2/7其余见书上P121 表7-1NOTE: 硼酸为单元酸化学会IChO培训讲座-第七章62019/2/7不同电解质的电离平衡常数相差越大,转化程度越大。Ka值相近时则可互相转化。强电解质能促进弱电解质的生成相当于“强酸置换弱酸”化学会IChO培训讲座-第七章72019/2/7有几个概念是必须搞清楚的:
酸碱的强度——酸碱给出或得到质子能力的大小,以解离常数ka、kb表示;
酸碱的浓度——溶质的分析浓度,即总浓度,以 C 表示;
溶液的酸度——溶液中H+的活度,即H+的平衡浓度,以pH表示。
弱酸(碱)的电离度——溶液中弱电解质电离的难易程度,用?表示。二、弱酸弱碱水溶液的pH值计算化学会IChO培训讲座-第七章82019/2/71.一元酸碱溶液的pH计算A)对强酸 [H+] = C(HA)
如果强酸的浓度很小时,那也不相同,可按下式计算:
[H+]2 -C [H+] - Kw = 0Q: 如果是强碱又如何?化学会IChO培训讲座-第七章92019/2/7Discussion:CHCl > 10-6, [H+] = C
CNaOH > 10-6 , [OH-] = C
CHCl < 10-8 , pH = 7;
CNaOH < 10-8 , pOH = 7
3. 10-6 > C > 10-8 , 需考虑水的电离.化学会IChO培训讲座-第七章102019/2/7B) 对一元弱酸化学会IChO培训讲座-第七章112019/2/7 很显然:
1) Ka、c、α三者中只要已知任何两个,便可得第三个数。
2) 已知任何一个,可知其他两个的比值。
3) c 和α成反比,是为稀释定律
根据分析化学的误差理论,只要α≤5%,便可视 1-α = 1。(相差20倍以上时可忽略小的一项),
此时,当c/Ka?400时α≤5%。化学会IChO培训讲座-第七章122019/2/7据此:
只要c/Ka?400,便可得:严格而论,还应有 cKa≥20Kw成立,方可有上式成立。化学会IChO培训讲座-第七章132019/2/7多元酸只考虑第一级解离。
通常,因第二级解离受到第一级解离的抑制(同离子效应),此时可按一元弱酸处理:2.多元酸碱溶液的pH计算但严格而论,只有满足2 Ka2 / [H+]<0.05时才能忽略第二级的解离。
一元弱碱和多元弱碱均可照此办理。化学会IChO培训讲座-第七章142019/2/7例:求0.01和 0.001 mol/L氨水溶液的pH. (见P122 例7-1)分析:两条件时的Ckb均大于20Kw,但 C/kb分别为555.6和55.6,可直接用最简式进行计算,而后者则必须用近似式解方程求得。
处理:1、2、化学会IChO培训讲座-第七章152019/2/7再讨论3.溶液浓度与存在形态的关系这是具有普遍意义的结论,即对任何弱酸都适用。在?=50%时:可求得化学会IChO培训讲座-第七章162019/2/7换一种表示方法:对一元弱碱的处理完全相似。化学会IChO培训讲座-第七章172019/2/74.溶液中各存在形态的分布情况解离的难易还可从各存在形态的分布中看出。
可以像P123例7-2那样计算而求得四种存在形式的浓度,但这样计算实在太麻烦。
以一元弱酸为例进行讨论:化学会IChO培训讲座-第七章182019/2/7有三种方法:
不简化假定: 每个可能存在组分都列出方程,解联立方程组得出。方程数多而复杂,不易求得
图解法:方法简单直观,但一图专用,浓度变化后即需换图
利用分布系数: 溶液中某组分的平衡浓度占该物质总浓度的分数 主要介绍多组分体系中相关组分间有如下关系存在: CA =[A]+[HA]+[H2A]+[H3A] (物料平衡) 往往需要了解在一定条件下各型体的平衡浓度化学会IChO培训讲座-第七章192019/2/7对一元弱酸HA,其离解平衡为:
根据定义:化学会IChO培训讲座-第七章202019/2/7即:由此可知任一酸度下的平衡浓度
[HA]=?HA·C总同理可得:化学会IChO培训讲座-第七章212019/2/7由图可知,在pH > pKa 时,以[Ac—]为主;
在 pH < pKa 时,以 [HAc]为主。
在 ?HA = ?A = 0.5时,[HA]= [A—],pH = pKa 化学会IChO培训讲座-第七章222019/2/7一元弱酸(碱)溶液一元弱酸HA,在水溶液中有HA和A-两种物种。设它们的总浓度为c,即c = c(HA) + c(A-)。 化学会IChO培训讲座-第七章232019/2/7例4-17 计算pH = 4.00时,浓度为0.10mol.L-1 HAc溶液中,HAc和Ac-的分布分数和平衡浓度。
解:
一元弱酸(碱)溶液化学会IChO培训讲座-第七章242019/2/7二元弱酸H2A在水溶液中有H2A,HA-和A2-三种物种,它们的总浓度为c,即c = c(H2A) + c(HA-) + c(A2-)。则有多元弱酸溶液化学会IChO培训讲座-第七章252019/2/7化学会IChO培训讲座-第七章262019/2/7 酒石酸的p = 3.04,p = 4.37, pH<p 以H2A占优势;pH>p ,A2-物种为主;当p <pH<p 时,则主要是HA-物种。p 与p 值相差越小,HA-占优势的区域越窄。多元弱酸溶液化学会IChO培训讲座-第七章272019/2/7三元酸体系:化学会IChO培训讲座-第七章282019/2/7磷酸(H3A)的型体分布图 (p135)化学会IChO培训讲座-第七章292019/2/7三、缓冲溶液 Buffers缓冲溶液是分析化学实验或其他化学实验中经常使用的重要试液之一,通常所指的缓冲溶液是一种能够抵抗加入少量强酸或强碱或稀释而能保持溶液pH值基本不变的溶液,一般由弱酸(碱)以及其共轭碱(酸)所组成,能控制氢离子浓度。化学会IChO培训讲座-第七章302019/2/7 血液中存在着许多缓冲剂,如H2CO3-HCO3-,HPO42-,蛋白质、血红蛋白和含氧血红蛋白等,这些缓冲体系可使血液的pH稳定在7.40左右。
土壤中一般含有H2CO3-HCO3-、腐殖酸及其共轭碱组成的缓冲体系,因此,土壤溶液是很好的缓冲溶液.大多数植物在pH<3.5和pH>9的土壤中都不能生长。不同的植物所需要的pH值也不同,如水稻生长适宜的pH为6~7。化学会IChO培训讲座-第七章312019/2/7缓冲作用原理缓冲溶液是由一种酸和它的共轭碱组成的混合体系。
HB + H2O H3O+ + B-
大量 少 大量
抗酸的作用:
当加入少量强酸时,H3O+浓度增加,平衡向左移动,B-浓度略有减少,HB浓度略有增加,H3O+浓度基本未变,即溶液pH值基本保持不变。化学会IChO培训讲座-第七章322019/2/7抗碱的作用:
当加入少量碱时,OH-浓度增加,H3O+浓度略有减少,平衡向右移动,HB和H2O作用产生H3O+以补充其减少的H3O+。而H3O+浓度几乎未变,pH基本保持不变。
缓冲作用原理化学会IChO培训讲座-第七章332019/2/71L浓度为0. 1mol/L的HAC-NaAc缓冲溶液体系可见,缓冲作用十分明显。化学会IChO培训讲座-第七章342019/2/7缓冲体系应具备的条件:
1. 具有既能抗碱(弱酸)又能抗酸(共轭碱)的组分;
2. 弱酸及其共轭碱保证足够大的浓度和适当的浓度比。
常见缓冲体系:
HAc-Ac-、HPO42-、NH4+-NH3和HCO3--CO32-等。缓冲作用原理化学会IChO培训讲座-第七章352019/2/7缓冲溶液pH值的计算以弱酸HB及其共轭碱NaB组成的缓冲溶液为例,设其浓度分别为ca和cb。
HB + H2O H3O+ + B-
(4-17)
可写成下面的形式:
(4-18)
弱碱与其共轭酸组成缓冲溶液,则:
(4-19)化学会IChO培训讲座-第七章362019/2/71、缓冲作用 缓冲溶液的缓冲作用主要依靠弱酸(碱)的弱电离平衡。当它与其共轭碱(酸)共存时,其pH值取决于下列关系:即溶液的pH或pOH 值除由组成缓冲溶液的弱酸(碱)的固有性质pKa或pKb所决定外,还受缓冲溶液中弱酸(碱)及其共轭就(酸)的浓度比的影响。化学会IChO培训讲座-第七章372019/2/72、缓冲容量缓冲容量是指缓冲溶液抵御外来强酸强碱的能力,它以缓冲指数β的大小来衡量。 缓冲容量与pH的关系任何一种缓冲溶液都有一定的缓冲容量,即外加的酸或碱过多,将使缓冲溶液失效。化学会IChO培训讲座-第七章382019/2/7由图可知:
强酸强碱只有在浓度大时才有较大缓冲指数,且不能抵御稀释作用,故不属于缓冲溶液.
弱酸及其共扼碱浓度为1︰1时β有最大值,即有最大的缓冲容量。 缓冲容量与pH的关系化学会IChO培训讲座-第七章392019/2/7综上所述,可得如下结论:
1)、β? C
2)、[HA]=[A—]时,β有极大值
3)、[HA]与[A—]相差越大β越小。(相差为10倍时, )
4)、公式中的C为总浓度,即弱酸和其共轭碱的总浓度。化学会IChO培训讲座-第七章402019/2/73、缓冲范围一元弱酸(碱)缓冲溶液:pKa土1 pH单位或 pKb土1 pOH单位。
在此范围以外,因Buffer的一组分浓度很低,缓冲容量很小,效果很差。
对二元弱酸(碱)及其共轭碱(酸)组成的缓冲溶液的缓冲范围较为复杂。根据pKa1和pKa2的差值,可以组成分段的和连续的两类缓冲溶液。化学会IChO培训讲座-第七章412019/2/74、缓冲溶液的有关计算A. 缓冲溶液的pH值
例: 0.1 mol/L的HAc150mL和0.2 mol/L的NaAc 100mL混合后的pH值是多少?
分析: 两溶液非等摩尔混合, pH值不会是4.74。因是碱多,会大于4.74。
解: 化学会IChO培训讲座-第七章422019/2/7缓冲溶液计算实例例 对于HAc-NaAc,HCOOH-HCOONa和H3BO3-NaH2BO3的缓冲体系,若要配制pH=4.8的酸碱缓冲溶液。①应选择何种体系为好?②现有c(HAc)=6.0 mol.L-1HAc溶液12mL配成250mL的酸碱缓冲溶液,应取固体NaAc.H2O多少克?
解: 已知: p (HCOOH)=3.75,p (HAc)=4.75,
p ( H3BO3)=9.24
如择HAc-NaAc体系,则
lg = pH-p =4.8-4.75=0.05;
=1.12≈1 浓度比值接近1,缓冲能力强;
ca=c(HAc)=12×6.0/250=0.288 mol.L-1,
cb=c(NaAc)=1.12×0.288=0.322 mol.L-1,
m(NaAc.H2O)=0.322×136×250/1000=11(g)化学会IChO培训讲座-第七章432019/2/7§7 -2 盐类的水解 The Hydrolysis of salts一、盐的种类和基本性质
定义:盐是酸分子中的氢原子被金属原子置换(取代)而成的化合物。
种类:有正盐、酸式盐、碱式盐、复盐、络盐等。
基本性质:常温下一般为晶体,绝大多数为强电解质。溶解度随物质不同有很大差别。化学会IChO培训讲座-第七章442019/2/7二、各类盐的水解定义:物质加水所引起的分解作用。
通常是指无机盐的水解。
常规的盐是酸和碱的产物,溶于水中后必然有重新生成相应的酸和碱的趋势。根据生成的酸或碱的强度不同,将使溶液的酸碱性有本质的区别。
有机物也会水解,如蛋白质水解成水解蛋白。此处不讨论有机物水解。
溶于水后溶液的pH值则以相应酸碱的强弱决定。化学会IChO培训讲座-第七章452019/2/7二、各类盐的水解规律:
1、强酸和强碱在水中都立即全部电离,相应盐解离后产生的Na+或Cl-不会引起体系酸碱度的变化。
2、弱酸和弱碱在水中只能部分电离,相应盐溶于水后产生的酸根或碱性阳离子有较强的生成相应酸或碱的倾向,将消耗水中H+或OH-而引起体系酸碱度的变化。
3、酸(或碱)越弱,水解后引起体系中H+(或OH- )的降低值越大,引起pH值额度变化值也越大。化学会IChO培训讲座-第七章462019/2/71、强酸强碱盐如规律 2 所言,强酸强碱盐(NaCl等)溶于水后不改变溶液酸碱度,因而,也就认为“不水解”。
化学会IChO培训讲座-第七章472019/2/72、弱酸强碱盐现象:弱酸强碱盐溶于水后因有生成弱酸趋势而消耗水中的H+,从而使溶液呈碱性。
原因:总反应:化学会IChO培训讲座-第七章482019/2/7水解平衡常数Kh只要该酸不太弱,且其浓度不太稀,则可用最简式计算其pH值。化学会IChO培训讲座-第七章492019/2/73、强酸弱碱盐其处理程序与强碱弱酸盐完全相同,只是将其中的酸与碱位置互换而已。因而不用多言而直接给出结论即可。 (以NH4Cl为例)化学会IChO培训讲座-第七章502019/2/7应用实例例: 0.1mol/LNaAc溶液的pH值。
解:NaAc水解而生成HAc和OH-,由于KaC>20Kw,且C/Ka>400,可直接用最简式进行计算。 如果按书上P129例7-6方法计算,结果相同。化学会IChO培训讲座-第七章512019/2/74、弱酸弱碱盐分析:弱酸弱碱盐因其酸碱两部分都会水解,都对体系pH值的改变有 “贡献” 。溶液的pH值具体数据则要视两者的相对强弱而定。
判断:酸碱性越弱的,其水解趋势越大,引起pH值的改变量也越大,因而体系的酸碱性由它决定,具体数据由两者的比例决定。化学会IChO培训讲座-第七章522019/2/70.1 mol/L NH4F的pH值化学会IChO培训讲座-第七章532019/2/70.1 mol/L NH4F的pH值然后可依据C’(HF)=9. 6?10-5或C’(NH3H2O) )=9. 6?10-5,从酸式或碱式分别计算体系的pH值。水解掉的组分的量为:化学会IChO培训讲座-第七章542019/2/7化学会IChO培训讲座-第七章552019/2/7其实,还有另一算法:前提是KaC>20Kw, 且 C>20Ka, C>20Kb Ka>Kb 时溶液呈酸性,Ka< Kb溶液呈碱性。化学会IChO培训讲座-第七章562019/2/75、多元酸根多元酸根同时具有酸式解离和碱式解离的趋势,溶液的酸碱度要视两种趋势的相对大小而定。
以HCO3-为例,其酸式解离的趋势由Kb2 决定,而其碱式解离则由Ka2决定。由于大多数酸式盐的Kb2和Ka2都不大,因而溶液的pH值可直接用下式进行计算:化学会IChO培训讲座-第七章572019/2/7三、影响水解的因素温度:K是温度的函数,升温有利于水解
浓度:稀释有利于水解的进行
体系pH值:对强酸弱碱盐或强碱弱酸盐,增加其“弱”的部分能促进水解化学会IChO培训讲座-第七章582019/2/7§7 -3 难溶物的溶度积 The solubility product of insoluble compounds任何一种化合物在水中都有一定的溶解趋向,所差就是溶解度大小而已,就如NaCl能完全溶解而AgCl只能部分溶解。
难溶化合物微量溶解后成为饱和溶液,大部分难溶化合物的溶解部分几乎能全部电离。
在一定温度下,溶解速率和沉淀速率相等时达到沉淀-溶解平衡。化学会IChO培训讲座-第七章592019/2/7一、溶度积常数(Ksp)1.溶度积 (积分以AgCl为例)
对于AgCl Ag+ + Cl- , K = [Ag+][Cl-]/[AgCl]
由于是饱和溶液,其[Ag+][Cl-]的乘积为常数。
一般形式AnBm中:
同类型沉淀,KSP大的溶解度大。化学会IChO培训讲座-第七章602019/2/72、溶度积和溶解度溶解度:一定温度下每升饱和溶液中所含溶质的物质的量。 (过去的单位为 g/100mL水)
从理论上讲,溶解度和溶度积都反映了难溶电解质的溶解能力,但由于实际上可能发生许多不可预料的副反应和其他情况,除少数几种化合物外,很多难溶电解质的溶解度和溶度积不能直接互算。
以可以互算的物质为例。化学会IChO培训讲座-第七章612019/2/7例7-8:298K时Ag2CrO4在水中溶解度为4.3mg,求其KSP分析: Ag2CrO4溶解后即解离,两离子水解趋势小符合互算条件。
解:
单位变换:4.3mg/100mL = 1.3?10-4 mol/L
浓度计算:[Ag+] = 2[CrO-4] = 2.6?10-4 mol/L
KSP计算: KSP = [Ag+]2[CrO-4] = 8.8 ?10-12 化学会IChO培训讲座-第七章622019/2/7说明:凡溶解后形成的构晶离子有明显副反应的(如水解、分步解离、形成配合物等)不能简单通过溶解度计算KSP值。
任何情况下,KSP值与构晶离子浓度的关系是确定的。 如 KSP(CaCO3) = [Ca2+][CO32-] 化学会IChO培训讲座-第七章632019/2/73、溶度积规则溶度积与离子积是不同的概念。
溶度积与离子积有紧密的关系。化学会IChO培训讲座-第七章642019/2/7二、沉淀-溶解平衡的移动主要考虑同离子效应和盐效应
同离子效应——往难溶强电解质饱和溶液中加入与该电解质相同的离子,从而使沉淀溶解度降低的效应
盐效应——由于有过量强电解质存在而使沉淀溶解度增大并随电解质的增加而增加的现象化学会IChO培训讲座-第七章652019/2/71、同离子效应 例7-9纯水中BaSO4的溶解度为:在0.01 mol/L Na2SO4溶液中BaSO4的溶解度为:差别是十分明显的。化学会IChO培训讲座-第七章662019/2/72、盐效应盐效应作用的根本原因是大量的强电解质增加了体系的离子强度,降低了离子的活动性,使其活度系数减小,亦即降低构晶离子的“有效浓度”,进而使平衡
向右移动,增加了沉淀的溶解度。
盐效应的计算十分复杂,一般由实验测得。化学会IChO培训讲座-第七章672019/2/73、沉淀的生成和溶解增大或减小构晶离子的浓度是促使沉淀生成或溶解的唯一条件。
离子沉淀完全的标准: 10-5 mol/L
合理调控实验条件可控制沉淀的生成或溶解。化学会IChO培训讲座-第七章682019/2/7 沉淀生成的方法加沉淀剂:控制沉淀剂量,即要保证沉淀完全,也要避免出现盐效应。
例:要使SO42-沉淀完全,需把体系中Ba2+量控制在什么浓度?
解:控制Ba2+量使其在溶液的过量部分为1.1?10-5即可,实际操作时过量部分要更多些。化学会IChO培训讲座-第七章692019/2/7控制酸碱度:控制合适pH值可使共存的不同金属离子分别沉淀,进而实现分离的目标。从表中可知,控制不同pH值可以分别沉淀Fe3+和Fe2+。同时也可知道,若仅仅是要除去铁的影响,将Fe2+氧化成Fe3+后再沉淀除去更为有利,此时对其他共存离子的影响最小。化学会IChO培训讲座-第七章702019/2/7例5-6 要使0.1molFeS完全溶于1L盐酸中,求所需盐 酸的最低浓度。 解:当0.1molFeS完全溶于1L盐酸时,
c(Fe2+) = 0.1mol·L-1, c(H2S) = 0.1mol·L-1
K?SP (FeS)=c(Fe2+)·c(S2-)
根据
化学会IChO培训讲座-第七章712019/2/7
生成H2S时消耗掉0.2mol盐酸,故所需的盐酸的最
初浓度为0.03+0.2=0.23mol·L-1。
化学会IChO培训讲座-第七章722019/2/7考察:什么pH时可使CdS沉淀完全而ZnS不沉淀。化学会IChO培训讲座-第七章732019/2/7控制[H+]在0.21~0.34即可实现完全沉淀CdS而ZnS不沉淀的目标,实际操作时在饱和H2S溶液中控制HCl为0.3 mol/L。 P132例7-11请自学.化学会IChO培训讲座-第七章742019/2/7 沉淀溶解的方法根据 MA ====M+ + A- 只要设法减小[M+]或[A-]即可使沉淀趋于溶解。
降低离子浓度的方法主要有:
生成弱电解质 —— 主要是减少[A-]
生成配合物 —— 主要是减少[M+]
改变离子价态 —— 对[M+]和[A-]都有影响
多因素联用 —— 效果更好,条件也更苛刻化学会IChO培训讲座-第七章752019/2/7 1、生成弱电解质 由于加入H+使OH-和H+结合成弱电解质水,溶液中的OH-离子的浓度降低使平衡向着溶解方向移动。从而使沉淀溶解。化学会IChO培训讲座-第七章762019/2/72. 通过氧化还原反应使沉淀溶解 如CuS(K?SP为1.27×10-36)溶于硝酸。
CuS(s) = Cu2+ + S2-
+
HNO3 S↓ + NO↑ + H2O
HgS (K?SP为6.44×10-53)需用王水来溶解。
3HgS + 2HNO3 + 12HCl 3H2[HgCl4] + 3S +
2NO + 4H2O 化学会IChO培训讲座-第七章772019/2/73. 生成配合物使沉淀溶解 例如AgCl不溶于酸,但可溶于NH3溶液。
AgCl(s) = Ag+ + Cl-
+
2NH3
‖
[Ag(NH3)2]+
使Qi<K?SP ,则固体AgCl开始溶解。
化学会IChO培训讲座-第七章782019/2/74、沉淀的转化有时,因所研究化合物沉淀的组成、存在形式、表面性质等多种因素对将要进行的研究会产生影响,需要对沉淀进行转化后继续研究。
如:为免外加阴离子影响,将BaSO4沉淀转化为BaCO3沉淀,分离后酸化即消除了SO42-的影响。
又如:CuI↓强烈吸附 I2,进行碘量法测铜时,近终点处需加入KSCN使CuI↓转化为CuSCN↓,释放出吸附的I2,从而使滴定反应顺利进行。化学会IChO培训讲座-第七章792019/2/7将BaSO4沉淀转化为BaCO3沉淀的平衡常数计算书上以列出,其数值较小,将使转化不完全,但加大浓度并多次转化后还是可以实现的。化学会IChO培训讲座-第七章802019/2/7§7 -4 离子方程式的书写和配平基本原则:
反应前后原子个数相等
氧化剂的电子总数与还原剂失电子总数相等化学反应方程式的正确书写和配平是理解、处理化学反应过程的重要步骤,尤其是氧化-还原反应。必须给予重视。化学会IChO培训讲座-第七章812019/2/7§7 -4 离子方程式的书写和配平具体过程:
根据实验事实写出反应产物
分解而列出两个半反应式
先配平除H、O外的原子数,然后以H2O、H+、OH-来配平H、O的原子数。
调整两半反应间的化学计量数,使得失电子的总数相等。
最后配上异电荷离子。
以P135例题所用竖式相加法较为合适。化学会IChO培训讲座-第七章822019/2/7离子式的其他注意事项:
只适合于溶液中或熔化状态
仅将强酸、强碱、可溶性盐写成离子,其余为化学式
微溶物的情况有特殊要求
氨水的书写需视情况而定化学会IChO培训讲座-第七章832019/2/7谢谢大家!
