安徽省滁州市定远县育才学校2021-2022学年高二(普通班)上学期第三次月考(12月)化学试题(Word版含答案)
文档属性
| 名称 | 安徽省滁州市定远县育才学校2021-2022学年高二(普通班)上学期第三次月考(12月)化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 290.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-07 10:52:07 | ||
图片预览



文档简介
育才学校2021-2022学年第一学期第三次月考试卷
高二化学(适用普通班)
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题 48分)
一、单选题(16小题,每小题3分,共48分)
1.(本题3分)下列说法错误的是
A.HF的水溶液中既有、,又有大量的HF分子,因此HF是弱电解质
B.向氨水溶液中加入氢氧化钠固体,一水合氨的电离平衡逆向移动,增大
C.0.3mol/L氢硫酸溶液加水稀释,电离程度增大,一定增大
D.将的溶液加水稀释,变大
2.(本题3分)下列对水的电离平衡的影响因素的说法错误的是
A.向水中加入可溶性酸,能抑制水的电离
B.向水中加入可溶性碱,能抑制水的电离
C.升高温度,能促进水的电离
D.向水中加入金属钠,能抑制水的电离
3.(本题3分)已知T℃时,的硫酸溶液由水电离的,则在T℃时,将的NaOH溶液a L与的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的,则a:b为
A.1:9 B.9:1 C.1:10 D.10:1
4.(本题3分)25℃时,下列溶液的微粒浓度关系正确的是
A.Na2CO3溶液:c(OH-)= c(H+)+c(HCO)+c(H2CO3)
B.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.(NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)=c(NH3 H2O)
5.(本题3分)下列说法正确的是
A.pH=0的溶液不存在
B.中性溶液的pH不一定等于7
C.使用广范pH试纸测得某溶液的pH=3.5
D.酸或碱溶液稀释时,溶液的pH均减小
6.(本题3分)甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是
A.甲酸溶液与锌反应比强酸溶液缓慢
B.甲酸能与碳酸钠反应放出二氧化碳
C.10mL1mol·L-1甲酸溶液恰好与10mL1mol·L-1NaOH溶液完全反应
D.常温下,1mol·L-1甲酸溶液中的c(H+)约为1×10-2mol·L-1
7.(本题3分)在恒温恒容的条件下,反应A(g)+B(g) C(g)+D(s)已达平衡,能使平衡正向移动的措施是
A.减少C或D的浓度 B.增大D的浓度
C.增大A或B的浓度 D.减小压强
8.(本题3分)常温下0.1 mol/L的下列物质的水溶液,加热到80℃,溶液的pH几乎不变的是
A.氢氧化钠 B.硫酸铵 C.氯化钠 D.硫酸
9.(本题3分)室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a点水的电离程度大于b点
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)10.(本题3分)关于溶液的说法正确的是
A.25°C时,pH=3的盐酸与pH=11的NaOH溶液等体积混合后,溶液显中性
B.pH=7的溶液一定呈中性
C.能使石蕊指示剂呈紫色的溶液一定呈中性
D.能使甲基橙指示剂变黄的溶液一定呈碱性
11.(本题3分)常温下,纯水中存在电离平衡:H2O H++OH-,若要使水的电离平衡向右移动,并使c(H+)增大,应加入的适当物质是
A.NaHSO4 B.HCl C.Na2CO3 D.FeCl3
12.(本题3分)下列表达式书写正确的是
A.CaCO3的电离方程式:CaCO3 Ca2++CO
B.HCO的电离方程式:HCO+H2O H3O++CO
C.CO的水解方程式:CO+2H2O H2CO3+2OH-
D.CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO(aq)
13.(本题3分) 298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积小于20.0mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH>12
14.(本题3分)氯化银固体难溶于水,但在水中存在沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq),对该平衡的说法中错误的是
A.向该平衡中加入固体,平衡向左移动,溶解度减小
B.向该平衡中加入固体,平衡不移动
C.向该平衡中加水,平衡向右移动,溶解度增大
D.向该平衡中加入固体,平衡向右移动,转化为
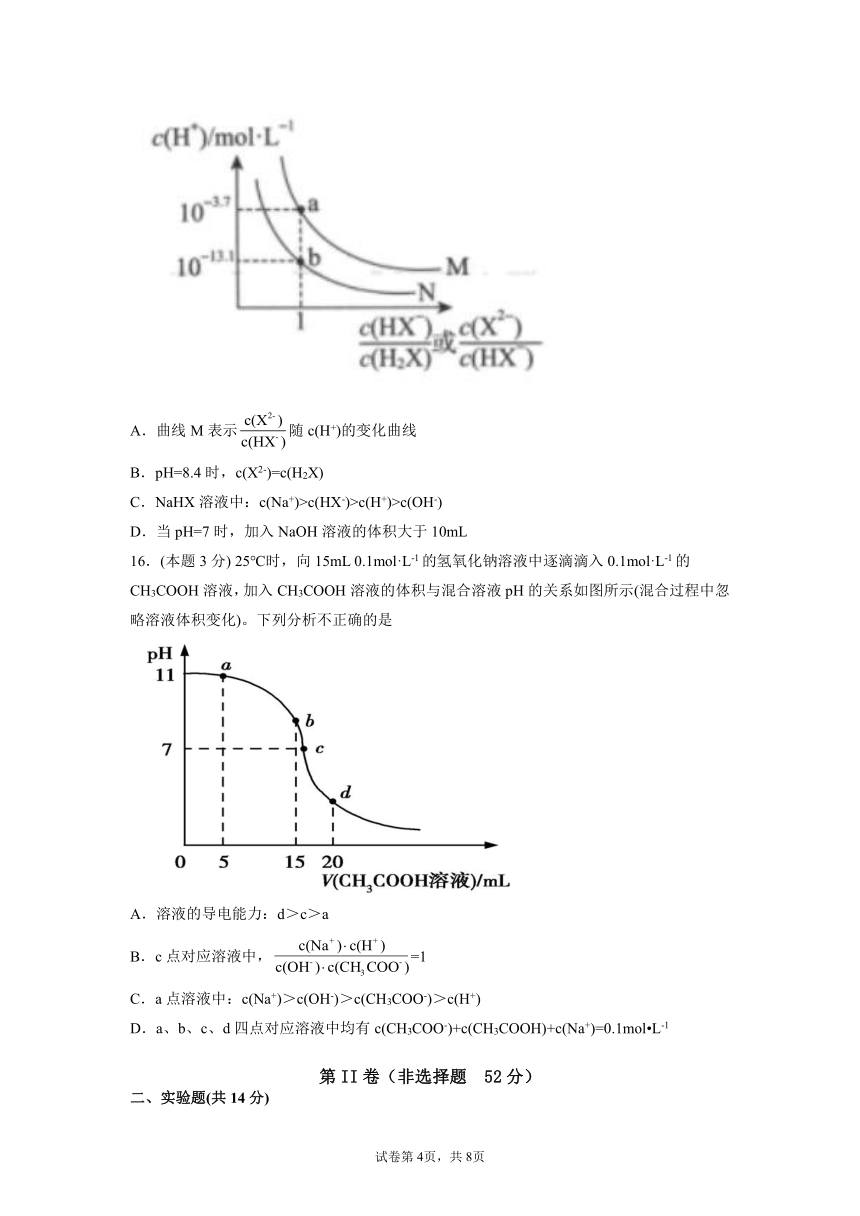
15.(本题3分) H2X是一种二元弱酸。常温下,将NaOH溶液滴加到10mL等浓度的H2X溶液中,测得混合溶液的c(H+)与离子浓度变化的关系如图所示。下列叙述正确的是
A.曲线M表示随c(H+)的变化曲线
B.pH=8.4时,c(X2-)=c(H2X)
C.NaHX溶液中:c(Na+)>c(HX-)>c(H+)>c(OH-)
D.当pH=7时,加入NaOH溶液的体积大于10mL
16.(本题3分) 25℃时,向15mL 0.1mol·L-1的氢氧化钠溶液中逐滴滴入0.1mol·L-1的CH3COOH溶液,加入CH3COOH溶液的体积与混合溶液pH的关系如图所示(混合过程中忽略溶液体积变化)。下列分析不正确的是
A.溶液的导电能力:d>c>a
B.c点对应溶液中,=1
C.a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.a、b、c、d四点对应溶液中均有c(CH3COO-)+c(CH3COOH)+c(Na+)=0.1mol L-1
第II卷(非选择题 52分)
二、实验题(共14分)
17.(本题14分,每空2分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配置待测液:准确称量8.4g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品,配成450mL待测溶液。除烧杯和玻棒外,还需要用到的主要仪器有___________、___________。
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,可选用___________作指示剂,下图中仪器A的名称是___________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是___________
滴定次数 待测溶液体积(mL) 标准酸体积
滴定前的刻度(mL) 滴定后的刻度(mL)
第一次 10.00 0.40 20.50
第二次 10.00 1.15 24.25
第三次 10.00 4.10 24.00
(4)滴定时,若用酚酞做指示剂,则达到滴定终点的判断方法是:___________。
(5)以下操作会导致测得的NaOH溶液浓度偏高的是___________
A.锥形瓶在取用NaOH待测液前用少量水洗涤
B.滴定前滴定管中有气泡,滴定后气泡消失
C.达到滴定终点时俯视读数
D.碱式滴定管量取NaOH溶液时,未进行润洗操作
E.标准液读数时,若滴定前俯视,滴定后仰视
三、原理综合题(共38分)
18.(本题14分,每空2分)回答下列问题:
(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是_ _ (填“I”或“II”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_ _。
③V1和V2的关系:V1_ _V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_ _。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀。相同温度下,溶解度:AgSCN>AgI。
操作步骤 现象
步骤1:向2mL0.005mol L-1AgNO3溶液中加入2mL0.005mol L-1KSCN溶液,静置。 出现白色沉淀。
步骤2:取1mL上层清液于试管中,滴加1滴2mol L-1Fe(NO3)3溶液。 溶液变红色。
步骤3:向步骤2的溶液中,继续加入5滴3mol L-1AgNO3溶液。 现象a,溶液红色变浅。
步骤4:向步骤1余下的浊液中加入5滴3mol L-1KI溶液。 浊液中出现黄色沉淀。
①写出步骤2中溶液变红色的离子方程式_ __。
②步骤3中现象a是_ _。
③用化学平衡原理解释步骤4的实验现象_ _。
19.(本题24分,每空3分)“碳中和”是当代新兴的一种环保形式,其中“碳中和”形式中的一个重要反应是CO(g)+H2O(g) CO2(g)+H2(g)。某化学实验小组在容积为的密闭容器甲中,加入的和的,在催化剂存在和的条件下加热,发生上述反应,反应中的浓度随时间变化情况如下图:
(1)已知CO(g)+2H2(g) CH3OH(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
则反应:CO(g)+H2O(g) CO2(g)+H2(g) ___________
(2)下列能够判定容器甲中可逆反应达到平衡的标志是___________
A.的消耗速率等于的生成速率 B.混合气体的平均密度不再变化
C.密闭容器内的总压强不再变化 D.密闭容器内的键数目不再变化
(3)根据上图数据,计算时间段内的化学反应速率___________;
(4)当反应达到平衡后,若将容器甲升温至,平衡将会___________移动(填“向正反应方向”、“向逆反应方向”或“不”);再次达到平衡时该反应的化学平衡常数___________1(填“”、“”或“”);
(5)在催化剂存在和的条件下,在另一容器乙中,某时刻测得各物质的浓度为:、,则此时正、逆反应速率的大小___________(填“”、“”或“”);
(6)若下容器甲达到平衡后,再充入的水蒸气,重新达到平衡时,的转化率___________(填“增大”、“减小”或“不变”),的浓度___________。
参考答案
1.C2.D3.A4.D5.B6.D7.C8.D9.B10.A11.D12.B13.B14.C
15.B16.A
17.(1) 500mL容量瓶 胶头滴管
(2) 酚酞或甲基橙 酸式滴定管
(3) 0.4mol/l
(4)当滴加最后一定盐酸溶液,溶液的红色褪去,且30s内不再恢复到原来的颜色
(5)BE
18.(1) I 醋酸 < c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(2) Fe3++3SCN- Fe(SCN)3 出现白色沉淀 AgSCN存在溶解平衡AgSCN(s) Ag+(aq)+SCN-(aq),加入KI后,因溶解度AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓
19.(1)-41
(2)D
(3)0.003
(4) 逆反应方向 <
(5)<
(6) 减小 0.04
试卷第2页,共9页
试卷第1页,共9页
高二化学(适用普通班)
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题 48分)
一、单选题(16小题,每小题3分,共48分)
1.(本题3分)下列说法错误的是
A.HF的水溶液中既有、,又有大量的HF分子,因此HF是弱电解质
B.向氨水溶液中加入氢氧化钠固体,一水合氨的电离平衡逆向移动,增大
C.0.3mol/L氢硫酸溶液加水稀释,电离程度增大,一定增大
D.将的溶液加水稀释,变大
2.(本题3分)下列对水的电离平衡的影响因素的说法错误的是
A.向水中加入可溶性酸,能抑制水的电离
B.向水中加入可溶性碱,能抑制水的电离
C.升高温度,能促进水的电离
D.向水中加入金属钠,能抑制水的电离
3.(本题3分)已知T℃时,的硫酸溶液由水电离的,则在T℃时,将的NaOH溶液a L与的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的,则a:b为
A.1:9 B.9:1 C.1:10 D.10:1
4.(本题3分)25℃时,下列溶液的微粒浓度关系正确的是
A.Na2CO3溶液:c(OH-)= c(H+)+c(HCO)+c(H2CO3)
B.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.(NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)=c(NH3 H2O)
5.(本题3分)下列说法正确的是
A.pH=0的溶液不存在
B.中性溶液的pH不一定等于7
C.使用广范pH试纸测得某溶液的pH=3.5
D.酸或碱溶液稀释时,溶液的pH均减小
6.(本题3分)甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是
A.甲酸溶液与锌反应比强酸溶液缓慢
B.甲酸能与碳酸钠反应放出二氧化碳
C.10mL1mol·L-1甲酸溶液恰好与10mL1mol·L-1NaOH溶液完全反应
D.常温下,1mol·L-1甲酸溶液中的c(H+)约为1×10-2mol·L-1
7.(本题3分)在恒温恒容的条件下,反应A(g)+B(g) C(g)+D(s)已达平衡,能使平衡正向移动的措施是
A.减少C或D的浓度 B.增大D的浓度
C.增大A或B的浓度 D.减小压强
8.(本题3分)常温下0.1 mol/L的下列物质的水溶液,加热到80℃,溶液的pH几乎不变的是
A.氢氧化钠 B.硫酸铵 C.氯化钠 D.硫酸
9.(本题3分)室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a点水的电离程度大于b点
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)
A.25°C时,pH=3的盐酸与pH=11的NaOH溶液等体积混合后,溶液显中性
B.pH=7的溶液一定呈中性
C.能使石蕊指示剂呈紫色的溶液一定呈中性
D.能使甲基橙指示剂变黄的溶液一定呈碱性
11.(本题3分)常温下,纯水中存在电离平衡:H2O H++OH-,若要使水的电离平衡向右移动,并使c(H+)增大,应加入的适当物质是
A.NaHSO4 B.HCl C.Na2CO3 D.FeCl3
12.(本题3分)下列表达式书写正确的是
A.CaCO3的电离方程式:CaCO3 Ca2++CO
B.HCO的电离方程式:HCO+H2O H3O++CO
C.CO的水解方程式:CO+2H2O H2CO3+2OH-
D.CaCO3的沉淀溶解平衡表达式:CaCO3(s)=Ca2+(aq)+CO(aq)
13.(本题3分) 298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积小于20.0mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH>12
14.(本题3分)氯化银固体难溶于水,但在水中存在沉淀溶解平衡AgCl(s) Ag+(aq)+Cl-(aq),对该平衡的说法中错误的是
A.向该平衡中加入固体,平衡向左移动,溶解度减小
B.向该平衡中加入固体,平衡不移动
C.向该平衡中加水,平衡向右移动,溶解度增大
D.向该平衡中加入固体,平衡向右移动,转化为
15.(本题3分) H2X是一种二元弱酸。常温下,将NaOH溶液滴加到10mL等浓度的H2X溶液中,测得混合溶液的c(H+)与离子浓度变化的关系如图所示。下列叙述正确的是
A.曲线M表示随c(H+)的变化曲线
B.pH=8.4时,c(X2-)=c(H2X)
C.NaHX溶液中:c(Na+)>c(HX-)>c(H+)>c(OH-)
D.当pH=7时,加入NaOH溶液的体积大于10mL
16.(本题3分) 25℃时,向15mL 0.1mol·L-1的氢氧化钠溶液中逐滴滴入0.1mol·L-1的CH3COOH溶液,加入CH3COOH溶液的体积与混合溶液pH的关系如图所示(混合过程中忽略溶液体积变化)。下列分析不正确的是
A.溶液的导电能力:d>c>a
B.c点对应溶液中,=1
C.a点溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.a、b、c、d四点对应溶液中均有c(CH3COO-)+c(CH3COOH)+c(Na+)=0.1mol L-1
第II卷(非选择题 52分)
二、实验题(共14分)
17.(本题14分,每空2分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配置待测液:准确称量8.4g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品,配成450mL待测溶液。除烧杯和玻棒外,还需要用到的主要仪器有___________、___________。
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,可选用___________作指示剂,下图中仪器A的名称是___________。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是___________
滴定次数 待测溶液体积(mL) 标准酸体积
滴定前的刻度(mL) 滴定后的刻度(mL)
第一次 10.00 0.40 20.50
第二次 10.00 1.15 24.25
第三次 10.00 4.10 24.00
(4)滴定时,若用酚酞做指示剂,则达到滴定终点的判断方法是:___________。
(5)以下操作会导致测得的NaOH溶液浓度偏高的是___________
A.锥形瓶在取用NaOH待测液前用少量水洗涤
B.滴定前滴定管中有气泡,滴定后气泡消失
C.达到滴定终点时俯视读数
D.碱式滴定管量取NaOH溶液时,未进行润洗操作
E.标准液读数时,若滴定前俯视,滴定后仰视
三、原理综合题(共38分)
18.(本题14分,每空2分)回答下列问题:
(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是_ _ (填“I”或“II”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_ _。
③V1和V2的关系:V1_ _V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_ _。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀。相同温度下,溶解度:AgSCN>AgI。
操作步骤 现象
步骤1:向2mL0.005mol L-1AgNO3溶液中加入2mL0.005mol L-1KSCN溶液,静置。 出现白色沉淀。
步骤2:取1mL上层清液于试管中,滴加1滴2mol L-1Fe(NO3)3溶液。 溶液变红色。
步骤3:向步骤2的溶液中,继续加入5滴3mol L-1AgNO3溶液。 现象a,溶液红色变浅。
步骤4:向步骤1余下的浊液中加入5滴3mol L-1KI溶液。 浊液中出现黄色沉淀。
①写出步骤2中溶液变红色的离子方程式_ __。
②步骤3中现象a是_ _。
③用化学平衡原理解释步骤4的实验现象_ _。
19.(本题24分,每空3分)“碳中和”是当代新兴的一种环保形式,其中“碳中和”形式中的一个重要反应是CO(g)+H2O(g) CO2(g)+H2(g)。某化学实验小组在容积为的密闭容器甲中,加入的和的,在催化剂存在和的条件下加热,发生上述反应,反应中的浓度随时间变化情况如下图:
(1)已知CO(g)+2H2(g) CH3OH(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
则反应:CO(g)+H2O(g) CO2(g)+H2(g) ___________
(2)下列能够判定容器甲中可逆反应达到平衡的标志是___________
A.的消耗速率等于的生成速率 B.混合气体的平均密度不再变化
C.密闭容器内的总压强不再变化 D.密闭容器内的键数目不再变化
(3)根据上图数据,计算时间段内的化学反应速率___________;
(4)当反应达到平衡后,若将容器甲升温至,平衡将会___________移动(填“向正反应方向”、“向逆反应方向”或“不”);再次达到平衡时该反应的化学平衡常数___________1(填“”、“”或“”);
(5)在催化剂存在和的条件下,在另一容器乙中,某时刻测得各物质的浓度为:、,则此时正、逆反应速率的大小___________(填“”、“”或“”);
(6)若下容器甲达到平衡后,再充入的水蒸气,重新达到平衡时,的转化率___________(填“增大”、“减小”或“不变”),的浓度___________。
参考答案
1.C2.D3.A4.D5.B6.D7.C8.D9.B10.A11.D12.B13.B14.C
15.B16.A
17.(1) 500mL容量瓶 胶头滴管
(2) 酚酞或甲基橙 酸式滴定管
(3) 0.4mol/l
(4)当滴加最后一定盐酸溶液,溶液的红色褪去,且30s内不再恢复到原来的颜色
(5)BE
18.(1) I 醋酸 < c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(2) Fe3++3SCN- Fe(SCN)3 出现白色沉淀 AgSCN存在溶解平衡AgSCN(s) Ag+(aq)+SCN-(aq),加入KI后,因溶解度AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓
19.(1)-41
(2)D
(3)0.003
(4) 逆反应方向 <
(5)<
(6) 减小 0.04
试卷第2页,共9页
试卷第1页,共9页
同课章节目录
