安徽省滁州市定远县育才学校2021-2022学年高一上学期第三次月考(12月)化学试题(Word版含答案)
文档属性
| 名称 | 安徽省滁州市定远县育才学校2021-2022学年高一上学期第三次月考(12月)化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 170.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-07 11:46:01 | ||
图片预览



文档简介
育才学校2021-2022学年第一学期第三次月考考试
高一化学试题
一、选择题(本大题共18小题,共54分)
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是
A. 物质的量:甲乙 B. 相对分子质量:甲乙
C. 摩尔体积:甲乙 D. 气体体积:甲乙
除去中混有的少量气体,最好选用的试剂是
A. 澄清石灰水 B. 品红溶液 C. 溶液 D. 饱和溶液
下列反应的离子方程式书写正确的是
A. 钠和冷水反应:
B. 氯气溶于水:
C. 铁跟稀硫酸反应:
D. 溶液跟反应:
设为阿伏加德罗常数的值.下列叙述正确的是
A. 甲醇中含有键的数目为
B. ,的溶液中含有的数目为
C. 与足量反应产生 ,转移电子的数目为
D. 标准状况下,己烷含有分子的数目为
根据有关操作与现象,所得结论不正确的是
选项 操作 现象 结论
将湿润的有色布条伸入中 布条褪色 氯气有漂白性
用洁净的铂丝蘸取某溶液灼烧 火焰呈黄色 溶液中含有
将湿润的红色石蕊试纸伸入中 试纸变蓝 氨水显碱性
向某溶液中滴加溶液 溶液变红 溶液中含有
有一澄清透明的溶液,只可能含有、、、、、、七种离子中的几种,向溶液中逐滴加入一定量的溶液的过程中,开始没有沉淀,而后有沉淀。下列判断正确的是
A. 一定不含和 B. 溶液可能含有
C. 溶液可能含有 D. 可能含有但一定不含
下列实验操作能达到实验目的是
选项 实验目的 实验操作
比较水和乙醇中氢的活泼性 分别讲少量钠投入到盛有水和乙醇的烧杯中
由溶液制备无水 将溶液加热蒸干
除去粉中混有的 加入稀硝酸溶液,过滤、洗涤、干燥
制备胶体 将浓溶液滴加到饱和的溶液中
下列叙述错误的是
A. 向某溶液中加入盐酸酸化的溶液有白色沉淀,该溶液中一定含有
B. 过氧化钠可用于呼吸面具作为氧气的来源
C. 氧化铁常用作红色油漆和涂料
D. 常温下可用铁制或铝制容器盛装浓硫酸
下列有关钠及其化合物说法不正确的是
A. 实验室将保存在煤油中
B. 过氧化钠是强氧化剂,氧化钠是一种碱性氧化物
C. 金属钠和氧气反应,条件不同,产物不同
D. 相同质量的和分别与足量盐酸反应,放出多
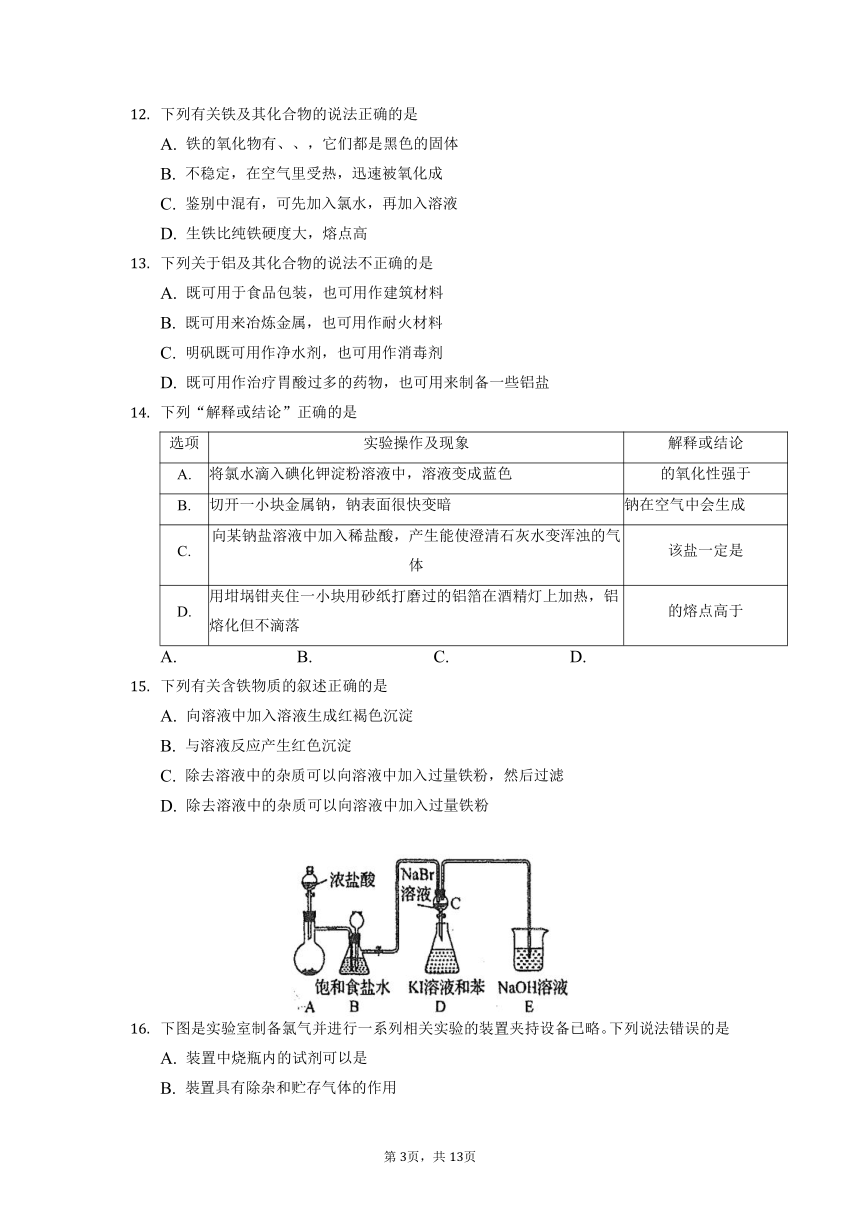
某同学用以下装置制备并检验氯气的性质.下列说法正确的是
A. 图Ⅰ:若二氧化锰过量,则浓盐酸可全部消耗完
B. 图Ⅱ:仅证明新制氯水具有酸性
C. 图Ⅲ:产生了棕黄色的雾
D. 图Ⅳ:湿润的有色布条褪色
有臭氧与二氧化碳的混合气体共,其标况下体积为,下列说法错误的是
A. 混合气体含有的原子数为
B. 混合气体对氢气的相对密度为
C. 混合气体中,臭氧的物质的量分数为
D. 混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体的质量为
下列有关铁及其化合物的说法正确的是
A. 铁的氧化物有、、,它们都是黑色的固体
B. 不稳定,在空气里受热,迅速被氧化成
C. 鉴别中混有,可先加入氯水,再加入溶液
D. 生铁比纯铁硬度大,熔点高
下列关于铝及其化合物的说法不正确的是
A. 既可用于食品包装,也可用作建筑材料
B. 既可用来冶炼金属,也可用作耐火材料
C. 明矾既可用作净水剂,也可用作消毒剂
D. 既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
下列“解释或结论”正确的是
选项 实验操作及现象 解释或结论
A. 将氯水滴入碘化钾淀粉溶液中,溶液变成蓝色 的氧化性强于
B. 切开一小块金属钠,钠表面很快变暗 钠在空气中会生成
C. 向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 该盐一定是
D. 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,铝熔化但不滴落 的熔点高于
A. B. C. D.
下列有关含铁物质的叙述正确的是
A. 向溶液中加入溶液生成红褐色沉淀
B. 与溶液反应产生红色沉淀
C. 除去溶液中的杂质可以向溶液中加入过量铁粉,然后过滤
D. 除去溶液中的杂质可以向溶液中加入过量铁粉
下图是实验室制备氯气并进行一系列相关实验的装置夹持设备已略。下列说法错误的是
A. 装置中烧瓶内的试剂可以是
B. 裝置具有除杂和贮存气体的作用
C. 实验结束后,振荡会观察到液体分层且下层呈紫色
D. 利用该装置能证明氯、溴、碘的非金属性逐渐减弱
根据元素周期表和元素周期律,判断下列叙述不正确的是
A. 若和的核外电子层结构相同,则原子序数:
B. 由水溶液的酸性:,可推断出元素的非金属性:
C. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D. 和分别位于第六周期Ⅰ和Ⅱ族,碱性:
短周期元素、、、、在元素周期表中的相对位置如表所示,其中的单质在一定条件下能与的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体。则下列相关说法正确的是
A. 简单离子半径:
B. 的最高价氧化物的水化物是中强酸
C. 化合物中不满足电子稳定结构
D. 在水溶液中和反应可以制得
二、综合题(本大题共5小题,共46分)
(7分)钠、碳及它们的化合物在生产、生活中有着重要的用途。
某汽车安全气囊的产气药剂主要含有、 、、等物质。当汽车发生碰撞时,迅速分解产生和,同时放出大量的热。使气囊迅速膨胀,从而起到保护作用。
中氯元素的化合价是________,具有________填“还原性”或“氧化性”。
可处理产生的,反应为,反应中作________填“还原剂”或“氧化剂”。
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是______________。
可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究与的反应。请回答下列问题。
根据实验目的,将虚线框中的装置补充完整并标出所用的试剂。
装置中观察到的现象是_________________________________________________,反应的化学方程式是____________________________。
装置的作用是吸收未反应的便于的检验,吸收的离子方程式是_________________。
(8分)物质由三种常见元素组成,某研究小组按下图流程探究其组成:
已知:Ⅰ各反应均充分;Ⅱ固体与气体均为纯净物;Ⅲ用火焰灼烧溶液,火焰呈紫色透过蓝色钴玻璃。请回答:
白色沉淀的化学式 ______,物质的化学式为 ______;
已知气体通入漂白粉溶液也会生成白色沉淀,写出该反应的化学方程式 ______;
已知与固体在酸性条件下可以反应生成一种气体单质,请写出该反应的离子方程式 ______。
(12分)高锰酸钾是一种广泛使用的氧化剂和消毒剂。完成下列填空:
测定室内甲醛含量,发生反应如下。
______ ______ ______ ______ ______ ______
配平该方程式。
将室内气体通入酸性溶液中,通入时,溶液颜色恰好变为无色,计算室内甲醛的浓度为 ______ ;上述酸性是指用硫酸酸化的溶液,请说明不使用硝酸酸化的理由 ______ 。
配制溶液,定容操作的方法为 ______ 。
将气体通入溶液中,溶液会逐渐褪色,体现的 ______ 性质。
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀,写出该反应的化学方程式 ______ 。
的溶液可用于消毒蔬果和餐具,该溶液一般保存在棕色试剂瓶中,请解释原因 ______ 。
(10分)下表是元素周期表的一部分,针对表中的号元素,用元素符号或化学式回答以下问题:
在号元素中,原子半径最大的是________填元素符号,其离子的结构示意图为________。
号元素中,最高价氧化物对应的水化物中酸性最强的是________填化学式,下同,碱性最强的是________,呈两性的氢氧化物是________;三者相互反应的离子方程式为________、________、________。
元素的一种原子的质子数比中子数少,则此原子形成的简单离子中含有的电子的物质的量为________。
在与的单质中,化学性质较活泼的是________,可用什么化学反应说明该事实写出反应的化学方程式:________。
(9分)有和的混合物共,将其放入某浓度的盐酸中恰好完全反应.另取等质量该混合物与
溶液反应,当混合物质量不再减少时,消耗溶液.
求:原混合物中和的质量各多少克?
盐酸的物质的量浓度为多少?
答案和解析
1.【答案】
【解析】解:同温同压下气体的密度之比等于其相摩尔质量之比,而甲的密度大于乙的密度,则甲的摩尔质量比乙大,根据可知,物质的量:甲乙,故A正确;
B.同温同压下气体的密度之比等于其相对分子质量之比,而甲的密度大于乙的密度,则相对分子质量:甲乙,故B错误;
C.温度、压强影响气体摩尔体积,同温同压下气体摩尔体积相同,故C错误;
D.由中分析可知,物质的量:甲乙,同温同压下气体的体积之比等于其物质的量之比,则气体体积:甲乙,故D错误; 故选:。
2.【答案】
【解析】氢氧化钙与二氧化硫、二氧化碳都反应,故A不选;
B.品红微溶于水,即使达到饱和,溶解度也不大,而且品红和反应生成的物质不稳定,很容易分解,因此不适合用作吸收剂,故B不选;
C.二氧化硫、二氧化碳都能与氢氧化钠溶液反应,被氢氧化钠溶液吸收,故C不选;
D.可与饱和溶液反应生成,但不反应,可用于除杂,故D选; 故选:.
3.【答案】
【解析】、钠和冷水反应的离子方程式为:,故A错误;
B、氯气溶于水:;故该B错误;
C、铁跟稀硫酸反应:,故C错误;
D、溶液跟反应的离子方程式:;故D正确; 故选D.
4.【答案】
【解析】解:甲醇中含有碳氢键,含有键的数目为,故A错误;
B.没有告诉的溶液的体积,无法计算溶液中氢氧根离子的物质的量,故B错误;
C.过氧化钠与水的反应中,生成氧气,转移了电子,转移电子的数目为,故C正确;
D.标准状况下,己烷不是气体,题中条件无法计算己烷的物质的量,故D错误;故选C。
5.【答案】
【解析】解:氯气与水反应生成具有漂白性,可使湿润的有色布条褪色,而氯气不具有漂白性,故A错误;
B.钠的焰色反应为黄色,由操作和现象可知溶液中含有,故B正确;
C.氨水显碱性,可使红色石蕊试纸变蓝,操作和现象、结论均合理,故C正确;
D.铁离子遇溶液变为血红色,由操作和现象可知溶液中含有,故D正确; 故选:。
6.【答案】
【解析】解:向该溶液中加入一定量 溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的离子,
在酸性溶液中、离子分别与离子反应生成沉淀、气体而不能存在,
根据溶液的电中性可知一定含有阴离子,则只有离子符合;
而后才有沉淀。能够生成沉淀的是离子、离子或离子中的一种或几种,但在酸性条件下离子与离子发生氧化还原反应而不能共存,则一定不含离子,
综上所述,溶液中一定含有离子、离子,一定没有、、离子,、离子至少有一种,所以只有D正确, 故选:。
7.【答案】
【解析】解:钠与水反应比与乙醇反应剧烈,则可比较水和乙醇中氢的活泼性,故A正确;
B.水解生成易挥发,则蒸干不能制备,故B错误;
C.二者均与硝酸反应,应选盐酸或稀硫酸反应后过滤,故C错误;
D.浓溶液滴加到饱和的溶液,发生复分解反应生成沉淀,应在沸水中加饱和氯化铁制备胶体,故D错误; 故选:。
8.【答案】
【解析】解:白色沉淀可能为或硫酸钡,则溶液中可能含有或银离子,但二者不能同时存在,故A错误;
B.过氧化钠与二氧化碳反应生成氧气,则过氧化钠可用于呼吸面具作为氧气的来源,故B正确;
C.氧化铁为红色,则氧化铁常用作红色油漆和涂料,故C正确;
D.常温下、遇浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则常温下用铁制或铝制容器盛装浓硫酸,故D正确;
故选A.
9.【答案】
10.【答案】
【解析】A.图Ⅰ,二氧化锰与浓盐酸反应,随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完,故A错误;
B.图Ⅱ,溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,故B错误;
C.图Ⅲ,铜丝在氯气中燃烧,生成棕黄色的烟,故C错误;
D.图Ⅳ,氯气遇到湿润有色布条:,具有漂白性,湿润的有色布条褪色,故D正确。故选D。
11.【答案】
【解析】臭氧与二氧化碳的混合气体共,其标况下体积为即,
设臭氧,二氧化碳,
,,解得 ,以此解答。
A.臭氧与二氧化碳都是三原子分子,所以混合气体含有的原子数为 ,故A正确;
B.根据密度之比等于摩尔质量之比,因为混合气体的摩尔质量为,所以对氢气的相对密度为,故 B正确;
C.根据以上分析可知混合气体中,臭氧的物质的量分数为,故C错误;
D.混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体是臭氧,质量为,故D正确。故选C。
12.【答案】
【解析】A.铁的氧化物、,它们都是黑色的固体,是红色固体,故A错误;
B.氧化亚铁具有强的还原性,不稳定,在空气里受热,迅速被氧化成,故B正确;
C.鉴别中混有,先加入氯水,氧化亚铁离子生成铁离子,再加入溶液变红色,不能检验是否原溶液中含铁离子,鉴别中混有,直接加入溶液,变红色可证明,故C错误;
D.生铁是铁的合金,比纯铁硬度大,熔点低,故D错误;故选:。
13.【答案】
【解析】A.具有良好的延展性,被氧化生成的氧化铝熔点高,可作耐火材料,则 既可用于食品包装,也可用做建筑材料,故A正确;
B.电解法冶炼,且氧化铝的熔点高,可用做耐火材料,故B正确;
C.铝离子水解生成胶体,具有吸附性,可用做净水剂,不具有强氧化性,不能用作消毒剂,故C错误;
D.的碱性较弱,可与胃酸中的盐酸反应,既可用作治疗胃酸过多的药物,也可用来制备一些铝盐,故D正确;故选C。
14.【答案】
【解析】
A.的氧化性强于,则氯气与发生氧化还原反应生成碘,淀粉遇碘变蓝,故A正确;
B.切开一小块金属钠,钠表面很快变暗是应为金属钠在空气中被氧气氧化为,故B错误;
C.产生能使澄清石灰水变浑浊的气体,则气体为二氧化碳或二氧化硫,则盐为碳酸氢钠或碳酸钠,或亚硫酸钠等,故C错误;
D.氧化铝的熔点高,包裹在的外面,则铝熔化但不滴落,,故D错误。故选A。
15.【答案】
【解析】A.向溶液中加入溶液生成白色沉淀,迅速转化为灰绿色,最后变化为红褐色沉淀,故A错误;
B.与溶液反应产生红色溶液,不是沉淀,故B错误;
C.除去溶液中的杂质可以向溶液中加入过量铁粉,铁和氯化铁反应生成氯化亚铁,然后过滤,可以除去杂质,故C正确;
D.除去溶液中的杂质,向溶液中加入过量铁粉和氯化铁反应,和氯化亚铁不反应,不能除去氯化亚铁,故D错误;故选:。
16.【答案】
【解析】A. 实验室可通过浓盐酸和固体不加热反应制备氯气,故A正确;
B. 装置可除去氯气中的氯化氢,并且由于有长颈漏斗和大气相通,可以暂时储存气体,故B正确;
C.中会有碘单质生成,碘在苯中是紫红色,但是苯的密度小于水,所以是上层为紫红色,故C错误;
D. 该实验可以在、中观察到溶液颜色变化,即氯气在中置换出溴单质,溴单质在中置换出碘单质,从而证明非金属性氯溴碘,故D正确。
17.【答案】
【解析】A. 若和的核外电子层结构相同,则处于的下一周期,故原子序数:,故A正确;
B. 元素的非金属性与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故B错误;
C. 硅、锗都位于金属与非金属的交界处,具有一定金属性与非金属性,都可以做半导体材料,故C正确;
D. 同周期元素自左而右金属性减弱,金属性,金属性越强最高价氧化物对应水化物的碱性越强,故碱性,故D正确; 故选B。
18.【答案】
【解析】由短周期元素、、、、在元素周期表中的相对位置可知,位于第二周期,另外种元素处于第三周期,而的单质在一定条件下能与的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,应是碳与浓硫酸的反应生成二氧化碳与二氧化硫,故为碳、为硫,则为、为、为。
A.电子层结构相同,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:,故A错误;
B.的最高价氧化的水化物为磷酸,属于中强酸,故B正确;
C.为,结构式为,分子中每个原子均满足电子稳定结构,故C错误;
D.铝离子和硫离子会发生相互促进水解生成氢氧化铝沉淀和硫化氢,因而不能生成三硫化二铝,故D错误。
故选B。
19.【答案】;氧化性;还原剂;
;淡黄色固体变为白色;;
【解析】中氯元素的化合价为价,为最高价态,具有氧化性。
元素化合价升高,被氧化,为还原剂。
不稳定,易分解,可生成碳酸钠、二氧化碳和水,方程式为。
用为干燥装置,可用浓硫酸除去水,装置图为。
装置中发生 ,观察到的现象是淡黄色固体变为白色。
二氧化碳与氢氧化钠反应可生成碳酸钠,反应的离子方程式为。
20.【答案】
【解析】解:由分析可知,白色沉淀的化学式为;物质的化学式为,
故答案为:;;
通入溶液生成沉淀和,化学方程式为,
故答案为:;
和在酸性条件下反应可生成氯气、和水,反应的离子方程式为,
故答案为:。
物质和碳粉共热生成固体和气体,固体与气体均为纯净物,气体和足量澄清石灰水反应生成白色沉淀,由此推断气体为,该白色沉淀为,的物质的量为,则中 氧原子,固体和溶液反应生成白色沉淀,则为,其物质的量为,则物质中含有原子,用火焰灼烧溶液,火焰呈紫色透过蓝色钴玻璃,则溶液中含有,且固体为纯净物,则固体为,则物质中含有原子,::::::,则物质为,据此分析解题。
本题考查无机物的推断,题目难度较大,注意根据元素守恒和常见物质的性质和存在进行推断,解题的关键是物质确定,注意氯及其化合物性质的应用。
21.【答案】 硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低 向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平 酸性和还原性 高锰酸钾溶液见光能发生分解
【解析】解:在该反应中,元素化合价由反应前中的价变为反应后的价,化合价降低价;元素的化合价由反应前中的价变为反应后中的价,化合价升高价,化合价升降最小公倍数是,所以、的系数是,、的系数是;根据电荷守恒可知的系数是,最后根据元素守恒,可知的系数是,则配平后该反应的离子方程式为:,
故答案为:;;;;;;
酸性溶液中含有高锰酸钾的物质的量,根据物质反应关系可知,由于溶液的体积是,则甲醛的浓度为,用单位体积的质量表示浓度为,上述酸性是指用硫酸酸化的溶液,不使用硝酸酸化,是因为硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低,
故答案为:;硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低;
配制溶液,定容操作的方法为:向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平,
故答案为:向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平;
将气体通入溶液中,溶液会逐渐褪色,这是由于二者发生氧化还原反应,被氧化为,被还原为无色,同时部分提供酸根离子与金属阳离子结合形成盐,故该反应中体现了的酸性和还原性,
故答案为:酸性和还原性;
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀为,该反应的化学方程式为:,
故答案为:;
的溶液可用于消毒蔬果和餐具,说明具有强氧化性。该溶液一般保存在棕色试剂瓶中,这是由于不稳定,光照会发生分解反应,因此要保存在棕色瓶试剂瓶中避光保存,
故答案为:高锰酸钾溶液见光能发生分解。
根据升降价守恒、电荷守恒和原子守恒配平;
酸性溶液中含有高锰酸钾的物质的量,根据物质反应关系可知,根据关系式计算,硝酸具有强氧化性,会与待测物发生反应,所以用硫酸酸化;
向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平;
被氧化为,被还原为无色,同时部分提供酸根离子与金属阳离子结合形成盐,故该反应中体现了的酸性和还原性;
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀为;
由于不稳定,光照会发生分解反应,因此要保存在棕色瓶试剂瓶中避光保存。
本题考查了氧化还原反应和离子方程式的配平、物质的量浓度的计算、溶液的配制、试剂的保存、物质的性质等知识点,掌握基础是解题关键,题目难度中等。
22.【答案】;
;;;; ;
;
【解析】由元素在周期表中的位置可知,为、为、为、为、为、为、为、为、为、为。
同周期主族元素随原子序数增大,元素的原子半径减小,故在号元素中,的原子半径最大,其离子的结构示意图为。
元素的非金属性越强,最高价氧化物对应水化物的酸性越强,无含氧酸,则高氯酸的酸性最强,其化学式为;元素的金属性越强,最高价氧化物对应水化物的碱性越强,号元素中,的金属性最强,则碱性最强的是氢氧化钾,其化学式为;是两性氢氧化物;三者相互反应的离子方程式为高氯酸与氢氧化铝反应:、高氯酸与氢氧化钾反应:、氢氧化钾与氢氧化铝反应:。
元素的一种原子的质子数比中子数少,则为;此原子形成的简单离子中含有的电子的物质的量为。
同主族元素从上而下非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故在与的单质中,化学性质较活泼的是;氯气能置换出溴单质,反应的化学方程式为。
23.【答案】、;
【解析】解:溶液中,则:
所以,::,解得
故,
故答案为:、;
,,和的混合物与盐酸恰好反应所生产的、,根据原子守恒可知,,由氯离子守恒可知,故,
故答案为:.
第2页,共15页
第1页,共15页
高一化学试题
一、选择题(本大题共18小题,共54分)
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是
A. 物质的量:甲乙 B. 相对分子质量:甲乙
C. 摩尔体积:甲乙 D. 气体体积:甲乙
除去中混有的少量气体,最好选用的试剂是
A. 澄清石灰水 B. 品红溶液 C. 溶液 D. 饱和溶液
下列反应的离子方程式书写正确的是
A. 钠和冷水反应:
B. 氯气溶于水:
C. 铁跟稀硫酸反应:
D. 溶液跟反应:
设为阿伏加德罗常数的值.下列叙述正确的是
A. 甲醇中含有键的数目为
B. ,的溶液中含有的数目为
C. 与足量反应产生 ,转移电子的数目为
D. 标准状况下,己烷含有分子的数目为
根据有关操作与现象,所得结论不正确的是
选项 操作 现象 结论
将湿润的有色布条伸入中 布条褪色 氯气有漂白性
用洁净的铂丝蘸取某溶液灼烧 火焰呈黄色 溶液中含有
将湿润的红色石蕊试纸伸入中 试纸变蓝 氨水显碱性
向某溶液中滴加溶液 溶液变红 溶液中含有
有一澄清透明的溶液,只可能含有、、、、、、七种离子中的几种,向溶液中逐滴加入一定量的溶液的过程中,开始没有沉淀,而后有沉淀。下列判断正确的是
A. 一定不含和 B. 溶液可能含有
C. 溶液可能含有 D. 可能含有但一定不含
下列实验操作能达到实验目的是
选项 实验目的 实验操作
比较水和乙醇中氢的活泼性 分别讲少量钠投入到盛有水和乙醇的烧杯中
由溶液制备无水 将溶液加热蒸干
除去粉中混有的 加入稀硝酸溶液,过滤、洗涤、干燥
制备胶体 将浓溶液滴加到饱和的溶液中
下列叙述错误的是
A. 向某溶液中加入盐酸酸化的溶液有白色沉淀,该溶液中一定含有
B. 过氧化钠可用于呼吸面具作为氧气的来源
C. 氧化铁常用作红色油漆和涂料
D. 常温下可用铁制或铝制容器盛装浓硫酸
下列有关钠及其化合物说法不正确的是
A. 实验室将保存在煤油中
B. 过氧化钠是强氧化剂,氧化钠是一种碱性氧化物
C. 金属钠和氧气反应,条件不同,产物不同
D. 相同质量的和分别与足量盐酸反应,放出多
某同学用以下装置制备并检验氯气的性质.下列说法正确的是
A. 图Ⅰ:若二氧化锰过量,则浓盐酸可全部消耗完
B. 图Ⅱ:仅证明新制氯水具有酸性
C. 图Ⅲ:产生了棕黄色的雾
D. 图Ⅳ:湿润的有色布条褪色
有臭氧与二氧化碳的混合气体共,其标况下体积为,下列说法错误的是
A. 混合气体含有的原子数为
B. 混合气体对氢气的相对密度为
C. 混合气体中,臭氧的物质的量分数为
D. 混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体的质量为
下列有关铁及其化合物的说法正确的是
A. 铁的氧化物有、、,它们都是黑色的固体
B. 不稳定,在空气里受热,迅速被氧化成
C. 鉴别中混有,可先加入氯水,再加入溶液
D. 生铁比纯铁硬度大,熔点高
下列关于铝及其化合物的说法不正确的是
A. 既可用于食品包装,也可用作建筑材料
B. 既可用来冶炼金属,也可用作耐火材料
C. 明矾既可用作净水剂,也可用作消毒剂
D. 既可用作治疗胃酸过多的药物,也可用来制备一些铝盐
下列“解释或结论”正确的是
选项 实验操作及现象 解释或结论
A. 将氯水滴入碘化钾淀粉溶液中,溶液变成蓝色 的氧化性强于
B. 切开一小块金属钠,钠表面很快变暗 钠在空气中会生成
C. 向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 该盐一定是
D. 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,铝熔化但不滴落 的熔点高于
A. B. C. D.
下列有关含铁物质的叙述正确的是
A. 向溶液中加入溶液生成红褐色沉淀
B. 与溶液反应产生红色沉淀
C. 除去溶液中的杂质可以向溶液中加入过量铁粉,然后过滤
D. 除去溶液中的杂质可以向溶液中加入过量铁粉
下图是实验室制备氯气并进行一系列相关实验的装置夹持设备已略。下列说法错误的是
A. 装置中烧瓶内的试剂可以是
B. 裝置具有除杂和贮存气体的作用
C. 实验结束后,振荡会观察到液体分层且下层呈紫色
D. 利用该装置能证明氯、溴、碘的非金属性逐渐减弱
根据元素周期表和元素周期律,判断下列叙述不正确的是
A. 若和的核外电子层结构相同,则原子序数:
B. 由水溶液的酸性:,可推断出元素的非金属性:
C. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D. 和分别位于第六周期Ⅰ和Ⅱ族,碱性:
短周期元素、、、、在元素周期表中的相对位置如表所示,其中的单质在一定条件下能与的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体。则下列相关说法正确的是
A. 简单离子半径:
B. 的最高价氧化物的水化物是中强酸
C. 化合物中不满足电子稳定结构
D. 在水溶液中和反应可以制得
二、综合题(本大题共5小题,共46分)
(7分)钠、碳及它们的化合物在生产、生活中有着重要的用途。
某汽车安全气囊的产气药剂主要含有、 、、等物质。当汽车发生碰撞时,迅速分解产生和,同时放出大量的热。使气囊迅速膨胀,从而起到保护作用。
中氯元素的化合价是________,具有________填“还原性”或“氧化性”。
可处理产生的,反应为,反应中作________填“还原剂”或“氧化剂”。
是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是______________。
可用于呼吸面具或潜水艇中氧气的来源。某实验小组利用下图装置探究与的反应。请回答下列问题。
根据实验目的,将虚线框中的装置补充完整并标出所用的试剂。
装置中观察到的现象是_________________________________________________,反应的化学方程式是____________________________。
装置的作用是吸收未反应的便于的检验,吸收的离子方程式是_________________。
(8分)物质由三种常见元素组成,某研究小组按下图流程探究其组成:
已知:Ⅰ各反应均充分;Ⅱ固体与气体均为纯净物;Ⅲ用火焰灼烧溶液,火焰呈紫色透过蓝色钴玻璃。请回答:
白色沉淀的化学式 ______,物质的化学式为 ______;
已知气体通入漂白粉溶液也会生成白色沉淀,写出该反应的化学方程式 ______;
已知与固体在酸性条件下可以反应生成一种气体单质,请写出该反应的离子方程式 ______。
(12分)高锰酸钾是一种广泛使用的氧化剂和消毒剂。完成下列填空:
测定室内甲醛含量,发生反应如下。
______ ______ ______ ______ ______ ______
配平该方程式。
将室内气体通入酸性溶液中,通入时,溶液颜色恰好变为无色,计算室内甲醛的浓度为 ______ ;上述酸性是指用硫酸酸化的溶液,请说明不使用硝酸酸化的理由 ______ 。
配制溶液,定容操作的方法为 ______ 。
将气体通入溶液中,溶液会逐渐褪色,体现的 ______ 性质。
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀,写出该反应的化学方程式 ______ 。
的溶液可用于消毒蔬果和餐具,该溶液一般保存在棕色试剂瓶中,请解释原因 ______ 。
(10分)下表是元素周期表的一部分,针对表中的号元素,用元素符号或化学式回答以下问题:
在号元素中,原子半径最大的是________填元素符号,其离子的结构示意图为________。
号元素中,最高价氧化物对应的水化物中酸性最强的是________填化学式,下同,碱性最强的是________,呈两性的氢氧化物是________;三者相互反应的离子方程式为________、________、________。
元素的一种原子的质子数比中子数少,则此原子形成的简单离子中含有的电子的物质的量为________。
在与的单质中,化学性质较活泼的是________,可用什么化学反应说明该事实写出反应的化学方程式:________。
(9分)有和的混合物共,将其放入某浓度的盐酸中恰好完全反应.另取等质量该混合物与
溶液反应,当混合物质量不再减少时,消耗溶液.
求:原混合物中和的质量各多少克?
盐酸的物质的量浓度为多少?
答案和解析
1.【答案】
【解析】解:同温同压下气体的密度之比等于其相摩尔质量之比,而甲的密度大于乙的密度,则甲的摩尔质量比乙大,根据可知,物质的量:甲乙,故A正确;
B.同温同压下气体的密度之比等于其相对分子质量之比,而甲的密度大于乙的密度,则相对分子质量:甲乙,故B错误;
C.温度、压强影响气体摩尔体积,同温同压下气体摩尔体积相同,故C错误;
D.由中分析可知,物质的量:甲乙,同温同压下气体的体积之比等于其物质的量之比,则气体体积:甲乙,故D错误; 故选:。
2.【答案】
【解析】氢氧化钙与二氧化硫、二氧化碳都反应,故A不选;
B.品红微溶于水,即使达到饱和,溶解度也不大,而且品红和反应生成的物质不稳定,很容易分解,因此不适合用作吸收剂,故B不选;
C.二氧化硫、二氧化碳都能与氢氧化钠溶液反应,被氢氧化钠溶液吸收,故C不选;
D.可与饱和溶液反应生成,但不反应,可用于除杂,故D选; 故选:.
3.【答案】
【解析】、钠和冷水反应的离子方程式为:,故A错误;
B、氯气溶于水:;故该B错误;
C、铁跟稀硫酸反应:,故C错误;
D、溶液跟反应的离子方程式:;故D正确; 故选D.
4.【答案】
【解析】解:甲醇中含有碳氢键,含有键的数目为,故A错误;
B.没有告诉的溶液的体积,无法计算溶液中氢氧根离子的物质的量,故B错误;
C.过氧化钠与水的反应中,生成氧气,转移了电子,转移电子的数目为,故C正确;
D.标准状况下,己烷不是气体,题中条件无法计算己烷的物质的量,故D错误;故选C。
5.【答案】
【解析】解:氯气与水反应生成具有漂白性,可使湿润的有色布条褪色,而氯气不具有漂白性,故A错误;
B.钠的焰色反应为黄色,由操作和现象可知溶液中含有,故B正确;
C.氨水显碱性,可使红色石蕊试纸变蓝,操作和现象、结论均合理,故C正确;
D.铁离子遇溶液变为血红色,由操作和现象可知溶液中含有,故D正确; 故选:。
6.【答案】
【解析】解:向该溶液中加入一定量 溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的离子,
在酸性溶液中、离子分别与离子反应生成沉淀、气体而不能存在,
根据溶液的电中性可知一定含有阴离子,则只有离子符合;
而后才有沉淀。能够生成沉淀的是离子、离子或离子中的一种或几种,但在酸性条件下离子与离子发生氧化还原反应而不能共存,则一定不含离子,
综上所述,溶液中一定含有离子、离子,一定没有、、离子,、离子至少有一种,所以只有D正确, 故选:。
7.【答案】
【解析】解:钠与水反应比与乙醇反应剧烈,则可比较水和乙醇中氢的活泼性,故A正确;
B.水解生成易挥发,则蒸干不能制备,故B错误;
C.二者均与硝酸反应,应选盐酸或稀硫酸反应后过滤,故C错误;
D.浓溶液滴加到饱和的溶液,发生复分解反应生成沉淀,应在沸水中加饱和氯化铁制备胶体,故D错误; 故选:。
8.【答案】
【解析】解:白色沉淀可能为或硫酸钡,则溶液中可能含有或银离子,但二者不能同时存在,故A错误;
B.过氧化钠与二氧化碳反应生成氧气,则过氧化钠可用于呼吸面具作为氧气的来源,故B正确;
C.氧化铁为红色,则氧化铁常用作红色油漆和涂料,故C正确;
D.常温下、遇浓硫酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则常温下用铁制或铝制容器盛装浓硫酸,故D正确;
故选A.
9.【答案】
10.【答案】
【解析】A.图Ⅰ,二氧化锰与浓盐酸反应,随着反应的进行,浓盐酸变稀,二氧化锰不与稀盐酸反应,即使二氧化锰过量,盐酸也不能全部消耗完,故A错误;
B.图Ⅱ,溶液先变红后褪色,不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,故B错误;
C.图Ⅲ,铜丝在氯气中燃烧,生成棕黄色的烟,故C错误;
D.图Ⅳ,氯气遇到湿润有色布条:,具有漂白性,湿润的有色布条褪色,故D正确。故选D。
11.【答案】
【解析】臭氧与二氧化碳的混合气体共,其标况下体积为即,
设臭氧,二氧化碳,
,,解得 ,以此解答。
A.臭氧与二氧化碳都是三原子分子,所以混合气体含有的原子数为 ,故A正确;
B.根据密度之比等于摩尔质量之比,因为混合气体的摩尔质量为,所以对氢气的相对密度为,故 B正确;
C.根据以上分析可知混合气体中,臭氧的物质的量分数为,故C错误;
D.混合气体缓慢通过足量的氢氧化钠溶液后,剩余气体是臭氧,质量为,故D正确。故选C。
12.【答案】
【解析】A.铁的氧化物、,它们都是黑色的固体,是红色固体,故A错误;
B.氧化亚铁具有强的还原性,不稳定,在空气里受热,迅速被氧化成,故B正确;
C.鉴别中混有,先加入氯水,氧化亚铁离子生成铁离子,再加入溶液变红色,不能检验是否原溶液中含铁离子,鉴别中混有,直接加入溶液,变红色可证明,故C错误;
D.生铁是铁的合金,比纯铁硬度大,熔点低,故D错误;故选:。
13.【答案】
【解析】A.具有良好的延展性,被氧化生成的氧化铝熔点高,可作耐火材料,则 既可用于食品包装,也可用做建筑材料,故A正确;
B.电解法冶炼,且氧化铝的熔点高,可用做耐火材料,故B正确;
C.铝离子水解生成胶体,具有吸附性,可用做净水剂,不具有强氧化性,不能用作消毒剂,故C错误;
D.的碱性较弱,可与胃酸中的盐酸反应,既可用作治疗胃酸过多的药物,也可用来制备一些铝盐,故D正确;故选C。
14.【答案】
【解析】
A.的氧化性强于,则氯气与发生氧化还原反应生成碘,淀粉遇碘变蓝,故A正确;
B.切开一小块金属钠,钠表面很快变暗是应为金属钠在空气中被氧气氧化为,故B错误;
C.产生能使澄清石灰水变浑浊的气体,则气体为二氧化碳或二氧化硫,则盐为碳酸氢钠或碳酸钠,或亚硫酸钠等,故C错误;
D.氧化铝的熔点高,包裹在的外面,则铝熔化但不滴落,,故D错误。故选A。
15.【答案】
【解析】A.向溶液中加入溶液生成白色沉淀,迅速转化为灰绿色,最后变化为红褐色沉淀,故A错误;
B.与溶液反应产生红色溶液,不是沉淀,故B错误;
C.除去溶液中的杂质可以向溶液中加入过量铁粉,铁和氯化铁反应生成氯化亚铁,然后过滤,可以除去杂质,故C正确;
D.除去溶液中的杂质,向溶液中加入过量铁粉和氯化铁反应,和氯化亚铁不反应,不能除去氯化亚铁,故D错误;故选:。
16.【答案】
【解析】A. 实验室可通过浓盐酸和固体不加热反应制备氯气,故A正确;
B. 装置可除去氯气中的氯化氢,并且由于有长颈漏斗和大气相通,可以暂时储存气体,故B正确;
C.中会有碘单质生成,碘在苯中是紫红色,但是苯的密度小于水,所以是上层为紫红色,故C错误;
D. 该实验可以在、中观察到溶液颜色变化,即氯气在中置换出溴单质,溴单质在中置换出碘单质,从而证明非金属性氯溴碘,故D正确。
17.【答案】
【解析】A. 若和的核外电子层结构相同,则处于的下一周期,故原子序数:,故A正确;
B. 元素的非金属性与元素最高价氧化物对应水化物的酸性强弱有关,与氢化物水溶液的酸性无关,故B错误;
C. 硅、锗都位于金属与非金属的交界处,具有一定金属性与非金属性,都可以做半导体材料,故C正确;
D. 同周期元素自左而右金属性减弱,金属性,金属性越强最高价氧化物对应水化物的碱性越强,故碱性,故D正确; 故选B。
18.【答案】
【解析】由短周期元素、、、、在元素周期表中的相对位置可知,位于第二周期,另外种元素处于第三周期,而的单质在一定条件下能与的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,应是碳与浓硫酸的反应生成二氧化碳与二氧化硫,故为碳、为硫,则为、为、为。
A.电子层结构相同,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:,故A错误;
B.的最高价氧化的水化物为磷酸,属于中强酸,故B正确;
C.为,结构式为,分子中每个原子均满足电子稳定结构,故C错误;
D.铝离子和硫离子会发生相互促进水解生成氢氧化铝沉淀和硫化氢,因而不能生成三硫化二铝,故D错误。
故选B。
19.【答案】;氧化性;还原剂;
;淡黄色固体变为白色;;
【解析】中氯元素的化合价为价,为最高价态,具有氧化性。
元素化合价升高,被氧化,为还原剂。
不稳定,易分解,可生成碳酸钠、二氧化碳和水,方程式为。
用为干燥装置,可用浓硫酸除去水,装置图为。
装置中发生 ,观察到的现象是淡黄色固体变为白色。
二氧化碳与氢氧化钠反应可生成碳酸钠,反应的离子方程式为。
20.【答案】
【解析】解:由分析可知,白色沉淀的化学式为;物质的化学式为,
故答案为:;;
通入溶液生成沉淀和,化学方程式为,
故答案为:;
和在酸性条件下反应可生成氯气、和水,反应的离子方程式为,
故答案为:。
物质和碳粉共热生成固体和气体,固体与气体均为纯净物,气体和足量澄清石灰水反应生成白色沉淀,由此推断气体为,该白色沉淀为,的物质的量为,则中 氧原子,固体和溶液反应生成白色沉淀,则为,其物质的量为,则物质中含有原子,用火焰灼烧溶液,火焰呈紫色透过蓝色钴玻璃,则溶液中含有,且固体为纯净物,则固体为,则物质中含有原子,::::::,则物质为,据此分析解题。
本题考查无机物的推断,题目难度较大,注意根据元素守恒和常见物质的性质和存在进行推断,解题的关键是物质确定,注意氯及其化合物性质的应用。
21.【答案】 硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低 向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平 酸性和还原性 高锰酸钾溶液见光能发生分解
【解析】解:在该反应中,元素化合价由反应前中的价变为反应后的价,化合价降低价;元素的化合价由反应前中的价变为反应后中的价,化合价升高价,化合价升降最小公倍数是,所以、的系数是,、的系数是;根据电荷守恒可知的系数是,最后根据元素守恒,可知的系数是,则配平后该反应的离子方程式为:,
故答案为:;;;;;;
酸性溶液中含有高锰酸钾的物质的量,根据物质反应关系可知,由于溶液的体积是,则甲醛的浓度为,用单位体积的质量表示浓度为,上述酸性是指用硫酸酸化的溶液,不使用硝酸酸化,是因为硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低,
故答案为:;硝酸具有强氧化性,会与待测物发生反应,所以作为标准溶液会使测定结果偏低;
配制溶液,定容操作的方法为:向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平,
故答案为:向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平;
将气体通入溶液中,溶液会逐渐褪色,这是由于二者发生氧化还原反应,被氧化为,被还原为无色,同时部分提供酸根离子与金属阳离子结合形成盐,故该反应中体现了的酸性和还原性,
故答案为:酸性和还原性;
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀为,该反应的化学方程式为:,
故答案为:;
的溶液可用于消毒蔬果和餐具,说明具有强氧化性。该溶液一般保存在棕色试剂瓶中,这是由于不稳定,光照会发生分解反应,因此要保存在棕色瓶试剂瓶中避光保存,
故答案为:高锰酸钾溶液见光能发生分解。
根据升降价守恒、电荷守恒和原子守恒配平;
酸性溶液中含有高锰酸钾的物质的量,根据物质反应关系可知,根据关系式计算,硝酸具有强氧化性,会与待测物发生反应,所以用硫酸酸化;
向容量瓶中加蒸馏水至离刻度线,改用胶头滴管逐滴滴加,至凹液面最低处与刻度线齐平;
被氧化为,被还原为无色,同时部分提供酸根离子与金属阳离子结合形成盐,故该反应中体现了的酸性和还原性;
溶液与明矾溶液混合后,发生复分解反应,生成深紫色沉淀为;
由于不稳定,光照会发生分解反应,因此要保存在棕色瓶试剂瓶中避光保存。
本题考查了氧化还原反应和离子方程式的配平、物质的量浓度的计算、溶液的配制、试剂的保存、物质的性质等知识点,掌握基础是解题关键,题目难度中等。
22.【答案】;
;;;; ;
;
【解析】由元素在周期表中的位置可知,为、为、为、为、为、为、为、为、为、为。
同周期主族元素随原子序数增大,元素的原子半径减小,故在号元素中,的原子半径最大,其离子的结构示意图为。
元素的非金属性越强,最高价氧化物对应水化物的酸性越强,无含氧酸,则高氯酸的酸性最强,其化学式为;元素的金属性越强,最高价氧化物对应水化物的碱性越强,号元素中,的金属性最强,则碱性最强的是氢氧化钾,其化学式为;是两性氢氧化物;三者相互反应的离子方程式为高氯酸与氢氧化铝反应:、高氯酸与氢氧化钾反应:、氢氧化钾与氢氧化铝反应:。
元素的一种原子的质子数比中子数少,则为;此原子形成的简单离子中含有的电子的物质的量为。
同主族元素从上而下非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故在与的单质中,化学性质较活泼的是;氯气能置换出溴单质,反应的化学方程式为。
23.【答案】、;
【解析】解:溶液中,则:
所以,::,解得
故,
故答案为:、;
,,和的混合物与盐酸恰好反应所生产的、,根据原子守恒可知,,由氯离子守恒可知,故,
故答案为:.
第2页,共15页
第1页,共15页
同课章节目录
