第三单元物质构成的奥秘单元复习题--2021-2022学年九年级化学人教版上册(word版 含答案)
文档属性
| 名称 | 第三单元物质构成的奥秘单元复习题--2021-2022学年九年级化学人教版上册(word版 含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 185.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-08 08:03:31 | ||
图片预览


文档简介
第三单元《物质构成的奥秘》单元复习题
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、“沉睡三千年,一醒惊天下”。考古人员用碳14(质子数为6,中子数为8)年代检测方法进行分析,初步判断三星堆4号坑属于商代晚期,碳14原子的核外电子数是( )
A.14 B.6 C.8 D.12
2、月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子,氦3原子结构示意图是( )
3、新制的蒸馏水不宜用于养金鱼,是因为蒸馏水中含有较少的( )
A.氧元素 B.氧原子 C.氧分子 D.氢元素
4、下表是某品牌饮用天然水理化指标:
含有成分 钙 镁 钾 钠 其它
含量(mg/L) ≥4.0 ≥0.5 ≥0.35 ≥0.8 略
该表中的“钙、镁、钾、钠”应理解为( )
A.原子 B.分子 C.元素 D.物质
5、根据下列各组元素的原子结构示意图分析,具有相似化学性质的一组是( )
6、分子和原子都是构成物质的基本粒子。从分子的角度分析,下列解释错误的是( )
A.花香四溢——分子在不断运动
B.热胀冷缩——分子间的间隔随温度的变化而变化
C.空气是混合物——空气中含有多种不同的分子
D.水的天然循环——分子的种类发生了改变
7、如图是某元素的原子结构示意图。下列有关该原子的说法错误的是( )
A.质子数为9 B.易失电子形成阳离子
C.最外层有7个电子 D.该原子有两个电子层
8、核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
9、根据图的有关信息判断,下列说法不正确的是( )
A.镁离子(Mg2+)核外有10个电子
B.镁的相对原子质量是24.31
C.在化学反应中,氯原子容易失去1个电子
D.镁离子(Mg2+)与氯离子(Cl-)的最外层电子数相等
10、如图为元素周期表的一部分(X元素信息不全)。下列说法正确的是( )
A.碳原子的最外层有6个电子
B.X表示N2
C.氧原子的质子数是8
D.氧元素的相对原子质量是16.00g
11、掌握科学的方法可以帮助我们更轻松、高效地学习。下列说法错误的是( )
A.实验法:木炭、硫、红磷等能在氧气中燃烧,得出氧气具有助燃性
B.分类法:氯原子和氯离子都属于氯元素,所以它们的质子数相同
C.归纳法:离子、质子、电子是带电荷的粒子,因此微观粒子都带电荷
D.推理法:冰和水的分子构成相同,因此它们的化学性质相同
12、下列微观粒子结构示意图的相关叙述正确的是( )
A.②的元素在周期表的第二周期
B.③④的元素化学性质相似
C.③在化学反应中易得电子
D.①②④都具有相对稳定结构
二、本大题包括5小题,共28分
13、人类在探索物质世界和微观世界的历史长河中,充满了智慧。请你回答相关问题。
(1)下面的科学家中最早发现电子的是 (填字母)。
A.道尔顿 B.汤姆森 C.卢瑟福 D.门捷列夫
(2)“α粒子轰击金箔实验”为建立现代原子理论打下了基础。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”
①根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是 。
②该实验揭示了原子是由 和 构成的。
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,科学家都运用了 来表达他们的理论成果。
(4)碳-12、碳-13、碳-14都是碳元素的原子,它们的主要差别在于 。
(5)人们很早就意识到物质都是由几种亘古不变的基本成分“元素”组成的。如图是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?你的观点及依据是 。
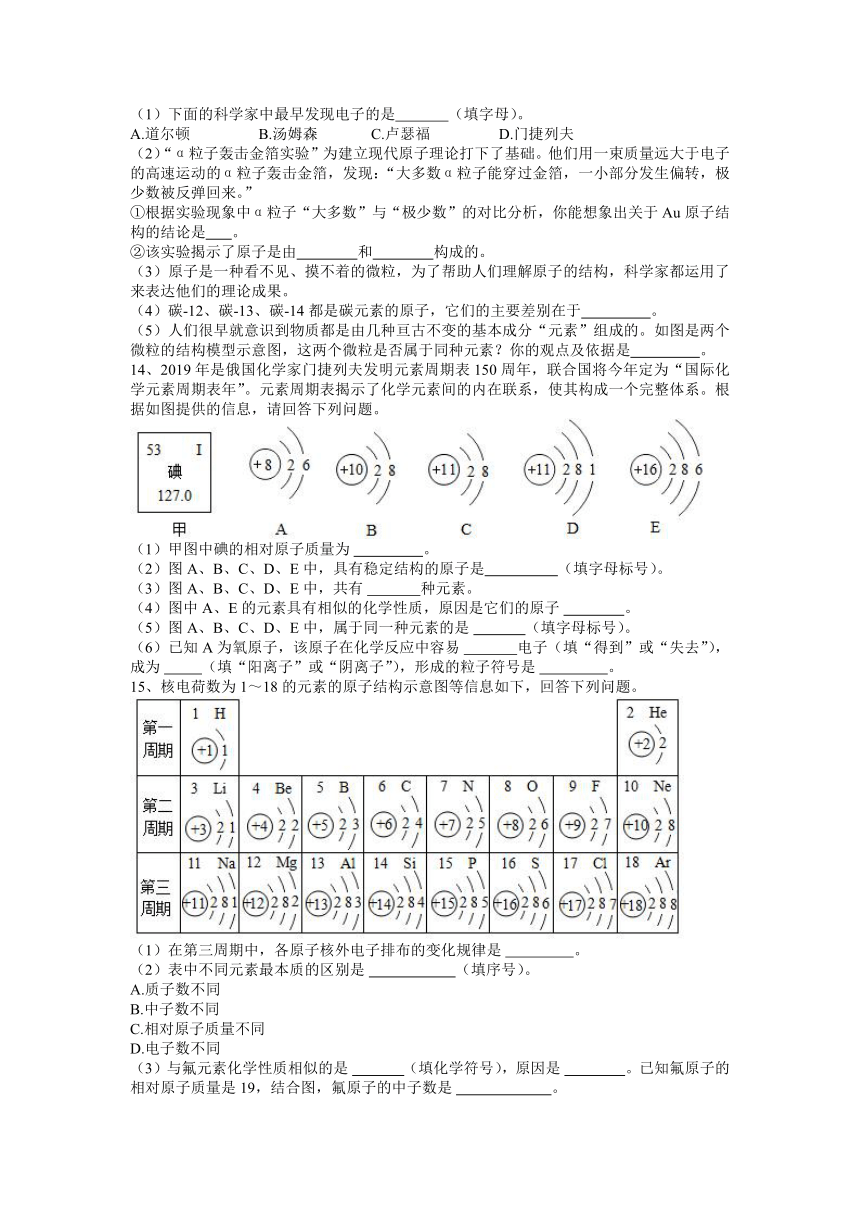
14、2019年是俄国化学家门捷列夫发明元素周期表150周年,联合国将今年定为“国际化学元素周期表年”。元素周期表揭示了化学元素间的内在联系,使其构成一个完整体系。根据如图提供的信息,请回答下列问题。
(1)甲图中碘的相对原子质量为 。
(2)图A、B、C、D、E中,具有稳定结构的原子是 (填字母标号)。
(3)图A、B、C、D、E中,共有 种元素。
(4)图中A、E的元素具有相似的化学性质,原因是它们的原子 。
(5)图A、B、C、D、E中,属于同一种元素的是 (填字母标号)。
(6)已知A为氧原子,该原子在化学反应中容易 电子(填“得到”或“失去”),成为 (填“阳离子”或“阴离子”),形成的粒子符号是 。
15、核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题。
(1)在第三周期中,各原子核外电子排布的变化规律是 。
(2)表中不同元素最本质的区别是 (填序号)。
A.质子数不同
B.中子数不同
C.相对原子质量不同
D.电子数不同
(3)与氟元素化学性质相似的是 (填化学符号),原因是 。已知氟原子的相对原子质量是19,结合图,氟原子的中子数是 。
(4)钠离子和氧离子核外电子排布 (填“相同”或“不同”),与钠离子核外电子排布相同的原子是 (填元素符号)。
(5)下列元素符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是 (填序号)。
A.O
B.Fe
C.He
D.Na+
16、模型是联系宏观与微观的桥梁。
(1)图1是钠原子结构示意图。
①x的数值为 。
②“11”指的是 。
③钠原子在化学反应中易 (得到、失去)1个电子,形成 (填离子符号)。
④钠元素与氯元素形成的化合物化学式为 。
(2)图2是氢分子和氧分子运动的示意图。
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是 (填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与 有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例: 。
17、学习化学的一个重要的途径是科学探究。对课本的实验改进是创新精神和能力的体现,宏观实验、微观探析是化学学习的重要方式和途径。
(1)如图A所示,注射器内吸入一段空气,右手堵住注射器的注射孔,左手向内推活塞,发现注射器内气体被压缩了,说明 。
(2)如图B所示,该实验观察到的实验现象是 ,说明分子 。这一现象还说明两种药品中 具有挥发性。图C实验中用胶头滴管吸取少许浓氨水,将其滴入T形三通管的细弯管处,然后用橡皮帽封闭管口。过一会儿,观察到 (填“ba”或“bc”)段纱布条先变成红色(氨气密度比空气小)。图C实验与图B实验对比,改进后的优点是 。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、D 3、C 4、C 5、A 6、D 7、B 8、B 9、C 10、C
11、C 12、D
二、本大题包括5小题,共28分
13、答案:(1)B;
(2)①相对原子来说,原子核很小,原子质量主要集中在原子核上;
②原子核;电子;
(3)模型;
(4)中子数不同;
(5)不属于同种元素,因为这两个微粒的质子数不同。
14、答案:(1)127.0;
(2)B;
(3)4;
(4)最外层电子数相等;
(5)CD;
(6)得到;阴离子;O2-。
15、答案:(1)从左至右原子核外最外层电子数依次增加。
(2)A。
(3)Cl;它们的原子最外层电子数相等;10。
(4)相同;Ne。
(5)BC。
16、答案:(1)①8;
②钠原子的核内有11个质子;
③失去;Na+;
④NaCl;
(2)①B、C;
②分子种类;
③衣服在阳光下比阴冷的地方干得快。
17、答案:(1)分子之间有间隔;
(2)酚酞试液变红色;在不断运动;浓氨水;具有挥发性;ba;节约药品,更环保;
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、“沉睡三千年,一醒惊天下”。考古人员用碳14(质子数为6,中子数为8)年代检测方法进行分析,初步判断三星堆4号坑属于商代晚期,碳14原子的核外电子数是( )
A.14 B.6 C.8 D.12
2、月球土壤含有大量氦3原子,它可能成为未来核能的重要原料。氦3原子核内有2个质子和1个中子,氦3原子结构示意图是( )
3、新制的蒸馏水不宜用于养金鱼,是因为蒸馏水中含有较少的( )
A.氧元素 B.氧原子 C.氧分子 D.氢元素
4、下表是某品牌饮用天然水理化指标:
含有成分 钙 镁 钾 钠 其它
含量(mg/L) ≥4.0 ≥0.5 ≥0.35 ≥0.8 略
该表中的“钙、镁、钾、钠”应理解为( )
A.原子 B.分子 C.元素 D.物质
5、根据下列各组元素的原子结构示意图分析,具有相似化学性质的一组是( )
6、分子和原子都是构成物质的基本粒子。从分子的角度分析,下列解释错误的是( )
A.花香四溢——分子在不断运动
B.热胀冷缩——分子间的间隔随温度的变化而变化
C.空气是混合物——空气中含有多种不同的分子
D.水的天然循环——分子的种类发生了改变
7、如图是某元素的原子结构示意图。下列有关该原子的说法错误的是( )
A.质子数为9 B.易失电子形成阳离子
C.最外层有7个电子 D.该原子有两个电子层
8、核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子 B.核电荷数为1
C.相对原子质量为4 D.质子数和中子数相等
9、根据图的有关信息判断,下列说法不正确的是( )
A.镁离子(Mg2+)核外有10个电子
B.镁的相对原子质量是24.31
C.在化学反应中,氯原子容易失去1个电子
D.镁离子(Mg2+)与氯离子(Cl-)的最外层电子数相等
10、如图为元素周期表的一部分(X元素信息不全)。下列说法正确的是( )
A.碳原子的最外层有6个电子
B.X表示N2
C.氧原子的质子数是8
D.氧元素的相对原子质量是16.00g
11、掌握科学的方法可以帮助我们更轻松、高效地学习。下列说法错误的是( )
A.实验法:木炭、硫、红磷等能在氧气中燃烧,得出氧气具有助燃性
B.分类法:氯原子和氯离子都属于氯元素,所以它们的质子数相同
C.归纳法:离子、质子、电子是带电荷的粒子,因此微观粒子都带电荷
D.推理法:冰和水的分子构成相同,因此它们的化学性质相同
12、下列微观粒子结构示意图的相关叙述正确的是( )
A.②的元素在周期表的第二周期
B.③④的元素化学性质相似
C.③在化学反应中易得电子
D.①②④都具有相对稳定结构
二、本大题包括5小题,共28分
13、人类在探索物质世界和微观世界的历史长河中,充满了智慧。请你回答相关问题。
(1)下面的科学家中最早发现电子的是 (填字母)。
A.道尔顿 B.汤姆森 C.卢瑟福 D.门捷列夫
(2)“α粒子轰击金箔实验”为建立现代原子理论打下了基础。他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,极少数被反弹回来。”
①根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是 。
②该实验揭示了原子是由 和 构成的。
(3)原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,科学家都运用了 来表达他们的理论成果。
(4)碳-12、碳-13、碳-14都是碳元素的原子,它们的主要差别在于 。
(5)人们很早就意识到物质都是由几种亘古不变的基本成分“元素”组成的。如图是两个微粒的结构模型示意图,这两个微粒是否属于同种元素?你的观点及依据是 。
14、2019年是俄国化学家门捷列夫发明元素周期表150周年,联合国将今年定为“国际化学元素周期表年”。元素周期表揭示了化学元素间的内在联系,使其构成一个完整体系。根据如图提供的信息,请回答下列问题。
(1)甲图中碘的相对原子质量为 。
(2)图A、B、C、D、E中,具有稳定结构的原子是 (填字母标号)。
(3)图A、B、C、D、E中,共有 种元素。
(4)图中A、E的元素具有相似的化学性质,原因是它们的原子 。
(5)图A、B、C、D、E中,属于同一种元素的是 (填字母标号)。
(6)已知A为氧原子,该原子在化学反应中容易 电子(填“得到”或“失去”),成为 (填“阳离子”或“阴离子”),形成的粒子符号是 。
15、核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题。
(1)在第三周期中,各原子核外电子排布的变化规律是 。
(2)表中不同元素最本质的区别是 (填序号)。
A.质子数不同
B.中子数不同
C.相对原子质量不同
D.电子数不同
(3)与氟元素化学性质相似的是 (填化学符号),原因是 。已知氟原子的相对原子质量是19,结合图,氟原子的中子数是 。
(4)钠离子和氧离子核外电子排布 (填“相同”或“不同”),与钠离子核外电子排布相同的原子是 (填元素符号)。
(5)下列元素符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是 (填序号)。
A.O
B.Fe
C.He
D.Na+
16、模型是联系宏观与微观的桥梁。
(1)图1是钠原子结构示意图。
①x的数值为 。
②“11”指的是 。
③钠原子在化学反应中易 (得到、失去)1个电子,形成 (填离子符号)。
④钠元素与氯元素形成的化合物化学式为 。
(2)图2是氢分子和氧分子运动的示意图。
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是 (填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与 有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例: 。
17、学习化学的一个重要的途径是科学探究。对课本的实验改进是创新精神和能力的体现,宏观实验、微观探析是化学学习的重要方式和途径。
(1)如图A所示,注射器内吸入一段空气,右手堵住注射器的注射孔,左手向内推活塞,发现注射器内气体被压缩了,说明 。
(2)如图B所示,该实验观察到的实验现象是 ,说明分子 。这一现象还说明两种药品中 具有挥发性。图C实验中用胶头滴管吸取少许浓氨水,将其滴入T形三通管的细弯管处,然后用橡皮帽封闭管口。过一会儿,观察到 (填“ba”或“bc”)段纱布条先变成红色(氨气密度比空气小)。图C实验与图B实验对比,改进后的优点是 。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、D 3、C 4、C 5、A 6、D 7、B 8、B 9、C 10、C
11、C 12、D
二、本大题包括5小题,共28分
13、答案:(1)B;
(2)①相对原子来说,原子核很小,原子质量主要集中在原子核上;
②原子核;电子;
(3)模型;
(4)中子数不同;
(5)不属于同种元素,因为这两个微粒的质子数不同。
14、答案:(1)127.0;
(2)B;
(3)4;
(4)最外层电子数相等;
(5)CD;
(6)得到;阴离子;O2-。
15、答案:(1)从左至右原子核外最外层电子数依次增加。
(2)A。
(3)Cl;它们的原子最外层电子数相等;10。
(4)相同;Ne。
(5)BC。
16、答案:(1)①8;
②钠原子的核内有11个质子;
③失去;Na+;
④NaCl;
(2)①B、C;
②分子种类;
③衣服在阳光下比阴冷的地方干得快。
17、答案:(1)分子之间有间隔;
(2)酚酞试液变红色;在不断运动;浓氨水;具有挥发性;ba;节约药品,更环保;
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
